Комплексное лечение остеосаркомы грудины с замещением сложного дефекта грудной стенки
Автор: Иванов Вячеслав Евгеньевич, Курильчик Александр Александрович, Рагулин Юрий Александрович, Жеравин Александр Александрович, Стародубцев Алексей Леонидович, Зубарев Алексей Леонидович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 4 т.16, 2017 года.
Бесплатный доступ
Введение. Остеогенная саркома относится к высокозлокачественным новообразованиям скелета и составляет до 6 % от всех костных опухолей. В литературе описаны единичные случаи первичной остеосаркомы грудины. Особый интерес представляет возможность выполнения расширенных радикальных оперативных вмешательств на грудной стенке с одномоментной комбинированной реконструкцией реберного каркаса имплантатами из биологически совместимых материалов. Материал и методы. Представлен случай редкой локализации остеосаркомы в области грудины у 49-летнейпациентки. Больной было проведено комбинированное лечение, включающее курсы химиотерапии,лучевую терапию и хирургические вмешательства на первичном очаге и легких. Для замещения дефекта каркаса грудной стенки использовали имплантаты из никелида титана. результаты. Активная лечебная тактика, включающая химиотерапию и хирургические этапы, позволила достичь оптимального качества жизни на протяжении 21 мес у пациентки с крайне неблагоприятным прогнозом. Заключение.Представленный способ реконструкции каркаса грудной стенки с использованием биосовместимых материалов из никелидтитана является эффективным и безопасным для использования у пациентов со злокачественными новообразованиями грудной стенки
Опухоли костей, остеосаркома грудины, никелид титана
Короткий адрес: https://sciup.org/140254434
IDR: 140254434 | УДК: 616.713-006.34.04-089.843 | DOI: 10.21294/1814-4861-2017-16-4-96-102
Текст научной статьи Комплексное лечение остеосаркомы грудины с замещением сложного дефекта грудной стенки
Первичные злокачественные опухоли грудины встречаются редко и составляют около 0,5 % от всех злокачественных новообразований костей. Еще реже встречается остеосаркома с первичной локализацией в грудине и ребрах. В литературе описаны единичные случаи первичной остеосаркомы грудины [1, 2]. Клинические проявления не отличаются специфичностью – обычно заболевание манифестирует болью и визуально определяемой деформацией грудной стенки. Течение остеосаркомы грудной стенки немногим отличается от картины классических вариантов этого заболевания, локализующихся на конечностях, и требует проведения комбинированного лечения с использованием индукционной и адъювантной химиотерапии. Большую важность имеет выполнение комплексной предоперационной диагностики, включающей рентгенографию, компьютерную томографию грудной клетки и остеосцинтиграфию. Точное определение распространенности опухоли как по костным структурам, так и интраторакально позволяет спланировать объем резекции грудного каркаса, мягких тканей, органов средостения, легких, а также определить необходимый вариант реконструкции пострезекционного дефекта [1, 3, 4].
Определение метода замещения костного каркаса остается довольно сложной задачей, так как это требует решения ряда вопросов, таких как выбор
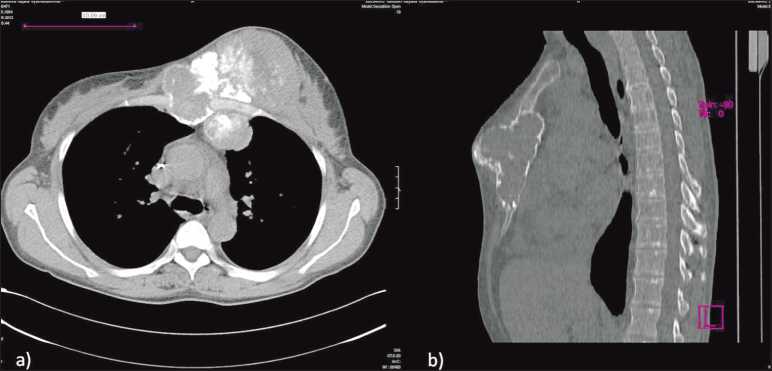
Рис. 1. МСКТ грудной клетки до операции. Обширное интра- и экстраторакальное распространение опухоли
материала, способного длительное время поддерживать заданную форму, выбор оптимального способа фиксации к ребрам, препятствующего смещению конструкции [5, 6]. Известно большое количество способов восстановления целостности костно-хрящевого каркаса грудной стенки: пневмопексия, пластика мышечным лоскутом на питающей ножке, трансплантатом из лопатки, пластинами и сетками из нержавеющей стали, титана, тантала, полимерами на основе полиэтиленов, полиэфиров, полиуретанов, полиакрилатов и др. [4, 7]. Несмотря на множество предложенных методик, не существует единого мнения об оптимальном способе замещения дефекта. Особый интерес представляет возможность выполнения расширенных радикальных оперативных вмешательств на грудной стенке с одномоментной комбинированной реконструкцией реберного каркаса имплантатами из биологически совместимого материала – никелида титана, обладающего высокими интегративными и биомеханическими свойствами и предназначенного для длительного функционирования [5, 8, 9].
Клиническое наблюдение
Пациентка М., 1964 г.р., с осени 2011 г. отметила появление деформации в области передней грудной стенки, болевой синдром, усиливавшийся в вечерние и ночные часы. При обследовании в апреле 2012 г. выявлено опухолевое поражение грудины с распространением на левую половину грудной клетки, без признаков метастазирования в лимфатические узлы и отдаленные органы. Получена гистологическая верификация – остеосаркома G3. Препараты пересмотрены в РОНЦ РАМН и МРНЦ г. Обнинска. Начало лечения – май 2012 г. В неоадъювантном режиме проведены курсы полихимиотерапии (ПХТ): 2 цикла по схеме доксорубицин (СД – 172 мг, в 1–4-й дни, 96-часовая инфузия) + цисплатин (СД – 230 мг, 6-й день). После I линии ПХТ по данным спираль- ной компьютерной томографии (СКТ) органов грудной клетки отмечалось увеличение размеров экстраоссального компонента опухоли. С учётом прогрессирования заболевания произведена смена режима химиотерапии. Проведено 3 курса ПХТ по схеме Ифосфамид + Этопозид, затем курс дистанционной лучевой терапии (ДЛТ) на первичную опухоль, СОД 30 Гр. Через 4 мес, при контрольном обследовании по данным СКТ органов грудной клетки отмечается деформация и разрушение костной структуры в области средней и нижней трети грудины размерами 58×51 мм, протяжённость до 9 см. Внекостный компонент опухоли имеет как интра- так и экстраторакальное распространение. Размеры экстраторакального компонента, располагающегося в мягких тканях передней грудной стенки слева, в области левой молочной железы – 125×85 мм. Интраторакаль-ный компонент, размером 40×43×50 мм, распространяется в проекции переднего средостения (рис. 1). Структура опухоли с множественными включениями костной плотности. Увеличенных лимфоузлов в средостении не выявлено. Определяется локальное утолщение в проекции нижней лёгочной вены справа размером 19 мм. Жидкости в плевральных полостях нет. Сердце увеличено за счёт всех отделов. В перикарде имеется жидкость. Таким образом, отмечалось уменьшение размеров мягкотканного компонента опухоли на 20 % по шкале RECIST. В связи с этим принято решение о выполнении хирургического этапа лечения в объёме удаления опухоли передней грудной стенки с одномоментной реконструкцией (рис. 2).
Хирургическое лечение выполнено на базе МРНЦ г. Обнинска. Операция выполнена в два этапа. Резекционный этап проведен в положении пациентки на спине с отведенной левой рукой на подлокотнике. Выполнен окаймляющий зону опухолевой инфильтрации кожный разрез в поперечном направлении с формированием верхнего и нижнего кожно-фасциальных лоскутов. Вы-
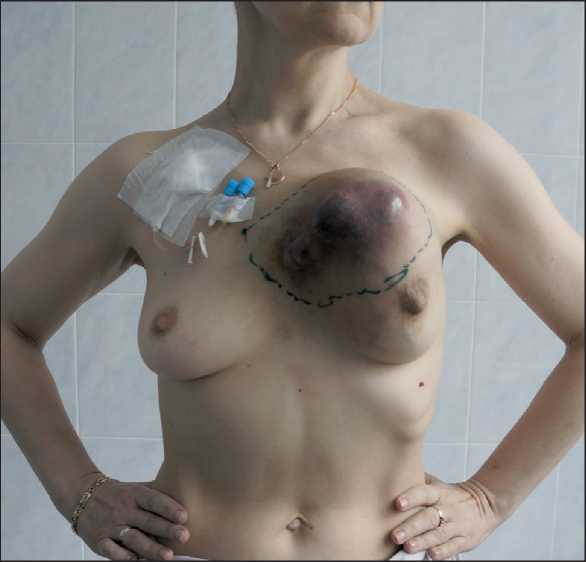
Рис. 2. Внешний вид больной после проведения курса предоперационной лучевой терапии. Разметка границ резекции делен экстраторакальный компонент опухоли. Во II межреберьях справа и слева выделены a. et v. thoracica interna, лигированы и пересечены. Границы резекции передней грудной стенки: справа – хрящевые части рёбер на 2 см от края грудины; слева – тела II, III, IV, V ребер; верхняя граница – на уровне дистальной трети рукоятки грудины, нижняя граница – уровень реберной дуги. Дистальная перевязка внутригрудных сосудов после пересечения реберной дуги. Пересечение ребер, рукоятки грудины. При ревизии средостения выявлено близкое прилежание интраторакального компонента опухоли к перикарду, без признаков истинного врастания (рис. 3). Макропрепарат удален. Размеры костного дефекта составили 160×150 мм. Через отдельный прокол произведена эвакуация жидкости из перикарда.
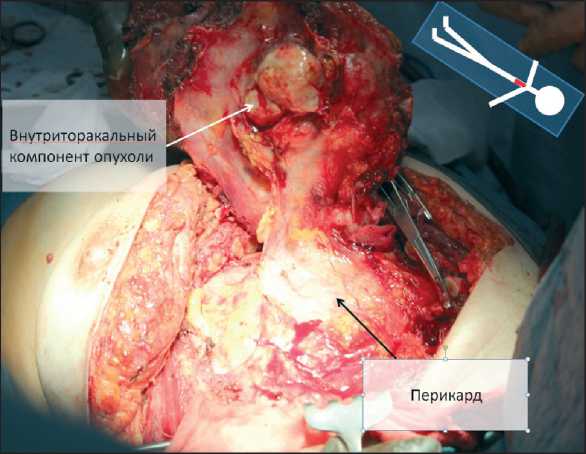
Рис. 3. Резекционный этап операции. Опухоль мобилизована в пределах здоровых тканей в едином блоке с фрагментами ребер, грудины и мягких тканей грудной стенки
Вторым этапом выполнена комбинированная реконструкция грудной стенки. Для замещения дефекта кожи и мягких тканей в положении больной на правом боку осуществлен подъем торако-дорсального лоскута на подлопаточных сосудах. Для придания большей мобильности лоскуту осуществлено пересечение головки широчайшей мышцы. Пациентка уложена в исходное положение, лоскут временно фиксирован к мягким тканям вне зоны дефекта. Для реконструкции реберного каркаса были использованы оригинальные имплантаты из никелида титана, а именно эндопротезы ребер в сочетании с текстильным сверхэластичным имплантатом (рис. 4). Выполнена пластика рёберного каркаса: фиксация лигатурами по периметру раны никелид-титановой ткани, установлены 4 эндопротеза ребер, фиксация рёбер лигатурами к мягким тканям и никелид титановой сетке (рис. 5). Контроль стабильности конструкции. Дренирование плевральной полости, средостения. Пластика дефекта мягких тканей – торако-дорсальный лоскут уложен на дно дефекта в межмаммарном пространстве. Послойное ушивание раны.
Гистологическое заключение (№ 651/13, 15.02.13): во всех участках препарата обнаружена остеогенная саркома G3 с участками некроза.

Рис. 4. Текстильный сверхэластичный имплантат и эндопротезы ребер из никелида титана
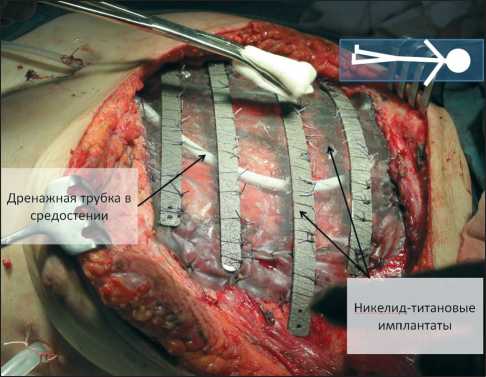
Рис. 5. Вид операционной раны после установки эндопротезов ребер
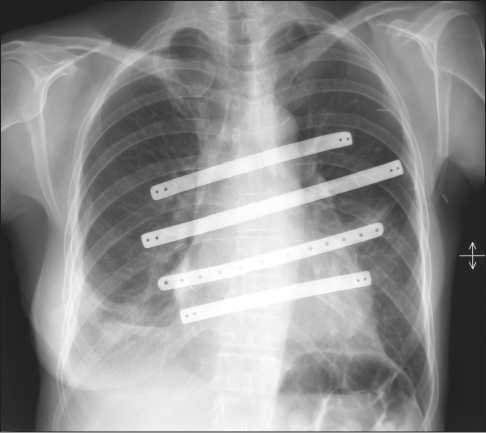
Рис. 6. Рентгенография грудной клетки через 4 мес после операции. Признаков прогрессирования заболевания не выявлено
Признаки терапевтического патоморфоза II степени.
Послеоперационный период протекал гладко. Экстубация через 3 ч после завершения операции. Признаков дыхательной недостаточности зафиксировано не было. Заживление послеоперационной раны первичным натяжением, швы сняты на 14-е сут после операции. При контрольной рентгенографии, выполненной через 4 мес после операции, отмечалось стабильное положение эндопротезов ребер (рис. 6, 7). С учётом гистологического заключения пациентке было проведено 3 курса адъювантной ПХТ по схеме Ифосфамид + Этопозид.
Через 4 мес после операции при контрольном обследовании по данным СКТ отмечено появление метастатических очагов в правом лёгком. Проведено лечение в объёме прецизионной резекции правого лёгкого с последующим проведением консолидирующей ПХТ по альтернативной схеме. Спустя 3 мес (октябрь 2013 г.) у пациентки появились жалобы на образование в мягких тканях передней грудной стенки в области послеоперационного рубца. По данным УЗИ в области соска и в верхне-внутреннем квадранте левой молочной железы определяется многоузловое образование, размером 28×13×25 мм, отдельные узлы – до 13 мм в диаметре, преимущественно гипоэ-хогенное с гиперэхогенными включениями с множественными сосудами. Диагностирован рецидив заболевания. Выполнена операция в объёме удаления образования мягких тканей передней грудной стенки. В послеоперационном периоде проведено 3 курса ПХТ по схеме АР (Цисплатин + Доксорубицин).
Через 9 мес (сентябрь 2014 г.) при контрольном исследовании по данным СКТ органов грудной полости отмечается появление метастатических очагов в правом лёгком и в средостении, процесс признан неоперабельным. По месту жительства больной проводилось паллиативное лечение. В ноябре 2014 г. больная умерла от прогрессирования заболевания, общий срок наблюдения с момента операции составил 21 мес. На протяжении всего срока наблюдения общее состояние пациентки оставалось стабильным, признаков дыхательной недостаточности, обусловленной перенесенной операцией на грудной стенке, не отмечалось.
Обсуждение
Представленное редкое клиническое наблюдение имеет целью показать возможность комбинированного лечения остеосаркомы грудины с обширным местным распространением. Лечебные подходы при остеосаркоме грудной стенки не отли-
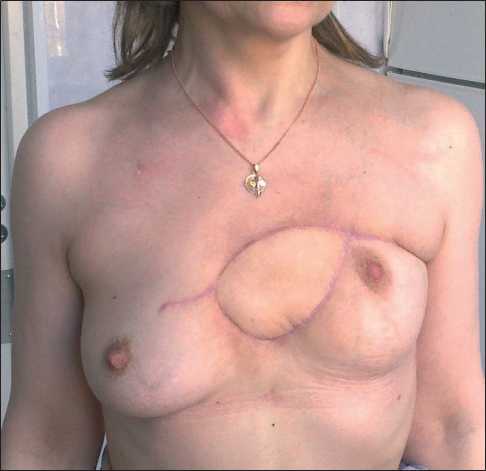
Рис. 7. Внешний вид больной через 4 мес после операции чаются от таковых при классической локализации этого типа опухолей на конечностях. Основу лечебной программы составляет системная химиотерапия с последующим хирургическим этапом [2]. В представленном случае операция была выполнена после проведения 2 линий химиотерапии и лучевой терапии на первичный очаг, по достижении стабилизации опухолевого процесса, что демонстрирует низкую чувствительность опухоли к системному воздействию, что является неблагоприятным фактором прогноза.
Важным аспектом успешности лечения остеосаркомы грудной стенки является возможность выполнения резекции в радикальном объеме, что подразумевает нарушение каркасности, герметичности плевральной полости и нарушение биомеханики дыхания. Владение простой в исполнении и эффективной методикой для замещения утраченных сегментов ребер и грудины является необходимым условием при планировании обширной радикальной резекции [10]. В данном клиническом наблюдении использовались имплантаты и нике-лид титана. Эндопротезы ребер изготавливались индивидуально по данным МСКТ грудной клетки с учетом объема резекции и количества удаляемых ребер. Подобные имплантаты имеют высокие прочностные характеристики, эластичность, схожую с нормальной костной тканью. Упругость сердечника эндопротеза ребра и пористая поверхность обеспечивают оптимальную фиксацию в заданном положении и не ограниченное по времени функционирование за счет прорастания сетки и реберных имплантов фиброзной тканью [9]. Подобная интеграция материала в ткани организма исключает возможность формирования остаточных полостей, смещения элементов конструкции, появления очагов напряжения в местах контакта с костными структурами. Использование представленной методики позволило достичь полного восстановления дыхательной функции в раннем послеоперационном периоде и обеспечило его неосложненное течение.
Активная тактика ведения больных с метастатическим поражением легких является вполне оправданной. Продолжение системной химиотерапии и хирургическое удаление манифестирующих легочных метастатических очагов позволяют добиться 5-летней выживаемости у части больных [11]. В представленном случае также проводилось удаление метастатических очагов в противоположном легком, при этом предшествующая операция на первичном очаге не ограничила возможность проведения последующих хирургических вмешательств.
Таким образом, активная лечебная тактика, включающая химиотерапию, хирургические этапы позволили достичь оптимального качества жизни на протяжении 21 мес у пациентки с крайне неблагоприятным прогнозом. Мы считаем, что представленный способ реконструкции каркаса грудной стенки с использованием биосовместимых материалов из ни-келида титана является эффективным и безопасным для использования у пациентов со злокачественными новообразованиями грудной стенки.
Список литературы Комплексное лечение остеосаркомы грудины с замещением сложного дефекта грудной стенки
- Тепляков В.В., Карпенко В.Ю., Илюшин А.Л., Донскова Ю.С., Собченко Л.А., Долгова С.Г., Епифанова С.В., Державин В.А., Бухаров А.В., Бондарев А.В. Хирургическое лечение злокачественных опухолей грудной стенки. Хирургия. Журнал им. Н.И. Пирогова. 2010; 9: 36-41.
- Rad M.P., Fattahi Masoum S.H., Layegh P., Rad M.S. PrimaryOsteosarcoma of the Sternum: A case Report and Review of the Literature.Arch Bone Jt Surg. 2014 Oct; 2(4): 272-5.
- Давыдов М.И., Алиев М.Д., Тепляков В.В., Полоцкий Б.Е.,Стилиди И.С., Соболевский В.А., Карпенко В.Ю. Лечение местно распространенных опухолей грудной стенки. Два случая из практики.Вестник РОНЦ им. Н.Н. Блохина РАМН. 2003; 2-1: 93-96.
- Berthet J.P., Canaud L., D'Annoville T., Alric P., Marty-Ane C.H.Titanium plates and Dualmesh: a modern combination for reconstructingvery large chest wall defects. Ann Thorac Surg. 2011 Jun; 91 (6): 1709-16. DOI: 10.1016/j.athoracsur.2011.02.014
- Жеравин А.А., Гюнтер В.Э., Анисеня И.И., Гарбуков Е.Ю.,Жамгарян Г.С., Богоутдинова А.В. Реконструкция грудной стенкис использованием никелида титана у онкологических больных.Сибирский онкологический журнал. 2015; 3: 31-37.


