Конденсация ацетона с диэтилоксалатом и арилдиазониевыми солями
Автор: Левенец Татьяна Васильевна, Козьминых Владислав Олегович, Толстикова Александра Олеговна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 24 (283), 2012 года.
Бесплатный доступ
Реакцией 1-этокси-1,4-диоксо-2-пентен-2-олята натрия с арилдиазониевыми солями получены этиловые эфиры 3-арилгидразоно-2,4-диоксопентановых кислот. Изучена однореакторная трехкомпонентная конденсация ацетона с диэтилоксалатом и солями арилдиазония, приводящая к образованию этиловых эфиров 3-арилгидразоно-2,4-диоксопентановых кислот. Обсуждаются особенности строения синтезированных соединений на основании данных УФ-, ИК-, ЯМР 1H-спектроскопии и РСА. Исследована антимикробная активность полученных соединений.
Трехкомпонентная конденсация, однореакторный метод, этиловые эфиры 3-арилгидразоно-2, 4-диоксопентановых кислот, e- и z-изомеры
Короткий адрес: https://sciup.org/147160229
IDR: 147160229 | УДК: 547.341+547.725
Текст научной статьи Конденсация ацетона с диэтилоксалатом и арилдиазониевыми солями
Известно, что гидразоны α-оксосистем образуются при азосочетании β-дикарбонильных соединений с арилдиазониевыми солями [1]. Наличие активированной метиленовой группы у соединений, содержащих β-дикетонное звено – центра атаки электрофила – позволяет широко использовать эти соединения в тонком органическом и комбинаторном синтезе. В частности, 1,3-диоксосоединения и их производные легко вступают в азосочетание с хлоридом арилдиазония, приводящее к получению соответствующих 2-арилгидразонов (рис. 1) [2].
NNHAr
OO
X = OH, OAlk
Рис. 1. Схема синтеза 2-арилгидразонов 1,3-диоксосоединений
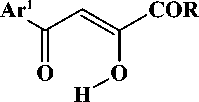
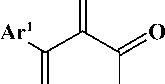
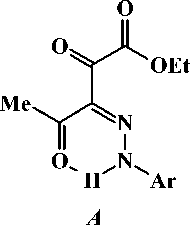
В последнее время стали появляться работы по синтезу гидразонов на основе реакции азосочетания активированных карбоксильными акцепторами 1,3-диоксосоединений с хлоридом арилдиазония [3, 4]. В литературе описаны реакции ароилпировиноградных кислот и их производных с хлоридом арилдиазония, приводящие к образованию 3-арилгидразонов 4-арил-2,3,4-триоксо-бутановых кислот и их производных (рис. 2) [4], которые обладают более широким кругом синтетических возможностей, нежели их простые предшественники.
+ Ar2N2Cl
NNHAr2
O COR
R = OH, OMe, OEt
Рис. 2. Схема синтеза 3-арилгидразонов 4-арил-2,3,4-триоксобутановых кислот и их производных
В связи со значительным структурным разнообразием и широкими реакционными возможностями азопроизводных ацилпируватов (2-гидрокси-4-оксо-2-бутеноатов) актуальным является исследование поведения разнообразных производных ацилпировиноградных кислот, в первую очередь алканоилпируватов, в реакциях азосочетания. Взаимодействие алканоилпируватов с диазореагентами до наших исследований не изучались.
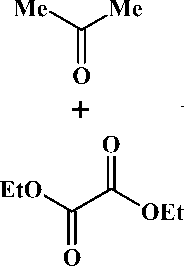
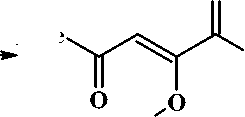
Известно, что конденсация Клайзена метилкетонов с диэтилоксалатом и гидридом натрия (или натрием) приводит к образованию натриевых енолятов оксопроизводных 1,3-дикарбо-нильных соединений [6]. Нами изучено взаимодействие 1-этокси-1,4-диоксо-2-пентен-2-олята натрия ( 1 ) [6] с арилдиазониевыми солями, образующимися in situ из соответствующих ароматических аминов и нитрита натрия в кислой среде (способ А ). В результате реакции с препаративными выходами выделены ожидаемые новые биологически активные этиловые эфиры 3-арилгид-разоно-2,4-диоксопентановых кислот ( 2а-с ) (рис. 3). С целью усовершенствования указанного способа получения соединений 2а-с, сокращения числа стадий проведения реакции нами исследовано протекание трёхкомпонентной однореакторной постадийной конденсации с участием ацетона, диэтилоксалата и диазореагентов (способ Б ). Предложенный способ Б характеризуется простотой и удобством и в отличие от способа А и известных методов получения структурных аналогов [3] исключает стадию выделения 1-этокси-1,4-диоксо-2-пентен-2-олята натрия ( 1 ) и эфиров 2,4-диоксобутановых кислот с последующим вовлечением их в реакцию азосочетания с диазореагентами. Выход соединений 2а-с , полученных способом А , больше, что связано с чистотой используемого 1-этокси-1,4-диоксо-2-пентен-2-олята натрия ( 1 ) по сравнению со способом Б , где в реакции используется суспензия соединения 1 в толуоле.
Na, толуол, 10 ч, t, 0C Me
способ Б
O
OEt
Na
|Ar-N=N]a,-
1-1,5 ч способ А
O
Me
1. NaH, толуол, 3 ч, 5 0С
2. [Ar-N +E Njci -
1-1,5 ч
OEt
O HN
Ar
2а-с
Ar = C6H5 ( 2a ), 45*, 39**; p -CH 3 C 6 H 4 ( 2b ), 52*, 47**; p -NO2C6H4 ( 2c ), 59*, 42** выход (%): *способ А, **способ Б
Рис. 3. Схема синтеза этиловых эфиров 3-арилгидразоно-2,4-диоксоалкановых кислот
Синтезированные этиловые эфиры 2а-с - кристаллические соединения желтого цвета, растворимые в хлороформе, диметилсульфоксиде, при нагревании растворимые в этаноле, этилацетате, не растворимые в воде.
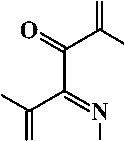
Соединения 2а-с могут существовать в арилгидразонной форме А , в которой возможно образование внутримолекулярной водородной связи (ВВС) между атомом водорода гидразонного фрагмента и атомом кислорода карбонильной группы, а также в азодикетонной форме В и азоке-тоенольной форме С , в которой также возможно образование ВВС [2]:
Ar
N N
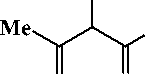
COOEt
OO
B
Ar
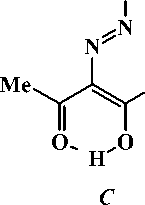
COOEt
Органическая химия
В ЯМР 1Н-спектрах соединений 2a–с присутствуют сигналы протонов ароматических ядер в области 7,45–8,32 м.д. и связанных с ними заместителей. В слабом поле в области 14,84–15,08 м.д. наблюдаются сигналы NH-протонов, что свидетельствует в пользу формы А . Отсутствие в ЯМР 1Н-спектрах сигналов метиновых протонов в области 1–6 м.д. позволяет исключить для синтезированных соединений структуру азосоединений В . Отсутствие интенсивного фиолетового окрашивания эфиров 2a–с с раствором хлорида железа (III), характерного для соединений, содержащих енольную гидроксильную группу, а также отсутствие в ИК-спектрах интенсивной полосы поглощения в области 3600–3200 см–1 позволяют исключить возможную азоенольную форму С .
В ИК-спектрах синтезированных соединений наблюдаются полосы поглощения сложно-эфирной карбонильной группы в области 1735–1728 см–1 и кетонных С2=О и С4=О групп в области 1682–1628 см–1, смещение которых в низкочастотную область свидетельствует об участии в образовании водородных связей.
В УФ-спектрах соединений 2a–с в области 381–386 нм наблюдается один максимум поглощения (lg ε 4,39–4,48), обусловленный поглощением арилгидразонного фрагмента, сопряженного с карбонильной группой. Батохромное смещение полос поглощения на 100–110 нм и гиперхром-ный эффект, в отличие от азосоединений [7], позволяют опровергнуть наличие альтернативных арилдиазониевых структур (форма В и С ). Смещение полос поглощения на 5 нм для соединений 2а и 2b в сторону более длинных волн по сравнению с соединением 2с свидетельствует о существовании их в форме Е -изомеров.
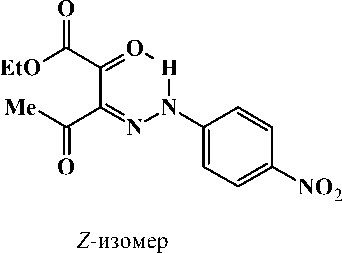
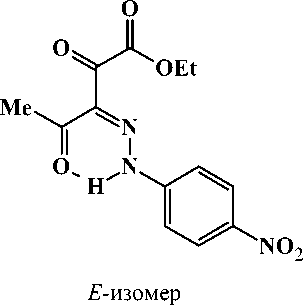
В случае соединения 2с было отмечено наличие двух изомеров ( Z - и E -изомеров), обусловленное, по видимому, электроноакцепторным влиянием заместителя в ароматическом ядре. Наличие пространственного E -изомера подтверждается в ЯМР 1Н-спектре дублирующимися сигналами протоносодержащих групп преобладающего Z -изомера.
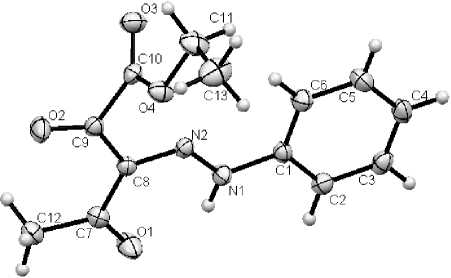
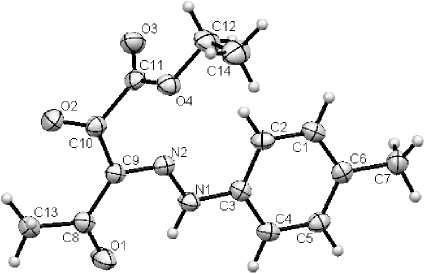
Для соединений 2а и 2b удалось вырастить монокристаллы из этанола, что позволило изучить стереохимическое строение синтезированных соединений методом рентгеноструктурного анализа. Молекулы исследованных кристаллов (рис. 4) имеют почти плоское строение: ориентация ароильного фрагмента относительно плоскостей O(1)C(7)C(8)N(2)N(1)H–N(1) ( 2а ) и O(1)C(8)C(9)N(2)N(1)H–N(1) ( 2b ) характеризуется торсионнымм углами 176,9(1)° и 173,4(1)° соответственно. Данные РСА указывают на образование внутримолекулярной водородной связи между атомом водорода NH-группы и атомом кислорода γ -карбонильной группы. Для соединения 2а расстояние О(1)---Н(1) составляет 1,927 Å, а углы H–N(1)O(1)C(7) и O(1)H–N(1)N(1) составляют 102,98° и 133,06° соответственно. Аналогично, для структуры 2b расстояние О(1)---Н(1) составляет 1,896 Å, а углы H–N(1)O(1)C(8) и O(1)H–N(1)N(1) – 103,05° и 133,32° соответственно. Распределение длин связей во фрагменте O(1)=C(7)–C(8)=N(2)–N(1)–H–N(1) ( 2а ) и O(1)=C(8)–C(9)=N(2)–N(1)–H–N(1) ( 2b ) указывает на то, что в кристаллическом состоянии синтезированные соединения существует в оксо-гидразонной форме Е -изомера. Такая же форма присутствует и в растворе метанола, что согласуется с данными УФ-спектроскопии.
а)
Рис. 4. Структуры молекул: а - этилового эфира 3-фенилгидразоно-2,4-диоксопентановой кислоты (2а); б - этилового эфира 3-(4-толил)гидразоно-2,4-диоксопентановой кислоты (2b)
б)
Антимикробная активность полученных соединений была исследована методом последовательных разведений в отношении модельных грамположительных ( S. aureus ) и грамотрицатель-ных ( E. coli ) микроорганизмов. Терапевтическую активность синтезированные соединения проявляют в отношении модельных тест-культур при разведении 1:8 – 1:16, что отвечает значениям рабочих концентраций действующего вещества – 125–62,5 мкг/мл.
Установлено, что раствор соединения 2с в этаноле изменяет цвет в зависимости от рН среды. Так, в кислой среде раствор окрашен в желтый цвет, в основной – в красный. Интервал перехода для 1 %-ного спиртового раствора соединения 2с составил 8,7–9,5 рН [8].
Заключение
В результате реакции азосочетания 1-этокси-1,4-диоксо-2-пентен-2-олята натрия с диазореагентами, а также на основе однореакторной трехкомпонентной конденсации ацетона с ди-этилоксалатом и солями арилдиазония получены новые этиловые эфиры 3-арилгидразоно-2,4-диоксоалкановых кислот. Строение синтезированных соединений установлено с помощью спектральных методов анализа. Совокупность спектральных данных, их сопоставление с литературными позволяет исключить для продуктов азосочетания возможные арилдиазониевые структуры (форма В и С ), и сделать вывод о том, что синтезированные соединения 2a–с имеют гидра-зонное строение. Соединение 2с представлено пространственными Z - и E -изомерами.
Следует отметить, что полученные соединения проявляют антибактериальную активность в отношении модельных грамположительных ( S. aureus ) и грамотрицательных ( E. coli ) микроорганизмов. Соединение 2с обладает свойствами кислотно-основного индикатора.
Экспериментальная химическая часть
ИК-спектры полученных соединений записаны на спектрофотометре «Инфралюм ФТ-02» в пасте твёрдого вещества в вазелиновом масле. Спектры ЯМР 1H соединений получены на приборе «MERCURYplus-300» (300,05 МГц) в СDCl 3 , внутренний стандарт – ТМС. УФ-спектры полученных соединений записаны на спектрофлуориметре СМ 2203 в метаноле с 10 –5 –10 –6 моль/дм 3 . Протекание реакций контролируют, а индивидуальность полученных веществ подтверждают методом ТСХ на пластинках Silufol UV-254 в системе бензол – диэтиловый эфир – гексан 1:2:3, хроматограммы проявляют парами йода. Исходные реактивы перед использованием очищают перегонкой.
Синтез этиловых эфиров 3-арилгидразоно-2,4-диоксопентановых кислот (2a-c). Общая методика. Способ А. 1,8 г (10 ммоль) 1-этокси-1,4-диоксо-2-пентен-2-олята натрия ( 1 ) [6] растворяют в воде. К образующемуся раствору добавляют смесь 10 ммоль ароматического амина, 2 мл концентрированной соляной кислоты и 0,69 г (10 ммоль) нитрита натрия в 20 мл воды (контроль рН = 5–7, t = 0–5 °C). Спустя 1–1,5 часа интенсивного перемешивания осадок отфильтровывают, сушат на воздухе и перекристаллизовывают из этанола.
Cпособ Б. К смеси 0,73 мл (10 ммоль) ацетона, 1,36 мл (10 ммоль) диэтилоксалата и 80 мл абсолютного толуола добавляют при перемешивании 0,24 г (10 ммоль) гидрида натрия, охлаждают до 5 °С. К образующейся суспензии добавляют смесь 10 ммоль ароматического амина,
Органическая химия
2 мл концентрированной соляной кислоты и 0,69 г (10 ммоль) нитрита натрия в 20 мл воды (контроль рН = 5-7, t = 0-5 °C). Через 1-1,5 часа интенсивного перемешивания верхний органический слой отделяют, растворитель испаряют, остаток перекристаллизовывают из этанола.
Этиловый эфир 3-фенилгидразоно-2,4-диоксопентановой кислоты (2а)
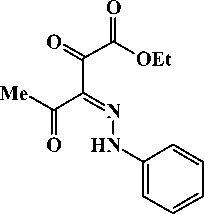
Выход: способ А - 1,17 г (45 %), способ Б - 1,02 г (39 %), т. пл. 105-107 °C.
ИК-спектр, V , см-1 (ваз. масло): 1728 vc = o, 1676 vc = o, 1632 vc = o, 1590, 1538, 1520, 1508 vch + vc = n, 1160, 1113 8Ш сн , 1109 V c-o-c , 836, 815, 788, 755 З непл сн .
Спектр ЯМР 1 H, 8 , м.д. (CDCl 3 ): 1,39 т (3Н, СН 3 СН 2 О, J 7,2 Гц), 2,64 с (3Н, СН 3 ), 4,41 к (2Н, СН 3 СН 2 О, J 7,2 Гц), 7,22-7,29 м (1Н, С 6 Н 5 ), 7,32-7,47 м (4Н, С 6 Н 5 ), 15,00 уш. с. (1Н, NH).
Кристаллографические параметры: хорошо ограненные кристаллы C13H14N2O4 ромбической сингонии: a = 18,1323 (17) A, b = 7,7173 (5) A, c = 18,8516 (14) А, а = 90,00 град, в = 90,00 (11) град, Y = 90,00 град, V = 2637,95 А3, М = 262,28, Z = 8, пространственная группа Pbca . Основные длины связей, d , А: О(1)-С(7) 1,231(2), О(2)-С(9) 1,217(2), О(3)-С(10) 1,203(2), О(4)-С(10) 1,316 (2), О(4)-С(11) 1,461(2), N(1)-N(2) 1,296(2), N(1)-C(1) 1,413(2), N(1)-H-N(1) 0,87(2), N(2)-C(8) 1,325(2), C(1)-C(2) 1,386(2), C(1)-C(6) 1,388(2), C(2)-C(3) 1,389(2), C(3)-C(4) 1,378(2), C(4)-C(5) 1,388(2), C(5)-C(6) 1,383(2), C(7)-C(8) 1,469(2), C(7)-C(12) 1,488(2), C(8)-C(9) 1,462(2), C(9)-C(10) 1,530(2), C(11)-C(13) 1,486(2); основные валентные углы, to , град: С(10)О(4)С(11) 115,5(1), N(2)N(1)C(1) 119,5(1), N(2)N(1)H-N(1) 118(1), C(1)N(1)H-N(1) 122(1), N(1)N(2)C(8) 122,0(1),
N(1)C(1)C(2) 118,2(1), N(1)C(1)C(6) 120,9(1), C(2)C(1)C(6) 120,9(1), C(1)C(2)C(3) 119,3(1),
C(2)C(3)C(4) 120,4(1), C(3)C(4)C(5) 119,8(1), C(4)C(5)C(6) 120,6(1), C(1)C(6)C(5) 119,0(1),
О(1)С(7)С(8) 118,7(1), О(1)С(7)С(12) 121,3(1), C(8)C(7)C(12) 120,0(1), N(2)C(8)C(7) 124,8(1),
N(2)C(8)C(9) 110,7(1), C(7)C(8)C(9) 124,4(1), О(2)С(9)С(8) 126,8(1), О(2)С(9)С(10) 118,0(1), C(8)C(9)C(10) 115,2(1), О(3)С(10)О(4) 125,8(1), О(3)С(10)С(9) 122,8(1), О(4)С(10)С(9) 111,3(1). Полная таблица координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 873481).
Этиловый эфир 3-(4-метилфенил)гидразоно-2,4-диоксопентановой кислоты (2b)
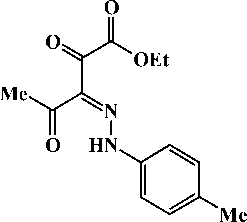
Выход: способ А - 1,43 г (52 %), способ Б - 1,29 г (47 %), т. пл. 110-112 °C.
ИК-спектр, V , см-1 (ваз. масло): 1734 vc = o, 1682 vc = o, 1628 vc = o, 1587, 1538, 1520, 1508 vch + vc = n, 1172, 1112 З пл сн , 1109 v c-o-c , 823, 798, 785 З непл сн .
Спектр ЯМР 1 H, 8 , м.д. (CDCI 3 ): 1,39 т (3Н, СН 3 СН 2 О. J 7,2 Гц), 2,36 с (3Н, СН 3 ), 2,64 с (3Н, СН 3 ), 4,40 к (2Н, СН 3 СН 2 О, J 7,2 Гц), 7,20 д (2Н, С в Н4, J 8,4 Гц), 7,25 д (2Н, С в Н4, J 8,4 Гц), 15,08 уш. с. (1Н, NH). "
Кристаллографические параметры: хорошо ограненные кристаллы С1 4 H1 6 N 2 O 4 моноклинной сингонии: a = 10,4868 (12) A, b = 7,6448 (10) A, c = 17,588 (2) А, а = 90,00 град, в = 96,936 (11) град, Y = 90,00 град, V = 1399,7 А3, М = 276,28, Z = 4, d выч = 1,311 г/см3, пространственная группа Р 2 1 /n . Основные длины связей, d , А: О(1)-С(8) 1,235(2), О(2)-С(10) 1,219(2), О(3)-С(11) 1,199(2), О(4)-С(11) 1,330 (2), О(4)-С(12) 1,463(3), N(1)-N(2) 1,293(2), N(1)-C(3) 1,416(2), N(1)-H-N(1) 0,90(2), N(2)-C(9) 1,329(2), C(1)-C(2) 1,383(2), C(1)-C(6) 1,392(2), C(2)-C(3) 1,391(2), C(4)-C(5) 1,386(2), C(5)-C(6) 1,391(2), C(6)-C(7) 1,509(2), C(8)-C(9) 1,472(2), C(8)-C(13) 1,486(2), C(9)-C(10) 1,457(2), C(10)-C(11) 1,534(2), C(12)-C(14) 1,498(3); основные валентные углы, to , град: С(11)О(4)С(12) 115,8(1), N(2)N(1)C(3) 119,5(1), N(2)N(1)H-N(1) 118(1), C(3)N(1)H-N(1) 122(1), N(1)N(2)C(9) 121,7(1), С(2)С(1)С(6) 121,7(1), С(1)С(2)С(3) 118,9(1), N(1)С(3)С(2) 121,4(1), N(1)С(3)С(4) 118,0(1), С(2)С(3)С(4) 120,6(1), С(3)С(4)С(5) 119,4(1), С(4)С(5)С(6) 121,4(1), С(1)С(6)С(5) 117,9(1), С(1)С(6)С(7) 121,3(1), С(5)С(6)С(7) 120,8(1), О(1)С(8)С(9) 118,8(1), О(1)С(8)С(13) 121,1(1), С(9)С(8)С(13) 120,1(1), N(2)С(9)С(8) 124,7(1), N(2)С(9)С(10) 110,6(1), С(8)С(9)С(10) 124,7(1), О(2)С(10)С(9) 127,1(2), О(2)С(10)С(11) 118,0(1), С(9)С(10)С(11) 114,9(1), О(3)С(11)О(4) 126,1(2), О(3)С(11)С(10) 123,2(1), О(4)С(11)С(10) 110,6(1), О(4)С(12)С(14) 106,3(2). Полная таблица координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 872885).
Этиловый эфир 3-(4-нитрофенил)гидразоно-2,4-диоксопентановой кислоты (2с)
O
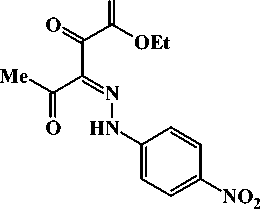
Выход: способ А - 1,81 г (59 %), способ Б - 1,28 г (42 %), т. пл. 128-130 °C.
ИК-спектр, V , см-1 (ваз. масло): 1735 vC = O, 1681 vC = O, 1642 vC = O, 1596, 1538, 1520, 1509 vCH + vC = N, 1338 V sNO2 , 1164, 1099 8 пл СН , 1100 vC -O-C , 848 (NO 2 ), 822, 792, 733 8 непл СН .
Спектр ЯМР 1 H, 8 , м.д. (CDCI 3 ): 1,41 т (3Н, СН 3 СН 2 О, J 6,9 Гц, Z -изомер), 1,41 т (3Н, СН 3 СН 2 О, J 6,9 Гц, Е- изомер), 2,52 с (3Н, СН 3 , Е- изомер 10 %), 2,68 с (3Н, СН 3 , Z- изомер 90 %), 4,44 к (2Н, СН 3 СН 2 О. J 6,9 Гц, Z -изомер), 4,46 к (2Н, СН 3 СН 2 О, J 6,9 Гц, Е- изомер), 7,45 д (2Н, С 6 Н 4 , J 9,0 Гц, Z -изомер), 7,57 д (2Н, С 6 Н 4 , J 9,0 Гц, Е- изомер), 8,30 д (2Н, С 6 Н 4 , J 9,0 Гц, Z -изомер), 8,32 д (2Н, С6Н4, J 9,0 Гц, Е- изомер), 14,05 уш. с. (1Н, NH, Е- изомер), 14,84 уш. с. (1Н, NH, Z -изомер).
Работа выполнена в рамках проекта № 1.2.11 «Синтез и исследование свойств высокоспиновых фрустрированных молекулярных магнетиков» Федерального агентства по образованию РФ на 2011– 2013 гг.
Список литературы Конденсация ацетона с диэтилоксалатом и арилдиазониевыми солями
- Реутов, О.А. Органическая химия/О.А. Реутов, А.Л. Курц, К.П. Бутин. -2-е изд. -М.: БИНОМ. Лаборатория знаний, 2005. -Ч. 3. -544 с.
- Китаев, Ю.П. Гидразоны/Ю.П. Китаев, Б.И. Бузыкин. -М.: Наука, 1974. -415 с.
- Пименова, Е.В. Взаимодействие ароилпировиноградных кислот и их производных с алифатическими и ароматическими диазосоединениями: автореф. дис.... канд. хим. наук/Е.В. Пименова. -Пермь, 1994. -17 с.
- (Гет)ароилпировиноградные кислоты и их производные как перспективные «строительные блоки» для органического синтеза/С.Г. Перевалов, Я.В. Бургарт, В.И. Салоутин, О.Н. Чупахин//Успехи химии. -2001. -№ 70 (11). -С. 1039-1058.
- Синтез и антимикробная активность замещенных 4-арил-3-фенилгидразоно-2,4-диоксоал-кановых кислот/Е.В. Пименова, Р.А. Хаматгалеев, Е.В. Воронина, Ю.С. Андрейчиков//Химико-фармацевтический журнал. -1999. -Т. 33, вып. 8. -С. 22-23.
- Металлопроизводные ρ-π-электроноизбыточных поликарбонильных систем с сочленёнными α-и β-диоксофрагментами. Сообщение 2. Синтез и строение натриевых енолятов оксопроизводных 1,3-дикарбонильных соединений/В.О. Козьминых, П.П. Муковоз, Е.А. Кириллова и др.//Вестник Оренбургского гос. ун-та. -2009. -№ 1 (95). -С. 128-140.
- Belskaya, N.P. Synthesis and properties of hydrazones bearing amide, thioamide and amidine functions/N. P. Belskaya, W. Dehaen, V.A. Bakulev//Special Issue Reviews and Accounts. -Arkivoc, 2010. -P. 275-332.
- Синтез, строение и рН-индикаторные свойства этилового эфира 3-(4-нитрофенил)гидра-зоно-2,4-диоксопентановой кислоты/Т.В. Левенец, Е.В. Листопад, В.О. Козьминых//Актуальные проблемы биологии, химии, физики: материалы Междунар. заочной науч.-практ. конф. -Новосибирск, 2011. -С. 126-129.


