Конформационные эффекты аллилзамещенных тио(окси)хинолинов
Автор: Шманина Елена Александровна, Барташевич Екатерина Владимировна, Ким Дмитрий Гымнанович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Краткие сообщения
Статья в выпуске: 24 (283), 2012 года.
Бесплатный доступ
Выполнен конформационный анализ молекулярных структур замещенных в положении 2 и 8 аллилтио- и аллилоксихинолинов. Показано, что конформационные состояния, включающие внутримолекулярные водородные связи N...H-C, могут препятствовать образованию межмолекулярных взаимодействий по основному центру - атому азота хинолинового кольца. Данные состояния способствуют стабилизации геометрии со сближенными реакционными центрами, ведущими к продуктам йодциклизации, наблюдаемым в эксперименте.
Тио(окси)хинолины, внутримолекулярная водородная связь, конформационный анализ
Короткий адрес: https://sciup.org/147160238
IDR: 147160238 | УДК: 547.831,
Текст краткого сообщения Конформационные эффекты аллилзамещенных тио(окси)хинолинов
Теоретическое исследование строения молекулярных систем, включающее конформационный анализ, позволяет выявить весь набор пространственных форм молекул и определить порядок их расположения в энергетической шкале согласно внутримолекулярным взаимодействиям [1, 2]. Необходимость проведения конформационного анализа при изучении реакционной способности новых органических соединений продиктована тем, что форма молекулы, наличие и сила сопряжения, возможность возникновения стерических препятствий, экранирующих доступность реакционных центров, выступают прямыми факторами, количественный учет которых может позволить контролировать условия эффективного синтеза полезных соединений.
Важным этапом исследования условий протекания реакции йодциклизации [3] является выявление конформационных структурных факторов, определяющих особенности электронного строения 2- и 8-аллилтио(окси)хинолинов, имеющих разнообразные донорные центры, которые могут активно вступать во взаимодействие с молекулами растворителей и реагентов. Например, в реакции йодциклизации, протекающей в избытке йода [4, 5], на первой стадии высока вероятность образования галогенных связей D…I–I, где D = N, O, S, C – основные центры, выступающие донорами электронов в структурах аллилтио-(окси)хинолинов.
Цель данной работы – установление влияния конформационной подвижности S-аллильного и O-аллильного заместителя в положениях 2 и 8 тио(окси)хинолинола на предпочтительность формирования комплексов с йодом, выступающих интермедиатами в реакции йодциклизации. Сформулированы следующие задачи: выполнить конформационный анализ аллилзамещенных тио-(окси)хинолинов; сравнить стерическую доступность электронодонорных центров, которые имеют потенциальную возможность связывать молекулярный йод за счет образования галогенных связей.
Экспериментальная часть
Конформационный анализ для изолированных молекулярных структур соединений (см. таблицу) проводился с использованием алгоритма Balloоn [6, 7]. На стадии отбора наиболее вероятных конформационных состояний последовательно привлекались программы для полуэмпириче-ских (RM1) квантово - химических расчетов MOPAC [8] и Conformers [9].
В процессе генерирования конформационных изомеров для каждой структуры получено от шести (для тиохинолинов) до восьми (для 8-аллилоксихинолина) наиболее вероятных структур с диапазоном полных энергий (A Etota i ): 1,2 ккал/моль - для 8-аллилтиохинолина; 1,4 ккал/моль -для 8-аллилоксихинолина; 4,3 ккал/моль – для 2-аллилтиохинолина; 7,2 ккал/моль – для 2-аллил-4-метилоксихинолина (см. таблицу).
Краткие сообщения
Теплоты образования и типы конформационных изомеров
|
Объект исследования |
Тип изомера |
Δ H обр , ккал/моль |
Об ъ ект исследования |
Тип изомера |
Δ H обр , ккал/моль |
|
1 |
60,28 |
2 |
27,14 |
||
|
3 |
60,46 |
1 |
27,71 |
||
|
NS |
5 |
60,61 |
NS |
3 |
27,94 |
|
6 |
63,97 |
1 |
28,21 |
||
|
6 |
64,14 |
4 |
28,30 |
||
|
2-аллилтиохинолин |
6 |
64,57 |
8-аллилтиохинолин |
3 |
28,55 |
|
2 |
27,14 |
CH3 |
1 |
13,41 |
|
|
6 |
27,72 |
1 |
13,73 |
||
|
ГП |
3 |
27,94 |
2 |
14,44 |
|
|
NO |
4 |
28,21 |
2 |
14,92 |
|
|
6 |
28,26 |
NO |
6 |
18,61 |
|
|
4 |
28,30 |
5 |
19,03 |
||
|
8-аллилоксихинолин |
6 |
29,81 |
2-аллил-4-метилоксихинолин |
6 |
20,60 |
|
5 |
30,29 |
Обсуждение результатов
Исходя из полученных результатов выделяются общие структурные особенности конформационных изомеров. Конформационные состояния могут быть объединены в группы, в которых структура стабилизирована одной или несколькими внутримолекулярными водородными связями типа C–H…N:
-
- взаимодействие атома азота с двумя атомами водорода заместителя, принадлежащим разным атомам углерода одинарной С–С-связи аллильного заместителя (тип 1);
-
- взаимодействие атома азота с двумя атомами водорода заместителя, принадлежащим одному атому углерода одинарной С–С-связи аллильного заместителя (тип 2);
-
- взаимодействие атома азота с одним атомом водорода при атоме углерода, связанным с атомом серы или кислорода (тип 3);
-
- взаимодействие атома азота с атомом водорода заместителя, связанн о го с атомом углерода при двойной связи, не являющимся концевым (тип 4);
-
- взаимодействие атома азота с атомом водоро д а, связанного с концевым атомом углерода при двойной связи аллильного заместителя (тип 5);
-
- отсутствие близко расположенных к атому азота атомов водорода аллильного з а местителя (тип 6).
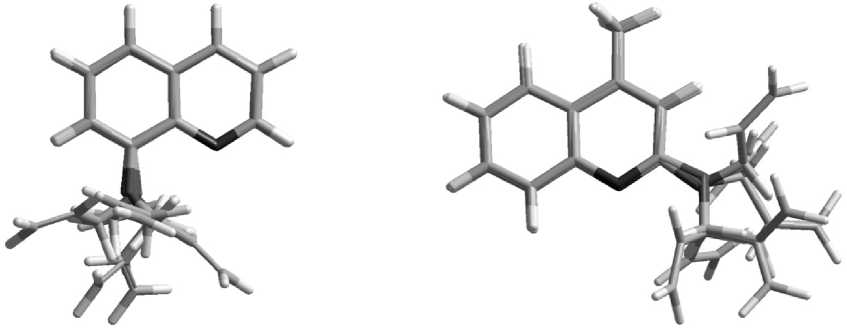
а) б)
Суперпозиции конформеров: а - 8-аллилоксихинолина; б - 2-аллил-4-метилоксихинолина
Разнообразие положений аллильного заместителя по отношению к хинолиновому кольцу показано на рисунке. Однако к энергетически более вы г одным конформационным состояниям приводит одновременное образование двух водородных связей азота: либо с водородом при двойной
Шманина Е.А., Барташевич Е.В., Ким Д.Г.
связи и метиленовой группы, либо с двумя атомами водорода метиленовой группы аллильного заместителя.
При анализе полных энергий конформационных изомеров очевидно, что аллильный заместитель в наиболее энергетически низких конформациях ориентирован таким образом, что экранирует самый сильный в молекуле нуклеофильный центр – атом азота хинолинового кольца.
Выводы
Для энергетически предпочтительных конформационных состояний тио(окси)хинолинов, имеющих аллильные заместители в положении 2 и 8, характерно экранирование атома азота хинолинового кольца, что приводит к стабилизации геометрии молекулы со сближенными реакционными центрами – атомов азота и углерода аллильной группы.
Такое конформационное состояние может выступать существенным препятствием к образованию взаимодействий с молекулярным йодом по атому азота, являющемуся самым сильным основным центром в молекуле. Этот фактор способствует образованию взаимодействий с реагентом по альтернативным донорным центрам – атому серы или кислорода, а также атому углерода аллильной группы, что способствует протеканию очередной стадии реакции галогенциклизации.
Список литературы Конформационные эффекты аллилзамещенных тио(окси)хинолинов
- Дашевский, В.Г. Конформационный анализ органических молекул/В.Г. Дашевский. -М.: Химия. -1982. -272 с.
- Comparative conformational analysis of isolated rotamers in methylamides of n-acetyl-α-L-amino acids/M.S. Kondratiev, A.A. Samchenko, V.M. Komarov, A.V. Kabanov//Mathematical models in biology, ecology and chemistry. -2006. -Vol. 2. -P. 444-454.
- Ким, Д.Г. О механизме галогенциклизациии 8-аллилтиохинолинов/Д.Г. Ким//Известия Челябинского научного центра. -2001. -Вып. 3, №12. -С. 56-59.
- Ким, Д.Г. Галогенциклизация 8-аллилтиохинолина/Д.Г. Ким//Химия гетероциклических соединений. -1997. -№ 8. -С. 1133-1135.
- Ким, Д. Г. Синтез и галогенциклизация 2-алкенилтиохинолинов/Д. Г. Ким//Химия гетероциклических соединений. -2008. -№ 11. -С. 1664-1668.
- Mikko, J. Generating conformer ensembles using a multiobjective genetic algorithm/J. Mikko, Mark S. Vainioand//Journal of chemical information and modeling. -2007. -Vol. 47. -Р. 2462-2474.
- Puranen, J.S. Accurate conformation-dependent molecular electrostatic potentials for high-throughput in silico drug discovery/J.S. Puranen, M.J. Vainio, M.S. Johnson//Journal of Computational Chemistry. -2009. -Vol. 31, No. 8. -P. 1722-1731.
- M0PAC2009, James J.P. Stewart, Stewart Computational Chemistry, Colorado Springs, CO, USA.
- Kolossvary, I. Compare-Conformer: a program for the rapid comparison of molecular conformers based on interatomic distances and torsion angles/I. Kolossvâry, W.C. Guida//Journal Chemical Computational Science. -1992. -Vol. 32, No. 3. -P. 191-199.


