Коррекция нарушений метаболизма суставного хряща и морфологическая оценка эффективности внутрисуставной озонотерапии при экспериментальном посттравматическом артрите
Автор: Захватов Алексей Николаевич, Беляев Александр Назарович, Кузнецов Сергей Иванович, Аткина Наталья Алексеевна
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Фундаментальная медицина
Статья в выпуске: 3, 2016 года.
Бесплатный доступ
Введение. Повреждение коленного сустава занимает одно из первых мест среди травм опорно-двигательного аппарата, составляя по разным источникам от 4,9 % до 24,0 % всех случаев травм и от 40 % до 50 % - среди повреждений суставов [1-3]. По данным Берглезова М. А. [1] и Насоновой В. А. [4], остеоартрозом крупных суставов страдает от 48 до 67,5 % трудоспособного (лица среднего и молодого возраста) населения России, причем 64-80% случаев имеет посттравматический характер. Таким образом, очевидна актуальность разработки современных методов диагностики, лечения травм коленного сустава и профилактики последующего прогрессирования посттравматического гонартроза. Цель исследования - изучить влияние внутрисуставной озонотерапии на некоторые показатели обмена коллагена и морфологические изменения тканей сустава при экспериментальном посттравматическом артрите. Материалы и методы. В ходе эксперимента на 132 белыгх нелинейных крысах было определено содержание фракций оксипролина в сыворотке крови и проведено морфологическое исследование суставного хряща, синовиальной оболочки и субхондрального слоя кости на фоне применения нимесулида, внутрисуставной озонотерапии и их комбинации. Результаты исследования. Комбинированное применение нимесулида и внутрисуставной озонотерапии при травматическом повреждении коленного сустава в большей степени способствует уменьшению альтерации коллагеновых элементов экстрацеллюлярного матрикса хряща и коррекции синтетических процессов в обмене коллагена (снижение БСО и отношения ПСО/СО), что предупреждает процессы избыточного фибриллогенеза и склерозирования тканей поврежденного сустава. При гистологическом исследовании хрящ вне зоны поражения и синовиальная оболочка существенно не отличались от хряща интактных животных. Зональность структуры хрящевой ткани вне очага повреждения четко прослеживалась. Фибрилляция поверхностной и промежуточной зоны не наблюдалась. При исследовании субхондральной кости деструкции и склероза костных балок обнаружено не было. Обсуждение и заключения. Экспериментальным путем было установлено, что сочетанное применение нимесулида и внутрисуставной озонотерапии при посттравматическом артрите препятствует развитию деструктивно-дистрофических изменений сустава, уменьшая биодеструкцию коллагеновых волокон и блокируя избыточную пролиферацию соединительной ткани, а также способствует регенерации дефекта.
Посттравматический артрит, оксипролин, коллаген, нимесулид, внутрисуставная озонотерапия
Короткий адрес: https://sciup.org/14720220
IDR: 14720220 | УДК: 616.72-002:612.014.464 | DOI: 10.15507/0236-2910.026.201603.359-369
Текст научной статьи Коррекция нарушений метаболизма суставного хряща и морфологическая оценка эффективности внутрисуставной озонотерапии при экспериментальном посттравматическом артрите
В настоящее время проблема травматических повреждений крупных суставов является актуальной, несмотря на разнообразие современных методов лечения [5–6]. Обеспокоенность данной проблемой объясняется тем, что в отдаленные сроки после травм суставов у 92 % больных имеется рентгенологическая картина деформирующего остеоартроза, приводяще- го к стойкой утрате нетрудоспособности [7–8].
В состав гиалинового хряща входят клетки – хондроциты и хондробласты, а также межклеточное вещество, которое представлено белково-поли-сахаридными комплексами и коллагеновыми волокнами [2; 9–12]. Известно, что травматическое повреждение сустава, сопровождающееся кровоизлиянием в его полость, в ранние сро- ки приводит к возникновению внутри-и внесуставных изменений и в первую очередь – развитию синовита. Хро-низация экссудативного процесса является одной из основных причин формирования вторичных пролиферативных и дегенеративно-дистрофических изменений [6; 11; 13].
Воспалительный процесс в суставе приводит к дисбалансу между катаболическими и анаболическими реакциями, протекающими в хрящевой ткани, в сторону увеличения активности распада коллагена и протеогликанов межклеточного матрикса. Их фрагменты попадают в синовиальную жидкость и усиливают воспалительную реакцию, в условиях которой наблюдается нарушение белоксин-тезирующей функции хондроцитов, в результате чего ими образуется короткоцепочечный нефибриллярный коллаген [14–15]. Оксипролин является специфической аминокислотой коллагена, поэтому может использоваться в качестве маркера его метаболизма [10; 16–19].
При развитии посттравматического артрита (ПА) наблюдается увеличение содержания оксипролина в сыворотке крови за счет его свободной (СО) и пептидосвязанной (ПСО) фракции [9; 20–21]. Синтез коллагена, напротив, характеризуется увеличением фракции белковосвязанного оксипролина (БСО). В настоящее время важную роль в патогенезе посттравматического остеоартроза отводится активации процессов перекисного окисления липидов, продукты которых усугубляют деструкцию хондроцитов и межклеточного матрикса суставного хряща [3–4; 22–23]. При этом патогенетически обоснованный подход к профилактике посттравматического остеоартроза в настоящее время отсутствует.
Учитывая механизмы развития острого асептического ПА, наиболее целесообразным в комплексном лечении является применение локаль- ной внутрисуставной озонотерапии, поскольку озон обладает широким спектром воздействия: анальгетическим, противовоспалительным, иммуномодулирующим; улучшает микроциркуляцию, оптимизирует про- и антиоксидантные системы, потенцируя действие других лекарственных препаратов [5; 16].
Цель исследования – изучить влияние внутрисуставной озонотера-пии на некоторые показатели обмена коллагена и морфологические изменения тканей сустава при экспериментальном ПА.
Материалы и методы
Эксперименты были проведены на 132 белых нелинейных крысах обоего пола массой 180–200 г., содержавшихся в стандартных условиях вивария ФГБОУ ВО «МГУ им. Н. П. Огарёва». Протокол экспериментов был составлен в соответствии с Конвенцией по защите животных, используемых в эксперименте и других научных целях (принятой Советом Европы в 1986 г.), с приказом МЗ РФ № 267 от 19.06.2003 «Об утверждении правил лабораторной практики»; он соответствует требованиям Хельсинкской декларации о гуманном отношении к животным (2000 г.), одобрен локальным этическим комитетом ФГБОУ ВО «МГУ им. Н. П. Огарёва».
Животные были разделены на 5 групп. Первую серию составили интактные животные в количестве 12 крыс. В контрольной (30 животных) и опытных группах под ингаляционным наркозом моделировали повреждение коленного сустава механическим путем в модификации Г. М. Дубровина [2]. Во II контрольной группе лечение не проводилось. Животным III группы (30 крыс), начиная со дня моделирования травмы, проводился курс лечения нимесулидом через зонд в среднетерапевтической дозе 2 мг/кг ежедневно в течение 10 дней. В IV группе (30 животных) проводилось внутрисуставное введение озоно-кислородной смеси в концентрации озона на выходе из аппарата 15 мг/л через день в количестве 5 сеансов. На животных V группы (30 крыс) изучалось комбинированное влияние нимули-да в дозе 2 мг/кг и внутрисуставного введения озоно-кислородной смеси в концентации 15 мг/л по указанной выше схеме введения. Для исследования от животных получали периферическую кровь и поврежденные коленные (скакательные) суставы конечностей.
Оценку метаболизма коллагена проводили по содержанию СО, ПСО и БСО в сыворотке крови по методу П. Н. Шараева [24] (на данную методику оценки интенсивности деструктивных процессов в суставе нами был получен патент № 2463000 от 10.10.2012 г.). Гистологическим методом изучали морфологию суставного хряща, синовиальной оболочки и субхондрального слоя костной ткани. Серийные срезы окрашивались гематоксилином и эозином. Исследование было проведено с использованием светового биологического микроскопа «Humascope Advanced Led» (Германия).
Животных выводили из эксперимента на 28-е сутки. Статистическая обработка результатов исследований была проведена с помощью t-критерия Стьюдента. Изменения считали достоверными при р < 0,05 (0,01; 0,001).
Результаты исследования
При исследовании сыворотки крови животных контрольной группы после моделирования травмы коленного сустава относительно интактной серии выявлено увеличение содержания
СО и БСО на 188,9 % и на 135,1 % соответственно; содержание ПСО выросло в 2,76 раза; коэффициент ПСО/ СО повышался и составил 1,38 ± 0,15 усл. ед. (p < 0,001).
На фоне внутрижелудочной нестероидной противовоспалительной терапии нимесулидом содержание СО в сыворотке крови было снижено на 20,5 %; ПСО – на 47,8 %; БСО – на 26,8 % по сравнению с соответствующими показателями в контрольной группы (p1 < 0,001). Коэффициент ПСО/СО был равен 0,91 ± 0,09 усл. ед.
При внутрисуставном введении газообразной озоно-кислородной смеси относительно данных контрольной серии наблюдалось снижение фракций оксипролина: уровень СО – на 25,0; концентрация ПСО – на 59,0%; БСО – на 39,4 % (p1 < 0,001). Коэффициент ПСО/СО составил 0,76 ± 0,05 усл. ед.
При комбинированном применении нестероидной противовоспалительной терапии нимесулидом и внутрисуставной озонотерапии фракции оксипролина в сыворотке крови по сравнению с данными контрольной серии изменились следующим образом: СО снизился на 35,1%; ПСО – на 66,4 %; БСО – на 47,8 %; коэффициент ПСО/СО – на 47,8 % (p1 < 0,001) (таблица).
При макроскопической оценке гиалиновый хрящ коленного сустава интактных животных имел беловаторозовую окраску, гладкую, блестящую поверхность и упругую структуру. Микроскопически гиалиновый хрящ эпифиза бедренной кости крысы имел сходство с человеческим, в нем выделялись 3 зоны: поверхностная, средняя (промежуточная) и глубокая.
Т а б л и ц а
T a b l e
Динамика некоторых показателей обмена коллагена при экспериментальном посттравматическом артрите на фоне комбинированного применения нимесулида и озона, 28-е сутки (M ± m)
Dynamics of some indicators of collagen metabolism in experimental post-traumatic arthritis by combination of nimesulide and ozone, 28 day (M ± m)
|
Показатель / Index |
Интактные животные (n = 12) / Intact animals (n = 12) |
Контрольная группа (n = 30) / Control group (n = 30) |
НПВС (n = 30) / NSAID (n = 30) |
В/с озон (n = 30) / Ozone (n = 30) |
НПВС + в/с озон (n = 30) / NSAID + ozone (n = 30) |
|
СО, мкмоль/л / FO, mmole/l |
13,74 ± 0,51 |
28,31 ± 0,94 (p < 0,001) |
22,51 ± 0,52 (p < 0,001; p1< 0,001) |
21,23 ± 0,45 (p < 0,001; p1< 0,001) |
21,23 ± 0,45 (p < 0,001; p1< 0,001) |
|
ПСО, мкмоль/л / PBO, mmole/l |
7,42 ± 0,42 |
39,36 ± 1,43 (p < 0,001) |
20,53 ± 1,07 (p < 0,001; p1< 0,001) |
16,13 ± 1,22 (p < 0,001; p1< 0,01) |
16,13 ± 1,22 (p < 0,001; p1< 0,01) |
|
БСО, мкмоль/л / PBH, mmole/l |
51,26 ± 0,89 |
123,93 ± 1,89 (p < 0,001) |
91,76 ± 1,20 (p < 0,001; p1< 0,001) |
75,19 ± 1,13 (p < 0,001; p1< 0,001) |
75,19 ± 1,13 (p < 0,001; p1< 0,001) |
|
ПСО/СО, усл. ед. / PBO/FO, mmole/l |
0,54 ± 0,02 |
1,38 ± 0,15 (p < 0,001) |
0,91 ± 0,09 (p < 0,01; p < 0,05) |
0,76 ± 0,05 (p < 0,001; p < 0,001) |
0,76 ± 0,05 (p < 0,001; p < 0,001) |
Примечания: p – достоверность отличий к данным интактных животных; р1 – достоверность отличий к данным контрольной группы / Note: p – reliatibility of differences in the data intact animals; р1 – significance of differences in the control group
При визуальной оценке у крыс контрольной серии в области коленного сустава наблюдался отек, стойкая сгибательная контрактура; при передвижении животные хромали и щадили травмированную конечность. Макроскопическое исследование суставной поверхности бедренной кости выявило в области медиального мыщелка дефект в виде углубления с нечеткими границами. Поверхность хряща имела желтовато-белую окраску без характерного блеска.
При световой микроскопии определялось нарушение цитоархитектоники хрящевой ткани, распространяющееся далеко от экспериментально нанесенной травмы. Отмечалось разволокнение поверхностной зоны и образо- вание узур, уменьшение количества клеточных элементов в лакунах и их дегенеративные изменения. В субхондральной кости обнаруживались признаки остеосклероза. Толщина суставного хряща была значительно ниже, чем у интактных животных, с одновременным сокращением численной плотности функционально активных хондроцитов, что способствовало дезорганизации коллагеновых фибрилл и формированию фиброзного хряща (рис. 1).
Деструктивно-дистрофические изменения обнаруживались также в синовиальной оболочке: атрофия и фиброз стромы, склероз сосудов микроцирку-ляторного русла и очаговая инфильтрация лейкоцитами.
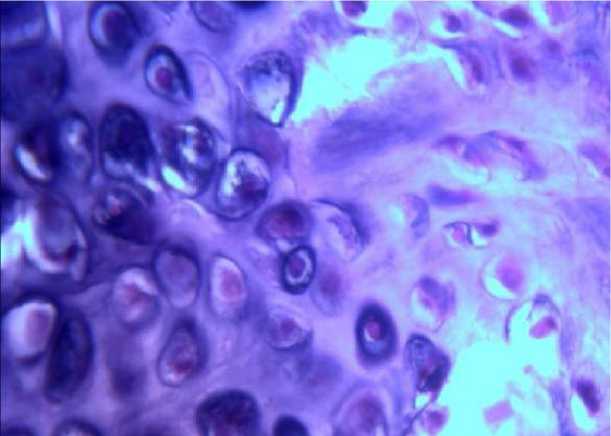
Р и с. 1. Гистологический препарат. Суставной хрящ коленного сустава крысы. Группа контрольная. (Посттравматический артрит). Увеличение 10х40. Окраска гематоксилином и эозином.
F i g 1. Histological preparation. Articular cartilage of rat knee joint. Group control. (Post-traumatic arthritis). Increased 10x40. Hematoxylin and eosin stain.
Суставы животных, получавших нимесулид, внешне были в удовлетворительном состоянии. Макроскопическое исследование выявило, что хрящ был тусклым, имел желтоватую окраску с участком организации в области травматического повреждения. При световой микроскопии были определены уменьшение количества хондроцитов поверхностной зоны, а также деструктивные изменения части клеточных элементов, деструкция межклеточного матрикса с образованием узур.
Аналогичные изменения наблюдались также в более глубоких слоях хрящевой ткани вплоть до субхондральной кости, где определялись признаки остеосклероза. Нарушение цитоархитектоники распространялось за пределы экспериментальной травмы. С морфологической точки зрения, в синовиальной оболочке была обнаружена картина хронического посттравматического синовита – фиброз, умеренная лимфоцитарная инфильтрация стромы и реактивные изменения синовиальных клеток.
У животных, получавших озон внутрисуставным способом введения, внешний вид сустава мало отличался от здорового. Макроскопически суставной хрящ имел свойственные ему цвет и блеск, область дефекта была покрыта соединительнотканным регенератом. Деструктивные изменения хряща ограничивались незначительным числом трещин поверхностной зоны в смежных с дефектом областях. Склеротические изменения субхондральной кости затрагивали отдельные трабекулы в зоне повреждения. Морфологическая структура синовиальной оболочки характеризовалась незначительной степенью воспаления в виде периваскулярной лейкоцитарной инфильтрации.
Наиболее выраженная регрессия морфологических изменений по сравнению с контрольными данными наблюдалась при комбинации перорального применения нимесулида и внутри- суставного введения озона. Отека в области коленного сустава не наблюдалось. Макроскопически участок хряща, соответствующий экспериментальной травме, отличался от другой локализации небольшим углублением и отсутствием типичного блеска. При гистологическом исследовании было выявлено, что сам дефект заполнен зрелой соединительной тканью, в которой определялось большое количество хондроцитов. Зональность структуры хрящевой ткани вне очага повреждения четко прослеживалась. Фибрилляции поверхностной и промежуточной зоны не наблюдалось. При исследовании субхондральной кости деструкции и склероза костных балок обнаружено не было (рис. 4). В синовиальной оболочке при морфологическом изучении редкой находкой были периваскулярные инфильтраты.
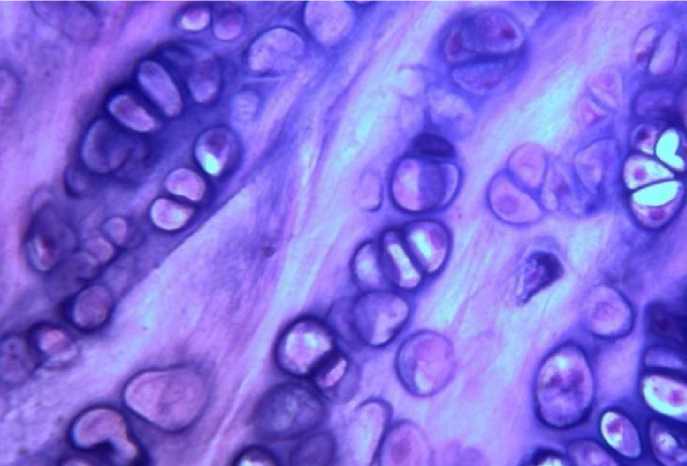
Р и с. 2. Гистологический препарат. Суставной хрящ коленного сустава крысы (Посттравматический артрит). Группа с комбинированным применением нимесулида и внутрисуставным введением озона. Увеличение 10х40. Окраска гематоксилином и эозином.
F i g 2. Histological preparation. Articular cartilage of rat knee joint (Post-traumatic arthritis). Group with the combined use of nimesulide and intra-articular injection of ozone. Increased 10x40. Hematoxylin and eosin stain.
Обсуждение и заключения
Моделирование ПА коленного сустава приводит к дисбалансу метаболизма коллагена, характеризующегося значительным ростом всех фракций оксипролина, свидетельствующем о деструктивных процессах коллагена с одновременной высокой активностью неполноценного фибриллогенеза, приводящего к избыточному накоплению соединительной ткани с развитием склерозирования хряща и субхондральной кости.
Нестероидная противовоспалительная терапия, уменьшая воспаление, препятствовала деградации биополимеров соединительной ткани сустава, однако не ограничивала избыточные процессы фибриллогенеза, о чем свидетельствует высокий уровень БСО сыворотки на поздних стадиях экспериментального ПА.
Комбинированное применение ни-месулида и внутрисуставной озонотера-пии при травматическом повреждении коленного сустава в большей степени способствует уменьшению альтерации коллагеновых элементов экстрацеллюлярного матрикса хряща и коррекции синтетических процессов в обмене коллагена (снижение БСО и ПСО/СО), в отличие от лечения нимесулидом и внутрисуставного введения озоно-кислородной смеси в качестве монотерапии.
Данный эффект обусловлен воздействием препаратов на различные звенья патогенеза ПА: с одной стороны, нимесулид подавляет хемотаксис нейтрофилов и макрофагов в очаг воспаления, снижая синтез простагландинов и провоспалительных цитокинов. С другой, озон устраняет тканевую гипоксию, оказывает иммуномодулирующий, противовоспалительный эффект, модифицирующее действие на структурно-функциональное состояние клеточных мембран, усиливая метаболические процессы в клетках. Это пре- дупреждает избыточный фибриллогенез и склерозирование тканей сустава.
Выявленные данные обосновывают комбинированное применение нестероидной противовоспалительной терапии и внутрисуставной озоноте-рапии, позволяющее в ранние сроки купировать воспалительный процесс в пораженном суставе, стимулировать заживление травматического дефекта и уменьшить развитие дегенеративнодистрофических процессов.
Полученные результаты обусловливают необходимость дальнейшего проведения углубленных доклинических исследований и планирования клинических испытаний эффективности комбинированного применения нимесулида и внутрисуставной озо-нотерапии у больных с травматическими повреждениями коленного сустава с целью предупреждения прогрессирования ПА.
Список литературы Коррекция нарушений метаболизма суставного хряща и морфологическая оценка эффективности внутрисуставной озонотерапии при экспериментальном посттравматическом артрите
- Берглезов М. А., Андреева Т. М. Остеоартроз: этиология, патогенез. Вестник травматологии и ортопедии им. Н. Н. Приорова. 2006. № 4. С. 79-86.
- Обоснование применения миелопида для профилактики посттравматического остеоартроза (экспериментальное исследование)/Г. М. Дубровин //Вестник травматологии и ортопедии им. Н. Н. Приорова. 2005. № 2. С. 60-62.
- Шостак Н. А. Остеоартроз: актуальные вопросы диагностики и лечения. Русский медицинский журнал. 2014. № 4. С. 278-281. URL: http://www.rmj.ru/articles/aktualnaya_problema/Osteoartroz%3A_aktualynye_voprosy_diagnostiki_i_lecheniya.
- Насонова В. А. Остеоартроз коленного сустава: причины развития, диагностика и профилактика. Consilium medicum. 2003. №2. С. 90-96. URL: http://old.consilium-medicum.com/media/consilium/03_02/90.shtml.
- Бархоткина Т. М., Томашевский Е С. Метод оценки эффективности озонотерапии. Медицинский альманах. 2013. № 3. С. 31-32. URL: http://cyberleninka.ru/article/n/metod-otsenki-elfektivnosti-ozonoterapii.
- Бурьянов А. А. Структурно-функциональные изменения костной ткани при неспецифических воспалительных поражениях суставов. Боль: суставы: позвоночник. 2013. № 1. С. 87-88. URL: http://www.mif-ua.com/archive/article/35770.
- Гришина Е. И., Бабинец О. М., Шулика С. А. Провоспалительные цитокины у больных остеоартрозом с метаболическим синдромом. Травма. 2011. Т. 12, № 4. C. 113-117. URL: http://www. mif-ua.com/archive/article/25645.
- Changes in serum and synovial fluid biomarkers after acute injury (NCT00332254)/J. B. Catterall //Arthritis Research & Therapy. 2010. Vol. 12, No. 6. P. 229.
- Зупанец И. А., Тюляков В. А., Шебеко С. К. Влияние комбинации глюкозамина гидрохлорида с парацетамолом на апоптоз хондроцитов в условиях развития системного стероидного артроза у крыс. Экспериментальная и клиническая фармакология. 2012. Т. 75, № 4. С. 34-37.
- Корочина К. В., Полякова В. С., Корочина И. Э. Реорганизация структур коленных суставов крыс с хронической сердечной недостаточностью. Фундаментальные исследования. 2014.
- Фундаментальная медицина № 10. С. 1335-1340. URL: http://cyberleninka.ru/article/n/reorganizatsiya-struktur-kolennyh-sustavov-krys-s-hronicheskoy-serdechnoy-nedostatochnostyu.
- Содержание АТФ и 2,3-ДФГ в эритроцитах при консервации и воздействии озона/B. Н. Крылов //Биомедицина. 2014. № 2. C. 37-12. URL: http://cyberleninka.ru/article/n/soderzhanie-atf-i-2-3-dfg-v-eritrotsitah-pri-konservatsii-i-vozdeystvii-ozona.
- Лечение локального глубокого дефекта хряща коленного сустава, сочетающегося с медиальным гонартрозом I стадии и варусной деформацией нижней конечности/Т. А. Куляба //Травматология и ортопедия России. 2011. № 1. С. 92-95.
- Биохимические изменения в синовиальной жидкости больных с остеоартрозом коленного сустава различной этиологии/Е. Л. Матвеева //Бюллетень ВСНЦ СО РАМН. 2013. № 5. С. 60-63.
- Роль интерлейкина-1В и интерлейкина-4В в патогенезе деформирующего артроза голеностопного сустава в разные сроки катамнестического периода наблюдения/А. О. Момбеков //Фундаментальные исследования. 2013. № 9. С. 1073-1076.
- Новочадов В. В., Гайфуллин Н. М., Фролов Д. М. Ремоделирование суставного хряща в условиях эндогенной интоксикации. Фундаментальные исследования. 2012. № 10-2. С. 271-275.
- Перетягин П. В., Мартусевич А. К., Перетягин С. П. Экспериментальная оценка состояния микроциркуляции при системном введении озонированного физиологического раствора. Биорадикалы и антиоксиданты. 2015. Т. 2, № 1. С. 54-61. URL: http://cyberleninka.ru/article/n/eksperimentalnaya-otsenka-sostoyaniya-mikrotsirkulyatsii-pri-sistemnom-vvedenii-ozonirovannogo-fiziologicheskogo-rastvora.
- Самойлов В. В., Мироманов А. М., Самойлова С. И. Значение цитокинов в патогенезе остеоартроза. Забайкальский медицинский вестник. 2014. № 2. С. 119-125.
- Ударцев Е. Ю. Морфогистохимические аспекты консервативного лечения больных с посттравматическим остеоартрозом крупных суставов нижних конечностей. Фундаментальные исследования. 2011. № 6. С. 182-187.
- Федоров В. Г. Структурная единица «синовиальный сустав» и основные принципы лечения остеоартроза и других дегенеративных заболеваний синовиального сустава. Успехи современного естествознания. 2015. № 1. С. 594-600. URL: http://www.natural-sciences.ru/ru/article/view?id=34862.
- Elvis A. M., Ekta J. S. Ozone therapy: a clinical review. Journal of Natural Science, Biology and Medicine. 2011. Vol. 2, No. 1. P. 66-70.
- Human knee synovial fluid cytokines correlated with grade of knee osteoarthritis -a pilot study/C. T. Vangsness //Bulletin of the NYU Hospital for Joint Diseases. 2011. Vol. 69, No. 2. P. 122-127.
- К вопросу моделирования остеоартроза коленного сустава у собак для изучения патогенеза (экспериментально-морфологическое исследование)/В. И. Шевцов //Гений ортопедии. 2012. № 1. С. 38-42.
- Oxidative stress in secondary osteoarthritis: from cartilage destruction to clinical presentation/C. Ziskoven //Orthopedic Reviews. 2010. Vol. 2, No. 2. P. 95-101.
- Шараев П. Н. Методы исследования обмена коллагена в клинике//Актуальные проблемы теоретической и прикладной биохимии: мат-лы науч. конф. Ижевск, 2001. С. 150-153.


