Критерии выбора диагностических методов у пациенток рецидивным раком яичников
Автор: Антонова И.Б., Ивашина С.В., Ашрафян Л.А., Бабаева Н.А., Алешикова О.И.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Лучевая диагностика
Статья в выпуске: 4 т.18, 2018 года.
Бесплатный доступ
Резюме Важным условием раннего выявления рецидивов рака яичников является применение современных, новых лучевых методов, что позволяет значительно улучшить результаты лечения и выживаемость пациенток. Неопределенность безрецидивного периода, отдаленное метастазирование, связанное с биологической особенностью опухолей яичников, предполагает включение дорогостоящих методов радионуклеидной визуализации (ПЭТ КТ) в программу динамического мониторинга после окончания комплексного лечения. В исследование были включены 147 пациенток рецидивным раком яичников I - IV ст. Первую группу составили 95 пациенток с безасцитным вариантом, вторую - 52 пациентки с асцитным вариантом. Подобное разделение на два патогенетических варианта рака яичников сопряжено с особенностями его клинического течения. Проведенные исследования позволили нам выстроить эффективный диагностический алгоритм, нацеленный на выявление ранних рецидивов рака яичников: ежемесячный маркерный (СА-125) и ультразвуковой мониторинг, вне зависимости от их результатов - раз в 3 месяца позитронно-эмиссионная томография при «условной» ремиссии заболевания.
Рак яичников, рецидив рака яичников, маркерная диагностика, сонография, позитронно-эмиссионная томография, асцитная форма рака яичников, безасцитная форма рака яичников
Короткий адрес: https://sciup.org/149132080
IDR: 149132080
Текст научной статьи Критерии выбора диагностических методов у пациенток рецидивным раком яичников
Criteria for selection of diagnostic methods in patients with recurrent ovarian cancer
Antonovа I.B., Ivashina S.V, Ashrafyan L.A., Babaeva N.A., Aleshikova O.I.
Federal State Budgetary Institution Russian Scientific Center of Roentgenoradiology (RSCRR) of the Ministry of Healthcare of the Russian Federation
Address: 117997 Moscow, Profsoyuznaya str., 86, Russian Scientific Center of
Roentgenoradiology
Authors
Antonova Irina Borisovna – MD, head of the research Department of prevention, complex diagnosis and treatment of oncological diseases of the Russian scientific center of radiology of the Ministry of health of the Russian Federation.
Ivashina Svetlana Vyacheslavovna – PhD, senior researcher of the research Department of prevention, complex diagnosis and treatment of oncogynecological diseases of the Russian scientific center of radiology of the Ministry of health of the Russian Federation.
Ashrafyan Levon Andreevich – academician of the Russian Academy of Sciences, Professor, MD, chief researcher of the research Department of prevention, complex diagnosis and treatment of oncological diseases
Babaeva Natalia Aleksandrovna – MD, leading researcher of the research Department of prevention, complex diagnosis and treatment of oncological diseases "Russian scientific center of radiology" of the Ministry of health of the Russian Federation
Aleshikova Olga Ivanovna – Ph. D., senior researcher of the research Department of prevention, complex diagnosis and treatment of oncogynecological diseases "Russian scientific center of radiology" of the Ministry of health of the Russian Federation
The contact person:
An important condition for early detection of recurrence of ovarian cancer is the use of modern, new radiation techniques that can significantly improve the results of treatment and survival of patients. The uncertainty of the relapse-free period, remote metastasis associated with the biological feature of ovarian tumors, requires the inclusion of expensive methods of radionuclide imaging (PET CT) in the program of dynamic monitoring after the end of complex treatment. The study included 147 patients with recurrent ovarian cancer (I – IV stages). The first group consisted of 95 patients without ascites while the second group included 52 patients with ascites.
We designed an effective diagnostic algorithm aimed at identifying early relapses of ovarian cancer: monthly marker (CA-125) and ultrasound monitoring, regardless of their results – once every 3 months positron emission tomography in "conditional" remission of the disease. Key words: ovarian cancer, ovarian cancer recurrence, marker diagnosis, sonography, positron emission tomography, ovarian cancer with / without ascites
Введение
Рак яичников относится к заболеваниям, представляющим значительные сложности, как на этапах первичной диагностики, так и в процессе мониторинга проведенного лечения и выявления рецидивов. Отсутствие ярко выраженной клинической симптоматики и патогномоничных признаков обуславливают большой удельный вес поздних стадий в структуре заболевания и, как результат, неутешительные результаты лечения с высокой частотой рецидивирования. Ежегодно в мире регистрируется более 225 тыс. больных раком яичников. В России ежегодно заболевают более 13 тыс. женщин, а погибают в течение года около 7,8 тысяч [5]. Улучшение результатов лечения, повышение выживаемости больных, является сложной задачей, пути решения которой лежат в нескольких плоскостях. Одним из важнейших направлений является улучшение методов ранней диагностики рецидивов заболевания [1, 2, 3]. Своевременная диагностика рецидивного рака яичников значительно улучшает результаты лечения и прогноз.
Совершенствование диагностической тактики невозможно без понимания путей развития опухолевого процесса, который при раке яичников отличается вариабельностью. Клиницистам очень хорошо известно, что в группе рака яичников, можно, в общих чертах, обозначить два варианта течения заболевания. Первый вариант наиболее многочисленный, когда заболевание диагностируется на стадии III - IV, сопровождается асцитом. При втором варианте поражается один или оба яичника, отсутствует визуально определяемая диссеминация или она весьма ограничена (в пределах малого таза), нет асцита. Понимание этих процессов позволяет четче дифференцировать диагностический поиск. Несмотря на появление таких высокотехнологичных методов, как ПЭТ-КТ, невозможно недооценивать значимость ультразвуковой диагностики. Доступность этого исследования в сочетании с различными режимами и методиками его проведения позволяет значительно улучшить результаты диагностики, вывести ее на новый уровень.
Цель исследования
Необходимость формирования современной диагностической модели ранней диагностики рецидивов рака яичников явилось основанием для формулировки основной цели исследования: изучение информативности трех методов (маркерная диагностика с использованием СА-125, сонография и ПЭТ КТ), которые, по опыту нашей клиники, на современном этапе способны внести существенный вклад в решение этой проблемы.
Материалы и методы
Для формирования наиболее полного экспертного заключения мы применяем сочетание нескольких ультразвуковых технологий: стандартный 2-Д режим, 3-Д ангиография, энергетическое допплеровское картирование. Немаловажную роль в диагностическом поиске сыграло использование возможностей позитронно-эмиссионных томографов, способных выявить опухолевый метаболизм на достаточно ранних этапах канцерогенеза.
Клинический материал включал анализ 147 наблюдений больных с рецидивом рака яичников. Все больные были подразделены на две группы: 95 пациенток с безасцитным вариантом заболевания и 52 пациентки с асцитным вариантом заболевания, учитывая что клиническое течение и локализация рецидивных очагов при асцитных и безасцитных вариантах различны. Это позволило нам определить диагностическую ценность используемых методик. В основе проведенных исследований лежит концепция о двух патогенетических вариантах спорадического РЯ, где индуцирующей составляющей в развитии спорадического РЯ становится патологическая пролиферация в ходе повреждения покровного эпителия яичников во время овуляции. Источником этой пролиферации становится опухолевая стволовая клетка. При этом имеется два варианта развития заболевания. Если покровный эпителий представлен постнатальными разрастаниями и гетеротопиями (производные Мюллерова эпителия), то изначально имеет место относительно локализованный опухолевый процесс в зоне яичников или малого таза, постепенно распространяющийся по брюшной полости (I вариант). Именно при локализованных или относительно локализованных вариантах РЯ можно отметить такое многообразие гистологических типов (эндометриоидный, муцинозный, серозный, светлоклеточный рак). Если же покровный эпителий представлен мезотелиальным компонентом, то пролиферативный импульс распространен на весь мезотелий. При этом изначально имеет место обширное опухолевое поле (весь мезотелий брюшной полости, а в ряде случаев и плевральной полости). Формируется II вариант РЯ, где изначально заболевание имеет системный характер и невозможно зафиксировать начальный этап канцерогенеза.
Результаты
Проведенные нами исследования показывают, что не только появления солидных очагов в малом тазу от 5 мм, но и утолщение брюшины до 5 – 7 мм на фоне минимального объема свободной жидкости (15 – 30 мл), в ходе динамического наблюдения, могут свидетельствовать о рецидиве заболевания. Минимальные размеры рецидивных опухолевых очагов составляли 5 -10 мм и выявлены в 58 клинических случаях, что составило 39,5 %. При оценке васкуляризации рецидивных опухолей в режиме 3-Д ангиографии кровоток регистрировался не во всех наблюдениях, а его интенсивность была неодинаковой. Значительная часть рецидивных опухолевых очагов были аваскулярны (82 наблюдения, 55,8 %), или имели скудный кровоток (23 наблюдения, 15,6 %); умеренный и выраженный кровоток зарегистрирован лишь в 42 случаях (28,6 %) (Рисунки 1 - 3).
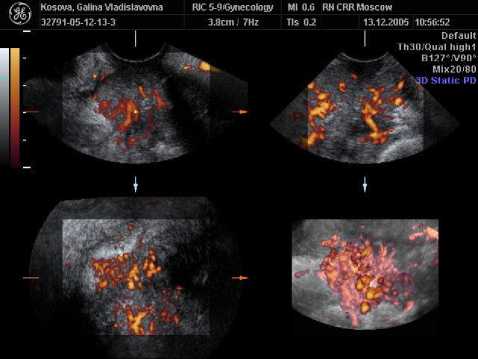
Рис.1. 3-Д эхограмма гиперваскуляризации рецидивного рака яичников в прикультевой области
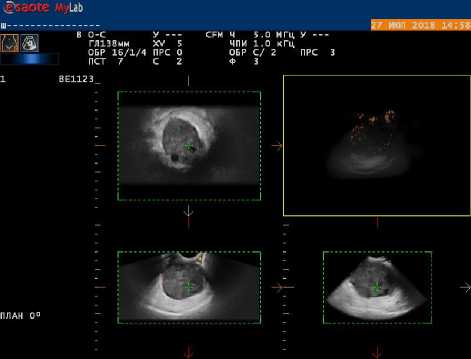
Рис. 2. 3-Д эхограмма рецидивного очага рака яичников со скудным периферическим кровотоком
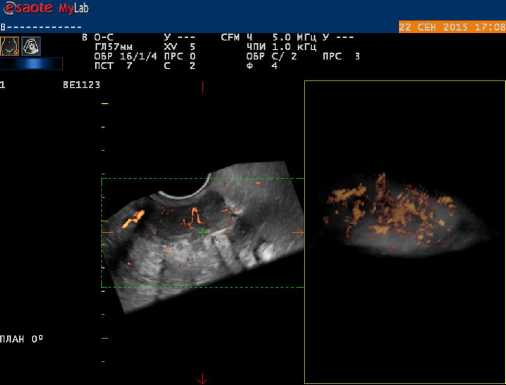
Рис. 3. Допплерограмма и 3-Д ангиограмма рецидивного очага рака яичников в прикультевой области
В группе пациенток (28,6 %) с умеренным и выраженным кровотоком в рецидивных очагах была оценена эффективность полихимитерапии. Положительным эффектом проводимого лечения было уменьшение количества цветовых локусов, снижение скорости кровотока и увеличение индекса резистентности.
Включение высокотехнологичных ультразвуковых методов (ЭДК, 3-Д реконструкция) для динамического мониторинга у пациенток рецидивным раком яичников увеличило информативность трансвагинальной сонографии до абсолютной при множественных очагах в малом тазу.
Большая часть выявленных рецидивов наблюдалась в диапазоне от 3 мес. до 1,5 лет. Однако в трех случаях (2 %) рецидивные опухоли яичников возникли спустя 3 года и более лет после проведения комплексного лечения первичной опухоли. Важно отметить, что динамическое наблюдение у пациенток с раком яичников необходимо продолжать даже спустя 3 – 5 лет после, казалось бы, достигнутого безрецидивного периода. Для успешного лечения пациенток рецидивным раком яичников необходимыми условиями являются: ранее выявление как очагов прикультевой зоны, так и выявление отдаленных очагов, учитывая особенности метастазирования. Необходимо обратить внимание, что на первом месте оказались рецидивные очаги прикультевой области, которые составили 63,9
% (94 пациентки), на втором и третьем месте по частоте поражения идут лимфатические узлы (тазовые и парааортальные) - 32,6% (48 пациенток) и париетальная брюшина таза -24,5 % (36 пациенток). Достаточно часто имеет место поражение капсулы печени (16,3%, 24 пациентки) и мезотелиального покрова диафрагмы (12,2%, 18 пациенток). Нами выделена группа пациенток с рецидивом рака яичников в виде одного опухолевого очага (25.2 %, 37 пациенток), у которых возможно проводить повторные операции.
Подобное деление на одиночные и множественные очаги сопряжено с тактикой лечения рецидивного рака яичников: при одиночных очагах на первом этапе применяется хирургическое лечение, при множественных очагах необходимо проведение полихимотерапии.
Как известно, из-за невысокой информативности маркера СА-125, возможности маркерной диагностики рецидивного рака яичников ограничены,. Однако в своих исследованиях мы попытались рассмотреть возможный подъем СА-125 с наименьшего уровня, который был достигнут после окончания комплексной терапии. Анализ результатов онкомаркера СА-125 показал, что при безасцитных вариантах рецидива практически у половины больных (49,1%) уровень маркера СА-125 в пределах нормальных его значений. У трети больных (30,3%) с асцитным вариантом рецидива показатели СА-125 также в пределах нормы. Информативность маркерной диагностики можно несколько увеличить, если учесть его колебания в пределах физиологической нормы, о чем говорят многие исследователи. В проведенных исследованиях выявилась значительная разница в уровнях экспрессии маркера СА-125 в группах с метастатическим и без метастатического поражения. Частота пациенток с высоким уровнем экспрессии маркера практически удваивается при поражении брюшины, что еще раз свидетельствует о значении мезотелиального компонента как фактора, напрямую связанного с продукцией протеина СА-125.
Как уже было отмечено, при раке яичников имеется достаточно широкий спектр зон проявления рецидивной болезни. Этот фактор требует использования таких методов диагностики, которые могли бы одномоментно давать информацию о всех анатомических зонах [3, 4]. Современная позитронно-эмиссионная томография имеет три очень важных компонента:
-
• метод одномоментно дает информацию о возможном патологическом накоплении 18F-ФДГ (18F- Фтордезоксиглюкозы) всего тела;
-
• чувствительность метода зависит от метаболической активности опухоли, что при рецидивном процессе позволяет выявлять очаги минимального размера (от 7 мм);
-
• метод можно использовать в рамках мониторинга (раз в 3 месяца).
Изучая информативность метода при выявлении опухолевых очагов в разных анатомических зонах, мы убедились в возможностях ПЭТ достаточно эффективно решать и эту задачу: в 84,2% выявлены рецидивные опухоли, наличие которых подтверждено дополнительными методами визуализации и хирургическими вмешательствами.
Достаточно эффективной оказалась ПЭТ и при вариантах, где имелся всего лишь один рецидивный очаг - 79,3% (Рис. 4).
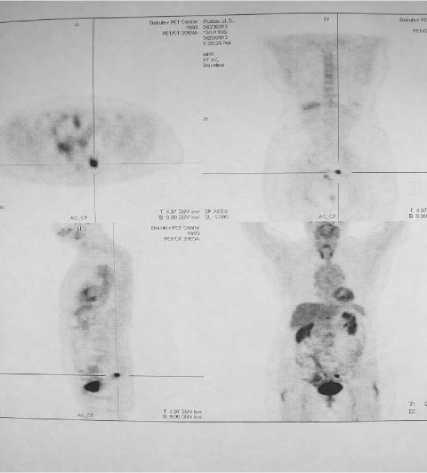
Рис. 4. Рецидивный очаг в прикультевой зоне по данным ПЭТ
Неэффективность диагностического мониторинга ПЭТ была связана или с кистозным типом рецидива, или небольшим (до 0,7 см) опухолевым очагом. Полученные результаты, в силу небольшого числа наблюдений, не позволяют говорить о высокой достоверности данных. Вместе с тем, уже сегодня на их основании можно достаточно точно осмыслить возможности ПЭТ в проблеме рецидивного рака яичников, что крайне необходимо для окончательного построения алгоритма мониторинга. В наших исследованиях мы рассмотрели три важных метода (маркер СА-125, сонография, ПЭТ) с позиций эффективной диагностики рецидивов рака яичников. Если сонография, в основном, является методом локальной диагностики, то маркерная и ПЭТ диагностики могут рассматриваться, как методы выявления заболевания на системном, полиорганном уровне.
Расчеты показывают, что наибольшая эффективность метода при рецидивах рака яичников проявилась в ходе сонографии малого таза: чувствительность – 91,2 %, специфичность – 87,7 %. Наименьшая чувствительность и специфичность при маркерной диагностике – 78,2% и 85 % соответственно. Для ПЭТ чувствительность составила 82,3%, специфичность – 89,1%. Таким образом, учитывая разнообразие клинического проявления рецидивных опухолей яичников, мы видим необходимость сочетанного использования методик, так как каждая из них имеет определенную роль в диагностическом процессе. Выводы
Накопленный опыт комплексного использования лучевых методов исследования у больных рецидивным раком яичников позволил определить возможности каждого метода и предложить программу исследования больных: при безасцитном варианте рецидива рака яичников предпочтительна сонография и ПЭТ КТ, при асцитном варианте – маркерная диагностика и сонография. Ежемесячное комплексное ультразвуковое исследование в сочетании с показателями онкомаркеров являются важными не только для постановки диагноза рецидива рака яичников, но и необходимыми для оценки эффективности проводимого химиотерапевтического лечения, динамики развития патологического процесса. Вне зависимости от результатов ультразвуковой и маркерной диагностики, мы рекомендуем проведение ПЭТ КТ раз в три месяца для поиска возможного отдаленного метастазирования.
Список литературы Критерии выбора диагностических методов у пациенток рецидивным раком яичников
- Ашрафян Л.А. и др. Ранняя диагностика рака эндометрия и яичников. Практическая онкология. 2009. Т. 10. №. 2. С. 71-75.
- Ашрафян Л.А., Асланиди И.П., Мухортова О.В. и др. Возможности позитронноэмиссионной томографии в диагностике первичного и рецидивного рака яичников: обзор литературы // Опухоли женской репродуктивной системы. 2012. №. 1. С. 75-81.
- Когай Н.В. Возможности сонографии, позитронно-эмиссионной томографии и серологического метода исследования в диагностике рецидивов рака яичников: дисс. Кандидата медицинских наук: 14.01.13/ Когай Н.В. 2013. 99 с.
- Ашрафян Л.А., Асланиди И.П., Мухортова О.В. и др. Возможности позитронноэмиссионной томографии в диагностике первичного и рецидивного рака яичников: обзор литературы//Опухоли женской репродуктивной системы. 2012. №. 1. С. 75-81.
- Каприн А.Д., Старинский В. В., Петрова Г. В. Злокачественные новообразования в России в 2013 году (заболеваемость и смертность). 2015. 250 с.


