Ксантан – целевой продукт биотехнологии пищевого, биомедицинского и технического назначения
Автор: Волова Т.Г., Прудникова С.В., Шишацкая Е.И.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Пищевые технологии
Статья в выпуске: 6, 2025 года.
Бесплатный доступ
Цель исследования – анализ современного состояния перспективных исследований и промышленных разработок в области выявления закономерностей синтеза и оптимизации условий получения ксантана, оценка мировых объемов производства и эффективности применения в различных областях. Ксантан обладает исключительными свойствами, включающими экологическую чистоту и биоразрушаемость, устойчивость к широкому диапазону температур, активной реакции и солености среды, неньютоновское поведение, высокую вязкость при низких концентрациях (600–2000 мг/л), устойчивость к механической деградации. Свойства ксантана обеспечили широкое применение в пищевой и кормовой, фармацевтической, косметической, биомедицинской, агрохимической, нефтяной промышленности в качестве загустителей, эмульгаторов, стабилизаторов суспензий и флокулянтов и прочих компонентов, улучшающих качество продуктов. В пищевой промышленности ксантан используют при изготовлении мясных и молочных продуктов, соусов, мороженого, желе и джемов, хлебобулочных изделий. Применение ксантана стабилизирует продукты, делает их структуру более пластичной, уменьшает потери влаги при обработке и хранении. Ксантан входит в состав фармпрепаратов, повышает качество и усвояемость кормов, повышает эффективность процессов нефтедобычи, имеет большие перспективы в биомедицине, клеточной и тканевой инженерии, в разработке материалов и биосистем для очистки стоков и охраны окружающей среды. Обзор содержит анализ научных публикаций и результатов интеллектуальной деятельности, включающих характеристики штаммовпродуцентов ксантана, результаты оптимизации состава питательных сред, условий биосинтеза ксантана, информацию о ведущих производителях ксантана и эффективности его применения.
Ксантан, ксантановая камедь, штаммы-продуценты, Xanthomonas campestris, биосинтез, промышленное производство ксантана, области применения ксантана
Короткий адрес: https://sciup.org/140310251
IDR: 140310251 | УДК: 663.1:606 | DOI: 10.36718/1819-4036-2025-6-265-290
Текст научной статьи Ксантан – целевой продукт биотехнологии пищевого, биомедицинского и технического назначения
Введение. Биотехнологические процессы обеспечивают получение широкого спектра востребованных целевых продуктов пищевого, кормового, биомедицинского и технического назначения с использованием различных углеродных субстратов, включая отходы техносферы. Использование отходов в биотехнологических процессах является значимым вкладом в «The Circular Economy», направлено на снижении объемов накопления отходов в биосфере, повышение эффективности использования сырьевых ресурсов и промышленных производств.
Актуальным продуктом биотехнологии являются камеди, представляющие собой группу полисахаридов, которые при растворении в воде в низких концентрациях образуют вязкие растворы и гидрофильные коллоиды [1]. Особое место среди камедей принадлежит полисахариду ксантану – ксантановой камеди. Общепринятые синонимы и международные названия ксан-тановой камеди (ксантановая камедь, ксантан, ксантановая смола, ксантановый биополимер, ксантановый загуститель для буровых растворов, биополимер ксантановой смолы, биополи- мер ксантан, загуститель ксантан, ксантановый загуститель, E415, Xanthan Gum). Ксантан, открытый в 1950-х гг. в Northern Regional Research Laboratories (NRRL) Министерства сельского хозяйства США [2], относится к одним из самых ранних и известных бактериальных экзополиса-харидов. Обширные исследования ксантана были начаты в зарубежных промышленных лабораториях в 1960-х гг. Это завершилось созданием полукоммерческого производства под названием Kelzan® компанией Kelco®. Коммерческие производства ксантана за рубежом стали активно создавать, начиная с 1964 г.
Ксантан как продукт микробного синтеза представляет собой экономически эффективную альтернативу полисахаридам растительного и животного происхождения. Связано это с тем, что бактерии синтезируют полисахариды в больших количествах в биотехнологических процессах с использованием различных субстратов, включая промышленные отходы, независимо от климатических и погодных условий, не требуя для этого больших площадей, без применения экстенсивных технологий выделения и очистки, как это принято при выделении из растительного сырья. Бактерии, продуцирующие ксантан, распространены повсеместно и могут быть выделены обычными методами традиционной микробиологии из водных и наземных сред, таких как морская вода, сточные воды, почвы, растения, фрукты, овощи, микробиом кишечника и ферментированная пища [3, 4].
Рост спроса на ксантан связан с его широким применением – в производстве продуктов питания, агрохимии, косметологии, биомедицине, нефтедобыче и др. Спектр областей применения ксантана постоянно расширяется. Самые крупные промышленные производства ксанта-новой камеди созданы в Китае, США, Австралии и Канаде. Основными производителями являются Jungbunzlauer, ADM, Cargill, CP Kelco, Deo-sen Biochemicals, Fufeng Group, IFF (Dupont) и Meihua Group [5, 6] . Рыночная цена ксантана составляет 1500–4000 долларов США за тонну [7] . По сравнению с другими микробными полисахаридами ксантан конкурентоспособен по стоимости и, следовательно, является приоритетным вариантом с точки зрения производительности, а также в экономическом аспекте.
Начиная с 50-х гг. прошлого века и до настоящего времени в России и за рубежом активно исследуются различные аспекты биотехнологии ксантана, выделяют новые штаммы, привлекают более дешевые и доступные субстраты [8–13]. Значительный вклад в исследования, направленные на поиск продуцентов ксантана и разработку технологий его получения, вносят научные коллективы РФ, среди которых – кафедра биотехнологии, биохимии и биоинженерии (Национальный исследовательский Мордовский государственный университет им. Н.П. Огарева); химический факультет МГУ, Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН; Санкт-Петербургский государственный университет промышленных технологий и дизайна; Кубанский сельскохозяйственный университет; ООО «Газпромнефть НТЦ» и др. Значимым событием стали представительные обзоры профессора А.И. Нетрусова и др. [3] и профессора В.В. Ревина и др. [14], в которых суммирован текущий прогресс исследований штаммов бактерий, продуцирующих различные экзополисахариды – бактериальную наноцел-люлозу (полимер глюкозы), ксантан, леван, включая их характеристики и источники выделения. Обзор H.A.H. Ibrahim et al. [4] рассматри- вает экзополисахариды, синтезируемые экс-тремофильными микроорганизмами, их синтез и оптимизацию производства для снижения стоимости и повышения производительности. В обзоре Е. Ефременко и др. [15] рассмотрены перспективы получения экзополисахаридов с применением каталитических биосистем на основе иммобилизованных клеток и ферментов.
В РФ промышленного производства ксантана до сих пор не создано, хотя планы обсуждаются с середины 2000-х гг. XXI в. На территории Технопарка «Мордовия» планировали создать предприятие мощностью 2 тыс. т ксантана в год, однако проект не реализован. В 2019 г. «Газпромнефть» планировала запустить проект по созданию производства ксантановой камеди, но он также не был реализован; остановлен аналогичный проект компании «Иннобиопром Юг». Активные исследования проводит Газпром («Промбиотех» и SioBio), который планирует проектирование и строительство завода мощностью 10 тыс. т ксантана в год. Обсуждается вопрос создания производства ксантановой камеди в Татарстане в ООО «АлНЭКо» (г. Альметьевск) [16].
Потребности РФ в ксантане – стратегическом для страны продукте биотехнологии – оценивают в 16 000 т в год (12 000 млн руб.). Объемы импорта ксантановой камеди, производимой в основном в Китае, растут. Согласно расчетам аналитиков DISCOVERY Research Group, объем рынка ксантановой камеди в России в 2019 г. составил 14,9 тыс. т, что на 3,3 % больше, чем в 2018 г., при этом 13 019,7 т, или 72,2 % от всего объема ввоза ксантана, будет предназначено для нефтегазовой промышленности [17].
Ключевые задачи, решение которых необходимо для наращивания объемов производства ксантана, повышения его доступности и расширения областей применения, включают необходимость поиска новых штаммов-продуцентов с широким органотрофным потенциалом, привлечение доступных углеродных субстратов, включая отходы, оптимизацию процессов ферментации и выделения ксантана из культуральной среды.
Цель исследования – анализ современного состояния перспективных исследований и промышленных разработок в области выявления закономерностей синтеза и оптимизации условий получения ксантана, оценка мировых объемов производства и характеристика областей применения.
Задачи: сбор и анализ результатов научных исследований и научно-практических разработок в области биотехнологического получения ксантана; характеристика физико-химических свойств, объемов промышленного производства и различных областей применения.
Объекты и методы: содержание научных публикаций и результаты интеллектуальной деятельности (РИД), включающие характеристики штаммов-продуцентов ксантана, результаты оптимизации состава питательных сред и условий культивирования, технологий выделения и получения готового продукта, информация о ведущих производителях ксантана и мировых объемах производства, а также данные эффективности применения ксантана в различных областях. Поиск публикаций и патентов для настоящего обзора выполнен по ключевым словам и их комбинациям в библиографических базах данных и научных электронных библиотеках (Scopus, elibrary.ru, PubMed, Google Scholar) и открытых реестрах ФГБУ «Федеральный институт промышленной собственности» за период 2000–2024 гг.
Результаты и их обсуждение
Химическая структура и свойства ксан-тана. Ксантан – нетоксичный биоразлагаемый экзополисахарид, синтезируемый различными штаммами бактерий, по большей части представителями Xanthomonas campestris (Pammel 1895) Dowson 1939, с использованием сахаров в качестве источника углерода и энергии. Молекула ксантана состоит из повторяющихся пента-сахаридных единиц, образованных D-глюкозой, D-маннозой и D-глюкуроновой кислотой в молярном соотношении 2,8 : 2,0 : 2,0 (рис. 1).
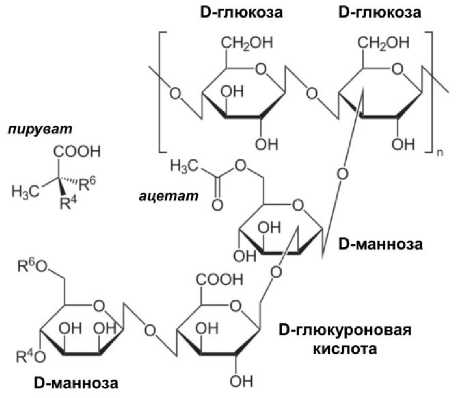
Рис. 1. Химическая структура ксантана Chemical structure of xanthan
Основная цепь ксантановой камеди образована двумя молекулами D-глюкозы, связанными β-1,4 гликозидными связями, и трисахаридной боковой цепью. Боковая цепь образована молекулой D-глюкуроновой кислоты между двумя молекулами D-маннозы. Внутренняя манноза ацетилирована и присоединена к каждой второй молекуле глюкозы в остове через α-1,2 гликозидные связи. Примерно половина конечных молекул маннозы содержит пировиноградную кислоту (пирувилманнозу). Звенья глюкуроновой кислоты связаны с D-маннозой через β-1,3 гликозидные связи. Эти боковые цепи перемежаются по всей основной цепи и различаются по длине. Объединение этих отдельных моносахаридных компонентов наделяет ксантановую камедь ее исключительной структурой и свойствами. Боковые цепи маннозы обеспечивают разветвленность и гибкость молекулы, в то время как боковые цепи глюкуроновой кислоты способствуют ее анионному характеру. Наличие боковых цепей маннозы и глюкуроновой кислоты делает ее высокогидрофильной. Это свойство способствует ее загущающим и гелеобразующим способностям в водных растворах [18, 19].
Исключительные свойства ксантана включают неньютоновское поведение, высокую вязкость при низких концентрациях (600–2000 мг/л), низкую чувствительность вязкости к изменениям солености, устойчивость к механической деградации, стабильность по отношению к температуре (до 90 °C), биоразлагаемость и экологическую чистоту [19].
Растворы ксантана стабильны в широком интервале активной реакции среды, а также термостабильны, когда структура полимера упорядочена (при высокой ионной концентрации), но не стабильны, когда макромолекулярная структура неупорядоченная (при низкой ионной концентрации) [20].
При повышенных температурах ксантан демонстрирует конформационные изменения. Структура ксантана становится неупорядоченной, что приводит к снижению его вязкости и изменению его реологического поведения. Однако при более низких температурах он демонстрирует высокоупорядоченную и жесткую структуру из-за когезионного внутримолекулярного и межмолекулярного взаимодействия. Это обеспечивает ксантану его характерную вязкость и псев-допластичное поведение. Высокая молекулярная масса ксантановой камеди обуславливает его способность к загущению, а жесткость полимерных цепей делает их устойчивыми к механическому сдвигу при высокой солености и/или концентрации двухвалентных ионов. В водном растворе ксантан демонстрирует конформацию от порядка к беспорядку. В средах с различной концентрацией ионов макромолекулярная структура ксантановой камеди переходит от неупорядоченной конформации к более жесткой или упорядоченной структуре из-за эффекта экранирования заряда.
Штаммы-продуценты ксантана. Важная проблема, решение которой необходимо для повышения эффективности процессов биосинтеза ксантана, - поиск новых штаммов-продуцентов, обладающих высокими продукционными показателями и широким органо-трофным потенциалом, позволяющим использовать в качестве ростового субстрата различные источники углерода. Ксантан синтезируют бактерии рода Xanthomonas, принадлежащие к классу Gammaproteobacteria типа Proteobacteria. Типовой штамм - X. campestris ATCC 33913T. X. campestris чаще всего используется для промышленного производства ксантана, при этом существует несколько других видов рода Xan-thomonas, которые могут синтезировать ксан- тан, включая X. pelargonii, X. phaseoli, X. Malva-cearum, X. arbicola, X. axonopodis и X. citri [2123]. Все представители рода Xanthomonas являются фитопатогенами и поражают широкий спектр растений, включая некоторые сельскохозяйственные, например капусту, люцерну и бобовые. Анализ эффективности производства ксантановой камеди с использованием потенциала различных видов Xanthomonas (X. Arbo-ricola, X. axonopodis, X. campestris, X. citri, X. fragaria, X. gummisudans, X. juglandis, X. phaseoli и X. vasculorium) показал, что самая высокая продукция и степень конверсии С-субстрата (80 %) у X. campestris [24].
В настоящее время исследованы метаболические, генетические и биохимические характеристики продуцентов ксантана, что позволяет создавать оптимальные условия культивирования для максимальной реализации биосинтетического потенциала штаммов. Выявлено, что продукция и качество ксантана зависят от многих параметров и переменных, включая состав питательной среды, тип источника углерода, температуру, pH, интенсивность массообмена по кислороду, объем и качестве инокулята, метод культивирования, продолжительность ферментации и т. д.
Биотехнологический синтез ксантана. В большом массиве публикаций, включая обзоры, описаны найденные основные параметры биосинтеза ксантана и стратегии оптимизации его производства в промышленных масштабах, удовлетворяющих требованиям биоэкономики [25-29] .
Для получения ксантана используют известные, хорошо отработанные и освоенные методы глубинного культивирования в ферментерах с перемешивающими устройствами. В промышленных масштабах ксантан получают путем погруженной аэробной ферментации в динамических условиях. Питательные среды, используемые для выращивания X. campestris , являются комплексными. Этому важному аспекту биотехнологии ксантана уделялось и уделяется большое значение [30–35]. Наиболее широко используемая среда - это среда «YM» [36] и полу-синтетический вариант среды YM, обозначенный как «YM-T» [37, 38].
Питательная среда для получения ксантана составляется исходя из того, что концентрация компонентов, необходимая для роста клеток, должна отличаться от состава среды, необходимого для суперпродукции ксантана. Для микробиологического синтеза ксантановой камеди необходимо несколько питательных веществ, прежде всего источники углерода (основной ростовой субстрат) и азота, а также соли калия, железа и кальция и др. Большинство штаммов-продуцентов ксантана усваивают сахара по укороченному пути Энтнера – Дудорова; известны также продуценты с пентозофосфатным путем метаболизма сахаров. Глюкоза и сахароза являются наиболее часто используемыми источниками углерода. Концентрация источника углерода оказывает значительное влияние на выход ксантана; принятая концентрация источника углерода – порядка 2–4 %; более высокие концентрации ингибируют рост бактерий [31, 39, 40]. Источником азота служат органические и неорганические формы [31, 41, 42]. Важное значение на стадии наращивания клеточной биомассы и стадии синтеза ксантана имеет соотношение C/N [31, 43]. Оптимизация условий суперпродукции ксантана показала, что рост отношения С/N в среде максимизирует выходы ксантана, накопление которого стимулируется лимитированием какого-либо минерального компонента конструктивного обмена микробного метаболизма [30, 44]. Рекомендованный оптимальный состав среды для производства ксантана, предложенный F. Garcia-Ochoa et al. [33], содержит следующий набор реагентов (г/л): сахароза (40,0), лимонная кислота (2,1), NH4NO3 (1,144), KH2PO4 (2,866), MgCl2 (0,507), Na2SO4 (0,089), H3BO3 (0,006), ZnO (0,006), FeCl3· 6H2O (0,020), CaCO3 (0,020), концентрированная HCl (0,13 мл/л) и для стабилизации pH до 7,0 добавляется NaOH.
Влияние физико-химических параметров среды на рост X. campestris и выход ксантана изучены при разных температурах (от 25 до 35 °C) и активной реакции среды [9]. Установлено, что оптимальные условия для производства ксанта-на с использованием известных и эксплуатируемых штаммов X. campestris составляют 28–30 °C и pH 7–8 [45–48]. Нейтральные значения pH являются оптимальными для роста продуцентов ксантана, однако в процессе накопления ксанта-на в культуре pH снижается до 5 из-за кислотных групп, присутствующих в ксантане. Некоторые авторы рекомендуют производить корректировку рН, используя растворы щелочей (KOH, NaOH и NHОН), но другие авторы не считают контроль рН необходимым. Так, в работе F. Garcia-Ochoa et al. [49] показано, что поддержание нейтральных значений рН при культивировании усиливает рост клеток, но производство ксантана прекращается после достижения стационарной фазы роста. Когда pH не контролируется, производство ксантана продолжается и во время стационарной фазы.
Для производства ксантана пригодны различные типы биореакторов, но наиболее распространены биореакторы с механическим перемешиванием, в которых скорость массопере-носа кислорода зависит от скорости потока воздуха и скорости оборотов мешалки. Исследование различных стратегий массопереноса кислорода и насыщения культуральной среды кислородом показали, что скорость потока воздуха, как правило, следует поддерживать на постоянном уровне, обычно 1,0 л/л мин. Напротив, режим перемешивания культуральной среды, регулируемый скоростью вращения перемешивающего устройства, следует закономерно изменять по ходу развития культуры и изменения физиологического состояния и метаболизма микробных клеток – от более низких значений (200–300 об/мин) в начале ферментации при низкой концентрации клеток продуцента в культуре от момента засева, до более высоких значений (400–600 об/мин) по мере увеличения урожая биомассы клеток и ксантана, изменяющих плотность культуральной среды [50–52].
Разработка доступных питательных сред. Высокая стоимость питательных сред является ограничивающим фактором для экономичного производства ксантана. Поэтому актуальный и важный аспект биопроцессов получения ксантана – решение проблемы снижения стоимости за счет расширения субстратных сценариев и применение различных источников углерода, помимо сахаров (глюкозы и сахаразы), включая отходы промышленности. Связано это с тем, что не менее 30 % от общих затрат на производство ксантана приходится на питательные среду, главным образом источник углерода [53]. Этот аспект биотехнологии ксантана – в перечне актуальных и важных исследований. До недавнего времени наиболее принятой для производства ксантана считали солевую среду с сахарозой [28], хотя известно, что источником углерода для производства ксантана могут служить крахмалы (кукурузный, картофельный), которые имеют относительно высокую стоимость [10].
Поиску доступных источников углерода для ксантана уделяется большое и оправданное внимание. Рассматриваются следующие группы промышленных отходов, потенциально пригодных в качестве углеродного источника для биотехнологического получения востребованных полисахаридов: (1) отходы пивоваренной и безалкогольной промышленности; (2) агропромышленные отходы; (3) отходы лигноцеллюлозных биоперерабатывающих заводов, целлюлозных заводов и сахарной промышленности; (4) текстильные фабрики; (5) отходы промышленности по выращиванию микроводорослей; (6) отходы биодизельной промышленности [54] .
Нарастающий поток публикаций свидетельствует о значимости проблемы поиска доступных субстратов для получения ксантана. Описаны различные типы отходов, опробованные в составе сред для выращивания продуцентов ксантана, включая кожуру фруктов и овощей, апельсиновую цедру [55]; отходы переработки моркови и тыквы [53]; гидролизаты отходов хлеба, а также различных кухонных отходов [56, 57]; щелочные гидролизаты гемицеллюлоз [58]; патока [59]; сыворотка производства сыра [60]; сточные воды ряда производств [61] и другое.
В качестве доступного углеродного субстрата для получения ксантана рассматривается глицерин - крупнотоннажный отход производства биодизеля. Особо привлекательным выглядит идея использовать наиболее дешевый неочищенный глицерин, так называемый «сырой» глицерин, который весьма активно исследуют для биосинтеза различных целевых продуктов биотехнологии. Однако такой глицерин содержит различные примеси (метанол, этанол, неорганические соли, металлы, длинноцепочечные жирные кислоты и мыла), которые токсичны для микроорганизмов, в том числе присутствие таких примесей в глицерине ингибирует развитие продуцентов [62]. Показано, что выход ксантана на этом доступном углеродном источнике, к сожалению, не превышает 7,6 и 11 г/л [63, 64].
В целом анализ литературы показывает актуальность и важность поиска доступных источников углерода, в том числе штаммов, толерантных к глицерину как перспективному субстрату для крупнотоннажного производства ксантана.
Способы выделения и очистки ксантана. Следующая значимая проблема для оптимизации процессов производства ксантана - это выделение полисахарида из культуральной среды, очистка и высушивание. Высокая вязкость культуральной среды, содержащей ксантан, представляет собой серьезную проблему при извлечении биомассы бактериальных клеток из нее. Выделение ксантана из культуральной среды -сложный и дорогостоящий процесс. Конечная культуральная среда обычно содержит от 10,0 до 30,0 г/л ксантана, 1,0-10,0 г/л клеток продуцента, от 3,0 до 10,0 г/л остаточных компонентов питательной среды и экзометаболитов клеток [65]. С повышением концентрации ксантана культуральная среда становится очень вязкой, это затрудняет извлечение ксантана и отделение от биомассы клеток. Процесс является сложным, энергоемким из-за вязкости, для обработки культуральной среды ее обычно разбавляют [66]. Метод очистки ксантана определяется областью применения и экономикой. Использование ксантана для повышения нефтедобычи требует удаления частиц, таких как клетки, которые могут засорить пористую нефтеносную породу. Для использования в пищевых продуктах ксантан освобождают от микробных клеток и компонентов питательной среды.
Процесс выделения ксантана включает следующие этапы: 1) дезактивация и удаление (или лизис) микробных клеток; 2) осаждение ксантана; 3) обезвоживание; 4) сушка и измельчение [9]. Все процедуры должны исключать деградацию ксантана. Процесс осаждения ксантана выполняют с использованием растворителей (этанол, метанол, изопропиловый спирт, ацетон и т. д.). Совершенствование и оптимизация методов осаждения ксантана включают расширение перечня реагентов-осадителей, совершенствование последующего процесса извлечения ксан-танового осадка с применением центрифугирования, ультрафильтрации. Заключительная стадия - высушивание (тепловое, распылительное, лиофильное).
Разбавление высоковязкого раствора ксан-тана предшествует фильтрации. Для разбавления применяют воду, спирт или смеси спирта и солей. Разбавленную культуральную среду фильтруют для удаления твердых частиц. Ксан-тан в растворе можно рассматривать как гидрофильный коллоид, образующий истинный раствор в воде. Осаждение полимера достигается путем снижения растворимости коллоида при добавлении солей или смешивающихся с водой нерастворителей [67]; использования смесей солей и алкоголя [65]; осаждения с трехвалентными или четырехвалентными солями [66]. Наиболее распространенный метод первичного выделения и очистки ксантана – осаждение с использованием смешивающихся с водой спиртов. Однако стоимость спирта вносит значительный вклад в общую стоимость производства ксантана. Поэтому актуальная задача – снижение объемов расходуемого спирта или замена его на другие, более доступные реагенты. Например, поливалентные катионы (кальций, алюминий и четвертичные аммониевые соли) эффективны для осаждения ксантана. Использование спирта вместе с солями позволяет значительно сократить расходы спирта [65, 68]. Более существенно объемы реагентов уменьшаются при использовании спирта и двухвалентных солей, но при этом образуются менее растворимые соли ксантана. Применение спирта и одновалентных солей, например хлорида натрия 1,0 г/л, вдвое сокращает расход спирта. Усовершенствованию методов для производства ксантана уделяется большое внимание [69]. Мембранные процессы все чаще используются для концентрирования высоковязкой культуральной среды. Показано, что ультрафильтрация позволяет экономить до 80 % энергии, необходимой для извлечения ксантановой камеди [70]. Таким образом, направления для решения и оптимизации способов осаждения ксантана и выделения из культуральной среды для упрощения этих процедур и снижения затрат реагентов и энергии обозначены.
После осаждения ксантана его сушат под вакуумом или с принудительной циркуляцией инертного газа для предотвращения возгорания органического растворителя в осадке. После сушки ксантан измельчают до заданного размера для необходимой степени диспергирования и скорости растворения. При измельчении высушенного ксантана необходимо соблюдение осторожности, чтобы в процессе теплового высушивания не происходило разложение ксантана [42] .
Коммерциализация и мировое производство ксантана. В России исследования по выделению штаммов-продуцентов ксантановой камеди и микробиологическому синтезу ксанта-
Вестник КрасГАУ. 2025. № 6 (219) на проводятся с 2000-х гг., однако промышленные производства отсутствуют.
В Республике Татарстан разработан способ культивирования X. campestris NRRL В-1459 (депонирован в ВКПМ под номером В-611) на средах с сахарозой или свекловичной мелассой в качестве источника углерода с выходами ксантана до 15 г/л [71]. Запатентован способ получения ксантана при культивировании штамма X. cаmpestris ВКПМ В-2228 на среде, содержащей гидролизованную щепу низкосортной древесины [72]. В Мордовском государственном университете им. Н.П. Огарева разработан способ получения ксантана штаммом X. cam-pestris В-12968 от 9,5 до 15,6 г/л на средах с сахарозой, мелассой и кукурузным крахмалом [73]; на среде с агар-агаром выход ксантановой камеди повышен до 20,9 г/л [74]; разработан способ синтеза ксантана штаммом X. theicola В-11268, обеспечивающий выход 21,2 г/л на среде с сахарозой и 27,9 г/л – на среде с мелассой [75]; выделен новый штамм X. campestris B-3503D, синтезирующий ксантан на среде с мелассой с выходом ксантана до 27,9 г/л [76].
В ООО «Газпромнефть НТЦ» запатентованы способы получения ксантановой камеди с использованием штамма X. fuscans В-13738 при культивировании на средах с сахарозой и мелассой с выходом ксантана 29,5 и 24,2 г/л [77] и штамма X. campestris ВКМ-615 при использовании воды с пониженным содержанием дейтерия – на среде с глюкозой, мелассой и гидролизатом рыбной муки выход ксантана достиг 51,5 г/л [78]. В Кубанском сельскохозяйственном университете в ВКПМ зарегистрирован штамм X. сampestris В-6720, в культуре которого на средах, содержащих экстракт отходов кукурузы, свекловичную мелассу или осахаренный крахмал, выход ксантановой камеди достигает от 17,4 до 20,1 г/л [79]. В УрФУ им. первого Президента России Б.Н. Ельцина разработан способ синтеза ксантановой камеди при культивировании штамма X. campestris B-6720 (из коллекции ВКПМ) на ферментированном соевом молоке; выходы ксантана составили 8,8 г/л [80].
Зарубежные научные исследования и разработки, ориентированные на промышленный синтез ксантановой камеди, опередили РФ на несколько десятилетий. В Китае, США, странах Тихоокеанского региона и Северной и Южной Америки проводят активные исследования раз- личных аспектов биотехнологии ксантана, имеют собственные штаммы продуценты, в основном природные штаммы Xanthomonas campestris, но также и генетически модифицированные микроорганизмы. В этих странах созданы и функционируют производства ксантановой камеди с различными объемами выпуска этого важного продукта; разработаны и запатентованы способы получения ксантановой камеди с различными выходами, от единиц до 20–30 г/л и более.
Зарегистрированы патенты на получение ксантановой камеди с использованием патоки сахарной свеклы в культуре X. сampestris с выходами до 23 г/л [81]; методом ферментации с использованием тростникового сока с выходом ксантана от 20 до 36 г/л [82]; с использованием гидролизатов дрожжевой биомассы и выходами ксантана от 9,37 до 15,09 г/л [83]. Запатентован способ синтеза ксантановой камеди на стоках котловой воды с электростанции [84]; способ получения беспигментной ксантановой камеди с использованием беспигментного штамма Xan-thomonas позволяет производить промышленную ксантановую камедь с высокой эффективностью без производства асептического флавина с выходами 41,1 г/л [85]; запатентован способ получения ксантановой камеди в питательной среде с ограничением азота, серы или фосфора в культуре X. campestris и выходом ксантановой камеди 9,32 г/л [86]; метод получения улучшенной ксантановой камеди с использованием штамма X. campestris CFBP 176 [87]; известен способ получения высококачественного ксантана с использованием штаммов X. cam-pestris NRRL B-12075 и NRRL B-12074 при непрерывном режиме культивирования [88]; запатентован процесс производства ксантановой камеди, растворимой в солевом растворе в культуре X. campestris [89]; известен способ получения ксантановой камеди с использованием в качестве сырья отходов патоки или маточного раствора отходов глюкозы [90].
Ксантан в настоящее время является одним из основных микробных экзополисахаридов, производимых в промышленных масштабах. Мировой объем производства ксантана значительно вырос с 2019 г. и достигает 50 000 т в год [91]. По различным оценкам рынок ксанта-новой камеди вырастет с 754,8 млн долл. США в 2024 г. до 996,3 млн долл. США к 2029 г. со среднегодовым темпом роста 5,71 % [5]. Ожидается, что ее рыночная стоимость достигнет 1,2 млрд долларов США к 2030 г. На мировом рынке продаж ксантановой камеди лидируют США, Канада, страны Тихоокеанского региона, включая Китай, Австралию, Малайзию и Индию. Компании – лидеры среди мировых производителей ксантановой камеди [5, 6]:
– Archer Daniels Midland Company (США) – крупнейшая компания-производитель сельскохозяйственных культур и продуктов их переработки;
– Shandong Fufeng Fermentation Co., Ltd. (Китай) – пищевая и химическая компания, один из ведущих производителей ксантановой камеди в Китае;
– MeiHua Holdings Group Co., Ltd. (Китай) – пищевая, биофармацевтическая и химическая корпорация, крупный переработчик сельскохозяйственного сырья;
– CP Kelco (США) – производитель натуральных ингредиентов для пищевой промышленности;
– International Flavors & Fragrances, Inc. (IFF) (США) – крупнейший производитель ароматизаторов, отдушек и ингредиентов для пищевой промышленности и ее дочерняя компания Dan-sico (Дания);
– J.M. Huber Corporation (США) – корпорация, производящая потребительские и промышленные товары);
– Jungbunzlauer Suisse AG (Швейцария) – ведущий производитель натуральных ингредиентов для пищевой, фармацевтической, косметической промышленности.
Рост спроса на ксантан связан с его широким применением. Помимо нефтедобычи, значительный сегмент потребления приходится на пищевую и кормовую промышленности, а также фармацевтику, косметологию, медицину и другие области.
Области применения ксантана. Уникальные свойства ксантана обеспечили широкое применение в различных областях: пищевой, фармацевтической, косметической, химической, текстильной, нефтяной промышленности в качестве загустителей, эмульгаторов и стабилизаторов суспензий, флокулянтов и добавок, улучшающих качество различных продуктов (табл., рис. 2) [6, 9, 25].


