Лечение острого психоза вследствие употребления синтетических каннабиноидов
Автор: Кекелидзе З.И., Клименко Т.В., Козлов А.А., Шахова С.М.
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Клиническая наркология
Статья в выпуске: 3 (96), 2017 года.
Бесплатный доступ
Цель: разработка эффективной стратегии терапии больных психотическими расстройствами вследствие употребления синтетических каннабиноидов. Материал: 43 больных от 18 до 45 лет в связи с употреблением СК и развитием психотического состояния в 2014-2016 г. проходили стационарное лечение. Методы: клинико-анамнестический, клинико-психопатологический, клинико-катамнестический, лабораторно-инструментальный, статистический. Всем проведено химико-токсикологическое исследование проб мочи. Результаты: сравнительное изучение терапевтической эффективности различных методов лечения психозов вследствие употребления синтетических каннабиноидов показало, что включение в комплексную терапию психозов нейролептических средств повышает эффективность терапии, улучшает приверженность больных к лечению и увеличивает вероятность отказа больных от возобновления приема синтетических каннабиноидов.
Новые психоактивные вещества, синтетические каннабиноиды, спайсы, психозы
Короткий адрес: https://sciup.org/14296001
IDR: 14296001 | УДК: 616.89-02:615:616.89-008.441.33
Текст научной статьи Лечение острого психоза вследствие употребления синтетических каннабиноидов
Со второй половины сентября 2014 г. на территории Российской Федерации (далее – РФ) стали регистрироваться случаи массовых отравлений вследствие употребления так называемых курительных смесей. В Кировской области, Сургуте и Ханты-Мансийском автономном округе более 2 тысяч человек было госпитализировано по экстренным показаниям с диагнозом «Отравление веществом неизвестного происхождения». Число летальных исходов на территории РФ только за 2014 г. превысило 900. В анализах мочи пациентов было выявлено вещество MDMB (N)-Bz-F-тридиметилбутановая кислота каннабиноидной синтетической группы JWH [ 1, 2] .
Первой на рынке появилась курительная смесь Spice (спайс), которая до сих пор остается самой известной. Несмотря на большое количество конкурирующих продуктов (Spice Gold, Spice Diamond, Arctic Spice, Silver, Aroma, K2, Genie, Scene, Dream), понятие спайс стало использоваться как имя нарицательное, под которым подразумеваются любые курительные смеси, используемые с целью одурманивания [3, 4].
Помимо сухого растительного материала, например, высушенные листья или смолы, в состав курительных смесей распылялись экстракты разнообразных растений (шалфей предсказателей Salvia divinorum, гавайская роза Argyreia nervosa, голубой лотос Nymphea caerulea и другие), содержащие в своем составе биологически активные вещества, обладающие психоактивными эффектами [5, 6, 7]. Но в последующем в состав курительных смесей стали вводить синтезируемые в подпольных лабораториях синтетические каннабиноиды (далее – СК) [6], которые в последние годы являются основным психоактивным веществом (далее – ПАВ) в составе курительных смесей.
СК представляют собой большую группу разных химических соединений, не связанных между собой, которые первоначально были синтезированы для изучения эндоканнабиноидов (эндогенные нейромедиаторы, связывающиеся с каннабиноидными рецепторами) и потенциально возможного их применения в терапевтических целях [78]. СК взаимодействуют с CB1 и CB2 каннабиноидными рецепторами, вызывая психотропные эффекты, сходные с дей- ствием дельта-9-тетрагидроканнабинола, первичной психоактивной составляющей каннабиноидов, являющегося алкалоидом каннабиса и агонистом каннабиноидного рецептора. В отличие от тетрагидроканнабиноидов, оказывающих лишь частичное воздействие на CB1-рецепторы, СК являются полными агонистами CB1-рецепторов, что обусловливает большую силу их эффекта, приводит к росту продолжительности их действия и повышению количества побочных явлений, в том числе вероятности развития психозов вследствие их употребления.
Несмотря на достаточно длительную историю описания психозов, ассоциированных с потреблением СК, данный вопрос по-прежнему остается малоизученным. Клинические контролируемые исследования, характеризующие психотический потенциал СК, а также исследования, посвященные разработке эффективной терапевтической тактики в отношении данных пациентов, отсутствуют. В литературе встречаются лишь ограниченные клинические данные, основанные на отчетах токсикологических центров [9, 10].
Цель исследования . Разработка эффективной стратегии терапии больных с психотическими расстройствами вследствие употребления синтетических каннабиноидов.
МАТЕРИАЛЫ И МЕТОДЫ
Обследовано 43 больных, у которых на различных этапах употребления СК и формирования зависимости к ним развилось психотическое состояние, по поводу которого они в период с 2014 по 2016 г. находились на стационарном лечении в клинике Национального научного центра наркологии – филиал ФГБУ «Федеральный медицинский исследовательский центр психиатрии и наркологии им. В.П. Сербского» Минздрава России (далее – ННЦ наркологии). В обследуемой клинической выборке у 15 (35,3%) больных диагностировано пагубное употребление СК, у 28 больных (64,7%) – синдром зависимости от СК. Диагностика пагубного употребления СК и синдрома зависимости от СК осуществлялась в соответствии с критериями МКБ-10.
В исследовании в качестве основных методов использовались клинико-анамнестический, клиникопсихопатологический, клинико-катамнестический, лабораторно-инструментальный и статистический. Для квантификации состояния пациентов прилагались психометрических шкалы.
Всем пациентам в лаборатории аналитической токсикологии ННЦ наркологии было проведено химико-токсикологическое исследование проб мочи. Во всех исследованных образцах выявлены СК, наиболее часто среди обнаруженных СК детектированы JWH, AB-PINACA и TMCP [11].
Среди обследованных больных большинство были лицами мужского пола (38; 89,0%). Возраст больных варьировал в пределах от 18 до 45 лет, средний возраст составил 25±0,1 года.
Психотические состояния развивались либо в состоянии интоксикации СК (28 чел.; 65,1%), либо на фоне абстинентных расстройств (12 чел.; 27,9%). В отдельных случаях (3 чел.; 7,0%) возникновение психотического состояния имело отсроченный дебют вплоть до 20 дней после последнего употребления СК. Независимо от этапа употребления СК и формирования зависимости к ним (этап пагубного употребления или синдром зависимости от СК) выявлено, что достоверно чаще психоз развивался в состоянии интоксикации СК (65,1%) (табл. 1).
Таблица 1
Частота психоза в зависимости от фазного состояния
|
Фазное состояние |
Пагубное употребление СК |
Синдром зависимости от СК |
|
Интоксикация |
34,9% (15 чел.) |
30,2% (13 чел.) |
|
Абстинентный синдром |
16,3% (7 чел.) |
11,6% (5 чел.) |
|
С отдаленным дебютом |
4,7% (2 чел.) |
2,3% (1 чел.) |
|
Всего |
55,8% (24 чел.) |
44,2% (19 чел.) |
По психопатологической структуре с учетом клинико-динамического течения и глубины помрачения сознания было выделено 3 клинических варианта психоза: делириозный (18; 41,9%), делири-озно-онейроидный (19; 44,2%), аментивноподобный (6; 13,9%) [12].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Основной задачей терапии больного с интоксикационным психозом является быстрое выведение токсинов из организма, купирование имеющейся психотической симптоматики и психомоторного возбуждения, предупреждение развития тяжелых соматоневрологических последствий, поддержание жизненно важных функций (дыхания, кровообращения, диуреза).
По получаемому лечению все больные были разделены на две группы.
-
1 -я группа включала 16 больных, которые получали базовую терапию по традиционным терапевтическим схемам интенсивной терапии пациентов с острым интоксикационным психозом [13]:
-
• инфузионная терапия (40–50 мл/кг под контролем);
-
• ноотропы (пирацетам 20% раствор 20 мл в/в с 10 мл 40% раствора глюкозы; пиридитол 0,2–0,8 г/сут, пантогам 1,5–3,0 г/сут, фенибут 0,75–1,0 г/сут);
-
• витаминотерапия: В 1 и В 6 2,0 мл 5% раствора (чередовались через день), В 12 400 мкг/сут назначали для стимуляции общего обмена веществ и нормализации работы центральной нервной системы;
-
• транквилизаторы бензодиазепинового ряда (феназепам до 4–6 мг/сут; диазепам до 80 мг/сут) назначались для купирования психомоторного возбуждения.
Во 2-ю группу вошло 27 больных, которым наряду с базовой дезинтоксикационной терапией назначались нейролептики: бутирофеноны (подгруппа 2А - 13 чел.), обладающие мощным общим инцизивным действием, равномерно редуцирующим различные психотические расстройства (галоперидол 1,5-20 мг/сут) или атипичные антипсихотические средства из группы замещенных бензаминов (тиапридал ® 100-800 мг/сут) как обладающие седативным, противосудорожным, антипсихотическим эффектами (подгруппа 2Б - 14 чел.). Применение нейролептиков было обусловлено их влиянием на дофаминергические и адренергические системы [14].
Терапия начиналась с первого дня пребывания больного в стационаре и продолжалась до полного купирования острой психотической симптоматики.
Эффективность лечения острого психотического состояния определялась по нормализации поведения пациента, купированию психомоторного возбуждения и психотической симптоматики, восстановлению критического отношения к перенесенным психопатологическим расстройствам, окружающей обстановке и собственной личности.
При оценке результатов исследования и проведении сравнительного анализа лечения использовались короткая психиатрическая оценочная шкала и шкала общего клинического впечатления [15]. Эффект признавался хорошим при достижении полной редукции психотической симптоматики. Оценка каждого признака осуществлялась по трёхбалльной шкале: 0 - отсутствие симптома, 1 - слабо выраженный, 2 - умеренно выраженный, 3 - сильно выраженный симптом.
На данном этапе исследования сравнительная терапевтическая динамика психоза оценивалась только по показателю использованной терапии (группы 1 и 2 - подгруппы 2А и 2Б) без учета психопатологической структуры психоза и особенностей динамики основного заболевания (пагубное употребление СК и синдром зависимости от СК). При этом допускалось, что эти клинические показатели имеют значение при выборе тактики терапии.
Как видно из рисунка 1, в результате применения использованных схем терапии уже к 3-му дню участия в лечении наблюдался заметный терапевтический эффект по купированию продуктивной симптоматики, аффективных расстройств, дисфории, диссомнических нарушений. К 7-му дню терапии наблюдалась дезактуализация синдрома патологи- ческого влечения к СК. Сравнительный анализ терапевтической динамики психических расстройств у больных, получавших разные схемы терапии, показал, что включение в комплексную терапию галоперидола (подгруппы 2, 2А) обеспечивало купирование психических расстройств в более короткие сроки по сравнению с больными из группы 1 и подгруппы 2Б группы 2.
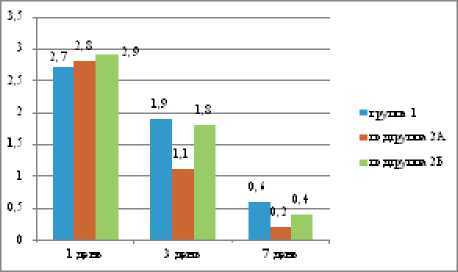
Рисунок 1. Терапевтическая динамика психических расстройств
Соматоневрологическая симптоматика в виде общего гипергидроза, легкого тремора языка и век, выраженной тахикардии, преходящей анизокории, лёгкого менингизма уже с первого дня терапии нивелировалась у больных, получающих в комплекс -ной терапии тиапридал (подгруппа 2Б группы 2), достоверно быстрее по сравнению с больными из группы 1 и подгруппы 2Б группы 2 (рис. 2).
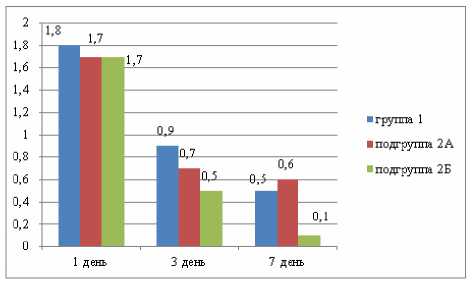
Рисунок 2. Терапевтическая редукция соматоневрологической симптоматики
Уже к 3-му дню терапии выявлено отставание терапевтической динамики соматоневрологических нарушений у больных в подгруппе 2А группы 2 (использование галоперидола) и у больных группы 1, что сохранялось и к 7-му дню терапии. Однако к 10му дню лечения наблюдалась практически полная редукция соматоневрологических расстройств.
Таким образом, наблюдалось терапевтическое преимущество лечебной программы с использованием галоперилода по купированию психических расстройств и терапевтическое преимущество с присоединением тиопредала по купированию со-матоневрологических расстройств у больных с пси- хозом вследствие употребления СК.
После купирования острых психотических и со-матоневрологических расстройств больные подгрупп 2А и 2Б группы 2 с целью профилактики рецидивов и обострений основного заболевания переводились на поддерживающую терапию малыми дозами галоперидола и тиапридала. Отдаленное клинико-катам-нестическое (спустя 6 месяцев) исследование показало, что среди больных 1-й группы (пролеченных с применением традиционной терапии интоксикационного психоза) 13 (81,3%) прошедших терапевтический курс больных вскоре после выписки из стационара возобновили употребление СК. В то же время большинство пациентов подгруппы 2А группы 2 (10; 76,9%) воздерживались от приёма СК. Среди больных подгруппы 2Б группы 2 доля больных, воздерживавшихся от приема СК, была достоверно меньше, чем в подгруппе 2А группы 2 (р≤0,001), но достоверно больше по сравнению с группой 1 (р≤0,05).
ЗАКЛЮЧЕНИЕ
Эффективность применения традиционных терапевтических подходов к терапии психозов, развившихся вследствие употребления СК, может быть значимо повышена за счет включения в схему комплексной терапии нейролептических средств. При этом при выборе тактики лечения необходимо учитывать соотношение в структуре психоза психических и сомато-неврологических расстройств, поскольку включение в терапевтическую схему галоперидола достоверно улучшает купирование психических расстройств, а подсоединение тиапридала ускоряет нивелирование соматоневрологической симптоматики. Также использование в комплексной терапии больных с психозом вследствие употребления СК нейролептических средств и их дальнейшее применение в рамках противорецидивной терапии не только улучшает приверженность больных к терапии, но и увеличивает вероятность воздержания больных от употребления СК. При этом противорецидивный потенциал у галоперидола достоверно выше, чем у тиапридала.
Список литературы Лечение острого психоза вследствие употребления синтетических каннабиноидов
- Савчук С.А. Обнаружение синтетических каннабимиметиков, наркотических, психоактивных веществ и их метаболитов в моче, волосах и ногтях методами жидкостной хроматографии с масс-спектрометрическим детектированием. Информационное письмо//Наркология. 2014; 8: 42-52.
- Булыгина И.Е. Клинические проявления интоксикации новым психоактивным веществом MDMB (N)-Bz-F. Совершенствование правовых основ наркологической помощи: Тезисы Всероссийской научно-практической конференции. М., 2014: 45-52.
- National Advisory Committee on Drugs An Overview of New Psychoactive Substances and the Outlets Supplying Them, 2011. URL:http://www.dit.ie/cser/media/ditcser/documents/Head_Rep ort2011_overview.pdf (дата обращения 12.06.2017)
- Dillon P., Copeland J. NCPIC Synthetic cannabinoids. Australian experience. 2012. Bulletin series 13 march.
- Schifano F., Orsolini L., Papanti D.G., Corkery J.M. Novel psychoactive substances of interest for psychiatry. World Psychiatry. 2015;14:15-26.
- Kikura-Hanajiri R., Uchiyama N., Goda Y. Survey of current trends in the abuse of psychotropic substances and plants in Japan. Leg. Med. (Tokyo). 2011; 13: 109-115.
- Castaneto M.S., Gorelick D.A, Desrosiers N.A., Hartman R. L., Pirard S., Huestis M.H. Synthetic cannabinoids: Epidemiology, pharmacodynamics, and clinical implications. Drug and Alcohol Dependence. 2014; 144: 12-41.
- Nacca N., Vatti D., Sullivan R., Sud P., Su M., Marraffa J. The synthetic cannabinoid with drawal syndrome. J. Addict. Med. 2013; 7: 296-298.
- Hu X., Primack B.A., Barnett T.E., Cook R.L. College students and use of K2: an emerging drug of abuse in young persons. Subst. Abuse Treat. Prev. Policy. 2011; 6: 16-19.
- Vandrey R., Dunn K.E., Fry J.A., Girling E.R. A survey study to characterize use of Spice products (synthetic cannabinoids). Drug and Alcohol Dependence. 2012; 120: 238-241.
- Савчук С.А., Григорьев А.М., Катаев С.С., Изотов Б.Н., Гофенберг М.А., Скребкова К.А., Гизетдинова Л.А., Мингазов А.А., Никитина Н.М., Васильев А.Б., Мелентьев А.Б., Лабутин А.В., Печников А.Л., Шитов Л. Н.П., Снятков А.В., Колосова М.В., Самышкина Н.В., Малышкина А.П., Ризванова Л.Н., Подоленко Е.В., Джурко Ю.А Обнаружение метаболитов синтетических каннабимиметиков в моче, волосах и сыворотке крови методом газовой хроматографии с масс-селективным детектированием. Информационное письмо. Наркология. 2014; 1: 96-97.
- Клименко Т.В., Шахова С.М., Козлов А.А. Психотические расстройства вследствие употребления синтетических каннабиноидов (спайсов). Сибирский вестник психиатрии и наркологии. 2017; 2 (95): 25-29.
- Наркология: национальное руководство/под ред. Н.Н. Иванца, И.П. Анохиной, М.А. Винниковой. М.: ГЭОТАР-Медиа; 2008: 720.
- Белоусов Ю.Б., Моисеев В.С., Лепахин В.К. Клиническая фармакология и фармакотерапия. Руководство для врачей. 2-е изд. испр. и доп. М.: Универсум паблишинг, 1997: 531.
- Bazire S. Risperidon ein schizophrenia. British Journal Psychiatry. 1996; Jan; 168 (1): 128 DOI: 10.1192/bjp.168.1.128a


