Лимфома Ходжкина
Автор: Михайлова Н.Б.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Гематология: вчера, сегодня, завтра
Статья в выпуске: 3 т.20, 2024 года.
Бесплатный доступ
Лимфома Ходжкина (ЛХ) является злокачественной В-клеточной лимфомой. Заболеваемость составляет 2,2 - 2,7 случаев на 100 000 населения. Чаще болеют молодые пациенты от 20 до 35 лет. Этиология заболевания не вполне ясна, возможно, что вирус Эпштейна-Барр имеет этиологическое и патогенетическое значение в развитии опухоли. Большой вклад в изучение опухоли внесли Т. Ходжкин, К. Штернберг, Д. Рид и С.Е. Березовский. Клетки лимфомы Ходжкина имеют уникальный иммунофенотип: отсутствие В-клеточных маркеров и наличие CD30. ЛХ имеет своеобразное гистологическое и клеточное строение: на долю опухолевых клеток приходится не более 2%. Вся остальная масса опухоли представлена доброкачественным микроокружением. Для лимфомных клеток характерны хромосомные аберрации локуса 9p24.1 и гиперэкспрессии генов, содержащихся в этой области, включая PD-L1, PD-L2 и JAK2. Эти особенности привели к созданию направления иммунотерапии в лечении лимфомы Ходжкина. Для клинической картины характерно увеличение различных групп лимфоузлов, при распространенных стадиях часто наблюдаются В-симптомы. ЛХ относится к химиочувствительным опухолям. В результате терапии первой линии (режимы химиотерапии ABVD или BEACOPP) удается вылечить до 85-90% пациентов с локальными стадиями и до 65-70% с распространенными стадиями лимфомы. Снизить токсичность химиотерапевтических режимов позволяет эскалационная или деэскалационная ПЭТ-адаптированная терапия. При рецидивах хороших результатов (50% длительных ремиссий) удается добиться с помощью резервных платиносодержащих схем с последующей аутологичной трансплантацией гемопоэтических стволовых клеток (аутоРТПХ). В последние годы в первую и вторую линию терапии активно внедряют таргетный препарат (иммуноконъюгат брентуксимаб ведотин) или ингибиторы иммунных контрольных точек, что позволило снизить токсичность и улучшить эффективность терапии. У пациентов с высоким риском рецидива проводят поддерживающую терапию брентуксимабом ведотином. При рецидивах после аутоТГСК может быть полезна иммунотерапия: ингибиторы иммунных контрольных точек (ИКТ) или аллоТГСК. Следует помнить, что ИКТ следует применять с осторожностью, так как они могут вызывать аутоиммунные осложнения, а после аллоТГСК - индуцировать реакцию «трансплантат- против-хозяина». Таким образом, в настоящее время имеется большой арсенал химиотерапевтических, таргетных и иммунных опций для терапии ЛХ. Эта лимфома стала излечима для большинства пациентов.
Лимфома ходжкина, аутологичная трансплантация гемопоэтических стволовых клеток, брентуксимаб ведотин, иммунотерапия, поддерживающая терапия
Короткий адрес: https://sciup.org/170207413
IDR: 170207413
Текст научной статьи Лимфома Ходжкина
Первое возможное упоминание лимфомы Ходжкина принадлежит выдающемуся итальянскому биологу и врачу Марчелло Мальпиги. В 1666 году он опубликовал труд “De vescerum structura”, с описанием результатов вскрытия 18-ти летней девушки с диссеминированным увеличением лимфоузлов и очаговым поражением селезенки. Через полтора столетия к заболеванию вновь было привлечено внимание, на этот раз английским врачом и общественным деятелем Томасом Ходжкиным. В работе “On some morbid appearances of the absorbent glands and spleen” в 1832 году [1] он сообщил о 7 случаях пациентов, погибших от заболевания, проявлявшегося увеличением лимфоузлов и селезенки, кахексией и лихорадкой, но представить свою работу на заседании Лондонского Королевского хирургического общества он не мог, так как на тот момент не являлся членом этого общества. По этой причине доклад был представлен секретарем общества, доктором Робертом Ли (рисунок 1).
Рисунок 1. Оригинальные иллюстрации, сделанные другом Томаса Ходжкина Робертом Карсвеллом и представленные во время доклада на заседании Лондонского Королевского хирургического общества [2].
Поскольку метод микроскопии на тот момент лишь зарождался, Томас Ходжкин мог ориентироваться лишь на макроскопическую структуру и клиническую картину. Позже было проведено

Рисунок 2. Томас Ходжкин гистологическое (1926 год) и иммуногистохимическое (1999 г.) исследование созданных им препаратов, и диагноз был подтвержден в 3-х из 7 случаев.
Томас Ходжкин (рисунок 2) родился в семье квакеров в городе Пентонвилл в 1798 году. Поскольку он относился к христианской общине квакеров, поступление в Оксфорд или Кембридж было для него запрещено, и он получил медицинское образование в Университете Эдинбурга. Ходжкин стажировался в Париже в госпитале Неккер у Рене Лаэннека и был одним их первых врачей, внедривших метод аускультации в клиническую практику в Великобритании. В 1827 году он занял позицию куратора музея, то есть, был руководителем морга, ведущим научную работу. Там он создал большую коллекцию гистологических препаратов, многие из которых используются и по сей день. Однако его карьере в госпитале наступил конец в результате конфликта с администрацией и Ходжкин полностью посвятил свою жизнь социальной активности. Спектр его интересов включал борьбу за права малых народов, таких как канадские индейцы, угнетаемых торговыми агентами компании Гудзонова залива. Он был активным членом американского колонизационного общества, активность которого привела к образованию государства Либерия. Когда устанавливались дипломатические отношения между Либерией и Великобританией, именно Томас Ходжкин был послом Либерии. Он был почетным секретарем королевского географического общества. Активно выступал с агитацией о профилактике заболеваний, давал рекомендации путешествинникам относительно подготовки к путешествию. Т. Ходжкин умер от холеры, путешествуя по Святой Земле, и похоронен в Яффе (Израиль).
В 1865 году Wilks привел 15 случаев похожего заболевания и предложил назвать его болезнью Ходжкина. В 1890 году русский врач С.Е. Березовский в журнале «Русская медицина» опубликовал работу «К вопросу о строении и клиническом течении Lymphadenoma malignae» [3]. В этой работе автор описал 6 случаев заболевания, характерной особенностью которых было увеличение лимфоузлов со своеобразным гистологическим строением. При микроскопии гистологических срезов он нашел клеточный полиморфизм с наличием больших клеток с несколькими ядрами. Исследуя препарат лимфомы Ходжкина, Березовский писал: «Мы имеем здесь дело с особенным патологическим процессом, который нельзя отнести ни к рубрике воспалительных образований, ни к рубрике известных новообразований лимфатических желез, но представляющих совершенно особенный тип по своей микроскопической характеристике».
Семью годами позже венские врачи Paltauf (1897) и Sternberg (1898) также описали крупные многоядерные клетки в материале пациентов с увеличенными лимфоузлами. В 1902 году Dorothy Reed провела еще более тщательный анализ гистологической картины этого заболевания. Таким образом, три патолога: С.Е. Березовский в России (1890), К. Штернберг в Австрии (1898) и Д. Рид в США (1902) независимо друг от друга выявили опухолевый субстрат ЛХ: многоядерные гигантские клетки неправильной формы с крупными ядрами и центрально расположенными ядрышками. Поэтому в отечественной литературе их принято называть клетками Березовского-Рид-Штернберга (БРШ), в зарубежной литературе – клетками Рид – Штернберга. В 1904 году на съезде патологов в Вене заболевание названо лимфогранулематозом. Это название было распространено в России до 2000 года. В настоящее время заболевание принято называть лимфомой Ходжкина.
Морфологическим субстратом ЛХ являются крупные опухолевые клетки: многоядерные клетки Бе-резовского–Рид–Штернберга (БРШ) и одноядерные клетки Ходжкина, также встречаются лакунарные клетки и мумифицированные клетки (рисунок 3).
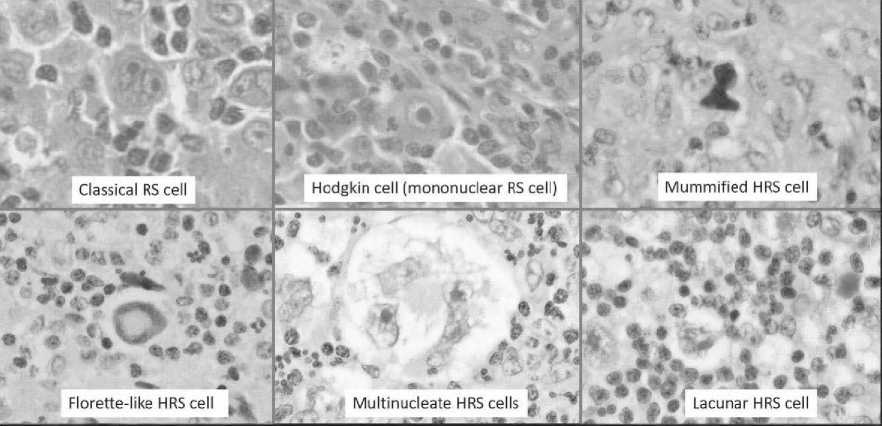
Рисунок 3. Опухолевые клетки, встречающиеся при ЛХ.
Несмотря на то, что морфологическая картина ЛХ была описана более 120 лет назад, ее принадлежность к В-клеточным опухолям была доказана только в 1995 году Hummel и соавторами. Посредством микродиссекции образцов опухолевой ткани пациентов с ЛХ и выделения единичных CD30+ клеток БРШ с последующим молекулярным анализом, доказывающим реаранжировку генов тяжелых цепей иммуноглобулинов, было продемонстрировано, что субстратом лимфомы Ходжкина являются трансформированные В-клетки герминомного центра. Причиной этого являются уникальный фенотип и биологические свойства клеток БРШ – почти полная потеря классических В-клеточных поверхностных маркеров (CD19, CD20, CD79a) и транскрипционных факторов (Oct-2, BOB.1, PU.1), а также аберрантная экспрессия антигенов, обычно ассоциированных с Т-клетками, миелоидными клетками или дендритными клетками. Несмотря на B-клеточное происхождение, опухолевые клетки лимфомы Ходжкина не могут вырабатывать нормальные антитела, что вероятно обусловлено их неспособностью производить факторы транскрипции, необходимые для активации промотора иммуноглобулинов. В-клетки, неспособные продуцировать антитела, должны подвергаться апоптозу, но клетки БРШ ускользают от самоуничтожения. Объяснением тому может быть постоянная активация антиапоптотического ядер-ного фактора транскрипции NFkB в этих клетках.
ЛХ имеет своеобразное гистологическое и клеточное строение. Злокачественные клетки происходят из В-клеток герминомного центра, в структуре опухоли на их долю приходится не более 2%. Вся остальная масса опухоли представлена доброкачественным микроокружением, состоящим преимущественно из иммунных клеток: Т-лимфоцитов, эозинофилов, нейтрофилов, гистиоцитов, моноцитов и плазматических клеток. Часто встречается также фиброзная ткань разной степени выраженности.
В современной классификации ВОЗ 2022 года (5-я редакция), также как в предыдущих редакциях, выделяют классический вариант ЛХ и нодулярную ЛХ с лимфоидным преобладанием. Классическая ЛХ представлена 4 морфологическими вариантами:
-
• Нодулярный склероз ЛХ (градация 1 и 2)
-
• Смешанно-клеточный вариант ЛХ
-
• Лимфоидное истощение ЛХ
-
• Классическая ЛХ с большим количеством лимфоцитов
Однако в связи с применением современных методов лечения прогностическое значение морфологических вариантов утеряно.
Классическая ЛХ с нодулярным склерозом является наиболее распространенным подтипом и составляет около 60%-70% случаев. Морфологической особенностью данного варианта является образование фиброзных тяжей и формирование нодулярных структур в составе опухолевого инфильтрата (таблица 1). Диагностические БРШ клетки при данном варианте заболевания, часто имеют форму лакунарных клеток [Криволапов, 2007].
На смешанно-клеточный вариант ЛХ приходится 20–25% случаев. Лимфоидная ткань в лимфа- тическом узле при данном варианте частично или полностью замещена рассеянным инфильтратом, включающим клетки БРШ среди лимфоцитов, плаз- матических клеток, макрофагов, фибробластов и гранулоцитов.
Классическая ЛХ, богатая лимфоцитами, составляет до 5% случаев. При данном варианте опухолевый инфильтрат состоит преимущественно из мелких лимфоцитов, гистиоциты и гранулоциты очень редки или отсутствуют.
Вариант с лимфоидным истощением встречается редко, менее 1% случаев. При данном подтипе количество клеточных элементов микроокружения, составляющих опухолевый инфильтрат, резко снижено. Данный вариант наиболее характерен для ВИЧ-инфицированных пациентов.
Для классических вариантов ЛХ характерен иммунофенотип: CD30+, CD15+, слабая ядерная экспрессия PAX5, MUM.1+, CD45–, CD20–/+ (CD20+ около 20–40% случаев). Клетки БРШ утратили большинство В-клеточных маркеров и, в отличие от других В-клеточных лимфом, на них не экспрессируются CD19, CD79a. При отсутствии экспрессии CD30 диагноз ЛХ сомнителен и требует дополнительного иммуногистохимического исследования.
Нодулярная ЛХ с лимфоидным преобладанием (НЛХЛП), хотя и остается в рамках ЛХ в 5-й редакции классификации ВОЗ, однако представляет собой самостоятельный вариант В-клеточной опухоли, которую можно было бы назвать «нодулярная В-клеточная лимфома с лимфоидным преобладанием». В отличие от клЛХ, 100% опухолевых клеток экспрессируют В-клеточные антигены CD20 и не экспрессируют CD15 и CD30. Важным аспектом НЛХЛП является определение различных типов роста, кото рые могут напоминать В-крупноклеточною лимфо му, богатую Т-клетками и гистиоцитами (THRLBCL).
Таблица 1Иммуноморфологические типы роста нодулярной ЛХ с лимфоидным преобладанием [4]
|
Тип роста |
описание |
|
Тип А |
Классический В-клеточный нодулярный |
|
Тип В |
серпигинозный |
|
Тип С |
Вариант с большим количеством экстранодальных В-клеток |
|
Тип D |
Нодулярный, богатый Т-клетками |
|
Тип E |
Диффузный, напоминающий THRLBCL/DLBCL |
|
Тип F |
Диффузный, «побитый молью» богатый В-клетками |
Примечание. THRLBCL – В-крупноклеточная лимфома богатая Т-клетками и гистиоцитами; DLBCL – диффузная В-крупноклеточная лимфома
Эти типы встречаются среди всех возрастных групп. В некоторых ретроспективных анализах показано, что варианты C, D, и E ассоциируются с более агрессивным клиническим течением и могут отражать прогрессирование лимфомы.
Для выживания клеткам БРШ необходимо тесное взаимодействие с микроокружением, формированию которого способствуют сами опухолевые клетки (рисунок 4). Клеточный состав и функциональные свойства опухолевого микроокружения являются следствиями комплексного взаимодействия между опухолевыми клетками и иммунными клетками, опосредованного сетью цитокинов и контактных молекул. Другие факторы, влияющие на структуру микроокружения, включают в себя иммунный статус пациента, возраст и особенности полиморфизмов генов, связанных с реализацией иммунного ответа. Несмотря на избыток иммунных клеток в опухолевом микроокружении кЛХ, эффективного иммунного ответа в отношении злокачественных клеток БРШ не происходит. Это связано с экспрессией лигандов рецептора программируемой клеточной гибели 1 (PD-1) на поверхности опухолевых клеток. Функцией рецептора PD-1, который представлен на поверхности
Т лимфоцитов и других иммунных клеток является ограничение активации иммунной системы. При взаимодействии клеток БРШ, отличающихся высоким уровнем лигандов PD-1 с Т-клетками, происходит активация PD-1 и каскада внутриклеточных сигналов, вызывающих анергию и апоптоз.
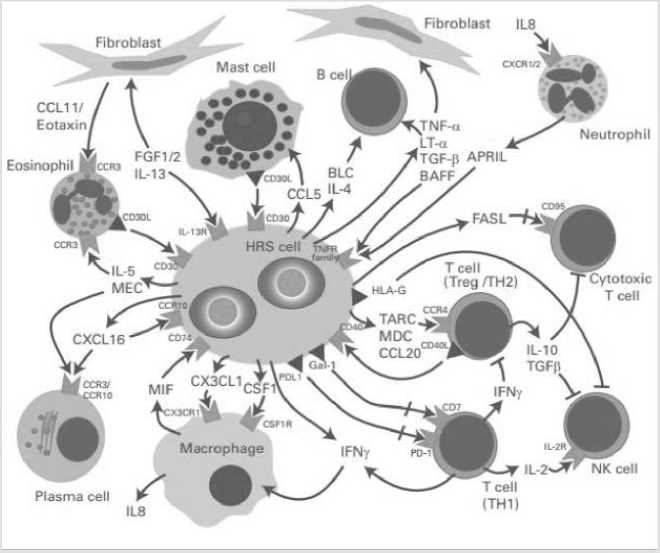
Рисунок 4. Опухолевое микроокружение при ЛХ [5].
Следствием этих событий становится подавление активации и пролиферации Т клеток, а также изменение спектра синтезируемых цитокинов, что является одним из важных факторов обеспечения иммуносупрессивного окружения при лимфоме Ходжкина. Помимо опухолевых клеток, лиганды PD-1 активно экспрессируются опухоль-ассоциирован-ными макрофагами, вносящими дополнительный вклад в ограничение нормального противоопухолевого ответа. Блокирование PD-1 лежит в основе применения иммунотерапии ЛХ.
Стадирование. Для стадирования ЛХ принято использовать шкалу Анн-Арбор по названию города в США, где она была принята, в модификации Cotswolds (город в Великобритании) [6]. Система стадирования основана на вовлечении в опухолевый процесс определенных лимфоузлов. Стадии заболевания отражают распространенность злока- чественного процесса в организме. Выделяют 4 стадии заболевания (рисунок 5): I стадия – увеличение лимфатических узлов одного региона или один экс-транодулярный очаг; II стадия – увеличение лимфоузлов двух и более регионов по одну сторону от диафрагмы или локализованное экстранодальное поражение по контакту с пораженным лимфатическим лимфоузлом по одну сторону от диафрагмы; III стадия – увеличение лимфатических узлов по обе стороны от диафрагмы, может присутствовать локализованное экстранодальное поражение по контакту с пораженным лимфоузлом; IV стадия – поражение паренхиматозных органов (не по контакту), в том числе костного мозга. Инфильтрация опухолевыми клетками костного мозга, печени, плевры, ЦНС всегда свидетельствует о IV стадии заболевания. Селезенка является лимфоидным органом и приравнивается к лимфоузлу.
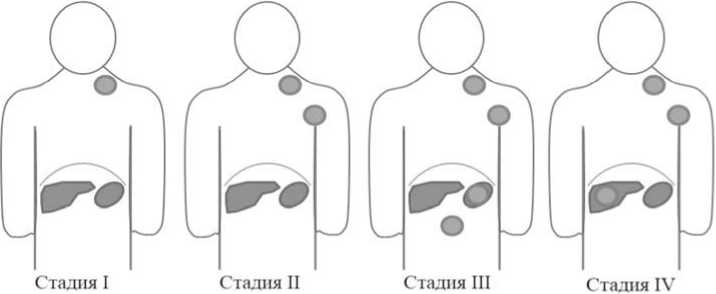
А: нет В симптомов
В: присутствует хотя бы один из В симптомов
X: массивная опухоль (Bulky)
Е: для стадий I-III; присутствие локализованного экстранодального поражения по контакту с пораженным лимфатическим узлом
Рисунок 5. Принцип стадирования лимфом в соответствии с классификацией Ann Arbor в модификации Cotswolds [6].
Кроме стадии необходимо определить наличие общих В-симптомов.
К В-симптомам относятся:
-
1. Лихорадка выше 38°С не менее трех дней подряд без признаков инфекции
-
2. Ночные профузные поты
-
3. Похудание на 10% массы тела за последние 6 месяцев.
До начала терапии следует провести визуализацию опухолевых очагов методом КТ с внутривенным контрастированием четырех зон: шеи, грудной клетки, брюшной полости и малого таза. В КТ описании должны быть указаны размеры пораженных лимфоузлов в 2-х перпендикулярных измерениях. В последнее время у больных ЛХ считается обязательным выполнение позитронно-эмиссионной томографии (ПЭТ), совмещенной с КТ: ПЭТ/КТ, отображающей функциональное состояние опухоли за счет количественного измерения ее метаболической активности. По сравнению со здоровой, опухолевая ткань способна более активно захватывать радиофармпрепарат 18F-фтордезоксиглюкозу. Метод позволяет более точно, чем КТ определить стадию заболевания. Кроме того, исходные значения метаболической активности необходимы для дальнейшей стратегии ПЭТ-адаптированной терапии. Накопление радиофармпрепарата в патологических очагах оценивают по 5-ти бальной шкале Deauville (по названию города во Франции, в котором проходила конференция). Шкала основана на сравнении интенсивности накопления препарата в опухолевой массе по сравнению с фоновым накоплением его в печени и средостении. Оценка и присвоение баллов производятся следующим образом:
-
1 балл - накопления препарата в опухолевой массе нет
-
2 балла - накопление препарата в опухолевой массе ниже, чем в средостении
-
3 балла - накопление препарата в опухолевой массе выше, чем в средостении, но ниже, чем в печени (правой доле)
-
4 балла - накопление препарата в опухолевой массе умеренно выше, чем в правой доле печени
-
5 баллов - накопление препарата в опухолевой массе значительно выше, чем в печени, либо определяется появление новых патологических очагов.
Особую сложность представляет оценка вовлечения в патологический процесс костного мозга. Раньше, до внедрения в клиническую практику ПЭТ/КТ, поражение костного мозга доказывали морфологически по данным гистологического исследования трепан-биопсии. В настоящее время считается достаточным данных ПЭТ/КТ. При локальных стадиях вовлечение костного мозга происходит очень редко. При распространенных стадиях наличие очагового распределения повышенной метаболической активности свидетельствует о поражении костного мозга. При диффузном повышении метаболической активности при ПЭТ/КТ необходимо подтверждать поражение костного мозга данными биопсии, так как при распространенных стадиях очень часто имеет место реактивное изменение костного мозга. При ПЭТ-адаптированной терапии ПЭТ/КТ следует выполнять до начала терапии, после 2-го цикла терапии и после окончания 1-й линии терапии. Иногда при трактовке данных ПЭТ/КТ возникают серьезные сложности. Чаще всего это происходит при лечении ингибиторами иммунных контрольных точек. Иммунные клетки способны инфильтрировать опухолевые очаги. В результате может наблюдаться рентгенологическое увеличение лимфоузлов. Это явление называется псевдопрогрессирование. Его отличительной чертой является улучшение общего субъективного, а иногда и объективного состояния пациента, несмотря на «ухудшение» рентгенологической картины. Кроме того, иммунные клетки активно захватывают 18F-фтордезоксиглюкозу, что может выражаться во временном увеличении метаболической активности пораженных лимфоузлов. Ложное увеличение размеров очагов и повышение их метаболической активности может привести к неправильной интерпретации результатов терапии, если использовать классические критерии ответа Лугано. Чтобы избежать этого, в 2016 году была предложена новая система оценки ответа LYRIC [7], включающая понятие неопределенного ответа (НО), что дает возможность в определенных обстоятельствах избежать констатации прогрессирования заболевания и продолжить лечение ингибиторами ИКТ.
Выделяют следующие типы НО:
Тип 1. Увеличение суммы произведений диаметров более, чем на 50% в первые 12 недель терапии.
Тип 2. Увеличении сумы произведений диаметров менее, чем на 50%, но: а) с новыми очагами, б) или более, чем на 50% увеличение произведения перпендикулярных диаметров одного очага или нескольких очагов.
Тип 3. Увеличение метаболической активности очага без увеличения размеров, соответствующих критериям прогрессирования.
В случае возникновения НО следует выполнить контрольное исследование через 3 месяца. НО может трансформироваться в прогрессирование заболевания или полный/частичный ответ. По нашим данным из 90 пациентов, получавших терапию ИКТ, НО имел место у 22 пациентов. В дальнейшем у 21% НО перешел в объективный ответ (полный или частичный).
Факторы риска. Уникальность ЛХ состоит в высокой химиочувствительности. 70% пациентов могут быть вылечены. Прогноз заболевания и выбор терапии первой линии зависит не только от стадии заболевания, но и от факторов риска (таблица 2). Существует несколько шкал определения риска для ЛХ. В таблице 2 приведены наиболее часто используемые шкалы.
Таблица 2
Наиболее часто используемые шкалы определения риска для ЛХ
|
Прогностическая группа |
EORTC (трактовка понятия) |
GHSG (трактовка понятия) |
|
Благоприятная |
Благоприятная — favorable CS* I и II стадии без факторов риска |
Ранняя — early CS I и II стадии без факторов риска |
|
Промежуточная |
Неблагоприятная — unfavorable CS I –II стадии с факторами риска А, В, С, D |
Промежуточная — intermediate CS I — IIА стадии с факторами риска А, В, С, D и IIВ стадия с факторами риска В, С |
|
Неблагоприятная |
Распространенная — advanced III и IV стадии |
Неблагоприятная — unfavorable CS IIВ стадия с факторами риска A, D, а также III и IV стадии |
|
Факторы риска |
|
|
Для распространенных стадий к факторам неблагоприятного прогноза относятся следующие критерии (Международный прогностический индекс):
-
• Альбумин <40 г/л
-
• Гемоглобин <105 г/л
-
• Мужской пол
-
• Возраст ≥45 лет
-
• Стадия IV
-
• Лейкоцитоз ≥15 × 109/л
-
• Лимфопения <8% при подсчете формулы крови или <0,6 × 109/л
Клинические проявления. Обычно больные обращаются к врачу с жалобами на стойкое увеличение шейных или надключичных лимфоузлов. Нередко от первых признаков заболевания до обращения к врачу проходит несколько месяцев или даже год. В отдельных случаях заболевание прогрессирует быстро. Иногда увеличение лимфоузлов средостения выявляют «случайно» на флюорографическом обследовании при диспансеризации. Приблизительно у 30% паци- ентов в дебюте заболевания могут присутствовать симптомы интоксикации: потеря веса, профузная ночная потливость, лихорадка. Часто больных беспокоит кожный зуд, который может появляться задолго до постановки диагноза лимфомы. Кожный зуд не относится к плохим прогностическим факторам и к общим В-симптомам. Чаще всего при ЛХ поражаются шейные, над- и подключичные лимфоузлы, аксиллярные лимфоузлы и лимфоузлы средостения. Последние могут достигать больших размеров до 10-20 см в наибольшем измерении. Такие лимфоузлы обозначают термином bulky. Большие образования в средостении могут быть причиной синдрома сдавления верхней полой вены. Иногда у пациентов прослеживается более выраженное поражение лимфоузлов какой-либо одной половины тела: правой или левой. При I-II стадиях заболевания чаще вовлекаются лимфоузлы выше диафрагмы. При IV стадии заболевания в патологический процесс часто вовлекаются плевра (может быть плеврит), легкие, кости. Реже печень, мягкие ткани и другие органы. Костный мозг поражается редко. ЛХ практически никогда не поражает ЦНС: в литературе описаны лишь единичные наблюдения. Очень редко в процесс вовлекается кожа над увеличенным лимфоузлом. В анализе крови часто увеличивается СОЭ. При распространенных стадиях может быть анемия, лейкоцитоз, увеличение нейтрофилов, лимфопения, иногда – эозинофилия. Часто увеличивается лактатдегидрогеназа.
Диагноз. Диагноз ЛХ ставят на основании морфологического и иммуногистохимического исследования биопсийного материала (лимфоузла или очага). Не следует выполнять пункционную или тонкоигольную биопсию ввиду их неинформативности. Обязательно должна выполняться эксцизионная биопсия. Сложности при постановке диагноза появляются в случае отсутствия увеличения периферических лимфоузлов, удобных для биопсии с последующим гистологическим исследованием. Если увеличены только лимфоузлы средостения или парааортальные лимфоузлы, дебют заболевания можно пропустить. В таких ситуациях больной может обратиться с неспецифическими жалобами на общую утомляемость, повышение температуры, похудание, боли в грудной клетке, тахикардию и т.д. При подозрении на лимфому у пациента должен быть тщательно собран анамнез, проведен осмотр с пальпацией всех доступных лимфоузлов, печени и селезенки, выполнен клинический и биохимический анализ крови, КТ и ПЭТ/КТ. Последняя является обязательным методом исследования, так как на полученных данных строится терапевтическая тактика. Выполняется биопсия измененного лимфоузла с гистологическим и обязательным иммуногистохимическим исследованием.
Биопсия костного мозга выполняется, если установлена распространенная стадия заболевания и не выполнено ПЭТ-исследование.
Дифференциальная диагностика. Дифференцировать ЛХ необходимо практически от всех состояний, сопровождающихся лимфоаденопатией. При небольшом увеличении лимфоузлов (1-3 см в диаметре) в первую очередь исключают наиболее часто встречающиеся причины лимфоаденопатий – бактериальные и вирусные инфекции. Во всех сомнительных случаях или при первичном подозрении на опухолевый процесс ответ необходимо искать с помощью морфологического и иммуногистохимического исследования. Среди онкологических заболеваний дифференциальный диагноз проводят с другими лимфомами, прежде всего с медиастинальной лимфомой, лимфомой «серой зоны», диффузной В-крупноклеточной лимфомой и другими. Следует также помнить о возможности метастатического поражения лимфоузлов при солидных опухолях.
Определение ответа на лечение проводится по классификации Лугано, принятой в 2014 году. Классификация предусматривает возможность оценки ответа посредством КТ и ПЭТ/КТ. Если лечение проводится ингибиторами ИКТ, то оценку терапии можно проводить по критериям LYRIC, о чем было сказано выше.
Оценка с помощью КТ
Полная ремиссия (ПР). 1. Полное исчезновение всех проявлений заболевания, в том числе выявляемых при помощи лабораторных и лучевых методов диагностики, а также клинических симптомов, если они имели место до начала лечения. 2. Размеры лимфатических узлов: a. ≤ 1,5 см по наибольшему диаметру, если до начала лечения размеры лимфатических узлов были больше 1,5 см; b. ≤ 1,0 см по наибольшему диаметру, если до начала лечения размеры лимфатических узлов были 1,5 – 1,1 см. 3. Печень, селезенка, если были увеличены до начала лечения, не пальпируются, по данным лучевых методов объемные образования в них не выявляются. 4. Костный мозг без признаков опухолевого поражения. Если результат морфологического исследования костного мозга неоднозначный, наличие или отсутствие поражения должно определяться иммуногистохимически. Для ЛХ ПР считается подтвержденной, если достигнутый эффект сохраняется не менее 3 месяцев или констатируется дальнейшее улучшение.
Частичная ремиссия (ЧР). 1. Уменьшение суммы диаметров всех измеряемых очагов (лимфоузлов и/ или очагов экстранодального поражения) не менее чем на 50%. Если размеры пораженных очагов менее 3см по наибольшему диаметру, то 2 наибольших очага должны уменьшиться не менее, чем на 50% по наибольшему диаметру. При наличии более 6 очагов поражения более 3 см, достаточна оценка 6 наибольших очагов, доступных четкому измерению в двух перпендикулярных направлениях. При наличии медиастинальных и/или ретроперитонеальных очагов поражения, они обязательно должны учитываться при измерении. 2. Отсутствие новых очагов поражения, отсутствие признаков увеличения какого-либо из ранее диагностированных очагов поражения. 3. В случае исходного поражения костного мозга статус костного мозга для определения ЧР не значим. Однако при сохранении поражения костного мозга в процессе и/или после завершения лечения, обязательно уточнение характеристики опухолевых клеток. Пациенты с исходным поражением костного мозга, у которых после завершения лечения клинически диагностируется ПР, но при этом сохраняется поражение костного мозга или костный мозг не может быть оценен, относятся к ЧР.
Стабилизация. Показатели опухоли не соответствуют ни критериям ПР или ЧР, ни критериям прогрессирования.
Рецидив (после ПР) или прогрессирование (после ЧР или стабилизации). 1. Появление новых очагов (увеличение лимфатических узлов или объемных образований экстранодальных локализаций) более 1,5 см в наибольшем измерении в процессе или после завершения лечения, вне зависимости от изменения размеров других очагов поражения. 2. Увеличение как минимум одного уже известного очага более чем на 25% от минимального. Для очагов менее 1 см в наибольшем измерении – увеличение до 1,5 см и более.
О ценка лечения с помощью ПЭТ/КТ. У пациентов с лимфомой Ходжкина желательно выполнить ПЭТ/ КТ до начала лечения, затем после 2-го цикла лечения и после окончания лечения. В периоде наблюдения достаточно выполнять КТ. Для измерения метаболической активности используется шкала Deauville.
Полный метаболический ответ/Полный ответ: баллы 1, 2 или 3 вместе с отсутствием FDG-активного поражения(-й) костного мозга интерпретируются как полный метаболический ответ, независимо от размера опухоли по данным КТ.
Частичный метаболический ответ/Частичный ответ: баллы 4 или 5 при условии, если поглощение FDG уменьшается по сравнению с предыдущим исследованием и отсутствует увеличение в размерах опухоли по данным КТ.
Стабилизация заболевания: баллы 4 или 5. Метаболическая активность не изменена или изменена незначительно по отношению к базовому исследованию.
Прогрессирование заболевания: баллы 4 или 5. Повышение метаболической активности по сравнению с предыдущим или базовым исследованием и/ или появлением нового FDG-активного поражения.
Лечение. Лечение первой линии. Терапия больных ЛХ, так же, как и всех других онкологических заболеваний, должна проводиться только в специализированных отделениях, имеющих опыт лечения больных цитостатическими препаратами. В зависимости от выбора терапевтической тактики, все больные могут быть разделены на 3 основные группы:
-
• Ранняя стадия с хорошим прогнозом: стадии I+IIA и В без факторов риска.
-
• Ранняя стадия с промежуточным прогнозом: стадии I+II А и В с факторами риска.
-
• Распространенная стадия: стадии III +IV.
При выборе терапии необходимо соблюдать баланс между эффективностью, интенсивностью и токсичностью, чтобы в дальнейшем избежать проблем, связан- ных с поздними осложнениями, которые иногда могут быть причиной смерти. Поэтому необходимо тщательно следить за поздними побочными эффектами, связанными с лечением.
В качестве первой линии терапии ранних стадий с хорошим прогнозом в мире используют режим ABVD (доксорубицин 25 мг/м2, блеомицин 5-10 мг/м2 , винбластин 6 мг/м2 и дакарбазин 375 мг/м2, все препараты вводятся в первый и 15-ый день, циклы повторяются каждые 28 дней, всего 6 циклов).
Для лечения пациентов имеющих раннюю стадию с промежуточным прогнозом или распространенные стадии ЛХ применяют режим ABVD (преимущественно в США и на юге Европе) или режим ВЕАСОРР в усиленной модификации (в Германии, России и некоторых других странах): (блеомицин 10 мг/м2 в день 1, этопозид 200 мг/м2 в дни 1-3, доксорубицин 35 мг/ м2 в день 1, циклофосфамид 1200 мг/м2 в день 1, винкристин 1.4 мг/м2 в день 8, прокарбазин 100 мг/ м2 с 1 по 7-й день, преднизолон 40 мг/м2 с 1 по 14-й день). Недостатком обоих режимов является наличие препарата блеомицин, обладающего выраженной токсичностью со стороны легких. Для уменьшения токсичности при сохраненной эффективности разработан новый режим лечения для первой линии: AVD+брентуксимаб ведотин (BV-AVD) (1,2 мг/кг). Брентуксимаб ведотин (БВ) является таргетным препаратом. Он представляет собой иммуноконъюгат антиCD30 моноклонального антитела и мощного цитостатического агента монометилауристатина Е, являющегося ингибитором микротрубочек и препятствующего расхождению веретена во время митоза. Ауристатин Е впервые был обнаружен в моллюске, называемом морской заяц. В чистом виде его нельзя использовать из-за токсичности. По своей силе он превосходит винбластин в 200 раз. Но в составе иммуноконъюгата препарат действует избирательно на опухолевые CD30-позитивные клетки и в целом мало токсичен для организма человека (рисунок 6). Тем не менее, он может вызывать осложнения в виде периферической нейропатии.
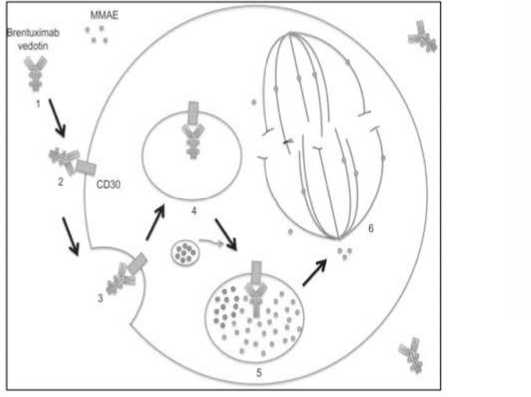
Брентуксимаб ведотин является иммуноконъюгатом, состоящем из химерного анти CD30 антитела, ковалентно связанного с 4 молекулами монометил ауристатина Е (MMAE) посредством валин-цитруллиновыми дипептидами. Сначала иммуноконъюгат (1) взаимодействует с CD30 на клеточной поверхности (2), затем проникает вглубь клетки-мишени путем рецептор-опосредованного эндоцитолиза (3,4). Слияние с лизосомами (5) приводит к протеолитическому разрушению дипептидного линкера и высвобождению свободного MMAE в цитоплазму. Затем MMAE связывается с тубулином (6), ингибирует тубулиновую полимеризацию и останавливает расхождение веретена. Происходит остановка деления клетки.
Рисунок 6. Механизм действия брентуксимаба ведотина [8].
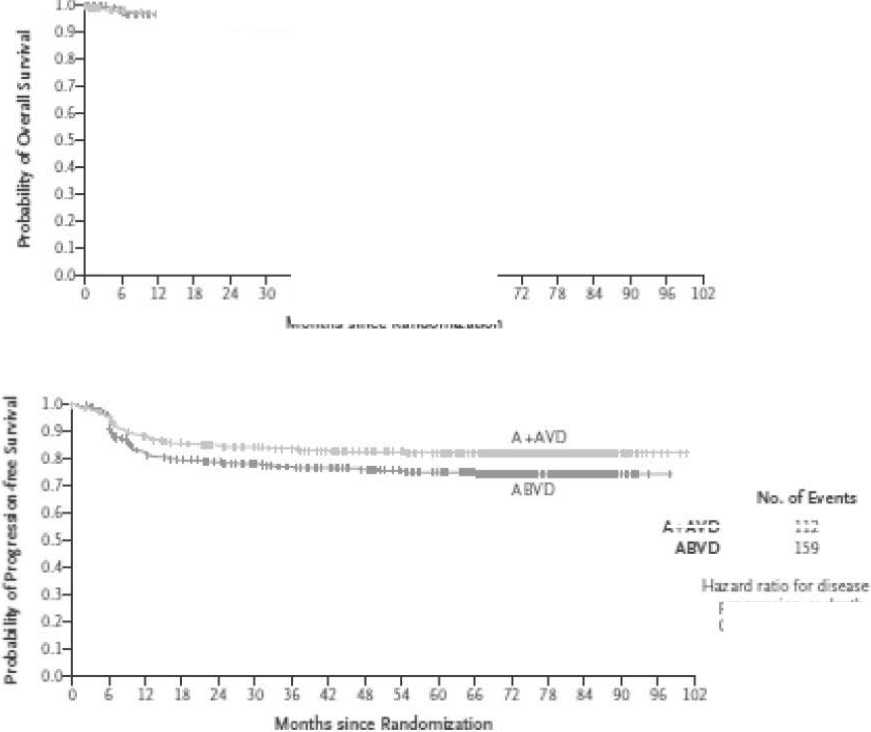
Преимущество режима BV-AVD продемонстрировано в рандомизированном многоцентровом исследовании ECHELON-1, в котором ранее не леченые
664 пациента получили A+AVD, а 670 пациентов были рандомизированы в группу ABVD. Результаты представлены на рисунке 7.
♦^Н***^* «Hitomi,» у^зд.
■мег
ABVD
A-AVD
ABVD
Huard ratio for death 039 (95% a 0.40-048)
P-0.009 by log-галк test
A+AVD кммь
No. of Deaths
К 42 48 54 60 ft
Months since Randomization
A-AVD progression of death. Ой (95% Cl 0 53-0 86)
Рисунок 7. Общая и беспрогрессивная 5-ти летняя выживаемость пациентов с ЛХ в исследовании ECHELON-1 [9].
Медиана периода наблюдения в этом исследовании составила 73 месяца. Уровень 6-ти летней общей выживаемости (ОВ) был 93,9% в группе A+AVD и 89,4% в группе ABVD, а беспрогрессивной выживаемости – 82,3% и 74,5%, соответственно. БВ-содержащий режим в целом хорошо переносился, однако следует отметить большее количество фебрильных нейтропений, что потребовало профилактического применения колониестимулирующего фактора. Периферическая нейтропения различной степени тяжести наблюдалась в группе с БВ, однако у 85% она полностью разрешилась. Кроме улучшения выживаемости в экспериментальной группе, хочется отметить меньшее количество вторых опухолей (23 vs 32), смертей от любых причин (5,9% vs 9,7%), потребности в следующей линии терапии (20,4% vs 23,8%).
Германская группа по изучению лимфом с целью уменьшения токсичности модифицировала режим BEACOPP. Сравнение режимов BEACOPP и BrECADD приведено в таблице 3.
Таблица 3
Сравнение режимов BEACOPP и BrECADD
|
Препарат |
День введения |
BEACOPP доза (мг/м2) |
BrECADD Доза (мг/м2) |
Потенциальное уменьшение токсичности |
|
Блеомицин |
8 |
10 |
- |
Легкие |
|
Этопозид |
1-3 |
200 |
150 |
Гематологическая, частота трансфузий |
|
Доксорубицин |
1 |
35 |
40 |
|
|
Циклофосфамид |
1 |
1250 |
1250 |
|
Винкристин |
8 |
1.4 |
- |
нейротоксичность |
|
Брентуксимаб ведотин |
1 |
- |
1.8 мг/кг |
|
|
Прокарбазин |
1-7 |
100 |
- |
Фертильность, вторичные ОМЛ, МДС |
|
Преднизолон |
1-14 |
40 |
- |
Вес, кости, инфекции |
|
Дакарбазин |
2-3 |
- |
250 |
|
|
Дексаметазон |
1-4 |
- |
40 |
Согласно данным, доложенным на ASH 2022 года, режим BeECADD ассоциировался с существенно меньшей острой токсичностью, с меньшей потребностью в трансфузии компонентов крови, более редким развитием нейропатии и сохранением нормального уровня половых гормонов. Эффективность двух модификаций не различалась и оставалась очень высокой.
В России для лечения распространенных стадий ЛХ зарегистрированы режимы ABVD, BV-AVD, BEACOPP эскалированный и ВЕАСОРР-14. Последний отличается от ВЕАСОРР повторением циклов каждые 2 недели. Важным достижением последних лет является внедрение риск-адаптированной и ПЭТ-адаптированной стратегии индукционной терапии. Существует два варианта такой терапии: эскалационный и деэска-лационный. При выборе деэскалационного режима лечение распространенных стадий начинают с более сильного режима ВЕАСОРР эскалированный. При достижении ПЭТ-негативного статуса после 2-ого цикла цитостатическую нагрузку снижают путем уменьшения количества циклов терапии или замены более токсичного режима ВЕАСОРР на ABVD. Такой подход позволяет излечить приблизительно 85% больных с промежуточным прогнозом и от 67% до 85% боль- ных с распространенными стадиями ХЛ. При выборе эскалационного подхода терапию начинают с менее токсичного режима ABVD. Если ПЭТ/КТ, выполненная после второго цикла лечения, демонстрирует отсутствие повышенной метаболической активности, то пациент продолжает получать лечение по схеме ABVD. Если же у пациента остаются ПЭТ-позитивные очаги, то переходят на более агрессивный режим ВЕ-АСОРР эскалированный. При выборе метода лечения необходимо учитывать возраст больного, а также наличие или отсутствие тяжелых сопутствующих заболеваний. В лечении ранних стадий сохраняется актуальность лучевой терапии. У пациентов, которым проведена ЛТ на область ПЭТ-позитивных очагов, рецидивы встречаются реже. На рисунке 8 представлена 5-ти летняя беспрогрессивная выживаемость пациентов с ранними стадиями ЛХ, получивших и не получивших лучевую терапию в первой линии.
Следует помнить, что если во время лечения появляются признаки прогрессирования, то следует признать терапию первой линии неэффективной и переключиться на вторую линию терапии.
Во время терапии первой линии следует проводить оценку эффективности лечения после каждого четного цикла, желательно методом ПЭТ/КТ.
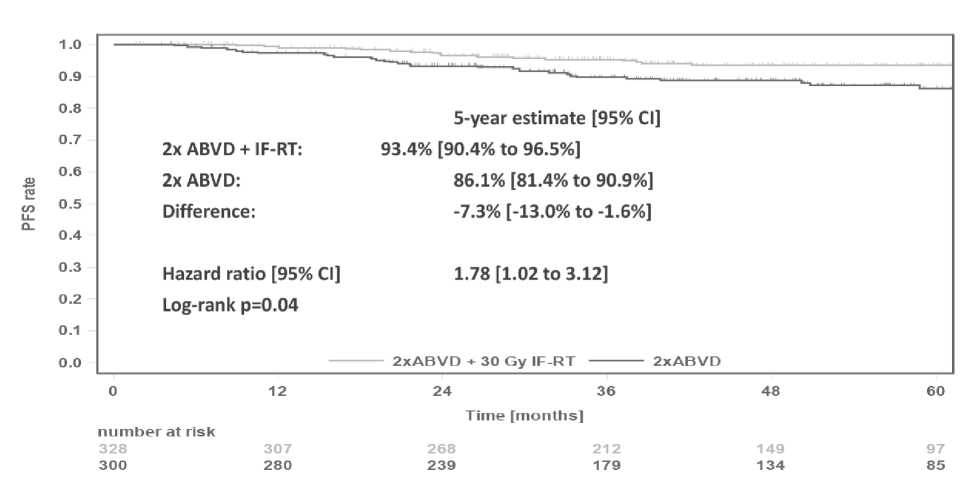
Рисунок 8. 5-ти летняя беспрогрессивная выживаемость пациентов с ранними стадиями ЛХ, получивших и не получивших лучевую терапию в первой линии. Исследование HD16 [10].
В последние годы опубликованы 3 работы по применению ингибиторов иммунных контрольных точек (ниволумаба и пембролизумаба) в первой ли- нии терапии. Во всех случаях пациенты относились к неблагоприятной группе, то есть имели распространенные стадии ЛХ или другие отягчающие прогноз факторы. Дизайн исследований обычно включал фазу монотерапии ИКТ с последующей комбинированной терапией: ингибитор+AVD. Результаты очень обнадеживают и демонстрируют беспрецедентный уровень эффективности. Так, в исследовании Checkmate 205 когорте D, 51 больной получил 4 введения ниволумаба и 6 циклов ниволумаба+AVD, общий ответ составил 84%, а полные ремиссии – 67%, БПВ через 21 месяц наблюдения равнялась 83%. Ansell S. et al. [11] представили результаты последовательного назначения пембролизумаба и AVD у 30 больных. Все пациенты достигли полного ответа, который сохранялся спустя 2 года. Германская группа по изучению лимфомы Ходжкина сравнила в рандомизированном исследовании последовательное и одновременное применение ниволумаба с химиотерапией AVD. Дополнительно была проведена консолидирующая лучевая терапия. Полный ответ достигнут у всех пациентов. Однолетняя бес-прогрессивная выживаемость равнялась 100% при одновременном назначении препарата и 98% – при последовательном. ИКТ обладают специфическим спектром токсичности. Они могут вызывать им-муноопосредованные осложнения. Поэтому полученные данные необходимо проверить на большой когорте пациентов, а также внимательно оценить непосредственные и более отдаленные нежелательные явления. На настоящий момент ни в одной стра- не применение ИКТ в первой линии терапии ЛХ не одобрено.
Лечение рефрактерных форм ЛХ и рецидивов. Несмотря на хорошие в целом результаты лечения ЛХ, у 30% больных встречаются рецидивы заболевания или выявляется резистентность к проводимой терапии. В таких случаях у пациентов молодого возраста без тяжелых сопутствующих заболеваний лечением выбора становится высокодозная полихимиотерапия под защитой аутологичной трансплантации гемопоэтических стволовых клеток (аутоТГСК).
Впервые преимущество аутоТГСК было показано в 1993 году в Великобритании. Пациентам с неудачей первой линии терапии предлагали терапию «спасения» ВЕАМ с последующей аутоТКМ или мини-ВЕАМ, которая не требовала поддержки аутоТКМ. В каждой группе было набрано по 20 пациентов. Рандомизация проходила с большими сложностями, так как пациенты часто отзывали свое согласие, если попадали в группу без аутоТКМ. В итоге исследование закончилось преждевременно: вместо 66 пациентов было набрано только 40. Однако этого количества хватило, чтобы доказать большую эффективность высокодозной химиотерапии с аутоТГСК. С этого времени аутоТГСК стала стандартом лечения пациентов с рецидивами и рефрактерным течением (р/р) ЛХ во всем мире. На рисунке 9 показана общая и бессобытийная выживаемость пациентов с р/р ЛХ в исследовании BNLI.
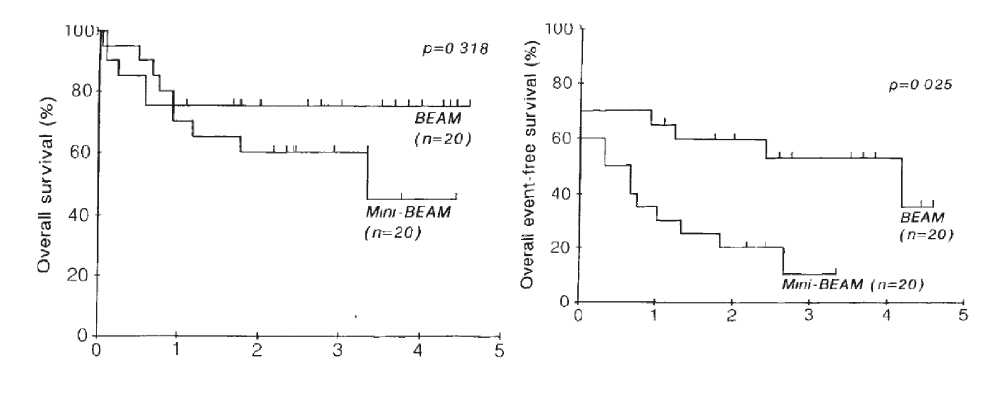
Рисунок 9. Общая и бессобытийная выживаемость пациентов с р/р ЛХ в исследовании BNLI [12].
Современные показания к ТГСК сформулированы EBMT (Европейская группа по трансплантации костного мозга и крови) и в последние годы не менялись, несмотря на появление новых эффективных препаратов для лечения ЛХ (таблица 4). По данным разных авторов аутоТГСК может привести к длительным ремиссиям более 5 лет у 40-60% больных.
В России получены аналогичные результаты. Птушкин В.В. и соавторы [13] провели большое ретроспективное исследование 184 пациентов с р/р ЛХ, получивших аутоТГСК в период с 1990 по 2003
годы в ведущих трансплантационных центрах Москвы, Санкт-Петербурга, Минска и Киева. Все пациенты относились к группе высокого риска рецидива после ТГСК, так как имели либо первично рефрактерное течение (44,8%), либо ранний рецидив (27,2%), либо множественные рецидивы (26,6%). При медиане наблюдения 30 месяцев, 5-ти летняя общая выживаемость составила 60%, выживаемость свободная от неудачи терапии 41,5%. Трансплантационная смертность за период с 1990 года по 2003 год уменьшилась с 5,4% до 1,4%.
Показания к аутоТГСК при лимфоме Ходжкина [14]
Таблица 4
|
Лимфома Ходжкина |
АллогеннаяТГСК |
Аутологичная ТГСК |
||
|
Совместимый родственный донор (сиблинг) |
Совместимый неродственный донор |
Частично совместимый альтернативный донор: частично несовместимый неродственный, пуповинная кровь, гаплоидентичный |
||
|
1 ремиссия |
обычно не рекомендовано (III) |
обычно не рекомендовано (III) |
обычно не рекомендовано (III) |
обычно не рекомендовано (III) |
|
Химиочувствительный рецидив без аутоТГСК |
Метод в разработке (III) |
Метод в разработке (III) |
обычно не рекомендовано (III) |
Стандарт (I) |
|
Химиочувствительный рецидив после аутоТГСК |
Стандарт (II) |
Стандарт (II) |
Стандарт (II) |
Клиническая опция (III) |
|
Рефрактерность |
Метод в разработке (III) |
Метод в разработке (III) |
Метод в разработке (III) |
Клиническая опция (III) |
Обычно перед высокодозной полихимиотерапией с целью уменьшения опухолевой массы и определения чувствительности опухоли к цитостатикам проводят 1, 2 или 3 цикла циторедуктивной терапии, которые часто называют терапией «спасения». Режимы второй линии терапии содержат препараты платины, гемцитабин, бендамустин, цитарабин в различных дозах и сочетаниях. Типичными режимами являются: DHAP (цисплатин, цитарабин, дексаметазон), ICE (ифосфамид, карбоплатин, этопозид), BeGeV (бендамустин, гемцитабин, винорельбин) и другие. Эти режимы высокотоксичны и проводить их можно только с учетом сопутствующих заболеваний и возраста пациента. В последние годы появилась тенденция к включению брентуксимаба ве-дотина во вторую линию терапии для уменьшения токсичности и увеличения эффективности. Кроме того, ряд авторов предлагает использовать ингибиторы ИКТ, обычно ниволумаб или пембролизумаб ввиду их большой эффективности. В таблице 5 приведены опубликованные режимы второй линии терапии.
Таблица 5
Режимы терапии «спасения»
|
Автор год |
Режим |
Кол-во |
Общий ответ |
Полный ответ |
Общая выживаемость |
Беспрогрессивная выживаемость |
|
|
ХТ-режимы |
Santoro A., 2007 |
ICE |
65 |
88 |
26 |
83% 43 мес |
68% 43 мес |
|
Nikolaenko L, 2017 |
IGEV |
91 |
81 |
54 |
70% 3 года |
53% 3 года |
|
|
Santoro A., 2020 |
ESHAP |
82 |
67 |
50 |
73% 5 лет |
78% 5 лет |
|
|
Moskowitz C, 2001 |
BEGEV |
59 |
83 |
73 |
78% 5 лет |
59% 5 лет |
|
|
BV-режимы |
Herrera A, 2018 |
BV |
56 |
75 |
43 |
93% 2 года |
67% 2 года |
|
Chen R, 2016 |
BV-ICE |
44 |
Нет данных |
76 |
95% 2 года |
80% 2 года |
|
|
Moskowitz A, 2015 |
BV-Benda |
55 |
93 |
74 |
92% 3 года |
60% 3 года |
|
|
Lynch R, 2021 |
BV-ICE |
45 |
94 |
74 |
98% 2 года |
80% 2 года |
|
|
LaCasce A., 2020 |
BV-ESHAP |
66 |
91 |
70 |
91% 30 мес |
71% 30 мес |
|
|
Garcia-Sanz R, 2019 |
BV-DHAP |
67 |
90 |
81 |
95% 2 года |
75% 2 года |
|
|
Режимы с ИКТ |
Advani R, 2021 |
BV-Nivo |
91 |
85 |
67 |
93% 3 года |
77% 3 года |
|
Moskowitz A., 2021 |
Pembro-GVD |
36 |
100 |
95 |
100% |
100% |
|
|
Bryan L, 2021 |
Pembro-ICE |
39 |
97 |
87 |
95% 27 мес |
88% 2 года |
|
|
Ansell S, 2015 |
Nivo-/+ICE |
42 |
93 |
91 |
95% 2 года |
72% 2 года |
|
|
Ding K, 2023 |
Tislelizumab +GemOx+ поддержка |
30 |
100 |
96,7 |
Нет данных |
96%, без аутоТГСК |
Включение таргетных или иммунопрепаратов привело не только к улучшению ответа (общего и полного), но и общей и беспрогрессивной выживаемости. Высокая эффективность заставляет задуматься о необходимости проведения токсичной высокодозной ХТ с аутоТГСК. С этой точки зрения отдельного внимания заслуживает работа Ding K и соавторов из Китая. Целью авторов было продемон- стрировать, что оригинальный ИКТ Tislelizumab, разработанный в Китае, в сочетании с гемцитабином и оксалиплатином (T-GemOx) приводит к стойким ремиссиям, что позволяет избежать проведения аутоТГСК. 30 пациентов получили 6-8 циклов T-GemOx с последующей поддержкой Tislelizumab в течении 2-х лет. Медиана периода наблюдения составила 15,8 месяцев. 12-ти месячная БПВ равнялась
96%. Ни один пациент не получил аутоТГСК. Однако пока нельзя сделать вывод об излечении этих пациентов, так как период наблюдения очень короткий.
До последнего времени считали, что перед ау-тоТГСК необходимо стремиться к достижению полного метаболического ответа, так как это являлось залогом успеха последующей высоко-дозной химиотерапии. Действительно, большое количество авторов поддерживало такой подход (таблица 6).
Таблица 6
ПЭТ-статус как фактор риска для аутоТГСК у пациентов с лимфомой Ходжкина
|
Автор |
Медиана периода наблюдения (мес) |
ПЭТ статус |
БПВ% |
ОВ% |
|
Gentzer et al, 2014 |
38 |
Позитив/негатив |
52/85 |
48/100 |
|
Niete et al, 2013 |
45 |
Позитив/негатив |
32/55 |
49/78 |
|
Cocorocchio et al, 2013 |
45 |
Позитив/негатив |
43/79 |
43/92 |
|
Sucak et al, 2013 |
21.5 |
Позитив/негатив |
37,6/70,6 |
74,5/94,1 |
|
Smeltzer et al, 2013 |
37.8 |
Позитив/негатив |
41/82 |
64/91 |
|
Mocikova et al, 2011 |
33.6 |
Позитив/негатив |
36/73 |
61,4/90,3 |
|
Arai et al, 2010 |
29 |
Позитив/негатив |
45/79 |
72/91 |
|
Devillier et al, 2012 |
36 |
Позитив/негатив |
0/75 |
47/84 |
|
Moscowitz et al, 2012 |
51 |
Позитив/негатив |
30/80 |
Нет данных |
ИКТ способны повышать чувствительность опухоли к последующей химиотерапии, включая вы-сокодозную. Четкого объяснения этому феномену нет. Предполагается, что ИКТ воздействует на опухолевое микроокружение, изменяя состав популяции иммунных клеток (макрофагов, Т-лимфоцитов) на длительное время. В ретроспективном исследовании, объединившим 78 пациентов из 22 трансплантационных центров в США, было показано, что результаты аутоТГСК улучшаются и не зависят от остаточной метаболической активности лимфомы. Условием включения была химиорезистентность как минимум к двум режимам терапии «спасения» и введение ИКТ в виде монотерапии или в комбинации с другими препаратами на разных этапах до вы-сокодозной химиотерапии. На рисунке 10 показан эффект сенсибилизации с помощью ингибиторов иммунных контрольных точек.
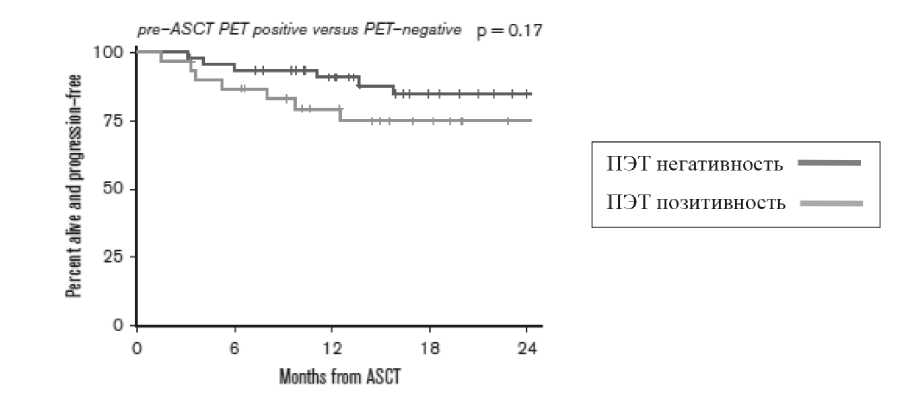
Рисунок 10. АутоТГСК у пациентов с химиорезистентной ЛХ. Эффект сенсибилизации с помощью ингибиторов иммунных контрольных точек [15].
Если в результате циторедуктивной терапии удалось достигнуть частичного или полного ответа со стороны опухоли, то проводят собственно высокодозную химиотерапию, состоящую из режима кондиционирования и инфузии ранее за- готовленных собственных гемопоэтических стволовых клеток. Количество клеток не должно быть менее 2 млн/кг веса. В качестве режима кондиционирования наиболее часто используют ВЕАМ (таблица 7).
Таблица 7
Режим кондиционирования ВЕАМ
|
Препарат |
Стандартная доза |
Путь введения |
Дни введения |
|
Кармустин |
300 мг/м2 |
в/в капельно |
-6 |
|
Цитарабин |
100 мг/м2 каждые 12 часов |
в/в капельно |
-5, -4, -3, -2 |
|
Этопозид |
100 мг/м2 |
в/в капельно |
-5, -4, -3, -2 |
|
Мелфалан |
140 мг/м2 |
в/в капельно |
-1 |
Кармустин может быть заменен на бендамустин в дозе 200 мг/м2 в дни -7 и -6 внутривенно капельно, в этом случае режим называется BeEAM. Есть варианты режимов кондиционирования с заменой кармустина на ломустин (LEAM) и мелфалана на циклофосфамид (BEAC и ВеЕАС).
Пациентам с высоким риском рецидива после ау-тоТГСК показана консолидирующая терапия брен-туксимабом ведотином (БВ) в дозе 1,8 мг/м2 максимально до 16 введений. Впервые эффективность поддерживающей терапии была продемонстрирована в многоцентровом, рандомизированном иссле- довании AETHERA. 165 пациентов получили поддерживающую терапию брентуксимабом ведотином, 164 пациента – плацебо. Медиана БПВ не достигнута в группе с БВ, в группе плацебо составляет 15,8 месяцев. 5-ти летняя БПВ была 59% (группа с БВ) против 41% (плацебо). На рисунке 11 видно, что различия в БПВ более наглядны среди пациентов, имеющих дополнительные факторы риска рецидива. К ним были отнесены: первичная рефрактерность, рецидив в течение первого года, экстранодальные очаги, использование более одного режима «спасения» и отсутствие полного ответа перед аутоТГСК.
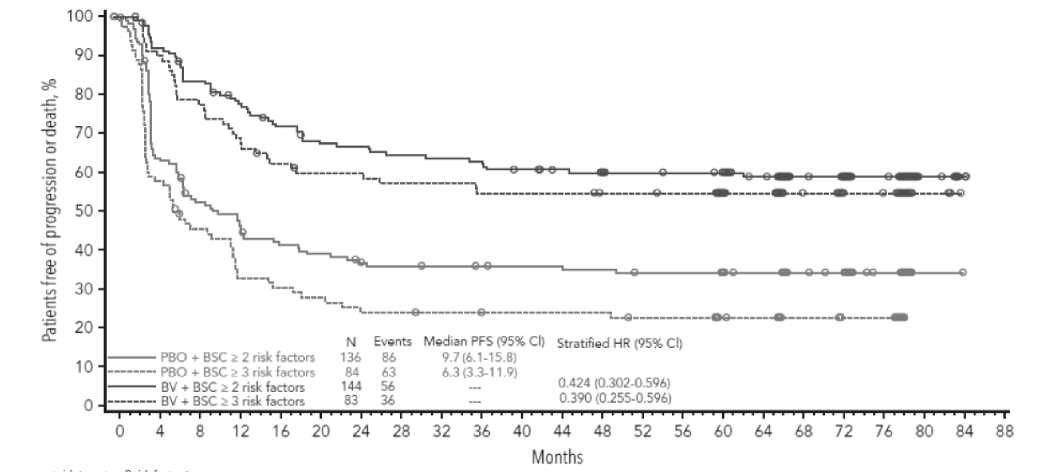
Рисунок 11. Исследование AETHERA. Беспрогрессивная выживаемость пациентов с р/р лимфомой Ходжкина, получивших поддерживающую терапию брентуксимабом ведотином vs плацебо в зависимости от факторов риска рецидива.
Пациентам, которые не являются кандидатами на высокодозную химиотерапию с аутоТГМК из-за возраста, коморбидности, рефрактерности к режимам «спасения», а также в случае рецидива после аутоТГСК проводят либо паллиативную химиотерапию, либо пытаются получить эффект посредством таргетной или иммунотерапии.
В 2016 году Chen R. И соавторы показали эффективность брентуксимаба ведотина у самой неблагоприятной группы пациентов с неудачей аутоТГСК. Общий ответ среди 102 пациентов составил 75%, а полный ответ – 34%. Более чем обнадеживающие результаты исследования привели к ускорен- ной регистрации препарата в FDA (Food and Drug Administration) в США. Однако отдаленные результаты показали, что хотя 5-ти летняя общая выживаемость оставалась хорошей (41%), беспрогрессивная выживаемость в общей группе составила 22% (рисунок 12). Принципиальное значение имело достижение полного ответа. В этой группе из 34 больных 5-ти летняя ОВ составила 64%, а БПВ – 52%. Следует отметить, что в 6-ти случаях в дальнейшем была выполнена консолидирующая аллоТГСК. Всего из 102 пациентов, включенных в исследование, только 9 пациентов не получили никакой дополнительной терапии и оставались при этом в ремиссии заболевания.
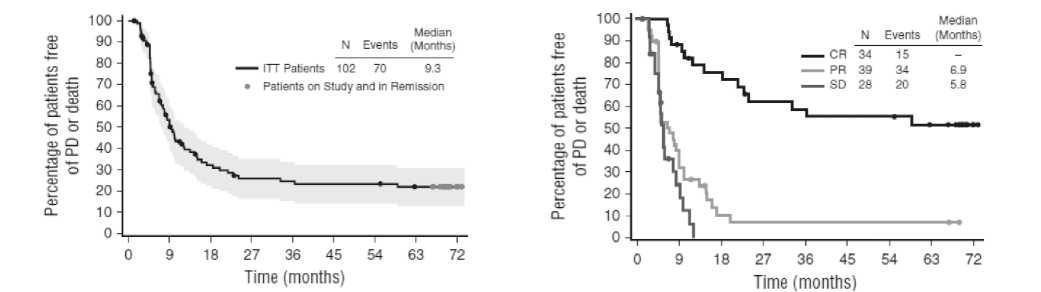
Рисунок 12. 5-ти летняя БПВ больных, получивших брентуксимаб ведотин по поводу р/р ЛХ [16].
Аналогичные результаты получены в клинике НИИ ДОГиТ им. Р.М. Горбачевой ПСПбГМУ им. И.П. Павлова (рисунок 13)
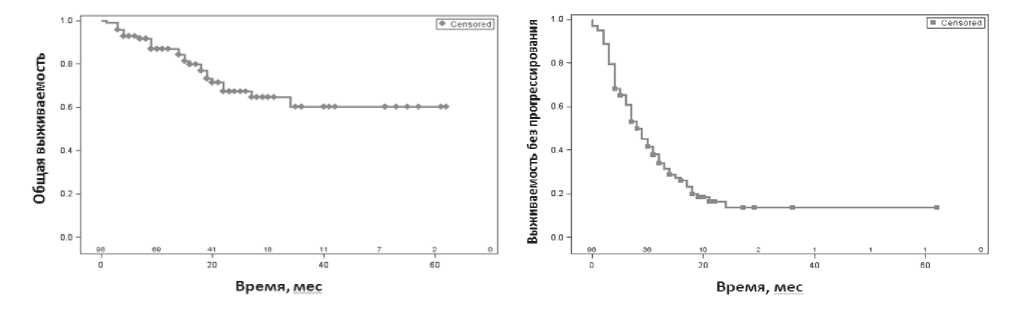
ОВ 73.5% при медиане наблюдения 18 мес.
ВБП 24% при медиане 8.7 мес.
Рисунок 13. Общая и беспрогрессивная выживаемость пациентов с р/р ЛХ, получивших терапию БВ в НИИ ДОГиТ им. Р.М.Горбачевой.
Для усиления эффекта БВ можно сочетать с химиотерапевтическими препаратами. При этом следует учитывать перекрестную токсичность препаратов.
Преимуществом иммунотерапии является отсутствие перекрестной резистентности с химиотерапией, таргетной и лучевой терапией. К иммунотерапии относится лечение ингибиторами иммунных контрольных точек (ИКТ) (например, ниволумабом или пембролизумабом), аллоТГСК и CAR-T терапия.
Создание концепции ИКТ и внедрение их в клиническую практику позволило добиться недостижимых ранее результатов в лечении ряда солидных опухолей, прежде всего меланомы, рака легких и др. Однако несмотря на то, что препараты-ингибиторы PD-1 создавались для лечения солидных новообразований, наиболее эффективны они оказались в лечении классической лимфомы Ходжкина. Молекулярное ис- следование клеточных линий кЛХ продемонстрировало наличие хромосомных аберраций локуса 9p24.1 и гиперэкспрессии генов, содержащихся в этой области, включая PD-L1, PD-L2 и JAK2. ИКТ представляют собой моноклональные антитела человеческого иммуноглобулина типа G4, которые выборочно ингибируют активность мембранного белка рецептора PD-1 (белок программируемой клеточной гибели-1), связываясь с его рецептором. Имеющиеся доклинические исследования показали, что клетки БРШ используют сигнальный путь программируемой клеточной гибели 1 (PD-1) как способ уклонения от иммунного надзора. Следует отметить, что ИКТ не оказывают прямого действия на опухоль, а устраняют ингибирующее влияние микроокружения на иммунный ответ, в результате происходит активация и миграция иммунных клеток в очаги опухоли (рис. 14).
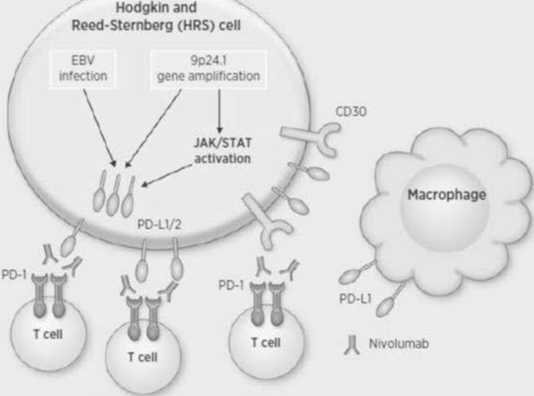
Лиганды PD-1 высоко экспрессируются на клетках БРШ из-за амплификации участка хромосомы 9p24.1 или инфекции EBV. PD-L1 также может экспрессироваться внутриопухолевыми макрофагами. PD-L1 и PD-L2 передают сигнал через PD-1, экспрессируемый на внутриопухолевых Т-клетках, и подавляют функцию Т-клеток, что приводит к неэффективному противоопухолевому иммунному ответу. Блокада передачи сигналов PD-1 ниволу-мабом, моноклональным антителом против PD-1 предотвращает анергию и истощение Т-клеток.
Рисунок 14. Механизм действия ингибиторов ИКТ [17].
Эффективность ИКТ была продемонстрирована в двух проспективных клинических исследованиях (таблица 8).
Таблица 8
Результаты исследований ниволумаба и пембролизумаба у пациентов с р/р ЛХ [18-20]
|
Исследование |
n |
Медиана наблюдения мес |
ОО % |
ПО % |
ЧО % |
БПВ мес |
|
CheckMate 0391 ниволумаб |
23 |
40 |
87 |
17 |
70 |
Нет данных |
|
CheckMate 2052 ниволумаб |
243 |
33 |
71 |
21 |
50 |
15 |
|
-когорта А |
63 |
33 |
65 |
32 |
33 |
17 |
|
-когорта В |
80 |
33 |
71 |
14 |
58 |
12 |
|
-когорта С |
100 |
33 |
75 |
20 |
55 |
15 |
|
Keynote-0133 пембролизумаб |
31 |
25 |
58 |
19 |
39 |
11 |
|
Keynote 0874 пембролизумаб |
210 |
28 |
72 |
28 |
44 |
14 |
|
-когорта 1 |
69 |
28 |
77 |
26 |
51 |
16 |
|
-когорта 2 |
81 |
28 |
67 |
26 |
41 |
11 |
|
-когорта 3 |
60 |
28 |
73 |
32 |
42 |
19 |
Когорты отличались различной предлеченно-стью пациентов: все пациенты, кроме когорты 2, прошли аутоТГСК, в когорте А и когорте 3 не было предшествующего брентуксимаба ведотина. Ниво-лумаб назначали в дозе 3 мг/кг каждые 2 недели, пембролизумаб вводили в фиксированной дозе 200 мг 1 раз в 3 недели. Лечение проводили до прогрессирования или непереносимой токсичности. Результаты оценивали по критериям Лугано. Структура ответа и БПВ были сопоставимы во всех когортах. Медиана общей выживаемости не была достигнута ни в одной подгруппе. В настоящее время опублико- вано много работ по эффективности ингибиторов ИКТ в реальной клинической практике. Результаты оказались сравнимы с данными клинических исследований. В НИИ ДОГиТ им. Р.М. Горбачевой в рамках программы раннего доступа было пролечено 116 больных с р/р ЛХ. Медиана наблюдения составила 60 месяцев.
Общий ответ наблюдали у 65%, ПО – 32%, ЧО – 33%, прогрессирование было зафиксировано в 9% и в 3% – стабилизация. У 20% больных имел место неопределенный ответ (рисунок 15). Для оценки ответа использовали LYRIC критерии.
Общая выживаемость Беспрогрессивная выживаемость
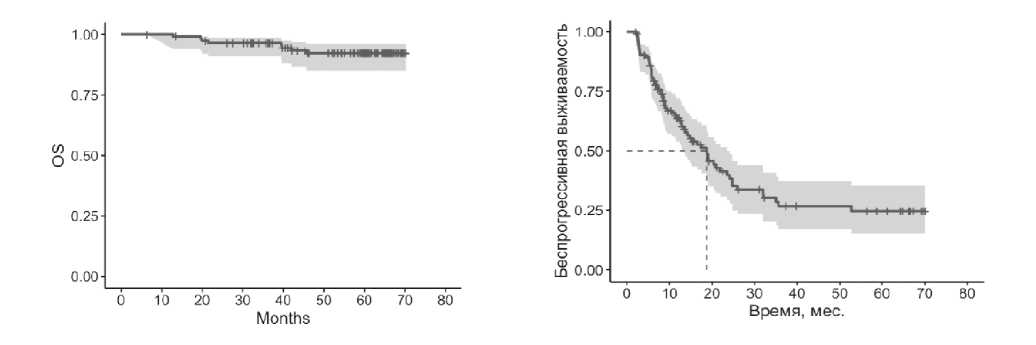
5-летняя ОВ 92,3%, медиана не достигнута
5-летняя БПВ 24,7%, медиана 19,1 мес
Рисунок 15. Результаты лечения ниволумабом больных с р/р ЛХ в рамках программы раннего доступа [21].
В данной работе применяли стандартную дозу препарата 3 мг/кг каждые 2 недели. Дальнейшие наблюдения показали, что доза ниволумаба может быть существенно уменьшена без потери эффективности.
Изучению эффективности малых доз ниволумаба в НИИ ДОГиТ им. Р.М. Горбачевой положило начало клиническое наблюдение применения ниволума-ба у пациентки с рецидивом ЛХ после аллоТГСК. В посттрансплантационном периоде у нее были небольшие проявления хронической РТПХ со стороны кожи и глаз. Рецидив в виде очага в легких был выявлен при ПЭТ/КТ исследовании на 130 день после аллоТГСК. На протяжении 3-х лет последовательно проводилась терапия брентуксимабом ведотином, химиотерапией, инфузией донорских лимфоцитов в монорежиме и в сочетании с таргетной терапией и химиотерапией. В связи с неэффективностью лечения (образование в легком достигло 6 см) был введен ниволумаб в дозе 0.5 мг/кг однократно. Доза была уменьшена в связи с опасностью иммуноопос-редованных осложнений, в том числе ухудшения течения хронической РТПХ. Через 10 дней развилось несколько серьезных негативных явлений: асептический менингит, гипотиреоз, надпочечниковая недостаточность, которые были купированы кортикостероидами и заместительной гормональной терапией. Через 4 месяца на контрольной ПЭТ/КТ зафиксирован полный регресс очага в легких (рисунок 16).
Рисунок 16. ПЭТ/КТ пациентки до введения ниволумаба в дозе 0,5 мг/кг и через 4 месяца.
Кроме того, на примере больных с меланомой, получивших ниволумаб в дозе от 0,1 мг/кг до 10 мг/кг, медиана оккупирования (блокады) PD-1 рецептора на CD3-позитивных Т-клетках равнялась 65% на каждой исследуемой дозе и не зависела от концентрации ниволумаба. В других клинических исследованиях анти PD-1 антител при различных солидных опухолях также не было обнаружено корреляций между дозой, негативными явлениями и эффективностью. При ЛХ вопрос дозирования является особенно актуальным в связи с уникальными биологическими характеристиками опухоли, а именно высокой гиперэкспрессией PD-L1 вследствие хромосомной альтерации в локусе 9p24.1 и большой чувствительности к PD-1 блокаде. Наше наблюдение и другие опубликованные клинические случаи также свидетельствуют о драматиче- ском эффекте малых доз ниволумаба у пациентов с ЛХ.
В 2020 году в НИИ ДОГиТ им. Р.М. Горбачевой было организовано и проведено проспективное исследование эффективности и безопасности ниволу-маба в фиксированной дозе 40 мг у больных с р/р ЛХ (NCT03343665). Всего было включено 30 больных. Доза была выбрана в связи с имеющейся готовой аптечной формой 40 мг препарата во флаконе. Медиана веса пациентов равнялась 67,5 (40-100) кг, медиана дозы на кг веса – 0,59 (0,4-1) мг/кг. Не было корреляции между дозой на кг и эффективностью терапии. Максимальное количество циклов терапии было 24. Ответ оценивали по критериям LYRIC. Полные ответы достигнуты в 43,3%, частичные ответы – 26,7%, неопределенный ответ в 23,3% случаев (рисунок 17).
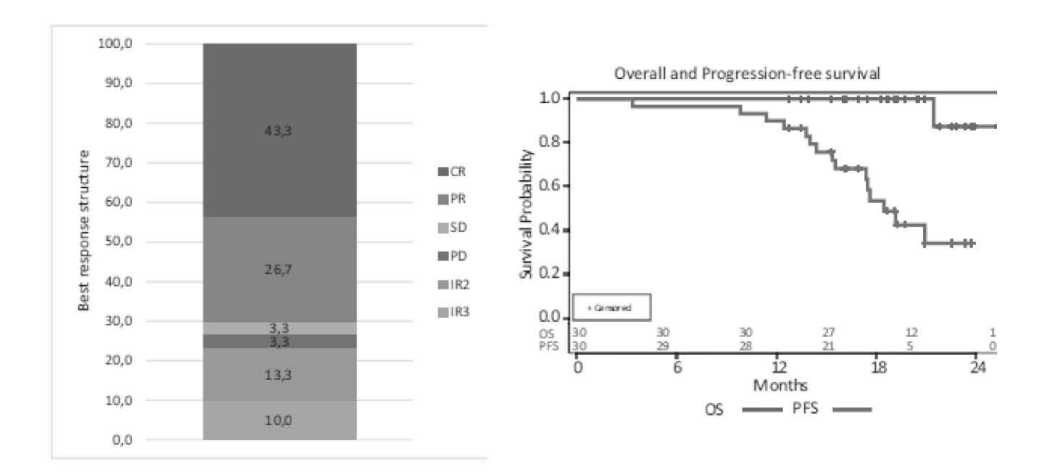
Структура ответа
Общая и беспрогрессивная выживаемости
Рисунок 17. Эффективность малых доз ниволумаба у р/р пациентов с ЛХ [22].
Проведенный дополнительный анализ показал полных и малых доз ниволумаба при лечении р/р отсутствие значимых различий в эффективности ЛХ (таблица 9).
Таблица 9Сравнение эффективности двух доз ниволумаба (анализ парных случаев) [23]
|
ОО |
ПО |
ЧО |
стаб |
прогр |
НО |
ОВ 3,5 г |
БПВ 3,5 г |
Медиана БПВ |
|
|
3мг/кг |
67 |
34 |
33 |
5 |
8 |
20 |
93,5 |
24,9 |
21,9 |
|
40 мг |
66 |
38 |
28 |
6 |
6 |
22 |
97,8 p=0,356 |
20,5 p=0,356 |
18,8 |
Отличительной чертой ИКТ являются аутоиммунные осложнения. Они могут возникать в любых органах и тканях: наиболее часто поражается кожа, суставы, кишечник, щитовидная железа, печень. По данным НИИ ДОГиТ им. Р.М. Горбачевой (Лепик К.В., диссертационная работа 2019 год) у 89,1% больных наблюдались различные негативные явления (НЯ) любой степени тяжести на фоне терапии ниволума-бом, но НЯ 3-4 степени имели место только у 21,8% (таблица 10).
НЯ у пациентов, получавших терапию ниволумабом
Таблица 10
|
НЯ |
НЯ всего % (абс) |
НЯ 1-2 ст. %(абс) |
НЯ 3-4 ст % (абс) |
|
любые |
89,1 (90) |
85,1 (86) |
21,8 (22) |
|
лейкопения |
34,7 (35) |
29,7 (30) |
5,0 (5) |
|
слабость |
27,7 (28) |
27,7 (28) |
0,0 (0) |
|
Головная боль |
20,8 (21) |
20,8 (21) |
0,0 (0) |
|
анемия |
19,8 (20) |
18,8 (19) |
1,0 (1) |
|
тошнота |
18,8 (19) |
18,8 (19) |
0,0 (0) |
|
нейропатия |
16,8 (17) |
16,8 (17) |
0,0 (0) |
|
Повышение трансаминаз |
15,8 (16) |
13,9 (14) |
2,0 (2) |
|
Кожный зуд |
15,8 (16) |
15,8 (16) |
0,0 (0) |
|
гипотиреоз |
14,9 (15) |
14,9 (15) |
0,0 (0) |
|
сыпь |
13,9 (14) |
13,9 (14) |
0,0 (0) |
|
одышка |
13,9 (14) |
13,9 (14) |
0,0 (0) |
|
Пирексия после 1 введения |
12,9 (13) |
12,9 (13) |
0,0 (0) |
|
Боль и вздутие живота |
12,9 (13) |
12,9 (13) |
0,0 (0) |
|
диарея |
10,9 (11) |
10,9 (11) |
0,0 (0) |
|
тромбоцитопения |
9,9 (10) |
5,9 (6) |
4,0 (4) |
|
Нарушение зрения |
8,9 (9) |
8,9 (9) |
0,0 (0) |
|
артралгия |
8,9 (9) |
8,9 (9) |
0,0 (0) |
|
Инфекция верхних дыхательных путей |
7,9 (8) |
7,9 (8) |
0,0 (0) |
|
Снижение аппетита |
6,9 (7) |
6,9 (7) |
0,0 (0) |
|
запор |
6,9 (7) |
6,9 (7) |
0,0 (0) |
|
Повышение креатинина |
6,9 (7) |
5,0 (5) |
2,0 (2) |
|
пневмония |
7,9 (8) |
5,0 (5) |
3,0 (3) |
|
рвота |
3,0 (3) |
3,0 (3) |
0,0 (0) |
|
Повышение амилазы |
3,0 (3) |
1,0 (1) |
2,0 (2) |
|
синусит |
3,0 (3) |
3,0 (3) |
0,0 (0) |
|
увеит |
2,0 (2) |
0,0 (0) |
2,0 (2) |
|
Менингит асептический |
2,0 (2) |
0,0 (0) |
2,0 (2) |
|
колит |
2,0 (2) |
0,0 (0) |
2,0 (2) |
|
Тромбоз |
2,0 (2) |
1,0 (1) |
1,0 (1) |
|
аспергилез |
2,0 (2) |
2,0 (2) |
0,0 (0) |
|
неврит |
1,0 (1) |
1,0 (1) |
0,0 (0) |
|
хореоретинит |
1,0 (1) |
1,0 (1) |
0,0 (0) |
|
ОНМК |
1,0 (1) |
0,0 (0) |
1,0 (1) |
|
гипофизит |
1,0 (1) |
0,0 (0) |
1,0 (1) |
|
Артрит псориатический |
1,0 (1) |
0,0 (0) |
1,0 (1) |
|
Артрит бактериальный |
1,0 (1) |
0,0 (0) |
1,0 (1) |
|
ОМЛ |
1,0 (1) |
0,0 (0) |
1,0 (1) |
Примечание. Жирным шрифтом выделены однозначно иммуноопосредованные НЯ.
Не исключено, что отдельные случаи тромбоцитопении, анемии, кожного зуда, повышения трансаминаз и амилазы также были связаны с нарушением иммунной толерантности. Наиболее частым аутоиммунным осложнением был гипотиреоз. У всех пациентов нарушения функционирования щитовидной железы купированы назначением заместительной гормональной терапии и не требовали отмены ни-волумаба. Увеит наблюдался у двух пациентов и привел к потере зрения на один глаз вследствие развития катаракты. В обоих случаях ИКТ был отменен. Асептический менингит развился у двух пациентов, получивших ниволумаб в связи с рецидивом ЛХ после аллоТГСК. Проявления были полностью быстро купированы кортикостероидами. В дальнейшем одна пациентка повторно получала ниволумаб без развития менингита.
На фоне терапии ИКТ необходимо тщательное наблюдение гематолога или онколога. В подавляющем большинстве случаев осложнения не угрожают жизни пациентов и легко купируются кортикостероидами. Оптимальная длительность лечения ИКТ до настоящего времени не определена. Есть мнение, что при достижении полного ответа терапию следует продолжать не менее 1 года. Однако в клинической практике уже есть случаи непрерывной терапии более 3-х лет, а также повторного назначения ИКТ. При отсутствии ответа к терапии ИКТ иногда добавляют брентуксимаб ведотин или химиопрепараты. Такая комбинированная терапия приводит к полным или частичным метаболическим ответам у большинства пациентов. Однако ответ нестойкий: медиана продолжительности ответа составляет от 10 до 18 месяцев. Поэтому у молодых пациентов этот подход используют в качестве «мостика» к аллоТГСК. Но даже при явном прогрессировании заболевания терапию ИКТ отменять не стоит. Исследования показали, что общая выживаемость пациентов, продолжающих получать ИКТ, лучше, чем у пациентов, прекративших лечение.
В последние 10 лет у больных ЛХ стали более широко использовать аллоТГСК. Механизм действия аллоТГСК объясняется эффектом «трансплантат-против-лимфомы», который обеспечивают аллоре-активные донорские Т-клетки.
До 2000 года аллоТГСК при ЛХ использовали редко: считалось, что пациенты тяжело предле-чены и не могут перенести режимы кондиционирования. Кроме того, аллоТГСК, выполненная вне ремиссии заболевания, не показывала хороших результатов, возможно в связи с медленным развитием и недостаточно сильной реакцией «транс-плантат-против-лимфомы». А способов получить полную ремиссию у пациентов с аутоТГСК в анамнезе просто не существовало. Тем не менее, отдельные публикации свидетельствовали, что пациенты, имевшие донора и получившие аллоТГСК, обладали преимуществом в выживаемости по сравнению с такими же пациентами, не имевшими донора (рисунок 18).
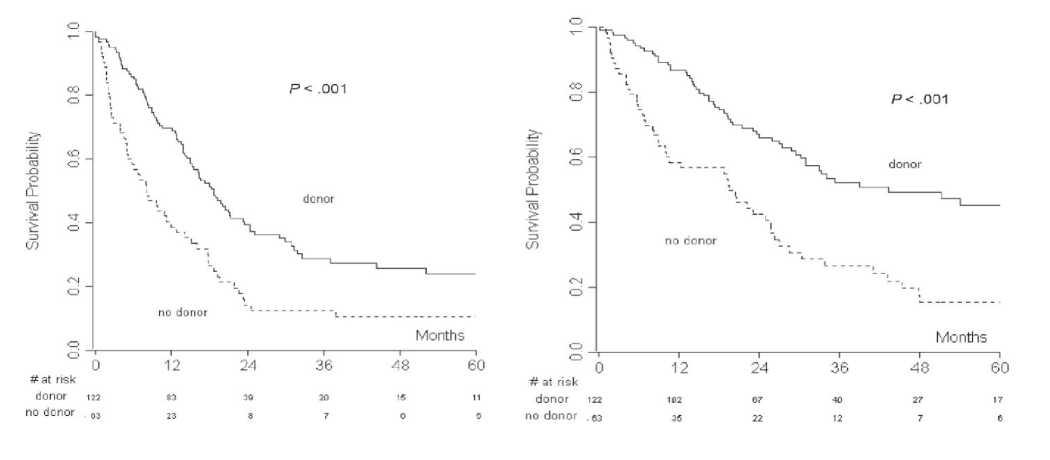
Рисунок 18. Эффективность аллоТГСК с кондиционированием со сниженной токсичностью у пациентов с рецидивом ЛХ после аутоТГСК. Ретроспективное исследование итальянской группы по ТКМ [24].
В ретроспективном исследовании среди 185 пациентов с рецидивом ЛХ после аутоТГСК у 122 больных был найден совместимый родственный донор (55%), совместимый неродственный донор (32%) или гаплоидентичный родственный донор (13%). У 63 больных доноров не удалось найти. Клинические характеристики были одинаковы в обеих группах. 2-х летняя БПВ и ОВ были лучше в группе, имевшей донора: 39/3% vs 14/2% и 66% vs 42%, соответственно (p <0,001), c медианой наблюдения 48 месяцев.
По данным ЕВМТ в течение 25 лет (с 1990 по 2014 годы) было выполнено 2204 аллоТГСК при ЛХ, при этом трансплантационная активность увеличивалась постепенно: в период с 1990 по 1994 годы было сделано 33 аллоТГСК, за период с 2003 по 2006 год – уже 440, а за 2011-2014 годы – 817. Количество трансплантационных центров, занимавшихся ал-лоТГСК при ЛХ, в Европе увеличилось с 25 в 1990 году до 276 в 2014. Триггерами активности в аспекте аллоТГСК стало внедрение в клиническую практику режимов кондиционирования со сниженной интенсивностью, использование гемопоэтических стволовых клеток периферической крови в качестве источника трансплантата вместо костного мозга и проведение гаплотрансплантаций. Общими тенденциями стал отбор на аллоТГСК более молодых пациентов, без коморбидности и с менее рефрактерной к химиотерапии ЛХ. Эти изменения привели к увеличению 3-х летней общей и беспрогрессивной выживаемости (с 21% и 15%, соответственно, в 1990-1994 годах до 43% и 35% в 2011-2014 годах) и снижению не связанной с рецидивом смертности в первый год после ТГСК с 58% до 19%. Однако уровень рецидивов остался практически без изменений: 27% в 1990-1994 годах и 35% в 2011-2014 годах [25].
Появление новых препаратов (брентуксимаба ведотина и позднее ингибиторов иммунных контрольных точек ниволумаба и пембролизумаба) дало надежду пациентам с рефрактерными к химиотерапии формами ЛХ и рецидивами после аутоТГСК на достижение полных ремиссий и, может быть, выздоровления без проведения аллоТГСК. Как результат, в последние годы остановился рост количества проводимых в Европе аллоТГСК (рисунок 19). Однако надежды не оправдались. Только 9% пациентов с р/р ЛХ достигли стойкой полной ремиссии заболевания после брентуксимаба ведотина, не по- требовавшей дальнейшей терапии, и около 20 % пациентов, лечившихся ингибиторами иммунных контрольных точек. У большинства больных новые препараты не решили проблему, хотя существенно продлили жизнь пациентов и отодвинули вопрос об аллоТГСК на некоторое время.
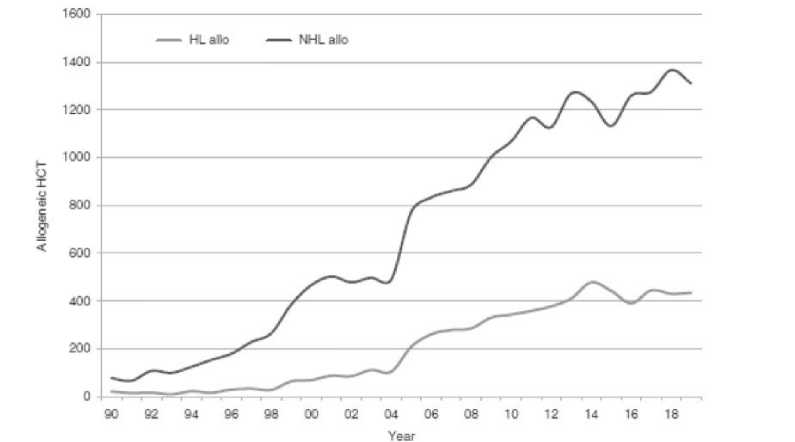
Рисунок 19. Трансплантационная активность в Европе. АллоТГСК при ЛХ и НХЛ [26].
Для выполнения аллоТГСК при любом заболевании необходимо иметь показания, не иметь противопоказаний и иметь донора. АллоТГСК – это сложный многоэтапный процесс. Первый этап лечения состоит из трансплантации аллогенных, совместимых родственных или неродственных или наполовину совместимых родственных (гапло-) по системе гистосовместимости, гемопоэтических стволовых клеток. С целью обеспечения приживления донорского трансплантата проводят подготовку (конди- ционирование) больного химиотерапевтическими режимами со сниженной интенсивностью. Наиболее часто используют режимы флударабин/бусульфан, флударабин/мелфалан, флударабин/циклофосфа-мид, так как флударабин обладает мощным лимфо-деплетирующим потенциалом (таблица 11). В нашем центре в последние годы применяется режим флударабин/бендамустин, предложенный впервые Khouri I.F. и соавторами из MD Anderson Cancer Center в 2014 году [27].
Таблица 11
|
Дни |
-4 |
-3 |
-2 |
-1 |
0 |
+1 |
+2 |
+3 |
+4 |
+5 |
+6 |
+7 |
|
|
бендамустин |
130 мг/м2 |
* |
* |
* |
|||||||||
|
Флударабин |
30-50 мг/м2 |
* |
* |
* |
|||||||||
|
ТГСК |
* |
||||||||||||
|
Посттрансплан-тационный циклофосфан |
50 мг/кг |
* |
* |
||||||||||
|
±такролимус |
0,03 мг/кг |
* |
* |
* |
|||||||||
|
±микофенолата мофетил |
15 мг/кг |
* |
* |
* |
Режим кондиционирования флударабин/бендамустин [27]
Такие режимы, как правило, удовлетворительно переносятся даже пациентами с большим количеством циклов химиотерапии в анамнезе. Для профилактики реакции «трансплантат-против хозяина» (РТПХ) пациенты в посттрансплантационном периоде получают иммуносупрессивную терапию. Второй этап (при необходимости) состоит из инфузий донорских лимфоцитов, который преследует цель усилить противоопухолевый эффект трансплантата. Аллогенная ТГСК при ЛХ показывает 5-летнюю выживаемость у половины пациентов. Эффективность метода зависит от статуса заболевания на момент ТГСК: чем глубже ремиссия перед ТГСК, тем лучше результаты. Анализ, проведенный крупным международным регистром ТГСК (CIBMTR), включившим с 2009 по 2019 годы 1694 пациентов с р/р ЛХ показал улучшение 3-х летней ОВ до 67% у больных с полной или частичной ремиссией перед трансплантацией по сравнению с 50% у больных с активным заболеванием.
В НИИ ДОГиТ получены аналогичные данные. Среди 92 пациентов на момент ТГСК 42,4% имели ПР, 20,7% – ЧР и 37% – стабилизацию или прогрессирование ЛХ. 2-х летняя ОВ составила 92%, 67% и 55%, соответственно (р=0,0015), а 2-х летняя БПВ – 74%, 41% и 34% (р=0,00077) (рисунок 20).
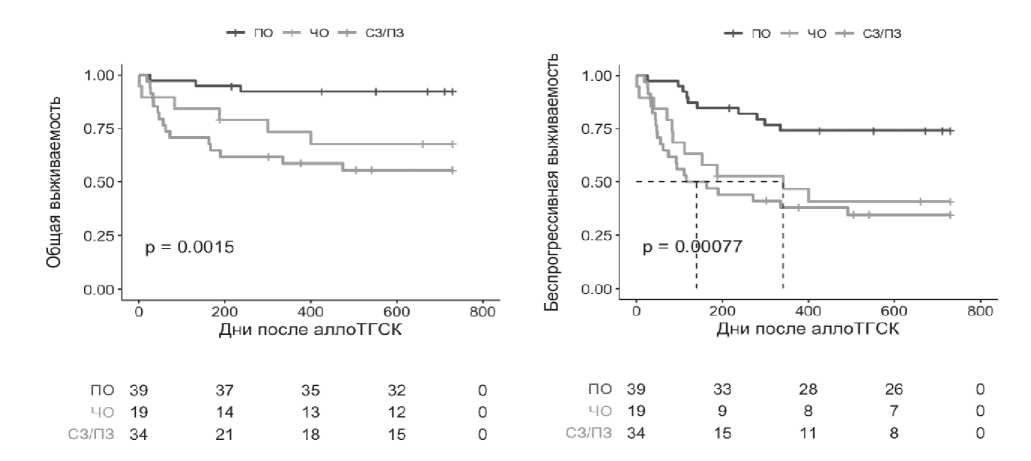
Рисунок 20. АллоТГСК при р/р ЛХ в НИИ ДОГиТ им. Р.М. Горбачевой. предтрансплантационного статуса на общую и беспрогрессивную выживаемости [28].
Влияние
В наши дни практически все больные до аллоТГСК получают ИКТ. В целом ряде работ было отмечено, что применение ниволумаба или пембролизумаба до трансплантации может привести к тяжелым острым и хроническим РТПХ, неинфекционным фебрильным эпизодам и другим иммуноопосредованным негативным проявлениям. Вероятно, это вызвано длительным периодом полувыведения ИКТ и активацией цитокинов и CD4+ T-хелперов. Метаанализ, проведенный Ijaz и соавторами в 2019 году, показал, что из 107 больных у 7% развилась сверхострая РТПХ, у 56% была острая РТПХ 2-4 степени, и у 29% – хроническая РТПХ [29]. Есть данные, что РТПХ 3-4 степени встречается в 3 раза чаще у больных, получивших ИКТ перед ТГСК (28% по сравнению с 8% в контрольной группе). Для уменьшения рисков обычно соблюдают интервал не менее 2 месяцев между последней дозой ИКТ и аллоТГСК. Введение циклофосфана на 4-5 дни после трансплантации также может предотвратить тяжелую форму РТПХ. Японские коллеги сообщили о снижении уровня РТПХ в результате применения посттрансплантационного циклофосфамида с 58% до 15% [30].
Кроме РТПХ у пациентов после аллоТГСК могут быть и другие серьезные осложнения. К ним относится неприживление трансплантата, гипофункция трансплантата, различные инфекционные осложнения. Хроническая РТПХ может существенно влиять на качество жизни больных и требовать длительного приема иммуносупрессивных препаратов. Поэтому решение об аллоТГСК необходимо принимать очень взвешенно с учетом всех возможных позитивных и негативных факторов.
Еще одна проблема – это рецидивы заболевания после аллоТГСК. Для их профилактики и лечения используются инфузии донорских лимфоцитов и те- рапия брентуксимабом ведотином. Применение ингибиторов иммунных контрольных точек после ал-лоТГСК также возможно, но только у пациентов без хрРТПХ. Следует помнить, что эта группа препаратов может спровоцировать РТПХ. Согласно данным НИИ ДОГиТ им. Р.М.Горбачевой 12 пациентов с рецидивом после аллоТГСК лечились ниволумабом. Все пациенты предварительно получали брентуксимаб ведотин, но эффект был либо недостаточный, либо утерян. Медиана интервала между выполнением ал-лоТГСК и первой дозой ниволумаба была 32 месяца (3-56 мес). Объективный ответ был получен у всех больных: 50% – полный ответ, 50% – частичный ответ. ОВ=90%, БПВ=62% [28]. Реактивация РТПХ была отмечена у одного больного.
Среди новых перспективных направлений в лечении р/р ЛХ следует упомянуть CAR-T терапию и биспецифические антитела. Наличие CD30 маркера практически на всех клетках БРШ и отсутствие этой молекулы на большинстве нормальных клеткок тканей человека делает идею антиCD30 CAR-T клеточной терапии весьма привлекательной. Однако количество клеток БРШ очень невелико и составляет около 1% от всей опухолевой массы. Поэтому необходимо создать условия, чтобы CAR-T клетки смогли добраться до, собственно, лимфомных клеток и уничтожить их. При разработке CAR-T для ЛХ исследователи обращают внимание на возможность воздействия на опухолевое микроокружение, способность CAR-T клеток проникать вглубь опухоли. Поэтому кроме CD30 мишени, рассматриваются также антиCD123- направленные CAR-T (против опухоль-ассоциированных макрофагов), антиССL17 (ССR4), молекулы, способствующие рекрутированию иммуносупресcивных клеток, и целый ряд дру- гих мишеней. Имеется несколько исследований I/II фазы с небольшим количеством очень предлеченых пациентов. Эффективность CAR-T терапии достигает 50%. При этом большая опухолевая масса ассоциируется с худшим прогнозом. Так в исследовании J. Meier и соавторов из Университета Северной Каролины, США, показали, что в случае метаболического объема опухоли более 60 мл, измеренного по ПЭТ/ КТ, 1-летняя БПВ равнялась 14%, а при меньшем объеме БПВ достигала 58% [31].
В настоящее время закончено клиническое исследование биспецифического антиCD30 и антиCD16
тетравалентного моноклонального антитела AFM13. Предполагается, что препарат будет соединять натуральные киллеры с опухолевыми клетками БРШ. Препарат получили 25 больных, резистентных к брентуксимабу ведотину и ингибиторам ИКТ. Общий ответ составил 16.7%. В связи с медленным набором исследование было завершено раньше времени [32].
Таким образом, ЛХ, которая была абсолютно фатальным заболеванием еще 40 лет назад, в настоящее время стала излечимой у подавляющего числа пациентов.
Список литературы Лимфома Ходжкина
- Hodgkin. On some Morbid Appearances of the Absorbent Glands and Spleen. Med Chir Trans. 1832; 17: 68-114. doi: 10.1177/095952873201700106.
- Dawson PJ. The original illustrations of Hodgkin's disease. Ann Diagn Pathol. 1999; 3(6): 386-93. doi: 10.1016/s1092-9134(99)80018-5
- Березовский С.Я. К вопросу о строении и клиническом течении lymphadenoma malignae. Русская медицина. 1980; 39: 610-613.
- Hartmann S, Eichenauer DA, Plütschow A, Mottok A, Bob R, Koch K, Bernd HW, Cogliatti S, Hummel M, Feller AC, Ott G, Möller P, Rosenwald A, Stein H, Hansmann ML, Engert A, Klapper W. The prognostic impact of variant histology in nodular lymphocytepredominant Hodgkin lymphoma: a report from the German Hodgkin Study Group (GHSG). Blood. 2013; 122(26): 4246-52; quiz 4292. doi:10.1182/blood-2013-07-515825
- Steidl C, Connors JM, Gascoyne RD. Molecular pathogenesis of Hodgkin's lymphoma: increasing evidence of the importance of the microenvironment. J Clin Oncol. 2011; 29(14): 1812-26. doi: 10.1200/JCO.2010.32.8401.
- Lister TA, Crowther D, Sutcliffe SB, Glatstein E, Canellos GP, Young RC, Rosenberg SA, Coltman CA, Tubiana M. Report of a committee convened to discuss the evaluation and staging of patients with Hodgkin's disease: Cotswolds meeting. J Clin Oncol. 1989; 7(11): 1630-
- doi: 10.1200/JCO.1989.7.11.1630. Erratum in: J Clin Oncol 1990 Sep;8(9):1602.
- Cheson BD, Ansell S, Schwartz L, Gordon LI, Advani R, Jacene HA, Hoos A, Barrington SF, Armand P. Refinement of the Lugano Classification lymphoma response criteria in the era of immunomodulatory therapy. Blood. 2016; 128(21): 2489-2496. doi:10.1182/blood-2016-05-718528
- Chen X, Soma LA, Fromm JR. Targeted therapy for Hodgkin lymphoma and systemic anaplastic large cell lymphoma: focus on brentuximab vedotin. Onco Targets Ther. 2013; 7: 45-56. doi: 10.2147/OTT.S39107
- Ansell SM, Radford J, Connors JM, Długosz-Danecka M, Kim WS, Gallamini A, Ramchandren R, Friedberg JW, Advani R, Hutchings M, Evens AM, Smolewski P, Savage KJ, Bartlett NL, Eom HS, Abramson JS, Dong C, Campana F, Fenton K, Puhlmann M, Straus DJ; ECHELON-1 Study Group. Overall Survival with Brentuximab Vedotin in Stage III or IV Hodgkin's Lymphoma. N Engl J Med. 2022; 387(4): 310-320. doi: 10.1056/NEJMoa2206125. Epub 2022 Jul 13
- Fuchs M, Goergen H, Kobe C, Kuhnert G, Lohri A, Greil R, Sasse S, Topp MS, Schäfer E, Hertenstein B, Soekler M, Vogelhuber M, Zijlstra JM, Keller UB, Krause SW, Wilhelm M, Maschmeyer G, Thiemer J, Dührsen U, Meissner J, Viardot A, Eich H, Baues C, Diehl V, Rosenwald A, von Tresckow B, Dietlein M, Borchmann P, Engert A. Positron Emission Tomography-Guided Treatment in Early-Stage Favorable Hodgkin Lymphoma: Final Results of the International, Randomized Phase III HD16 Trial by the German Hodgkin Study Group. J Clin Oncol. 2019; 37(31): 2835-2845. doi: 10.1200/JCO.19.00964
- Ansell S. , Ramchandren, R. , Domingo-Domènech, E. , Rueda, A.,Trneny, M., Feldman, T., Lee, H. , Provencio, M., Sillaber, Ch., Cohen J. , Savage, K.,Willenbacher, W., Sumbul, A. , Sacchi, M., Armand, P. Nivolumab plus doxorubicin, vinblastine and dacarbazine for newly diagnosed advanced-stage classical Hodgkin lymphoma:: CHECKMATE 205 cohort D 2-year follow-up. Hematological Oncology. 2019; 37: 146-147. 10.1002/hon.104_2629
- Linch DC, Winfield D, Goldstone AH, Moir D, Hancock B, McMillan A, Chopra R, Milligan D, Hudson GV. Dose intensification with autologous bone-marrow transplantation in relapsed and resistant Hodgkin's disease: results of a BNLI randomised trial. Lancet. 1993; 341(8852): 1051-4. doi:10.1016/0140-6736(93)92411-l
- Ptushkin, VV , Afanasyev, BV., Zhukov N.V., Uss, AL, Karamanesht, EE, Milanovich, NF, Mikhaylova, NB, Korenkova, IS, Minenko, SV, Demina, EA , Zmachinski, VA , Pugachev, AA , Borodkin, SV. Efficacy and safety of high-dose chemotherapy with autologous hematopoietic stem cell rescue for relapsed/refractory Hodgkin's lymphoma patients in former USSR countries. Retrospective analysis of data from four transplantation centers in Belarus, Russia and the Ukraine. Cellular Therapy and Transplantation. 2008; 1: 43-47
- Snowden JA, Sánchez-Ortega I, Corbacioglu S, Basak GW, Chabannon C, de la Camara R, Dolstra H, Duarte RF, Glass B, Greco R, Lankester AC, Mohty M, Neven B, de Latour RP, Pedrazzoli P, Peric Z, Yakoub-Agha I, Sureda A, Kröger N; European Society for Blood and Marrow Transplantation (EBMT). Indications for haematopoietic cell transplantation for haematological diseases, solid tumours and immune disorders: current practice in Europe, 2022. Bone Marrow Transplant. 2022; 57(8): 1217-1239. doi: 10.1038/s41409-022-01691-w.
- Merryman RW, Redd RA, Nishihori T, Chavez J, Nieto Y, Darrah JM, Rao U, Byrne MT, Bond DA, Maddocks KJ, Spinner MA, Advani RH, Ballard HJ, Svoboda J, Singh AK, McGuirk JP, Modi D, Ramchandren R, Romancik J, Cohen JB, Frigault MJ, Chen YB, Serritella AV, Kline J, Ansell S, Nathan S, Rahimian M, Joyce RM, Shah M, David KA, Park S, Beaven AW, Habib A, Bachanova V, Nakhoda S, Khan N, Lynch RC, Smith SD, Ho VT, LaCasce A, Armand P, Herrera AF. Autologous stem cell transplantation after anti-PD-1 therapy for multiply relapsed or refractory Hodgkin lymphoma. Blood Adv. 2021; 5(6):1648-1659. doi: 10.1182/bloodadvances.2020003556.
- Chen R, Gopal AK, Smith SE, Ansell SM, Rosenblatt JD, Savage KJ, Connors JM, Engert A, Larsen EK, Huebner D, Fong A, Younes A. Fiveyear survival and durability results of brentuximab vedotin in patients with relapsed or refractory Hodgkin lymphoma. Blood. 2016; 128(12): 1562-6. doi: 10.1182/blood-2016-02-699850.
- Ansell SM. Nivolumab in the Treatment of Hodgkin Lymphoma. Clin Cancer Res. 2017; 23(7): 1623-1626. doi: 10.1158/1078-0432. CCR-16-1387.
- Ansell SM, Lesokhin AM, Borrello I, Halwani A, Scott EC, Gutierrez M, Schuster SJ, Millenson MM, Cattry D, Freeman GJ, Rodig SJ, Chapuy B, Ligon AH, Zhu L, Grosso JF, Kim SY, Timmerman JM, Shipp MA, Armand P. PD-1 blockade with nivolumab in relapsed or refractory Hodgkin's lymphoma. N Engl J Med. 2015; 372(4): 311-9. doi: 10.1056/NEJMoa1411087.
- Armand Philippe, Yi-Bin Chen, Robert A. Redd, Robin M. Joyce, Jad Bsat, Erin Jeter, Reid W. Merryman, Kimberly C. Coleman, Parastoo B. Dahi, Yago Nieto, Ann S. LaCasce, David C. Fisher, Samuel Y. Ng, Oreofe O. Odejide, Arnold S. Freedman, Austin I. Kim, Jennifer L. Crombie, Caron A. Jacobson, Eric D. Jacobsen, Jeffrey L. Wong, Sanjay S. Patel, Jerome Ritz, Scott J. Rodig, Margaret A. Shipp, Alex F. Herrera; PD-1 blockade with pembrolizumab for classical Hodgkin lymphoma after autologous stem cell transplantation. Blood. 2019; 134 (1): 22–29. doi: https://doi.org/10.1182/blood.2019000215
- Zinzani, Pier, Chen, Robert , Lee, Hun , Armand, Philippe , Johnson, Nathalie , Brice, Pauline , Radford, John , Ribrag, Vincent , Molin, Daniel , Vassilakopoulos, Theodoros , Tomita, Akihiro , Tresckow, Bastian , Shipp, Margaret , Kim, Eunhee , Nahar, Akash , Balakumaran, Arun , Moskowitz, Craig. (2018). Two-Year Follow-up of Keynote-087 Study: Pembrolizumab Monotherapy in Relapsed/Refractory Classic Hodgkin Lymphoma. Blood. 132: 2900-2900. 10.1182/blood-2018-99-117045
- Lepik KV, Mikhailova NB, Moiseev IS, Kondakova EV, Tsvetkova LA, Zalyalov YR, Borzenkova ES, Babenko EV, Baykov VV, Markova IV, Afanasyev BV. Nivolumab for the treatment of relapsed and refractory classical Hodgkin lymphoma after ASCT and in ASCT-naïve patients. Leuk Lymphoma. 2019; 60(9): 2316-2319. doi: 10.1080/10428194.2019.1573368
- Lepik KV, Fedorova LV, Kondakova EV, Zalyalov YR, Babenko EV, Lepik EE, Kotselyabina PV, Beynarovich AV, Popova MO, Volkov NP, Stelmakh LV, Baykov VV, Moiseev IS, Mikhailova NB, Kulagin AD, Afanasyev BV. A Phase 2 Study of Nivolumab Using a Fixed Dose of 40 mg (Nivo40) in Patients With Relapsed/Refractory Hodgkin Lymphoma. Hemasphere. 2020; 4(5): e480. doi: 10.1097/HS9.0000000000000480.
- Федорова Л.В Эффективность модифицированных режимов иммунотерапии у пациентов с рефрактерной классической лимфомой Ходжкина с помощью PD-1 ингибитора ниволумаба: автореф. дис. канд. мед. наук 3.1.28 / Федорова Л.В.-СПб., 2023.- 23 с.
- Sarina B, Castagna L, Farina L, Patriarca F, Benedetti F, Carella AM, et al. Allogeneic transplantation improves the overall and progression-free survival of Hodgkin lymphoma patients relapsing after autologous transplantation: a retrospective study based on the time of HLA typing and donor availability. Blood. 2010; 115: 3671–7
- Sureda, A., Genadieva Stavrik, S., Boumendil, A. et al. Changes in patients population and characteristics of hematopoietic stem cell transplantation for relapsed/refractory Hodgkin lymphoma: an analysis of the Lymphoma Working Party of the EBMT. Bone Marrow Transplant. 2020; 55: 2170–2179. https://doi.org/10.1038/s41409-020-0929-y
- Passweg JR, Baldomero H, Ciceri F, Corbacioglu S, de la Cámara R, Dolstra H, Glass B, Greco R, McLornan DP, Neven B, de Latour RP, Perić Z, Ruggeri A, Snowden JA, Sureda A. Hematopoietic cell transplantation and cellular therapies in Europe 2021. The second year of the SARS-CoV-2 pandemic. A Report from the EBMT Activity Survey. Bone Marrow Transplant. 2023; 58(6): 647-658. doi: 10.1038/s41409-023-01943-3
- Khouri IF, Wei W, Korbling M, Turturro F, Ahmed S, Alousi A, Anderlini P, Ciurea S, Jabbour E, Oran B, Popat UR, Rondon G, Bassett RL Jr, Gulbis A. BFR (bendamustine, fludarabine, and rituximab) allogeneic conditioning for chronic lymphocytic leukemia/lymphoma: reduced myelosuppression and GVHD. Blood. 2014; 124(14): 2306-12. doi: 10.1182/blood-2014-07-587519.
- Бейнарович А.В. Роль аллогенной трансплантации гемопоэтических стволовых клеток в лечении пациентов с резистентным/рецидивирующим течением лимфомы Ходжкина дис. канд. мед. наук / Бейнарович А.В. СПб., 2024. – 163 с.
- Ijaz A, Khan AY, Malik SU, Faridi W, Fraz MA, Usman M, Tariq MJ, Durer S, Durer C, Russ A, Parr NNC, Baig Z, Sagar F, Ali Z, McBride A, Anwer F. Significant Risk of Graft-versus-Host Disease with Exposure to Checkpoint Inhibitors before and after Allogeneic Transplantation. Biol Blood Marrow Transplant. 2019; 25(1): 94-99. doi: 10.1016/j.bbmt.2018.08.028
- Ito A, Kim SW, Matsuoka KI, Kawakita T, Tanaka T, Inamoto Y, Toubai T, Fujiwara SI, Fukaya M, Kondo T, Sugita J, Nara M, Katsuoka Y, Imai Y, Nakazawa H, Kawashima I, Sakai R, Ishii A, Onizuka M, Takemura T, Terakura S, Iida H, Nakamae M, Higuchi K, Tamura S, Yoshioka
- S, Togitani K, Kawano N, Suzuki R, Suzumiya J, Izutsu K, Teshima T, Fukuda T. Safety and efficacy of anti-programmed cell death-1 monoclonal antibodies before and after allogeneic hematopoietic cell transplantation for relapsed or refractory Hodgkin lymphoma: a multicenter retrospective study. Int J Hematol. 2020; 112(5): 674-689. doi: 10.1007/s12185-020-02960-4
- Meier, J.A.; Savoldo, B.; Grover, N.S. The Emerging Role of CAR T Cell Therapy in Relapsed/Refractory Hodgkin Lymphoma. J. Pers. Med. 2022; 12: 197. https://doi.org/10.3390/jpm12020197
- Sasse S, Bröckelmann PJ, Momotow J, Plütschow A, Hüttmann A, Basara N, Koenecke C, Martin S, Bentz M, Grosse-Thie C, Thorspecken S, de Wit M, Kobe C, Dietlein M, Tresckow BV, Fuchs M, Borchmann P, Engert A. AFM13 in patients with relapsed or refractory classical Hodgkin lymphoma: final results of an open-label, randomized, multicenter phase II trial. Leuk Lymphoma. 2022; 63(8): 1871-1878. doi: 10.1080/10428194.2022.2095623.


