Лучевая дифференциальная диагностика остеомиелитов челюстно-лицевой области при иммунодефицитных состояниях
Автор: Егорова Е.А., Зорина И.С., Сангаева Л.М.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3-2 т.25, 2010 года.
Бесплатный доступ
Данная статья посвящена результатам лучевого исследования 64 пациентов с клиническими проявлениями остеомиелитов челюстно!лицевой области. У 34 больных при проведении лабораторных исследований выявлены признаки вторичных иммунодефицитных состояний. При анализе данных комплексного клинико-лабораторного и лучевого исследований определена корреляционная зависимость между изменениями показателей специфического иммунитета и тяжестью течения гнойно!воспалительного процесса, а также риском развития системных воспалительных реакций.
Остеомиелит, челюстно-лицевая область, иммунодефицитные состояния
Короткий адрес: https://sciup.org/14919255
IDR: 14919255 | УДК: 616.716!018.46!002:008!073.75
Текст научной статьи Лучевая дифференциальная диагностика остеомиелитов челюстно-лицевой области при иммунодефицитных состояниях
Остеомиелит – воспалительная деструкция костной ткани, сопровождающаяся ее септическим некрозом [4]. Выделяют травматический, первично-хронический и гематогенный остеомиелит.
Ряд факторов (последствия перенесенных повреждений, соматические заболевания, химио- и лучевая терапия, алиментарная недостаточность, хроническая интоксикация, алкоголизм, наркомания и т.п.), которые сопровождаются изменениями системы гомеостаза, развитием иммунодефицитных состояний, определяют высокий риск развития системных воспалительных реакций при остеомиелитах. Летальность от генерализованных форм гнойно-воспалительных заболеваний составляет 10–14% [1, 2, 4]. Отмечено, что в 35–40% случаев возбудителями гнойных процессов на фоне иммунодефицитов является сапрофитная флора [2, 3].
Цель проведенного исследования – определение клинико-лучевой семиотики остеомиелитов челюстно-лицевой области (ЧЛО) при вторичных иммунодефицитах.
Материал и методы
Обследовано 64 человека в возрасте от 3 до 68 лет с остеомиелитами челюстно-лицевой области (рис. 1). В ходе исследования выделены 2 группы пациентов:
-
1) в основную группу входило 34 человека с остеомиелитом при вторичном иммунодефиците;
-
2) группу сравнения составили 30 пациентов с остеомиелитом без вторичного иммунодефицита.
В основной группе причинами иммунодефицитных состояний в 55,8% случаев был хронический алкоголизм, в 26,5% – наркомания, у 17,7% пациентов – ранее проведенная полихимиотерапия.
В обеих группах остеомиелит имел посттравматическую (72%) или одонтогенную природу (28%). Всем пациентам проводилось комплексное клинико-лабораторное и лучевое исследования.
Оценивались общий и местный статус, выполнялись
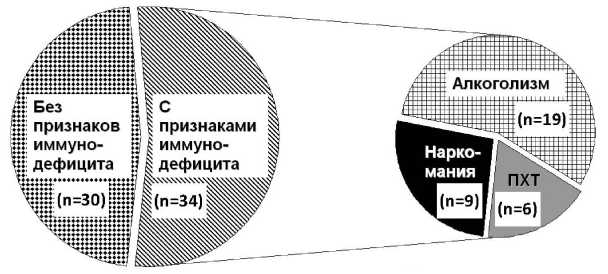
Рис. 1. Причины развития остеомиелита челюстно-лицевой области в группах наблюдения (n=64)
рентгенограммы заинтересованного сегмента для уточнения характера изменений кости и окружающих мягких тканей, при определении состояния сложных по своему строению анатомических областей проводили муль-тиспиральную компьютерную томографию (СКТ) на аппарате Brilliance 64 (Philips, Голландия, 2007). Для выявления скопления жидкости, анализа структуры мягких тканей и кровотока применяли ультразвуковое исследование (УЗИ), которое выполнялось на ультразвуковом сканере Philips AU-22 (Philips, Голландия, 2007) с использованием конвексных и линейных датчиков (2,5–8 МГц).
Анализы крови с определением лейкоцитарной формулы, количества субпопуляций лимфоцитов, иммунограммы, бактериологический анализ – выполняли при помощи полуавтоматических и автоматических анализаторов. Гемолитическую активность классического пути активации комплемента определяли по методу Л.М. Вавиловой и соавт. (1984). Для исследования фагоцитарной активности нейтрофилов использовался метод И.Д. По-някиной и соавт. (1983) с подсчетом процента активированных нейтрофилов (фагоцитарного индекса), поглотительной способности нейтрофилов (фагоцитарного числа), индекса завершенности фагоцитоза и активности внутриклеточного переваривания (бактерицидности).
Результаты и обсуждение
Наиболее многочисленную группу составили пациенты с переломами нижней челюсти (n=46; 72%). Чаще всего встречались двойные переломы нижней челюсти (в зоне приложения силы и отраженные) – 81,7% случаев, остальные локализации составили 18,3% (рис. 2 а, б).
В зоне приложения травмирующей силы обычно воз-
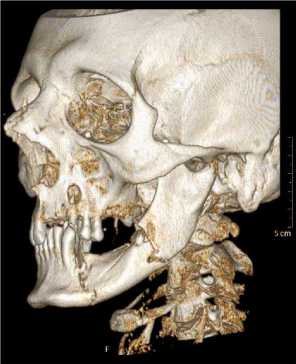
Рис. 2. Мультиспиральные компьютерные томограммы пациента Н. (20-е сутки после повреждения нижней челюсти): а – объемная реконструкция; б – аксиальная проекция. Отмечаются поперечные переломы угла и тела нижней челюсти слева и оскольчатый перелом основания головки мыщелкового отростка слева. Имеется утолщение и неоднородность мягких тканей в левой щечной области
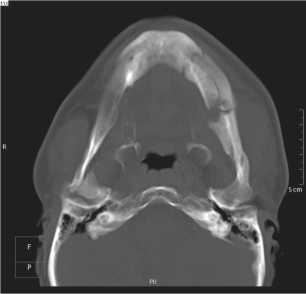
б никали оскольчатые переломы со сложной линией излома, смещение фрагментов зависело от мышечной тяги и направления травмирующей силы. Отраженные переломы возникали в наименее прочных местах – по срединной сагиттальной плоскости тела, в области угла челюсти, ее ветвей, в основании мыщелкового отростка. В альвеолярной части все переломы были открытыми (доходили до лунок зубов), первично инфицированные.
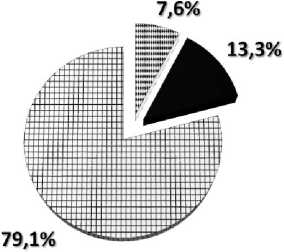
При развитии гнойных осложнений из ран, свищей и ротовой полости высевалась грамположительная и гра-мотрицательная микрофлора, которая в 7,6% случаев была антибиотикорезистентной или чувствительной к антибиотикам 3–4 поколения.
В 43,8% наблюдений роста микрофлоры не получено в виду того, что на ранних этапах медицинской помощи в качестве превентивной антибактериальной терапии использовались антибиотики (цефалоспорины, аминогликозиды, карбипинемы), в максимальных терапевтических дозах (рис. 3 а, б).
Отмечено, что независимо от причин и локализации воспалительной деструкции кости развитие остеомиелита проходило в три фазы своего развития: острую, подострую и хроническую.
В острую (септическую) фазу по данным рентгенологических исследований структурных изменений кости установить не удавалось. Эта фаза имела достаточно выраженные клинические проявления и постановка диагноза не вызывала затруднений. Эффективность лучевых методов повышалась в подострую (секвестрации) и хроническую (рубцовая перестройка тканей, нарушение кровоснабжения, остеосклероз, формирование гнойных полостей и свищей) фазы остеомиелита.
Остеомиелиты при вторичном иммунодефиците на фоне интоксикации, алкоголизма, наркотической зависимости, лучевой и полихимиотерапии также имели ряд особенностей. Возбудителями воспалительной деструкции кости в 1/3 случаев являлась сапрофитная флора (рис. 4 а, б).
Воспаление протекало длительно, с образованием воспалительных инфильтратов, свищей, характеризовалось распространенностью процесса, наличием септических осложнений (энцефалитов, септических пневмоний и т.п.).
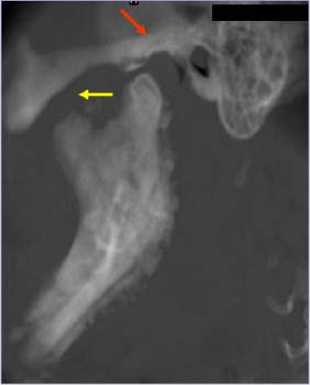
тальном отделе нижней челюсти выявлен патологический перелом (рис. 5 б).
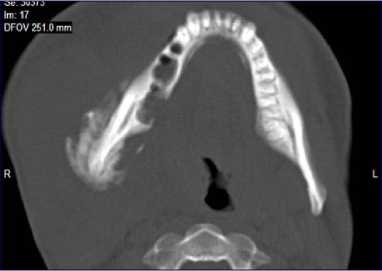
Имели место выраженные бахромчатые периостальные наслоения. Суставной отросток правой ветви нижней челюсти деформирован, смещен кпереди (патологический подвывих головки суставного отростка). Суставные поверхности с неровным, нечетким контуром. Верхушки корней зубов были погружены в зону деструкции, частично лизированы, периодонтальные щели расширены (рис. 5 в, г).
Мягкие ткани в области правой половины нижней челюсти и в проекции тела выглядели утолщенными, лишенными дифференцировки. При гистологическом исследовании биоптата – признаки гнойного воспаления. У всех пациентов в условиях уже развившихся, длительно протекающих осложнений показатели естественного иммунитета (фагоцитоза и комплементарной активности) были в пределах нормы.
Снижение количества активированных нейтрофилов (фагоцитарный индекс), их поглотительной способности (фагоцитарное число), а также индекс завершенности фагоцитоза был в пределах нормы, и значительных колебаний его не наблюдалось.
Угнетение фагоцитоза и активности системы комплемента отмечалось в септической (острой) фазе остеомиелита, сохранялось в среднем до 5–7 суток развития воспалительного процесса. Последующая динамика этих величин характеризовалась тенденцией к нормализации и теряла свое прогностическое значение. Противоположная картина отмечалась при изучении изменений специфического – клеточного и гуморального иммунитета. При повышенном содержании лейкоцитов процентное соотношение лимфоцитов оставалось в пределах нормальных значений. Однако отмечался дисбаланс в соотношениях Т- и В-лимфоцитов, а также изменение состава субпопуляций Т-лимфоцитов с уменьшением хелпер-но-супрессорного индекса до 0,2 (при норме 1,8–2,0). Количество В-лимфоцитов приближалось к нормальным значениям, однако совершенно отчетливо прослеживался недостаток Jg G и количества циркулирующих иммунных комплексов.
Таким образом, при оценке иммунного статуса паци-
Клинический пример
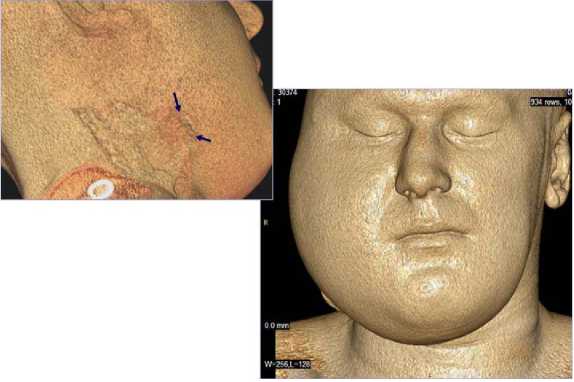
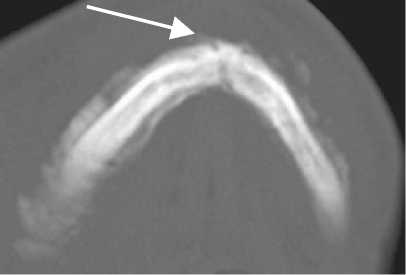
Пациент З., 28 лет (опиатная зависимость – 5 лет). В течение 6 месяцев (после удаления 4.5–4.7 зубов) отмечалось наличие инфильтративных изменений мягких тканей правой половины лица с формированием свищей в правой подчелюстной области (рис. 5 а).
При МСКТ определялись деструктивные изменения суставного и венечного отростков, правой ветви нижней челюсти с переходом на ее тело без признаков формирования секвестров. На фоне деструкции во фрон-
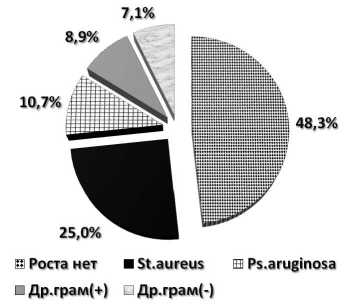
Рис. 3. Характер микрофлоры, высеваемой из минно-взрывных и огнестрельных ран (n=46): а – видовой состав микрофлоры; б – антибиотикочувствительность
Bl Антибиотикорезистентность
■ Фторхинолоны, тетрациклины, аминогликазиды
ЕВ Цефалоспорины, карбопенемы
б
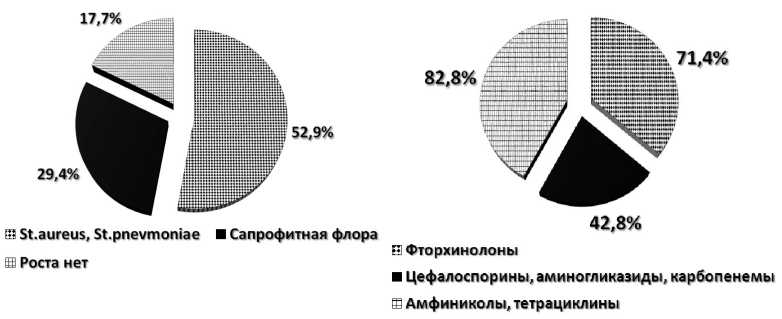
Рис. 4. Возбудители, вызывающие гнойно-воспалительные процессы при вторичном иммунодефиците: а – видовой состав микрофлоры; б – антибиотико-чувствительность
б
a
б
г
Рис. 5. Мультиспиральные компьютерные томограммы лицевого скелета (поверхностная и мультипланарная реконструкция изображений) пациента со вторичным иммунодефицитом, вызванным опиатной зависимостью: а – инфильтративные изменения мягких тканей правой половины лица с формированием свищей в правой подчелюстной области (стрелки); б – воспалительные изменения правого височно-нижнечелюстного сустава, патологический подвывих правой ветви нижней челюсти (стрелки); в – деструктивные изменения и патологический перелом нижней челюсти (стрелка); г – частичный лизис корней нижней челюсти, погруженных в зону деструктивных изменений
ентов с длительно протекающими воспалительными процессами прослеживалась картина иммунодефицитного состояния. На стадии возникших осложнениях наиболее показательными являются результаты изучения специфического иммунитета (клеточного и гуморального), характера микрофлоры, ее чувствительности к антибактериальной терапии. У этих пациентов процессы имели хроническое, распространенное, неограниченное течение. При вовлечении в воспаление костной ткани характерным являлись гиперостоз, периостит, остеосклероти- ческие изменения, наличие свищей, но без тенденции формирования секвестров.
Дифференциальную диагностику остеомиелитов при вторичных иммунодефицитах проводили со злокачественными опухолями, вторичным поражением и дистрофическим изменениями скелета.
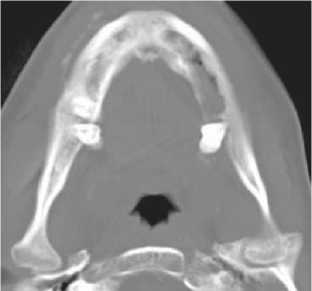
Например, верификацию саркомы Юинга (или круглоклеточной саркомы), ретикулосаркомы, которые исходят из костного мозга, и остеомиелита на основании клинико-лабораторных и рентгенологических данных бы-
a
б
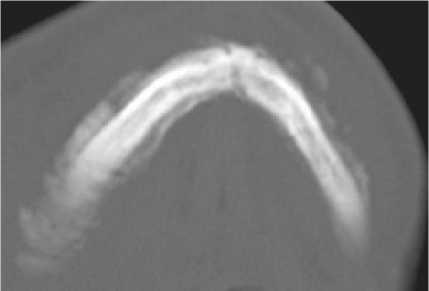
в
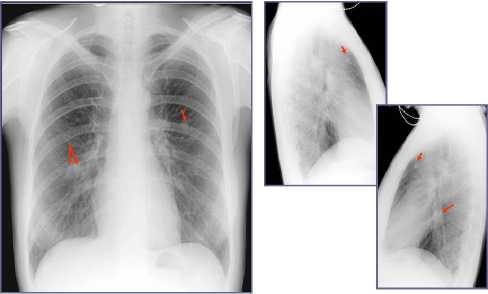
Рис. 6. Мультиспиральные компьютерные томограммы лицевого скелета (в аксиальной проекции) и рентгенограммы органов грудной клетки в прямых и боковых проекциях пациентов с деструктивными процессами нижней челюсти и вторичным поражением легких: а – остеосклеротическая деструкция и бахромчатые периостальные наслоения при саркоме Юинга; б – метастатическое поражение легких при саркоме Юинга (стрелки); в – остеосклеротическая деструкция и бахромчатые периостальные наслоения при остеомиелите на фоне вторичного иммунодефицита; г – септическая полисегментарная двусторонняя пневмония с левосторонним гидротораксом у пациента при остеомиелите на фоне вторичного иммунодефицита
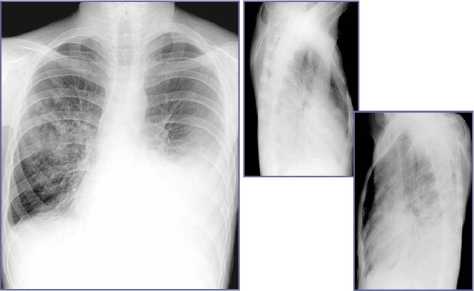
г
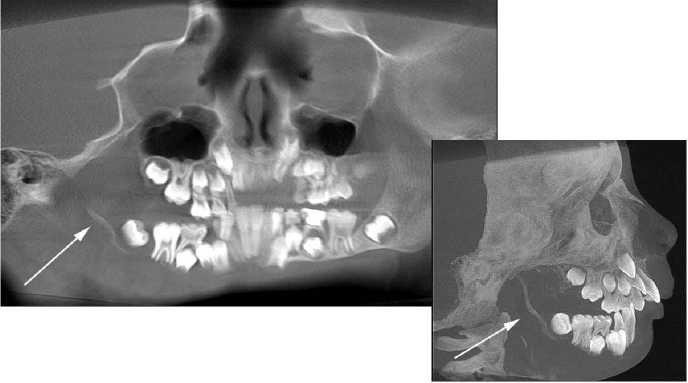
Рис. 7. Дентальные объемные томограммы пациента Ж., 8 лет: отмечается обширная остеолитическая деструкция нижней челюсти (стрелки)
вает провести достаточно сложно. Ретикуло- и круглоклеточная саркомы протекают с периодами обострения и ремиссии. В период обострения отмечается общая воспалительная реакция, местно проявляются болью, гиперемией, припухлостью. Дифференциальную диагности- ку можно провести только по результатам гистологических исследований и по наличию поражения других органов. Метастатическое поражение (чаще всего легких) характерно для злокачественных процессов. Септические осложнения присущи остеомиелитам, и в 75%
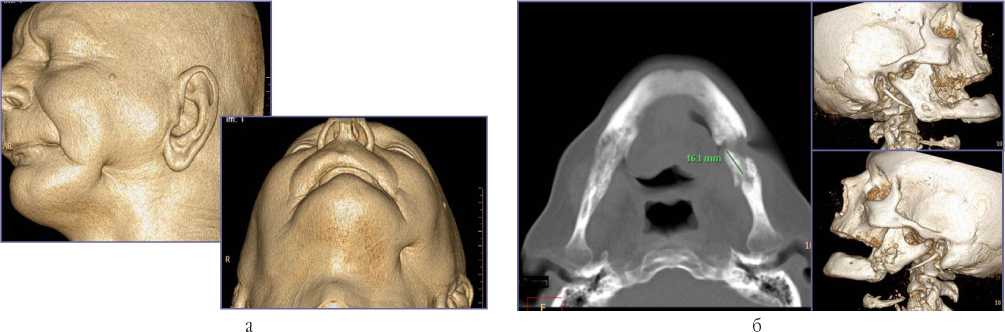
Рис. 8. Мультиспиральные компьютерные томограммы лицевого скелета пациента через 2 года после лучевой терапии по поводу заболевания ротоглотки (а, б – поверхностная реконструкция, аксиальная проекция и объемная реконструкция): а – рубцовые изменения мягких тканей левой подбородочной области с формированием свища; б – смешанная деструкция тела нижней челюсти с признаками секвестрации костной ткани, периостальная реакция на указанном уровне не прослеживается
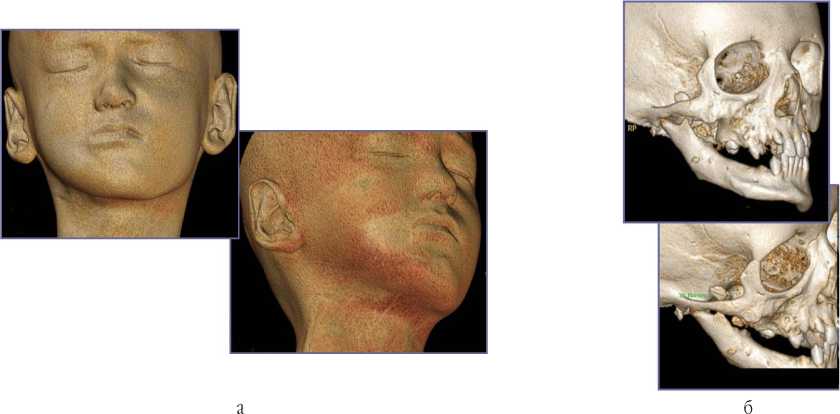
Рис. 9. Мультиспиральные компьютерные томограммы лицевого скелета пациента 10 лет через 8 лет после термического поражения правой половины лица – ожога пламенем (а, б – поверхностные и объемные реконструкции): отмечаются признаки дегенеративно-дистрофических изменений тканей с нарушением формирования ветви нижней челюсти и височно-нижнечелюстного сустава справа с эктопической оссификацией окружающих мягких тканей (стрелки)
случаев проявляются септическими пневмониями (рис. 6 а–г).
Прогрессирующий остеолиз (синдром Гарама) - очень редкая форма дегенеративных изменений кости. По мнению ряда авторов (Суслова О.Я., 1989), имеет врожденный характер, встречается у детей, лиц подросткового и юношеского возраста. По данным Волкова В.А. (1985), литические процессы кости развиваются после повреждения: ятрогенного (оперативные вмешательства, экстракции зубов и т.п.), внешнего механического воздействия. Они могут развиваться в любом возрасте, относятся к остеодистрофическим процессам, сопровождающимся остеолитической деструкцией, которая распространяется на всю кость, суставы не являются препятствием для распространения остеолиза (рис. 7 а, б).
В отсроченный период после воздействия низких и высоких температур и лучевого поражения имеют место нейротрофические изменения мягких тканей с рубцовой дегенерацией, атрофией, образованием свищей.
После лучевого поражения (обычно через 6–12 мес. после близкофокусной лучевой терапии злокачественных новообразований) кость подвергается смешанной перестройке: остеолизу и остеонекрозу вследствие гибели клеточных элементов кости, облитерации сосудов. Через 2–3 года отмечается выраженный остеопороз. Некротизированная ткань постепенно резорбируется, секвестрируется, возникают патологические переломы (рис. 8 а, б).
Рентгенологическая картина очень сходна с остеомиелитом, но без периостальных реакций. В посевах отделяемого из свищей роста патогенной флоры не определяется, при цитогистологическом исследовании тканей – признаки фиброзной дегенерации.
Последствия глубоких ожогов также выражаются нейротрофическими нарушениями тканей, их рубцовой перестройкой. Уже через 4–6 месяцев отмечается нарушение остеогенеза, что наиболее ярко проявляется у детей.
Ожоговые раны у них быстро эпителизируются, формируются мягкоэластичные рубцы. Но отмечается нарушение развития костей, деформации скелета, эктопическая оссификация (рис. 9 а, б).
Работа выполнена в рамках ведущей научной школы НШ 3481.2010.7
Выводы
-
1. Дифференциальная диагностика деструктивных изменений костно-суставной системы при вторичных иммунодефицитах может быть проведена только с учетом анамнеза, клинико-лабораторных данных и результатов лучевых методов исследования.
-
2. Об угрозе развития гнойно-воспалительных осложнений может свидетельствовать снижение значений показателей естественного иммунитета в ранний период после травмы (5–7 сутки), на начальных этапах развития заболевания.
-
3. В отсроченный период, при развитии гнойных осложнений, наиболее достоверно свидетельствуют о тяже-
- сти иммунодефицитных состояний:
-
a) характер местных и общих изменений;
-
b) показатели специфического (клеточного и гуморального) иммунитета;
-
c) характер высеваемой микрофлоры из ран (в том числе сапрофитной);
-
d) показатели цитогистологических анализов;
-
e) наличие поражений других органов и систем.
Список литературы Лучевая дифференциальная диагностика остеомиелитов челюстно-лицевой области при иммунодефицитных состояниях
- Волков М.В. Болезни костей у детей. -М.: Медицина, 1985. -496 c.
- Зарецкая Ю.М. и др. Иммунология и иммуногенетика человека. -М.: Триада-фарм, 2002. -138 с.
- Редькин Ю.В. Нарушения иммунитета при множественных и сочетанных травмах//Ортопедия, травматология и протезирование. -1983. -№ 6. -С. 17-22.
- Суслова О.Я. Рентгенодиагностика повреждений и заболеваний костей и суставов. -Киев: Здоров'я, 1989. -216 с.


