Механизмы развития инсулинорезистентности при ожирении: обзор литературы
Бесплатный доступ
В статье рассматриваются литературные данные о механизмах развития инсулинорезистентности, которые формируются при ожирении. В качестве факторов риска и механизмов развития инсулинорезистентности рассматривается наличие абдоминального ожирения и связанные с ним особенности функционирования в висцеральной жировой ткани. Также анализируется чрезмерное поступление углеводов с пищей и изменение направления активности цикла Рэндла как одного из механизмов развития инсулинорезистентности не только при ожирении, но также и у худых, с виду здоровых людей, но с развитым висцеральным ожирением. Изучается накопление биологически активных липидов (длинноцепочечного ацил-КоА, диацилглицерола (ДАГ), церамидов) и свободных жирных кислот, которое может приводить к нарушению проведения сигналов по сигнальному пути инсулина и транспорта глюкозы посредством белков переносчиков (ГЛЮТ-4). Также, рассматривается воспаление жировой ткани, а именно роль макрофагов и некоторых цитокинов: фактора некроза опухолей α, ИЛ-6 и ИЛ-1β, в снижении проведения сигналов инсулина. Описывается предполагаемая роль дефицита витамина D, который развивается при ожирении, в формировании резистентности к инсулину. Также рассматривается нарушение выработки адпиокинов: адипонектина, лептина и резистина.
Ожирение, инсулинорезистентность, биологически активные липиды, воспаление, дефицит витамина D, цикл Рэндла
Короткий адрес: https://sciup.org/170209405
IDR: 170209405 | УДК: 61 | DOI: 10.47475/2409-4102-2025-29-1-48-56
Текст научной статьи Механизмы развития инсулинорезистентности при ожирении: обзор литературы
Введение. Ожирение представляет собой сложное хроническое заболевание, которое характеризуется избыточным накоплением жировой ткани и может иметь серьезные негативные последствия для здоровья.
На сегодняшний день ожирение стало одной из самых актуальных глобальных проблем здравоохранения. По данным Всемирной организации здравоохранения на 2022 г. [5], избыточная масса тела была зарегистрирована у 2,5 млрд взрослых людей в возрасте от 18 лет и старше. Из этого числа более 890 млн страдали от ожирения. По сравнению с 1990 г., распространенность ожирения во всем мире увеличилась более чем вдвое. При этом также наблюдается рост числа детей и подростков, страдающих от избыточного веса: если в 1990 г. этот показатель составлял 8 %, то к 2022 г. он возрос до 20 %.
Ожирение представляет собой не просто эстетическую проблему, но и ведет к множественным метаболическим нарушениям, которые могут стать причиной различных заболеваний. Одним из наиболее опасных последствий ожирения является инсулинорезистентность, которая в свою очередь может привести к развитию диабета 2-го типа, сердечно-сосудистых заболеваний и других серьезных состояний.
Ожирение и инсулинорезистентность. Инсу-линорезистентность (ИР) — это состояние, при котором клетки организма теряют свою чувствительность к инсулину. Это приводит к нарушению метаболизма глюкозы, что, в свою очередь, может вызвать повышенный уровень сахара в крови.
Ожирение является одним из главных факторов, способствующих развитию инсулинорези-стентности [1;7].
В частности, особое внимание уделяется висцеральному (абдоминальному) ожирению, при котором жировая ткань накапливается вокруг внутренних органов [3; 8; 14; 16; 17; 20]. Важно отметить, что данное состояние может наблюдаться даже у людей с нормальным индексом массы тела (ИМТ), что делает его особенно коварным.
Ключевую роль играет метаболический профиль жировой ткани. Существует три основных типа адипоцитов, различающиеся по метаболическим свойствам и функциям: белые, бурые и бежевые. Бурые адипоциты участвуют в термогенезе; бежевые адипоциты представляют собой белые жировые клетки, изменившие свои функции и адаптированные к термогенезу после длительного воздействия холода. В контексте риска ин-сулинорезистентности оба этих типа адипоцитов менее значимы по сравнению с белыми жировыми клетками [15].
У взрослых белые адипоциты являются наиболее распространенной формой. Их основная задача заключается в накоплении избыточной энергии и выработке различных медиаторов (таких как лептин, адипонектин, резистин и другие). При этом метаболическая и секреторная деятельность белых адипоцитов сильно зависит от расположения жировой ткани — адбоминального или подкожного, а также от пола: мужчины чаще страдают от абдоминального ожирения, тогда как у женщин преобладает подкожное ожирение, которое имеет меньше негативных последствий для здоровья [15].
Подтверждение гипотезы о роли подкожной жировой ткани в регуляции чувствительности к инсулину было получено в исследованиях на животных моделях. В работе 2008 г. Ямамото и соавт. [22] показали, что пересадка подкожного жира в брюшную полость мышей ведет к снижению массы тела и адипоцитов, несмотря на неизменный рацион и энергетические затраты. Эти мыши также показали снижение уровней глюкозы и инсулина, а также улучшение толерантности к глюкозе. Эти результаты можно считать достоверными, так как для исследования чувствительности к инсулину использовался ги-перинсулинемический-эугликемический клэмп-тест, признанный «золотым стандартом» в оценке инсулинорезистентности.
Чрезмерное потребление углеводов. Одной из основных причин ожирения является избыток энергии, поступающий с пищей в организм. В наши дни потребление большого количества современных аппетитных и высококалорийных обработанных продуктов нарушает баланс между полученной и потраченной энергией. Это ведет к накоплению жировой ткани, так как избыток энергии сохраняется в виде триглицеридов (нейтральный жир).
Кроме того, высокий уровень углеводов в рационе непосредственно способствует развитию инсулинорезистентности. Простая схема, объясняющая этот процесс, заключается в избытке глюкозы в крови. Длительное повышение уровня глюкозы вызывает гликозилирование, что может привести к инсулинорезистентности, в частности, за счет модификации белка-переносчика глюкозы ГЛЮТ-4 [6].
Также при высокой гликемии поджелудочная железа начинает секретировать больше инсулина, что также приводит к изменению чувствительности клеток к нему. Длительная стимуляция клеток инсулином приводит к их адаптации и снижению чувствительности. Согласно исследованиям Гэвина и соавт. [11], длительное воздействие инсулина уменьшает активность киназ его рецепторов из-за совокупного влияния различных факторов, таких как фосфорилирование серина и дефосфорилиро-
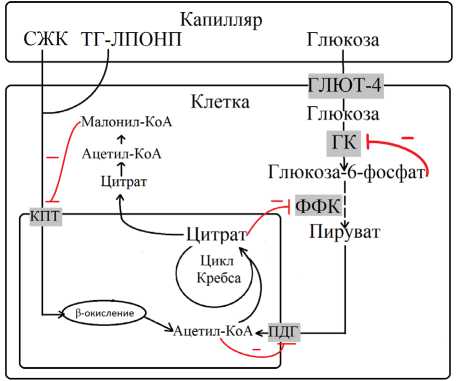
Рис. 1. Цикл Рэндла
ГК — гексокиназа, ФФК — фосфофруктокиназа, ПДГ — пируватдегидрогеназа
Fig. 1. Randle cycle
HK — hexokinase, PFK — phosphofructokinase, PDH — pyruvate dehydrogenase
Примечание: Иллюстративный материал заимствован из общедоступных ресурсов сети Интернет, не содержащих указаний на авторов этих материалов и каких-либо ограничений для их заимствования.
вание тирозина, а также за счет взаимодействия с молекулами-ингибиторами [14].
Цикл Рэндла. Нарушение метаболизма глюкозы через гликолитический путь считается одним из факторов, способствующих развитию и поддержанию инсулинорезистентности, что связано, преимущественно, с избытком свободных жирных кислот (СЖК). Связь между глюкозой и жирными кислотами прослеживается в цикле Рэндла, который также называют глюкозо-жирнокислотным циклом (Рис. 1).
В 1963 г. Рэндл с соавторами [18] впервые предложили гипотезу, согласно которой инсулиноре-зистентность, вызванная липидами в скелетных мышцах, обусловлена, прежде всего, нарушением усвоения глюкозы. Исследования показали, что более высокий уровень свободных жирных кислот коррелирует с выраженностью инсулино-резистентности, а также с повышенным уровнем инсулина в крови [16; 18].
Было отмечено, что повышенное окисление жирных кислот, вследствие увеличения их концентрации в крови, увеличивает уровень митохондриального ацетил-КоА, который способен активировать киназу пируватдегидрогеназы. Данный фермент осуществляет фосфорилирование пирувадегидрогеназы, таким образом переводя её в неактивное состояние, блокируя дальнейшее преобразование пирувата [12]. В то же время, ацетил-КоА, включаясь в процессы цикла Кребса, способствует накоплению цитрата внутри клеток. За счет повышения уровня цитрата, который является аллостерическим ингибитором самой пируватдегидрогеназы, а также фосфофруктокиназы-2, происходит ингибирование данных ферментов. В результате происходит накопление глюко-зо-6-фосфата, который подавляет активность гек-сокиназы, что ведет к уменьшению утилизации глюкозы внутри клеток [9].
Однако повышение уровня глюкозо-6-фосфа-та как минимум в скелетных мышцах не было обнаружено [12]. Это наталкивает на мысль, что на самом деле гексокиназа не имеет столь важной роли в контроле усвоения глюкозы, как изначально было предложено Рэндлом. Но, предполагается, что гексокиназа может быть фактором, который будет ограничивать скорость утилизации глюкозы, если её транспорт в клетку будет превышать гликолитический поток.
Также было обнаружено, что жирные кислоты могут влиять на экспрессию некоторых генов, путем связывания с рецепторами, активируемыми пролифераторами пероксисом (PPAR). Наиболее значимыми в контексте развития инсулино-резистентности являются две формы данных рецепторов — PPARα и PPARγ. Высокая, или даже избыточная, экспрессия PPARα способствует поглощению и окислению жирных кислот. При удалении PPARα наблюдается снижение окисления жирных кислот и одновременно усиление процессов гликолиза, что свидетельствует о том, что данная форма рецептора является одним из факторов, связывающих окисление жирных кислот и метаболизм глюкозы. Кроме того, имеются данные, что такая форма рецептора способствует повышению экспрессии киназы пируватдегидрогеназы, о которой уже упоминалось ранее [12].
Обратная связь наблюдается между экспрессией PPARγ и метаболизмом глюкозы. PPARγ обеспечивает дифференцировку адипоцитов, а также усвоение и хранение жирных кислот, уменьшая их концентрацию в крови. Это способствует повышению чувствительности тканей к инсулину. Также данный рецептор предотвращает излишнюю экспрессию киназы пируватдегидрогеназы [12].
Еще одним звеном, связующим глюкозу и липиды является AMP-активируемая протеинки-наза (AMPK). Она активируется при повышении концентрации цитозольного AMP (аденозинмонофосфата) во время недостатка энергетического субстрата (например, глюкозы) или при повышенной потребности в энергии. AMPK задействует механизмы, отвечающие за генерацию энергии, такие как окисление жирных кислот и гликолиз. При этом было выявлено, что AMPK стимулирует транспорт глюкозы независимо от инсулина вследствие активации Akt 160 — белка, который участвует в сигнальном пути привлечения ГЛЮТ-4 на поверхность мембраны клетки [12].
Кроме того, было показано, что AMPK может способствовать кликолизу в результате стимуляции фосфофруктокиназы, а при наличии кислорода может способствовать окислению жирных кислот благодаря снижению уровня малонил-КоА вследствие ингибирования ацетил-КоА-карбокси-лазы. Происходит активизация обоих процессов, обеспечивающих организм энергией. При этом ингибирование окисления глюкозы жирными кислотами уже не так выражено [12].
Интерес представляет малонил-КоА как фактор, регулирующий окисление жирных кислот. За счет процессов гликолиза и образования ацетил-КоА происходит активация цикла Кребса и образование в результате его деятельности малонил-КоА. Данный метаболит способен ингибировать перенос жирных кислот через мембрану митохондрий, за счет регулирования фермента карнити-нацилтрансферазы. В результате ингибирования этого фермента происходит нарушение связывания ацил-КоА с карнитином и перенос жирных кислот в митохондрии становится невозможным, какипроцессихокисления[12].Накопленныевнутри клетки жирные кислоты в таком случае вовлекаются в процессы образования триглицеридов.
Биологически активные липиды. Одной из характеристик висцеральной жировой ткани, отличающей её от подкожного жира, является более высокая липолитическая активность, что проявляется ускоренным высвобождение свободных жирных кислот (СЖК). Ранее предполагалось, что инсулинорезистентность связана с триглицеридами, но сейчас внимание уделяется активным липидам, таким как длинноцепочечный ацил-КоА, диацилглицерол и церамиды [14; 20].
СЖК, образующиеся в висцеральной жировой ткани, могут свободно попадать в воротную вену и затем в печень, что приводит к снижению чувствительности гликолитических ферментов к инсулину, уменьшению связывания инсулина с рецепторами и сокращению числа самих рецепторов, формируя инсулинорезистентность [9; 13].
После того как жирные кислоты проникают через клеточную мембрану, они активируются за счет присоединения кофермента А (КоА), что приводит к образованию ацил-КоА с длинной цепочкой [14]. Полученный длинноцепочечный ацил-КоА будет служить субстратом для синтеза других липидов или подвергаться бета-окислению в митохондриях. Исследования показывают, что у лиц с избыточным весом уровень длинноцепочечных ацил-КоА значительно увеличивается, и это наблюдается не только в скелетных мышцах и печени, но также и в жировой ткани [14].
Считается, что усиление синтеза жирных кислот из триглицеридов или разложение фосфолипидов способствует накоплению диацилглицеро-ла (ДАГ). В мышечной ткани было выявлено увеличение содержания ДАГ у крыс с инсулинорези-стентностью, которые питались диетой с высоким уровнем жиров. Более того, введение интрали-пида (внутривенной эмульсии на основе соевого масла) данным крысам привело к трехкратному росту концентрации ДАГ в печени. Это, в свою очередь, вызывало проблемы с инсулиновой чувствительностью [14].
Оба биоактивных липида, а именно длинноцепочечный ацил-КоА и диацилглицерол, инициируют работу фермента, известного как новая протеинкиназа С (nPKC). Когда nPKC активируется и мигрирует к клеточной мембране, происходит подавление активности тирозинкиназы инсулинового рецептора [7; 16]. В результате этого процесса снижается эффективность действия инсулина, что способствует возникновению инсулинорези-стентности (ИР).
Среди биологически активных липидов, предположительно вовлеченных в развитие инсулино-резистентности (ИР), также важное место занимает церамид. Церамид, являясь ключевым продуктом метаболизма сфинголипидов, образуется в результате гидролиза сфингомиелина, локализованного в клеточных мембранах. В исследованиях Койта и соавт. [14], анализ содержания церамида в мышечной, печеночной и жировой тканях показал его повышенный уровень у пациентов с ожирением, а также у лиц, страдающих ожирением в сочетании с сахарным диабетом 2-го типа (СД2), по сравнению с пациентами без избыточной массы тела.
Предполагается, что церамиды могут ингибировать экспрессию белка-транспортера глюкозы ГЛЮТ-4, отвечающего за транспорт глюкозы в клетки мышечной, печеночной и жировой тканей. Кроме того, установлено, что сфинго-зин-1-фосфат, образующийся из церамидов в результате гидролиза, способствует развитию воспалительных процессов, стимулируя выработку цитокинов в адипоцитах [14].
Хроническое воспаление в жировой ткани. В дополнение к уже упомянутым механизмам, считается, что воспалительные процессы в жировой ткани также играют значительную роль в развитии инсулинорезистентности у лиц с ожирением [3; 8; 14; 16; 17; 20].
При ожирении наблюдается постоянное, вялотекущее воспаление в жировой ткани, печени и мышцах. Данный процесс обусловлен избыточным накоплением липидов в адипоцитах, что приводит к их гипертрофии и увеличению объема жировой ткани. Предполагается, что это, в свою очередь, ведет к гипоксии жировой ткани, нарушению продукции адипокинов, провоспали-тельных цитокинов и свободных жирных кислот. Кроме того, такое состояние провоцирует усилен- ную выработку активных форм кислорода (АФК) и развитие окислительного стресса. Хроническая гипоксия и окислительный стресс активируют воспалительные процессы, способствуя привлечению макрофагов в жировую ткань [8; 17].
Макрофаги представляют собой объект пристального изучения в контексте патогенеза ожирения. Установлено, что при развитии ожирения происходит аккумуляция макрофагов в жировой ткани, сопровождающаяся их провоспалитель-ной поляризацией. В результате этой поляризации макрофаги секретируют цитокины, которые негативно влияют на чувствительность клеток к инсулину [8, 17].
Исследования [14; 16] выявили повышенную продукцию фактора некроза опухолей α (ФНО-α) при ожирении. ФНО-α способен активировать внутриклеточные сигнальные пути, включающие IKK-β и JNK, что приводит к нарушению передачи сигнала инсулина. ФНО-α также способствует фосфорилированию субстратов инсулинового рецептора, подавляя связанные с ними процессы, стимулирует синтез церамидов и активирует липолиз в адипоцитах.
Кроме того, при воспалении образуется белковый комплекс, именуемый «инфламмасомой». Его активация осуществляется посредством питательных веществ, таких как глюкоза и жирные кислоты. Данный комплекс стимулирует выработку цитокина интерлейкина-1β (ИЛ-1β). Исследования Эгути и соавт. [10; 19] показали, что ИЛ-1β нарушает секрецию инсулина в β-клетках поджелудочной железы и передачу сигнала инсулина в адипоцитах.
Таким образом, действие провоспалительных цитокинов, включая ФНО-α и ИЛ-1β, приводит к чрезмерному фосфорилированию субстрата инсулинового рецептора по остаткам серина, снижению количества ГЛЮТ-4 и, как следствие, уменьшению эффективности утилизации глюкозы из крови.
Дефицит витамина D. Недостаток витамина D может быть фактором риска развития инсулино-резистентности, так как он непосредственно вовлечен в процессы выработки инсулина и поддержания баланса глюкозы в организме [3].
Многочисленные исследования подтверждают связь между ожирением и снижением уровня кальцитриола — активной формы витамина D. Установлено, что увеличение индекса массы тела на 1 единицу приводит приблизительно к 1 % уменьшения концентрации кальцитриола — метаболита, способного связываться с VDR-рецепторами β-клеток поджелудочной железы, предположительно стимулируя выработку инсулина путем повышения активности генов рецептора инсулина [2].
Кроме того, кальцитриол модулирует деполяризацию клеток, что способствует перераспределению кальция и также может способствовать усилению секреции инсулина [2].
В ходе исследований in vitro было установлено, что кальцитриол обладает способностью подавлять иммунное воспаление, характерное для состояния ожирения. Кроме того, этот витамин оказывает регулирующее влияние на экспрессию генов, отвечающих за секрецию лептина и адипонектина [2].
Важно отметить, что витамин D способен регулировать функции митохондрий посредством взаимодействия с рецептором витамина D (VDR). Связываясь с VDR, он стимулирует экспрессию множества компонентов, участвующих в функционировании митохондрий, в том числе в митохондриальном дыхании. Это, с одной стороны, позволяет контролировать клеточную биоэнергетику, а с другой — ограничивает клетки от чрезмерной продукции активных форм кислорода, которые могут повредить клетки, в частности β-клетки. Также было показано, что витамин D способен уменьшать концентрацию активных форм кислорода (АФК) в адипоцитах, что связано с усилением синтеза антиоксидантных ферментов [21].
Адипокины. Одним из ключевых факторов развития инсулинорезистентности (ИР) при ожирении является дисбаланс в выработке ади-покинов — гормонов, секретируемых клетками жировой ткани. Наиболее существенным нарушением является снижение синтеза адипо-нектина, который в норме играет важную роль в повышении чувствительности тканей к инсулину и стимуляции окисления жирных кислот в мышечной ткани. Адипонектин преимущественно продуцируется зрелыми адипоцитами в значительных количествах. Его действие основано на фосфорилировании остатков тирозина на рецепторе инсулина, что приводит к усилению чувствительности тканей к воздействию инсулина. Исследования показали, что адипонектин также стимулирует экспрессию генов, кодирующих белки, участвующие в транспорте и окислении жирных кислот. Это способствует сниже- нию концентрации свободных жирных кислот в плазме крови [4].
В работе Вейера и его коллег [14] исследуется связь между концентрацией адипонектина в сыворотке крови и скоростью утилизации глюкозы, измеряемой с помощью гиперинсулинемическо-го теста у лиц с нормальным весом и страдающих ожирением. Авторы подтвердили, что ожирение и инсулинорезистентность ассоциированы с пониженным уровнем адипонектина. При этом корреляция между гипоадипонектинемией и ин-сулинорезистентностью оказалась более тесной, чем между гипоадипонектинемией и ожирением. Исходя из результатов некоторых исследований, можно сделать вывод о том, что снижение синтеза адипонектина может приводить к уменьшению чувствительности тканей к инсулину [4; 14].
Еще одним важным адипокином является лептин. Лептин, вырабатываемый в большом количестве адипоцитами жировой ткани, является важным адипокином, играющим ключевую роль в поддержании энергетического равновесия организма. Он воздействует на центральную нервную систему, подавляя аппетит и стимулируя расход энергии, что способствует снижению массы тела. Установлено, что концентрация лептина в плазме крови положительно коррелирует с увеличением массы тела. Однако при этом наблюдается снижение его эффективности вследствие развития резистентности к нему [14]. Данный феномен может указывать на связь ожирения, и, косвенно, инсу-линорезистентности, с резистентностью к лептину.
Резистин, являясь одним из адипокинов, играет прямую роль в развитии инсулинорезистент-ности. Исследования, проведенные МакТернаном и его коллегами [14], подтвердили эту взаимосвязь. Эксперименты на животных выявили, что повышение концентрации резистина усиливает инсулинорезистентность в инсулин-зависимых тканях, что, в свою очередь, приводит к нарушению метаболизма глюкозы.
Дальнейшие исследования на мышах, проведенные Цянем и соавторами [14], продемонстрировали статистически значимое повышение уровня резистина в сыворотке крови у животных с ожирением по сравнению с контрольной группой.
Заключение. Таким образом, можно отметить, что ожирение играет одну из важнейших ролей в развитии инсулинорезистентности в силу развития многих нарушений в организме. Увеличение объёма жировой ткани в организме, в особенности висцеральной, приводит к инфильтрации макрофагов и формированию провоспалительного фона, что приводит к развитию воспаления. Избыток свободных жирных кислот изменяет баланс липидов в организме, приводя к изменению направленности процессов цикла Рэндла, а также образованию биологически активных липидов. Важную роль играют адипокины, в первую очередь адипонектин, дефицит которого негативно сказывается на чувствительности тканей к инсулину. Менее очевидным и, вероятно, значимым фактором является дефицит витамина D, который может в некоторой степени снижать экспрессию генов рецептора инсулина за счет отсутствия модулирующего эффекта на транскрипционные факторы.
Необходимо отметить, что все перечисленные факторы тесно взаимосвязаны между собой, и нарушение одного из процессов влечет нарушение других. Однако пусковым механизмом всех процессов считается именно ожирение.


