Механизмы влияния докозагексаеновой кислоты на когнитивные функции при нейровоспалении
Автор: Тыртышная Анна Алексеевна
Рубрика: Внутренние, профессиональные и экологически обусловленные заболевания
Статья в выпуске: 5-2 т.16, 2014 года.
Бесплатный доступ
Докозагексаеновая кислота (ДГК) является одним из важнейших структурных и функциональных компонентов центральной нервной системы. Снижение ее содержания в головном мозге, сопровождающее процессы старения, часто связано с когнитивным дефицитом и развитием нейродегенеративных заболеваний. Цель исследования - оценка влияния ДГК на когнитивные функции при периферически-индуцированном нейровоспалении. Эксперимент проводили на мышах-самцах возрастом 3 месяца. ДГК вводили перорально в форме этилового эфира в течение 6 недель в дозировке 200 мкг/кг. Показано отсутствие снижения показателя рабочей памяти в группе животных, получавших ДГК при индукции нейровоспаления. Установлено снижение экспрессии белков GFAP и IL-1beta при нейровоспалении под действием докозагексаеновой кислоты.
Докозагексаеновая кислота, полиненасыщенные жирные кислоты, нейровоспаление
Короткий адрес: https://sciup.org/148101858
IDR: 148101858 | УДК: 615.017.
Текст научной статьи Механизмы влияния докозагексаеновой кислоты на когнитивные функции при нейровоспалении
поддержании клеточного гомеостаза, выживаемости клеток головного мозга и их восстановлении. NPD 1 играет важную роль в регуляции молекулярно-генетических механизмов, влияющих на накопление белка-предшественника β-амилоида (βAPP) и β-амилоида (βA). Дефицит ДГК способствует увеличению склонности к воспалению, апоптозу и дисфункции нейронов [3, 7].
Цель исследования: оценка влияния ДГК на когнитивные функции при нейровоспалении.
Материалы и методы. Экспериментальная часть работы одобрена комиссией по биомедицинской этике Института биологии моря им. А.В. Жирмунского ДВО РАН (протокол №12 от 14.12.2012). Исследование проводили в соответствии с правилами проведения работ и использования экспериментальных животных (приложение к приказу МЗ СССР № 755 от 12.08.1977 г.). Эксперимент проводили на мышах-самцах возрастом 3 месяца, средним весом от 25 до 30 г. В соответствии с целью эксперимента животных разделили на 4 группы по 8 в каждой группе:
-
1. «Контроль» - введение молока перорально, 200 мкл 0,9% NaCl внутрибрюшинно;
-
2. «ЛПС» - введение молока перорально, 200 мкл р-ра липополисахаридов E.coli в 0,9% NaCl внутрибрюшинно;
-
3. «ДГК» - введение ДГК перорально, 200 мкл 0,9% NaCl внутрибрюшинно;
-
4. «ДГК + ЛПС» - введение ДГК перорально, 200 мкл р-ра липополисахаридов E.coli в 0,9% NaCl внутрибрюшинно.
ДГК вводили перорально в форме этилового эфира в течение 6 недель в дозировке 200 мкг/кг. Нейровоспаление индуцировали путем однократной внутрибрюшинной инъекции бактериальных липополисахаридов (ЛПС) (Escherichia coli 0111:B4, Sigma Aldrich) в дозировке 5 мг/кг в последний день введения ДГК. Через 24 часа после инъекции проводили определение рабочей памяти и локомоторной активности в Y-образном лабиринте. Длительность тестирования одного животного составляла 5 мин. Фиксировалось количество и последовательность входов в рукава лабиринта с вычислением коэффициента спонтанных альтернаций (Ks) по формуле:
Ks = R/A ×100%, где R – количество правильных альтернаций (три последовательных входа в неповторяющиеся рукава лабиринта), A – общее количество возможных альтернаций.
Тестирование проводилось повторно спустя 48 часов после инъекции ЛПС. В течение часа после поведенческих тестов животных выводили из опыта декапитацией под изофлурановым наркозом с соблюдением правил и международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых для экспериментов или в иных научных целях (Страсбург, 1986). С целью иммуногистохимического выявления маркеров нейровоспаления было взято по 6 мышей из каждой группы, для анализа использовали по 6 срезов от каждого животного. Срезы толщиной 50 мкм изготавливали с использованием криостат-микротома Microm HM 525 Cryostat. Окраску производили с использованием первичных антител к белку GFAP (1:200; 18-0063, Life technologies). Для визуализации использовали вторичные антитела, конъюгированные с Alexa Fluor 546 (anti-rabbit, 1:200, A-11010, Life technologies). Полученные изображения анализировались с использованием программы ImageJ (NIH, США). Для твердофазного иммуноферментного анализа применялись антитела к IL-1beta (1:100, ab9722, Abcam). Для статистической обработки полученных данных использовали программу Statistica 6 (StatSoft, Inc, США). Данные представлены в виде M ± m, где M – средняя величина, m – ошибка среднего. Достоверность различий оценивалась по критерию Стьюдента .
Полученные результаты. По результатам тестирования в Y-образном лабиринте показатели рабочей памяти в группе «ЛПС» оказались существенно ниже, чем в группе «Контроль», в то время как в группе «ДГК + ЛПС» статистически значимых различий с группой «Контроль» не наблюдалось. (рис. 1).
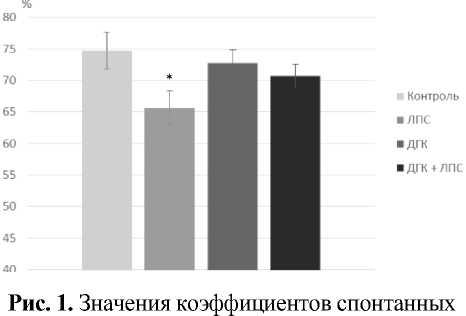
альтернаций в Y-лабиринте, *P=0,001, n=12
Подсчет количества входов в рукава Y-образного лабиринта через 24 часа после инъекции ЛПС показал, что локомоторная активность животных в группе «ЛПС» снизилась на 50±24,76%, в группе «ДГК + ЛПС» на 60,4±24,76%. Спустя 48 часов после инъекции ЛПС между показателями локомоторной активности в группах «Контроль» и «ДГК ЛПС» достоверных различий не было (рис. 2, 3).
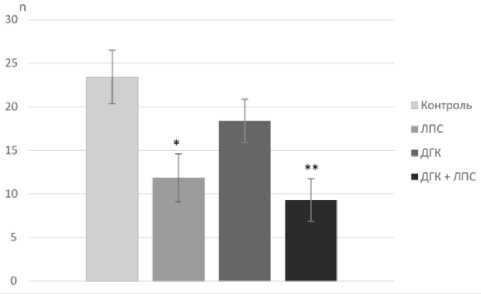
Рис. 2. Локомоторная активность (количество входов в рукава Y-лабиринта) через 24 часа после инъекции бактериальных ЛПС, *P=0,024, **P=0,01, n = 12.
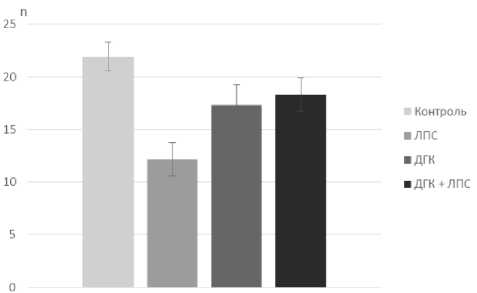
Рис. 3. Локомоторная активность (количество входов в рукава Y-лабиринта) через 48 часов после инъекции бактериальных ЛПС, *P=0,001, n = 12.
С помощью твердофазного иммунофер-ментного анализа выявлено достоверное повышение концентрации IL-1β в гиппокампе мышей группы «ЛПС» при лишь незначительном повышении данного параметра в группе «ДГК ЛПС» (рис. 4).
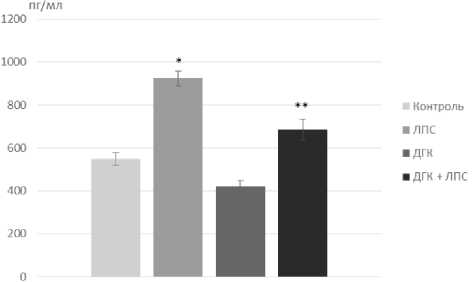
Рис. 4. Концентрация IL-1β в лизатах гиппокампа мышей через 48 часов после индукции нейровоспаления, *P=0,001, **P=0,037, n = 6.
Иммуногистохимическое исследование выявило статистически достоверное повышение экспрессии глиального фибриллярного кислого белка в группе «ЛПС» в то время как в группе «ДГК + ЛПС» уровень экспрессии GFAP достоверно не отличался от уровня в группе «Контроль» (рис. 5).
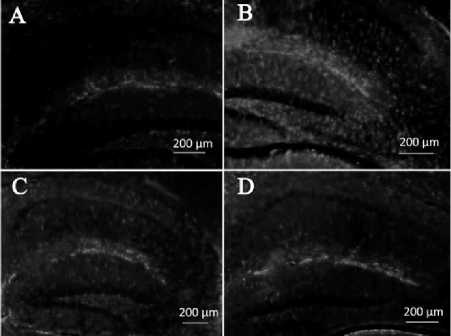
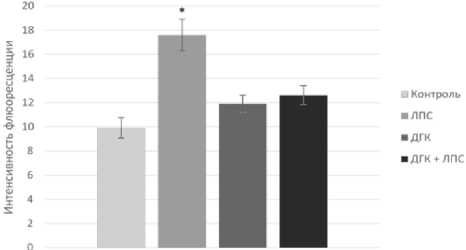
Рис. 5. Экспрессия глиального фибриллярного кислого белка (GFAP) (A – контроль, B – ЛПС, C – ДГК, D – ДГК + ЛПС), *P=0,001, n = 36.
Обсуждение результатов и выводы. В последние годы нейровоспалению уделяется большое внимание как общему компоненту самых разнообразных патологий центральной нервной системы, включая не только острые, но также нейродегенеративные и некоторые психические заболевания [1]. Хотя причинно-следственные взаимосвязи между нейровоспалением и повреждением мозга при заболеваниях ЦНС исследованы слабо, нейровоспаление часто принято считать нейродеструктивным фактором [2]. Известно, что многие медиаторы воспаления могут оказывать прямое токсическое действие, вызывая гибель нейронов [2]. По этой причине многие потенциальные стратегии нейропротекции направлены на ограничение воспалительного ответа путем ингибирования его медиаторов (IL-1β, TNFα). В настоящем исследовании показано, что пероральное введение ДГК в течение 6 недель препятствует развитию астроглиоза и повышению концентрации провоспалительного цитокина IL-1β в гиппокампе. Полученные данные свидетельствуют о противовоспалительной активности ДГК. Отсутствие снижения рабочей памяти при индукции нейровоспаления у мышей, которым вводили ДГК, свидетельствует о нейропротекторной активности данной омега-3 ПНЖК. Показано, что введение ДГК способствует восстановлению локомоторной активности экспериментальных животных на вторые сутки после индукции нейровоспаления.
Таким образом, одним из возможных механизмов влияния ДГК на когнитивные функции является противовоспалительная активность данной омега-3 жирной кислоты. Противовоспалительное действие ω-3 ПНЖК реализуется путем ингибирование каскада арахидоновой кислоты. К системным эффектам ДГК следует отнести ее участие в биосинтезе тканевых гормонов: резольвина и нейропротектина D1. Данные метаболиты связаны с процессами передачи сигналов, ведущих к развитию окислительного стресса, нейровоспаления и апоптоза. Биологическая роль первого – это ингибирование воспалительных процессов [2], а второй относится к наиболее важным эндогенным нейропротекторам. Получены убедительные экспериментальные доказательства того, что нейропротектин D1 снижает степень повреждения нейронов при травмах, ишемическом воздействии, токсическом поражении ЦНС. Этот тканевый гормон обладает доказанной антиапоптотической активностью, в частности, он способен снижать апоптоз нейронов, вероятно, путем активации сигнальной трансдукции в каскадах PI3K/Akt и mTOR/p70S6K [6]. Более детальное изучение механизмов влияния ПНЖК на когнитивные функции при нейровоспалении позволит в будущем осуществлять поиск новых путей фармакологической корректировки когнитивных нарушений при нейродегенеративной патологии.
Список литературы Механизмы влияния докозагексаеновой кислоты на когнитивные функции при нейровоспалении
- Громова, О.А. Омега-3 полиненасыщенные жирные кислоты и когнитивное развитие детей/О.А. Громова, И.Ю. Торшин, Е.Ю. Егорова//Вопросы современной педиатрии. 2011. Т. 10, № 1. С. 66-71.
- Огурцова, О.С. Нейропротекторное действие докозагексаеновой кислоты при моделировании компрессионной спинальной травмы/О.С. Огурцова, И.В. Манжуло, Н.А. Латышев и др.//Тихоокеанский медицинский журнал. 2014. № 2 (56). С. 64-69
- Eadya, T. Docosahexaenoic acid complexed to albumin provides neuroprotection after experimental stroke in aged rats/T. Eadya, L. Khoutorovaa, A. Obenaus//Neurobiology of Disease. 2014. V. 62. P. 1-7/
- Grant, W. The significance of environmental factors in the etiology of Alzheimer's disease/W. Grant, A. Campbell, R. Itzhaki, R. Savory//Journal of Alzheimer's Disease. 2002. P. 179-189.
- Itariu, B. Long-chain n-3 PUFAs reduce adipose tissue and systemic inflammation in severely obese nondiabetic patients: a randomized controlled trial/B. Itariu, M. Zeyda, E. Hochbrugger//American Society for Nutrition. 2012. V. 96, No. 5. P. 1137-1149.
- Johnson, R.W. Aging, neuroinflammation and behavior/R.W. Johnson, J.P. Godbout//Psychoneuroimmunology. 2006. V. 1. P. 379-391.
- Patterson, E. Health Implications of High Dietary Omega-6 Polyunsaturated Fatty Acids/E. Patterson, R. Wall, G.F. Fitzgerald//Journal of Nutrition and Metabolism. 2012. P. 1-16.


