Механизмы всасывания микроэлементов кишечником жвачных в условиях in vitro
Автор: Ковалнок Ю.К.
Статья в выпуске: 3 т.211, 2012 года.
Бесплатный доступ
В условиях модельного эксперимента in vitro установлены значимые (Р˂0,001) различия механизмов кишечного транспорта Cu, Zn, Co и Fe, находящихся в солевых и хелатных формах.
Микроэлементы, всасываемость, биодоступность
Короткий адрес: https://sciup.org/14287597
IDR: 14287597 | УДК: 636:612.39
Текст научной статьи Механизмы всасывания микроэлементов кишечником жвачных в условиях in vitro
Микроэлементозы животных продолжают оставаться одной из актуальных проблем современного промышленного животноводства [1, 3, 4 и др.]. Последние десятилетия отечественные и иностранные ученые активно работают над конструированием и изучением свойств элементорганических препаратов второго поколения, в которых минеральные вещества содержатся в виде комплекса веществами, подобными природным носителям микроэлементов [3,4,7,8 и др.]. Особо интересны внутрикомплексные вещества, содержащие циклические группировки органических молекул –хелатные соединения.
Известно, что микроэлементные препараты второго поколения, обладают более высоким потенциалом усвояемости в сравнении с солями. При этом абсолютное большинство исследователей [1, 3, 4 и др.]
констатируют значительный производственный эффект использования хелатных форм микроэлементов для лечения и профилактики микроэлементозов у животных и птиц, однако системных исследований механизмов, обеспечивающих данный процесс в доступной литературе нами не обнаружено. Вместе с тем, имеются сообщения [5], указывающие на возможную опасность применения соединений подобного типа ввиду предполагаемых возможных социальных последствий, противоречивости позиций всасываемости минеральных веществ из соединений хелатного типа и сорбции лигандами других, находящихся в химусе элементов – т.е. группы факторов, определяющих низкую степень изученности механизмов действия хелатов.
Исходными позициями методологии ниже излагаемых исследований послужили данные многочисленных исследователей, указывающими на то, что сам процесс всасываемости главным образом сопряжен с диссоциацией ионов и собственно их переносом (транспортом) как таковых (или в виде хелатных комплексов с аминокислотами и пептидами) через кишечный эпителий, осуществляющийся посредством специальных транспортных систем энтероцита. При этом в зависимости от различных вариантов сочетания факторов – стадией, лимитирующей процесс ассимиляции элемента в целом, может быть как первая, так и вторая.
В свете изложенного целью настоящих исследований явилось определения истоков статистически значимых различий в уровнях кишечного транспорта микроэлементов из хелатных и традиционно использующихся солевых форм микроэлементов.
Материал и методы исследований . Работа проводилась на базе кафедры внутренних болезней животных ФГОУ ВПО «Санкт-Петербургская государственная академия ветеринарной медицины» и лаборатории физиологии питания Института физиологии им. И.П.Павлова РАН. В опытах использовалось разработанное и запатентованное нами устройство (рисунок) для изучения всасываемости веществ кишечником животных [6].
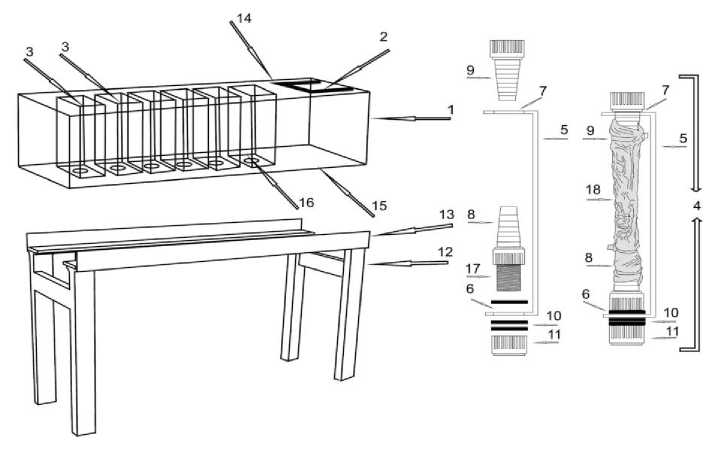
Рисунок. Устройство для изучения всасываемости веществ кишечником животных (1 – корпус устройства; 2 – отверстие для погружного циркуляционного термостата; 3 – автономные рабочие камеры; 4 – фиксирующая пластина; 5 – собственно пластина; 6 – нижнее и 7 – верхнее отверстие собственно пластины; 8 – нижний и 9 – верхний штуцер; 10 – уплотнительные кольца; 11 – глухая гайка; 12 – основание станины; 13 – платформа станины; 14 – верхнее и 15 – нижнее основание корпуса; 16 – отверстие для нижнего штуцера, 17 – резьба нижнего штуцера; 18 – участок кишечника).
В основу модели положен принцип изучения всасываемости веществ на изолированном из организма кишечном сегменте, исходные положения которого выдвинул крупнейший представитель Павловской школы нутрицинологии, основоположник мембранного пищеварения – А. М. Уголев.
Основываясь на сложившейся концепции взглядов о реализации механизма усвояемости микроэлементов по пути вторичного активного транспорта, мы построили серию исследований, в которой инкубация кишечных препаратов с испытуемыми веществами осуществлялась не в условиях предусмотренной оксигенации, а в условиях аноксии. Логика подобной методики сопряжена с тем, что активный транспорт веществ через апикальную мембрану энтероцита означает движение ионов через мембрану в комбинации с белком-переносчиком, заставляющим вещество двигаться против энергетического градиента. Такое движение, помимо кинетической энергии, требует дополнительного ее источника [1,5,8 и др.]. Об уровне (наличии) активного транспорта испытуемого субстрата судили по разнице аккумуляции его кишечной стенкой в условиях оксигенации и аноксии, поскольку известно [1,5,8 и др.], что подача азота в инкубационную смесь неизбежно приводит к окислительному стрессу и блокирует возможные механизмы активного транспорта веществ, в т.ч. и катионов.
В качестве объектов исследования выступали такие микроэлементы как Zn, Cu, Co и Fe, находящиеся в составе солей и разработанных нами хелатных соединений данных элементов с этилендиаминтетрауксусной кислотой, получившие коммерческие названия «Цинковет», «Купровет», «Кобальвет» и «Феравет».
Количество испытуемых элементов в исследуемых субстратах определяли методом масс-спектрометрии с индуктивно связанной плазмой (ICP-MS), используя спектрометр Varian ICP-810-MS.
Процедуры анализа полученных данных осуществляли с помощью статистических пакетов SAS 9.2, STATISTICA 9 и SPSS-19. Критическое значение уровня статистической значимости при проверке нулевых гипотез принималось равным 0,05.
Автор выражает благодарность научным консультантам, курировавшим данные исследования – профессорам Григорию Гавриловичу Щербакову, Андрею Андреевичу Груздкову и Александру Павловичу Курдеко.
Результаты исследований и их обсуждение . Инкубация свежеполученных участков тощей кишки крупного рогатого скота в условиях оксигенации и аноксии (таблица) в разработанном нами устройстве по методике его функционирования [6] показала, что позиции кишечного транспорта изучаемых элементов в разных химических формах имеют принципиальные отличия.
Так, если в условиях подачи кислорода в рабочие камеры устройства мы констатировали 13-32,6% снижение уровня испытуемого элемента в контрольных растворах сульфатов, то в условиях аноксии таковое изменение было на уровне 5,8% для CuSO4, 6,5% для ZnSO4, 7,8% для CoSO4 и 8,6% для железа лактата. В тоже время концентрация хелатных соединений испытуемых элементов в целом сохранила ранее сложившийся уровень и варьировала в диапазоне от -23 до -41,3%.
Наиболее яркие, статистически значимые (Р<0,001) различия коснулись кумуляции испытуемого субстрата кишечной стенкой после ее инкубации в условиях аноксии.
Таблица. Показатели кишечного транспорта некоторых микроэлементов (M ± m, P, n=36)
|
Испытуемый препарат |
Испытуемый субстрат |
||||
|
КР |
СР |
МР |
КК |
ОК |
|
|
В УСЛОВИЯХ ОКСИГЕНАЦИИ |
|||||
|
Меди сульфат |
4,81±0,346 |
0,036±0,0020 |
3,18±0,266 |
4,20±0,247 |
12,4±0,90 |
|
Купровет |
5,20±0,433 |
0,053±0,0029 |
3,08±0,173 |
4,52±0,336 |
16,1±0,88* |
|
Цинка сульфат |
54,0±4,56 |
0,466±0,021 |
37,9±1,91 |
22,3±1,48 |
80,7±4,63 |
|
Цинковет |
59,1±4,79 |
0,852±0,0509 |
36,9±2,27 |
26,3±1,43 |
113±6,2** |
|
Кобальта сульфат |
0,089± 0,0076 |
0,0079± 0,00059 |
0,083± 0,0047 |
0,0169± 0,00093 |
0,042± 0,0025 |
|
Кобальвет |
1,10± |
0,0115± |
0,877± |
0,021± |
0,055± |
|
0,066 |
0,00063 |
0,0460 |
0,0018 |
0,0034 |
|
|
Железа лактат |
185±13,9 |
0,177±0,0087 |
139±7,79 |
21,1±1,31 |
65,7±3,88 |
|
Феравет |
218±15,9 |
0,333±0,0186 |
160±9,1 |
27,5±1,71 |
108±6,3*** |
|
В УСЛОВИЯХ АНОКСИИ |
|||||
|
Меди сульфат |
4,81±0,346 |
0,039±0,0028 |
4,53±0,312 |
3,72±0,327 |
5,01±0,33 |
|
Купровет |
5,20±0,433 |
0,058±0,0040 |
3,07±0,238* |
4,04±0,287 |
16,9±1,12*** |
|
Цинка сульфат |
54,0±4,56 |
0,53±0,0313 |
50,5±3,39 |
22,9±1,85 |
29,3±1,56 |
|
Цинковет |
59,1±4,79 |
0,94±0,0707 |
36,3±2,16* |
26,8±2,09 |
100±5,4*** |
|
Кобальта сульфат |
0,089± 0,0076 |
- |
0,082± 0,0050 |
0,015± 0,0012 |
0,018± 0,007 |
|
Кобальвет |
1,10± |
0,814± |
0,019± |
0,045± |
|
|
0,066 |
- |
0,0591** |
0,0014 |
0,0031*** |
|
|
Железа лактат |
185±13,9 |
0,19±0,0104 |
169±11,0 |
24,1±1,65 |
31,1±1,78 |
|
Феравет |
218±15,9 |
0,37±0,0191 |
173±8,5 |
31,7±2,92 |
101±5,6*** |
Количественные значения испытуемых элементов в кишечной стенке кумулирующей их из солевых форм возросли до 95% ДИ по меди (4,385,64 мг/кг), цинку (26,2-32,4 мг/кг), кобальту (0,032-0,004 мг/кг) и железу (27,6-34,5 мг/кг), что в целом превышало исходные значения на 24-36% и в сравнении с условиями эксперимента, осуществляемого в условиях оксигенации можно охарактеризовать как ничтожно малый рост показателя, поскольку в последнем увеличение количества элементов констатировано нами на уровне 147-263%.
Вместе с тем, анализируя полученные числовые значения испытуемых элементов, входивших в рабочие растворы разработанных нами ветеринарных препаратов можно отметить сохранившуюся (в сравнении с условиями оксигенации) закономерность. Так, 95% ДИ для меди, аккумулированной кишечной стенкой из купровета составил 14,719,1 мг/кг, для хелатной формы цинка 95% ДИ составил 89,4-110,6 мг/кг, кобальта – 0,039-0,051 мг/кг и железа 90,1-111,9 мг/кг. Указанные значения превышали исходные на 136-318%, что определило весьма значимый (Р < 0,001) уровень различий как в сравнении с исходными величинами, так и с конечными, полученными для солей.
Резюме
В условиях модельного эксперимента in vitro установлены значимые (Р < 0,001) различия механизмов кишечного транспорта Cu, Zn, Co и Fe, находящихся в солевых и хелатных формах.


