Метаболическая адаптация эритроцитарных оксидоредуктаз к воздействию глутатион-содержащих динитрозильных комплексов железа
Автор: Давыдюк А.В., Мартусевич А.К., Соловьева А.Г., Каримова Р.Г.
Статья в выпуске: 1 т.221, 2015 года.
Бесплатный доступ
Целью работы явилось изучение активности некоторых оксидоредуктаз крови животных с термической травмой при введении динитрозильных комплексов железа (ДНКЖ). Исследование проведено на 30 крысах линии Вистар, 10 из них были включены в интактную группу, остальным наносили термическую травму. Животным контрольной группы (n=10) лечение осуществляли ежедневными инфузиями физиологического раствора. Крысы основной группы (n=10) получали ДНКЖ в физиологическом растворе (1:9). На 3 и 10 сутки в крови определяли физико-химические показатели, характеризующие состояние энергетического метаболизма. Установлено положительное действие ДНКЖ на энергетический метаболизм эритроцитов, реализующееся посредством регуляции активности лактатдегидрогеназы и наблюдающееся уже к 3 суткам послеожогового периода.
Динитрозильные комплексы железа, энергетический метаболизм, кровь
Короткий адрес: https://sciup.org/14288507
IDR: 14288507 | УДК: 533.92:537.525
Текст научной статьи Метаболическая адаптация эритроцитарных оксидоредуктаз к воздействию глутатион-содержащих динитрозильных комплексов железа
В настоящее время показаны многочисленные положительные эффекты естественной депонированной формы оксида азота – динитрозильных комплексов железа (ДНКЖ) – в отношении различных биологических систем [4-6]. Ранее нами in vitro установлен характер влияния ДНКЖ на отдельные компоненты метаболизма крови, включая энергетический обмен, состояние про- и антиоксидантных систем [2, 3] и т.д. В то же время комплексный анализ влияния рассматриваемого донора оксида азота на состояние крови при термической травме в литературе не представлен. В связи с этим, целью работы явилось изучение активности некоторых оксидоредуктаз крови животных с термической травмой при введении ДНКЖ.
Материал и методы. Исследование проводили на 30 половозрелых крысах-самцах линии Вистар массой 220-250 г., разделенных на 3 группы равной численности: интактную (никаких манипуляций не проводили, выполняли лишь однократный забор крови), контрольную (воспроизводили термическую травму и применяли стандартное лечение) и основную (аналогична контрольной с дополнительным введением водного раствора ДНКЖ).
Животным контрольной и основной групп комбинированную травму наносили по собственной методике, включающей контактный термический ожог кожи спины (площадь – 20% поверхности тела) в сочетании с термоингаляционной травмой. Содержание животных, экспериментальные вмешательства осуществляли согласно приказу Минздрава СССР №775 от 12.08.1977 г. Травму наносили под комбинированным наркозом («золетил» + «ксила»). Животным контрольной группы с первых суток после моделирования термической травмы проводили ежедневные внутрибрюшинные инфузии физиологического раствора (3 мл), раны обрабатывали левомеколем. Крысы основной группы ежедневно внутрибрюшинно получали ДНКЖ в физиологическом растворе (1 : 9 (по объему) – суммарно 3 мл; в течение 10 суток)
местное лечение аналогично
проводимому в контрольной группе.
ДНКЖ синтезировали по методике
А.Ф. Ванина [4].
На третьи и десятые сутки восуществляли забор образцов крови у животных обеих групп. Изучали активность лактатдегидрогеназы (ЛДГ) в прямой (ЛДГпр) и обратной (ЛДГобр) реакциях в гемолизате эритроцитов о методу Г.А. Кочетова [1]. Уровень лактата в эритроцитах оценивали с помощью автоматического анализатора SuperGL
Ambulance. Исходя из полученных значений параметров, рассчитывали интегральные показатели: коэффициент субстратного обеспечения (КСО) и баланса энергетических реакций (КБЭР) [3].
Данные были обработаны статистически с помощью Statistica 6.0.
Результаты исследования.
Установлено, что активность эритроцитарной ЛДГ в обратной реакции у крыс при термической травме существенно изменена относительно животных интактной группы на третьи и на десятые сутки послеожогового периода (р<0,05). На третьи сутки ЛДГпр у животных данной группы умеренно снижена, тогда как на десятые сутки эта тенденция сглаживается (рис. 1).
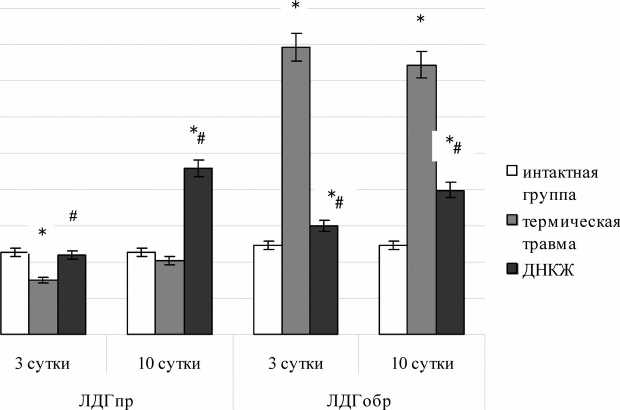
Рис. 1. Активность лактатдегидрогеназы эритроцитов в норме и при термической травме с учетом введения ДНКЖ
(ЛДГ пр – активность ЛДГ в прямой реакции; ЛДГобр – активность ЛДГ в обратной реакции; ДНКЖ – динитрозильные комплексы железа; * - статистическая значимость различий с уровнем интактных животных p<0,05; # - статистическая значимость различий с уровнем животных с термической травмой p<0,05)
Системное введение ДНКЖ животным с комплексным термическим повреждением значительно модифицировало активность фермента как в прямой, так и в обратной реакциях. В частности, каталитические свойства эритроцитарной ЛДГпр у крыс данной группы на третьи сутки практически не отличались от характерных для интактных животных, значимо превосходя уровень контрольной группы (р<0,05). На десятые сутки послеожогового периода у животных основной группы наблюдали выраженное нарастание активности энзима в прямой реакции, превышающее значения, выявленные для животных как интактной, так и контрольной группы в 2,02 и 2,24 раза соответственно (p<0,05). С учетом метаболической сущности данной реакции подобную динамику показателя следует, на положительного воздействия ДНКЖ.
Этому заключению в полной мере соответствует характер влияния изучаемого соединения на активность ЛДГ в обратной реакции: на третьи сутки она была лишь минимально повышена относительно уровня интактных животных (в 1,21 раза; p<0,05), оставаясь значительно ниже значений, зарегистрированных у животных контрольной группы (в 2,64 раза; p<0,05). Аналогичная картина имела место и на десятые сутки послеожогового периода (к моменту завершения эксперимента). Таким образом, наши исследования позволили предположить, что изучаемая депонированная форма оксида азота предотвращает избыточную активацию ЛДГобр, потенцирующую синтез лактата, известного молекулярного маркера гипоксии.
наш взгляд, расценивать как результат
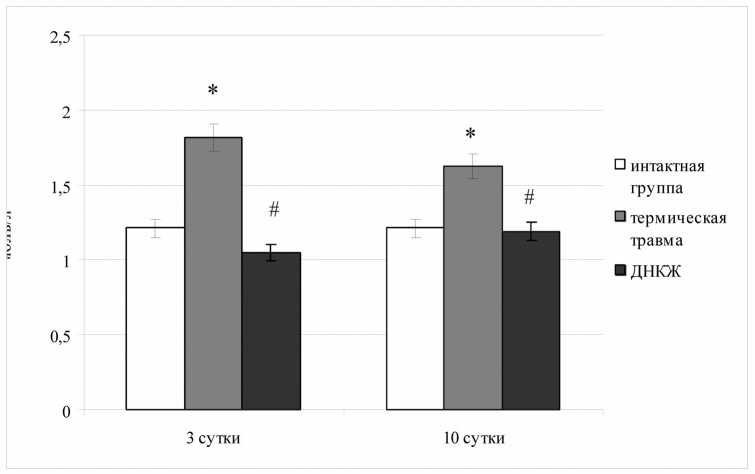
Рис. 2. Уровень лактата в эритроцитах в норме и при термической травме в зависимости от введения ДНКЖ (* - статистическая значимость различий с уровнем у интактных животных p<0,05; # - статистическая значимость различий с уровнем у животных с комбинированной термической травмой p<0,05)
Результат оценки уровня лактата в эритроцитах в экспериментальных группах животных приведен на диаграмме (рис. 2). Установлено, что, аналогично изменениям каталитических свойств ЛДГ, на третьи сутки после нанесения ожога у животных контрольной группы имело место существенное повышение концентрации лактата в эритроцитах относительно уровня у интактных крыс (в 1,5 раза; p<0,05)
сохраняющееся к завершению эксперимента (в 1,35 раза на десятые сутки; p<0,05). Данная динамика подтверждает формирующееся в результате тяжелой термической травмы смещение активности ЛДГ в сторону обратной реакции.
Иная картина регистрируется у животных, получавших инъекции ДНКЖ, у которых отмечена нормализация рассматриваемого звена энергетического метаболизма крови на всех сроках (рис. 2). Динамика концентрации лактата в эритроцитах у животных основной группы косвенно свидетельствовала о повышении адаптационных резервов исследуемого компонента системы энергообеспечения при действии депонированной формы оксида азота.
Также нами был произведен расчет дополнительных параметров: коэффициентов субстратного обеспечения и баланса энергетических реакций (рис. 3). Отмечено выраженное смещение режима функционирования ЛДГ с существенной активацией обратной реакции на фоне угнетения прямой, наблюдавшееся у крыс контрольной группы, что проявилось в резком снижении уровня КБЭР на 3 и 10 сутки послеожогового периода (в 23,1 и 11,2 раз соответственно, p<0,05). Этот сдвиг отражает системную метаболическую дезадаптацию, формирующуюся в условиях тяжелой термической травмы. При введении животным с комбинированной термической травмой ДНКЖ на 3 сутки лечения регистрировали лишь умеренное падение КБЭР (в 1,58 раза; p<0,05) сменявшееся его нарастанием ко времени завершения эксперимента (в 1,57 раза; p<0,05), что, в свою очередь, свидетельствовало о стимуляции энергетического обмена.
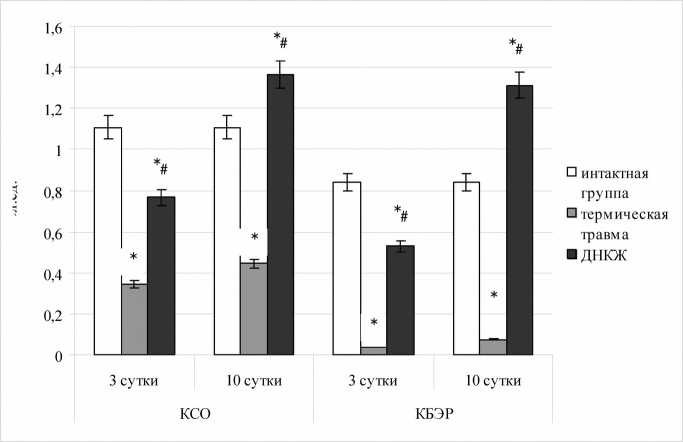
Рис. 3. Производные коэффициенты энергетического метаболизма эритроцитов в норме и при термической травме в зависимости от введения ДНКЖ (КСО – коэффициент субстратного обеспечения; КБЭР – коэффициент баланса энергетических реакций; * - статистическая значимость различий с уровнем у интактных животных p<0,05; # - статистическая значимость различий с уровнем у животных с термической травмой p<0,05)
Аналогичная, но менее показательная динамика была выявлена в отношении коэффициента субстратного обеспечения: у животных контрольной группы как на третьи, так и на десятые сутки регистрировали значительное снижение КСО (в 3,2 и 2,5 раза соответственно; p<0,05), что указывало на сопряженность сдвигов каталитической активности ЛДГ и эритроцитарной концентрации лактата, а также их декомпенсацию в условиях моделирования комбинированной ожоговой травмы. В то же время модуль сдвигов данного коэффициента при проведении курса инфузионной терапии с включением
ДНКЖ был существенно меньше, причем на 3 сутки обнаруживали умеренное снижение показателя (69% от нормы; p<0,05) с последующим его выраженным приростом (123% от нормы; p<0,05). Эта тенденция, по нашему мнению, указывает на протективное, адаптогенное действие изучаемого соединения в отношении энергетического метаболизма эритроцитов.
Заключение. В ходе эксперимента получены данные о положительном действии динитрозильных комплексов железа на метаболические параметры крови животных с термической травмой. Выявлено, что ДНКЖ стимулируют энергетический метаболизм эритроцитов крыс с термической травмой за счет преимущественной активации ЛДГ в прямой реакции (на 102% против +21% для обратной реакции) и снижения темпов нарастания уровня лактата.
ЛИТЕРАТУРА: 1. Кочетов Г.А. Практическое руководство по энзимологии / Г.А. Кочетов. -Москва: Высшая школа, 1980. 2. Мартусевич А.К. Анализ влияния оксида азота на физикохимические параметры крови in vitro / А.К. Мартусевич, А.Г. Соловьева, С.П. Перетягин, Н.В. Диденко // Врач-аспирант. – 2013. - №2. – С. 218-222. 3. Мартусевич А.К. Оценка влияния некоторых физических факторов на энергетический метаболизм крови in vitro / А.К. Мартусевич, А.Г.Соловьева, С.П. Перетягин, В.Н. Митрофанов // Биомедицина. - 2013. - №1. -С. 103-108. 4. Borodulin R.R. A simple protocol for the synthesis of dinitrosyl iron complexes with glutathione: EPR, optical, chromatographic and biological characterization of reaction products / R.R. Borodulin, L.N. Kubrina, V.O. Shvydkiy et al. // Nitric oxide. - 2013. - Vol. 35. - P. 110-115. 5. Shumaev K.B. Globins and other nitric oxide-reactive proteins. Dinitrosyl iron complexes bound with haemoglobin as markers of oxidative stress / K.B. Shumaev, O.V.Kosmachevskaya, A.A. Timoshin et al. // Methods in Enzymology. - 2008. V.436. P. 441-457. 6. Vanin A.F. Dinitrosyl-iron complexes with thiolate ligands: physico-chemistry, biochemistry and physiology // Nitric Oxide Biol. Chem. 2009. Vol. 21. P. 136-149.
МЕТАБОЛИЧЕСКАЯ АДАПТАЦИЯ ЭРИТРОЦИТАРНЫХ ОКСИДОРЕДУКТАЗ К ВОЗДЕЙСТВИЮ ГЛУТАТИОН-СОДЕРЖАЩИХ ДИНИТРОЗИЛЬНЫХ КОМПЛЕКСОВ ЖЕЛЕЗА
Давыдюк А.В., Мартусевич А.К., Соловьева А.Г., Каримова Р.Г.
Резюме
Целью работы явилось изучение активности некоторых оксидоредуктаз крови животных с термической травмой при введении динитрозильных комплексов железа (ДНКЖ). Исследование проведено на 30 крысах линии Вистар, 10 из них были включены в интактную группу, остальным наносили термическую травму. Животным контрольной группы (n=10) лечение осуществляли ежедневными инфузиями физиологического раствора. Крысы основной группы (n=10) получали ДНКЖ в физиологическом растворе (1:9). На 3 и 10 сутки в крови определяли физико-химические показатели, характеризующие состояние энергетического метаболизма. Установлено положительное действие ДНКЖ на энергетический метаболизм эритроцитов, реализующееся посредством регуляции активности лактатдегидрогеназы и наблюдающееся уже к 3 суткам послеожогового периода.
METABOLIC ADAPTATION OF OXIDOREDUCTASES OF ERYTHROCYTES TO GLUTATHIONE-CONTAINING DINITROSYL IRON COMPLEXES
Davyduk A.V., Martusevich A.K., Soloveva A.G., Karimova R.G.
Список литературы Метаболическая адаптация эритроцитарных оксидоредуктаз к воздействию глутатион-содержащих динитрозильных комплексов железа
- Кочетов Г.А. Практическое руководство по энзимологии/Г.А. Кочетов. -Москва: Высшая школа, 1980.
- Мартусевич А.К. Анализ влияния оксида азота на физико-химические параметры крови in vitro/А.К. Мартусевич, А.Г. Соловьева, С.П. Перетягин, Н.В. Диденко//Врач-аспирант. -2013. -№2. -С. 218-222.
- Мартусевич А.К. Оценка влияния некоторых физических факторов на энергетический метаболизм крови in vitro/А.К. Мартусевич, А.Г.Соловьева, С.П. Перетягин, В.Н. Митрофанов//Биомедицина. -2013. -№1. -С. 103-108.
- Borodulin R.R. A simple protocol for the synthesis of dinitrosyl iron complexes with glutathione: EPR, optical, chromatographic and biological characterization of reaction products/R.R. Borodulin, L.N. Kubrina, V.O. Shvydkiy et al.//Nitric oxide. -2013. -Vol. 35. -P. 110-115.
- Shumaev K.B. Globins and other nitric oxide-reactive proteins. Dinitrosyl iron complexes bound with haemoglobin as markers of oxidative stress/K.B. Shumaev, O.V. Kosmachevskaya, A.A. Timoshin et al.//Methods in Enzymology. -2008. V.436. P. 441-457.
- Vanin A.F. Dinitrosyl-iron complexes with thiolate ligands: physico-chemistry, biochemistry and physiology//Nitric Oxide Biol. Chem. 2009. Vol. 21. P. 136-149.


