Методика определения тетрациклиновой группы в томатах
Автор: Халявин И.А., Баиров А.Л.
Статья в выпуске: 3 т.259, 2024 года.
Бесплатный доступ
Различная растениеводческая продукция может содержать остатки ветеринарных препаратов, которые попадают в почву, удобренную побочным продуктом животноводства – навозом, используемым в сельском хозяйстве, особенно фермерами для повышения урожайности и качества. Необходим регулярный мониторинг продукции не только животного, но и растительного происхождения с целью контроля остаточных количеств анитибиотиков тетрциклиновой группы. В данной работе представлена быстрая и простая аналитическая методика определения антибиотиков тетрациклической группы (окситетрациклина, тетрациклина, хлортетрациклина и доксициклина) в овощах – томатах. Метод высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием является одним из наиболее чувствительных и селективных методов определения примесей органических веществ в пищевой продукции. Представленный авторами методика успешно проверена и эффективна для количественного определения тетрациклинов в томатах. Извлечение антибиотиков из образцов томатов с добавками варьировалось от 89,6 % до 108,1 %.
Антибиотики, тетрациклиновая группа, томаты, лабораторный контроль, экология, почва
Короткий адрес: https://sciup.org/142242497
IDR: 142242497 | УДК: 637.074 | DOI: 10.31588/2413_4201_1883_3_259_254
Текст научной статьи Методика определения тетрациклиновой группы в томатах
Антибиотики оказывают огромное влияние на нашу жизнь прямым и косвенным образом, исключить их применение не представляется возможным. Присутствие антибиотиков в окружающей среде даже в низких концентрациях представляет значительную экологическую проблему, которая оказывает негативное влияние на здоровье человека и животных [1-3]. При проведении мониторинга окружающей среды остатки антибиотиков обнаруживаются в сточных водах, в иле, переваренном осадке и твердых биоматериалах. Сельскохозяйственная почва и грунтовые воды служат двумя основными резервуарами остаточных количеств антибиотиков, по причине адсорбирования почвой, могут попадать в поверхностные и грунтовые воды [2].
Тетрациклиновая группа антибиотиков является одной из наиболее широко используемой в ветеринарии, животноводческой и птицеводческой отрасли сельского хозяйства. К антибиотикам этой группы относятся тетрациклин, окситетрациклин, доксициклин, хлортетрациклин и демеклоциклин. Для всех тетрациклинов характерен широкий спектр антимикробного действия, проявляющийся в отношении грамположительных и грамотрицательных бактерий, штаммов хламидий, микоплазм и риккетсий, простейших паразитов [1].
Антибиотики тетрациклиновой группы обладают значительным минусом, так как накапливаются в окружающей среде: почве, водоемах и сельскохозяйственных угодьях [4, 8].
Также применение антибактериальных препаратов, в том числе тетрациклиновой группы, приводит к нарушению работы микрофлоры кишечника и эндокринным заболеваниям. Живой организм теряет способность самостоятельно противостоять различным инфекциям и, кроме того, их широкое применение привело к тому, что появляются новые антибиотикорезистентные штаммы бактерий [5, 6].
Загрязнение антибиотиками овощей и фруктов возможно из-за нарушения технологии животноводства и санитарных норм, когда отходы с животноводческих и птицеводческих ферм утилизируются неправильно или органические отходы (навоз и помет) применяются в качестве удобрений, что ведет к загрязнению почв и грунтовых вод, и, как следствие, к попадаю остаточных количеств антибактериальных препаратов в растительную продукцию и корма для животных [7].
Возникает острая необходимость в мониторинге остатков антибиотиков не только в продукции животного происхождения, кормов и полуфабрикатов, но и плодовоовощной продукции [9].
Материал и методы исследований. При проведении научных испытаний авторы работы исследовали томаты 5 сортов по 1 кг каждый, приобретенные на продовольственных рынках города Москвы и Подмосковья. Опыты проводились на базе ФГБУ «ВНИИЗЖ», г. Москва.
Испытательное оборудование: высокоэффективный жидкостный хроматограф масс селективным детектором LCMS-8060 Shimadzu (Япония).
Вспомогательное оборудование: напольная центрифуга Thermo Scientific SL40R, нагревательный модуль Thermo 18821, весы неавтоматического действия Secura 225D-1ORU, дозаторы механические 1-канальные «Biohit»
переменного объема.
Химические реактивы:
ацетонитрил HPLC, метанол HPLC, муравьиная кислота ОСЧ.
Стандартные образцы антибиотиков: тетрациклина, окситетрациклина, доксициклина, хлортетрациклина и демеклоциклин (фирма Sigma-Aldrich).
Результат исследований. С целью определения остатков антибиотиков тетрациклиновой группы в данном научном исследовании было исследовано 5 образцов томатов с внесением в испытуемую пробу стандартного образца тетрациклиновой группы (50 мкг/кг).
Образец томата измельчали, вносили навеску 2,0 в пробирки на 50 см3, добавляли стандартные образцы антибиотиков объемом 100 мкл с концентрацией 1000 нг/мл. В качестве внутреннего стандарта извлечения дополнительно добавляли раствор демеклоциклина объемом 100 мкл в метаноле. Затем готовили буферный раствор с последующим добавлением к пробе, закрывали крышкой, интенсивно перемешивали.
Далее виалы с образцами помещали в центрифугу и центрифугировали в течение 20 мин. Процедуру экстракции и центрифугирование повторяли. Экстракты собирали в чистые виалы. В дальнейшем проводили твердофазную экстракцию.
В качестве подвижной фазы А и В готовили 0,1% растворы муравьиной кислоты и 0,1% раствор муравьиной кислоты в метаноле, соответственно. Для каждого антибиотика тетрациклиновой группы измеряли сигнал для двух фрагментных ионов, согласно таблице 1.
Таблица 1 – Значения масс ионов-предшественников и ионов-фрагментов
|
Антибиотик тетрациклиновой группы |
Ион-предшественник, m/z <*> |
Ионы-фрагменты, m/z <*> |
|
Тетрациклин |
445,1 |
410 |
|
427,1 |
||
|
Окситетрациклин |
461,1 |
426,1 |
|
444,2 |
||
|
Доксициклин |
445,1 |
428 |
|
410 |
||
|
Хлортетрациклин |
479,1 |
444,1 |
|
462,1 |
||
|
Демеклоциклин |
465,1 |
448,1 |
|
430,1 |
||
|
<*> m/z – отношение массы иона к его заряду |
||
Время удерживания тетрациклиновой группы определяют при анализе градуировочных растворов. Расчеты содержания тетрациклиновой группы выполняют с помощью градуировочной характеристики следующим образом. Вычисляют отношение площади пика фрагментного иона к площади внутреннего стандарта с помощью программы обработки спектров, поставляемой вместе с хромато-масс-спектрометром. Затем, для найденного значения (абсциссы) находят точку на градуировочной характеристике. На рисунке 1 представлены хроматограммы стандарта доксициклина.
St1
St2
St3
St4
Cone 11,6701
Area 466721
R#1 445,201410,20 7,27(0,00)
Q 445,201428,20 (+) 3,80e4
Cone 52,7207
Area 2352420
R#1 445,20 >410,20 6,80(0,00)
Q 445,201428,20 (+) 1,95e5
Cone 95,7885
Area 4859892
R#1 445,20 1 410,20 6,58 (0,00)
Q 445,201428,20 (+) 4,07e5
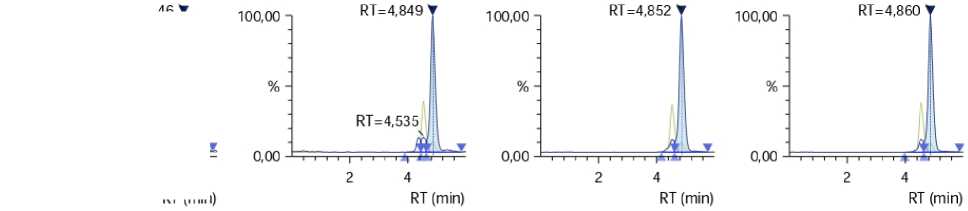
Рисунок 1 – Хроматограммы стандарта доксициклина
Cone 0,8207
Area 57074
R#1 445,201410,20 6,26 (0,00)
Q 445,201428,20 (+) 4,65e3
Помидор 2
Cone 99,3975
Area 19592554
R#1 445,20 >410,20 2,38 (0,00)
Помидор 3
Cone 95,6899
Area 20175951
R#1 445,20>410,20 0,99 (0,00)
Помидор_1
Cone 95,8372
Area 16239627
R#1 445,20> 410,20 1,03 (0,00)
Помидор_5
СОПС 108,0921
Area 22103778
R#1 445,20>410,20 6,82 (0,00)
Помидор 4
Cone 106,5352
Area 20662827
R#1 445,20>410,20 2,96 (0,00)
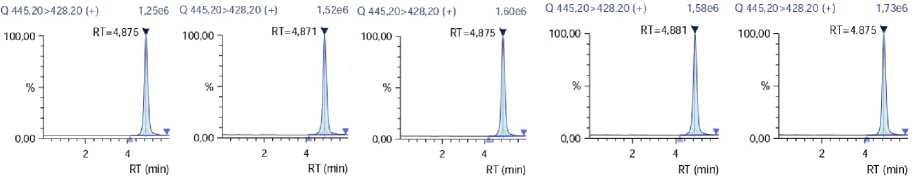
Рисунок 2 – Хроматограммы доксициклина в испытуемых образцах томатов с добавкой
Таблица 2 – Результаты обнаружения тетрациклиновой группы в образцах томатов
|
Антибиотик тетрациклиновой группы |
Степень извлечения антибиотиков тетрациклиновой групп, % |
||||
|
Томат 1 |
Томат 2 |
Томат 3 |
Томат 4 |
Томат 5 |
|
|
Тетрациклин |
91,4 |
95,3 |
97,2 |
102,3 |
94,3 |
|
Окситетрациклин |
94,7 |
96,1 |
89,9 |
98,6 |
98,2 |
|
Доксициклин |
95,8 |
99,4 |
95,2 |
106,4 |
108,1 |
|
Хлортетрациклин |
89,6 |
101,9 |
95,2 |
102,9 |
95,6 |
Представлены хроматограммы доксициклина в испытуемых образцах томатов с добавкой (Рисунок 2), время удерживания основного пика на хроматограмме испытуемого раствора соответствует времени удерживания доксициклина на хроматограмме стандартного образца.
Результаты опытов обнаружения антибиотиков тетрациклиновой группы (тетрациклин, окситетрациклин, доксициклин и хлортетрациклин) в томатах представлены в таблице 2.
Как видно из данных таблицы 2, погрешность в определении искомых веществ составила около 10 %, что является допустимым значением. Методика пробоподготовки, использованная в данном научном исследовании, и дальнейшее обнаружение остатков тетрациклинов в томатах, с применением высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием является одним из наиболее чувствительных и селективных методов с целью определения примесей органических веществ в пищевой продукции.
Заключение. В современное время на территории Российской Федерации не осуществляется в полной мере контроль за содержание тетрациклиновой группы в плодовоовощной продукции. Поэтому определение остаточных количеств антибиотиков в овощах является актуальной и важной задачей для обеспечения пищевой безопасности.
В своем научном исследовании мы представили результаты собственных исследований по методике, разработанной авторским коллективом для определения антибиотиков тетрациклиновой группы в овощах – а именно в томатах. Предложенная методика обнаружения ветеринарных препаратов в томатах методом ВЭЖХ МС/МС позволит повысить уровень контроля качества проверяемой продукции и ее безопасность для потребителя.
Таким образом, необходим мониторинг продуктов животного и растительного происхождения, почвы и воды, в отношении присутствия в них остаточных количеств антибактериальных препаратов, а также углубленное изучение поставленного вопроса.
Список литературы Методика определения тетрациклиновой группы в томатах
- Лаврухина, О. И. Определение остаточных количеств антибиотиков в объектах окружающей среды и пищевых продуктах / О. И. Лаврухина, В. Г. Амелинa, Л. К. Киш // Журнал аналитической химии. – 2022. – Т. 77. – № 11. – С. 969-1015.
- Aust, M. O. Distribution of Sulfamethazine, Chlortetracycline and Tylosin in Manure and Soil of Canadian Feedlots after Subtherapeutic Use in Cattle / M. Aust, F. Godlinski, G. R. Travis [et all.] // Environ. Pollut. – 2008. – № 156. – Р. 1243–1251.
- Azanu, D. Uptake of Antibiotics from Irrigation Water by Plants / D. Azanu, C. Mortey, G. Darko [et all.] // Chemosphere. – 2016. – № 157. – Р. 107-114.
- Hamscher, G. Determination of Persistent Tetracycline Residues in Soil Fertilized with Liquid Manure by High- Performance Liquid Chromatography with Electrospray Ionization Tandem Mass Spectrometry. / G. Hamscher, S. Sczesny, H. Höper [et all.] // Anal. Chem. – 2002. – № 74. – Р. 509-1518.
- Huygens, J. Impact of Fertilization with Pig or Calf Slurry on Antibiotic Residues and Resistance Genes in the Soil / J. Huygens, G. Rasschaert, M. Heyndrickx [et all.] // Sci. Total Environ. – 2022. – № 822. doi: 10.1016/j.scitotenv.2022.153518. PMID: 35101484.
- Metcalfe, C. D. An Introduction to the Sources, Fate, Occurrence and Effects of Endocrine Disrupting Chemicals Released into the Environment / C. D. Metcalfe, S. Bayen, M. Desrosiers et all. // Environ. Res. – 2022. – № 207. doi: 10.1016/j.envres.2021.112658. PMID: 34990614.
- Selvam, A. Fate of Tetracycline, Sulfonamide and Fluoroquinolone Resistance Genes and the Changes in Bacterial Diversity during Composting of Swine Manure / A. Selvam, D. Xu, Z. Zhao [et all.] // Bioresour. Technol. – 2012. – № 126. – Р. 383-390.
- Tasho, R. P. Veterinary Antibiotics in Animal Waste, Its Distribution in Soil and Uptake by Plants: A Review / R. P. Tasho, J. Y. Cho // Sci. Total Environ. – 2016. – Р. 563-564.
- Zhang, Y.L. Sorption–Desorption and Transport of Trimethoprim and Sulfonamide Antibiotics in Agricultural Soil: Effect of Soil Type, Dissolved Organic Matter, and PH. Environ / Y. L. Zhang, S. S. Lin, C. M. Dai [et all.] // Sci. Pollut. Res. – 2014. – № 21. – Р. 5827-5835.


