Методы хирургического лечения локальных дефектов гиалинового хряща крупных суставов (обзор литературы)
Автор: Айрапетов Георгий Александрович, Воротников Александр Анатольевич, Коновалов Евгений Александрович
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Обзор литературы
Статья в выпуске: 4, 2017 года.
Бесплатный доступ
Повреждение суставного хряща крупных суставов является частой патологией опорно-двигательного аппарата. Более 50 % обращений к врачу травматологу-ортопеду в амбулаторном звене связано с болью в крупных суставах. Консервативные методы лечения не претерпели существенных изменений в последнее время, чего не скажешь о хирургических вмешательствах. Методики стимуляции хондрогенеза и восстановления хрящевого покрова путем замещения дефекта клеточными технологиями продолжают активно развиваться. В данной статье проведен обзор литературных источников, касающихся современных методов лечения повреждений суставного хряща.
Гиалиновый хрящ, локальные дефекты, микрофрактурирование, мозаичная аутохондропластика, туннелизация, клеточные технологии
Короткий адрес: https://sciup.org/142213597
IDR: 142213597 | УДК: 616.72-018.3-007.21-089.8 | DOI: 10.18019/1028-4427-2017-23-4-485-491
Текст научной статьи Методы хирургического лечения локальных дефектов гиалинового хряща крупных суставов (обзор литературы)
Повреждение суставного хряща крупных суставов является частой патологией опорно-двигательного аппарата. Более 50 % обращений к врачу травматологу-ортопеду в амбулаторном звене связано с болью в крупных суставах [1]. Изучение результатов 31516 артроскопических вмешательств по поводу повреждений и заболеваний крупных суставов показало, что в 63 % случаев имела место патология хряща различной степени [2, 3]. Консервативные методы лечения не претерпели существенных изменений в последнее время, чего не скажешь о хирургических вмешательствах. Методики стимуляции хондрогенеза и восстановления хрящевого покрова путем замещения дефекта клеточными технологиями продолжают активно развиваться [4, 5].
Попытки восстановления суставного хряща консервативными и оперативными технологиями имеют продолжительную историю. Ранние методики сводились к выполнению трансплантации суставного конца кости. В 1925 году Lexer и соавт. была описана первая такая трансплантация. Современные методы стимуляции хондрогенеза берут свое начало от техники туннелизации зоны дефекта суставного хряща, предложенной Pridie [6], которую в дальнейшем развил Ficat под названием спонгиализация. Суть методики состоит в удалении поврежденного хряща с субхондральной костью для обеспечения выхода мезенхимальных стволовых клеток из губчатой кости с последующей дифференцировкой их в фиброзную ткань и замещением дефекта. Gross и соавт. предложили концепцию аллотрансплантации свежих костно - хрящевых блоков [7], а L. Peterson первым выполнил имплантацию культивированных хондроцитов первого поколения в эксперименте [8]. Сегодня известны разнообразные хирургические техники, направленные на лечение повреждений суставного хряща, однако все они берут свое начало именно от этих трех методов.
В данной статье проведен обзор литературных источников, касающихся современных методов лечения повреждений суставного хряща.
Стимуляция костного мозга
Суть данного метода заключается в обеспечении доступа к клеткам, содержащимся в костном мозге, и их перемещение в дефект с целью улучшения регенерации хряща. Туннелизация, абразивная артропластика, спонгиализация и микрофрактурирование позволяют добиться кровоизлияния и последующего
формирования фибринового сгустка, который должен покрыть локальный дефект гиалинового хряща. Элементы костного мозга, такие как мезенхимальные стволовые клетки (MSC), лейкоциты и факторы роста способствуют трансформации фибринового сгустка в хрящеподобную фиброзную ткань [4]. Механические и биохимические свойства такой ткани индивидуальны, а вопрос о возможности противостояния различным нагрузкам на сустав остается открытым.
Туннелизация . Pridie K. сообщал об эффективности множественного просверливания дефекта суставного хряща спицей Киршнера. Результатом операции считалось выраженное кровотечение из спонгиозной кости с возможным образованием на месте дефекта хрящеподобной фиброзной ткани. Несмотря на то, что метод разработан более 50 лет назад, он и сегодня используется во время артроскопических вмешательств на крупных суставах. Так, Малюк Б.В. в своей кандидатской диссертации на тему “Остеоперфорации субхондральной кости при рассекающем остеохондрите мыщелков бедра коленного сустава” говорит о том, что глубокая туннелизация дефекта коленного сустава позволяет добиться сбалансированного процесса остео- и хондрорегенерации, тем самым позволяя покрыть дефект хряща [9]. Некоторые авторы считают, что показанием к туннелизации являются повреждения хряща на фоне рассекающего остеохондрита или локального идиопатического остеонекроза. При этом выполняется удаление поврежденных костно-хрящевых фрагментов и глубокое просверливание области дефекта спицей (диаметром 1,5–2 мм) или тонким сверлом (диаметром 2,5–3,5 мм) до появления кровоизлияний (рис. 1) [10]. К явным недо статкам туннелизации следует отнести возникновение ожога прилегающих тканей при некорректном сверлении, что приводит к минимализации кровотечения из субхондральной кости, а также препятствует формированию полноценной и стабильной хрящеподобной фиброзной ткани.
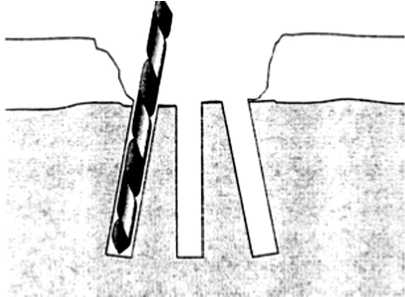
Рис. 1. Метод туннелизации локального хрящевого дефекта
Абразивная артропластика. Изначально идея заключалась в обработке поврежденного участка хряща и подлежащей кортикальной пластинки бором диаметром 1–2 мм до появления кровоизлияния с обязательным сохранением целостности субхондральной кости (рис. 2). В дальнейшем эту методику модифицировали до более глубокой краевой резекции кортикальной кости, вплоть до спонгиозной. Авторы считают, что использование методики позволяет добиться ремиссии деградации хряща сроком до 5 лет у 70 % пациентов с лучшими результатами у молодых людей [11]. К преимуществам абразии относят равномерное образование регенерата и лучшее восстановление формы суставной поверхности по сравнению с тунне-лизацией [12]. Недостатком метода, как и туннелиза-ции, является нестабильность образованной ткани и неспособность адекватно противостоять нагрузкам на суставную поверхность хряща [13].
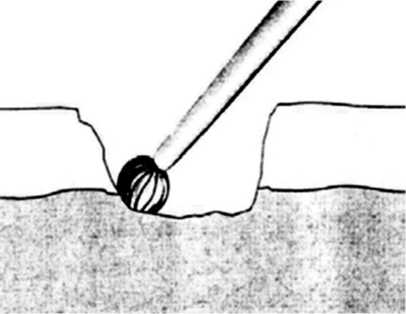
Рис. 2. Абразивная артропластика
Спонгиализация . Принцип заключается в санации дефекта хряща и удалении тканей вместе с субхондральной костью вплоть до губчатой (рис. 3). Автор метода сообщал о 79 % положительных результатах через 2 года, однако подобного положительного результата не удалось получить в других исследованиях. К недостаткам, обусловленным избыточной глубиной резекции, относятся неполноценное покрытие дефекта и короткий период ремиссии [14].
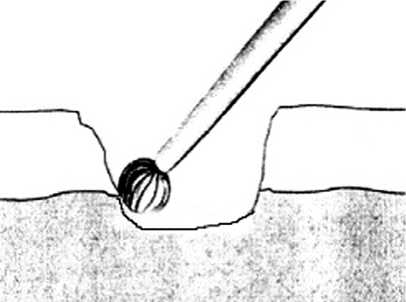
Рис. 3. Спонгиализация
Микрофрактурирование . Первым сообщил о положительном влиянии микропереломов на восстановление локальных дефектов суставного хряща Steadman в 1997 году. В дефекте хряща специальным шилом производят микропереломы субхондральной кости на глубину 4–5 мм в количестве 3–4 на 1 см² до появления геморрагий (рис. 4). Преимуществами метода является отсутствие ожогов, сохранение достаточного количества субхондральной кости и легкость исполнения во время артроскопии [15]. Сегодня микрофрактурирование продолжает с успехом использоваться при дефектах хряща [16]. При этом нет однозначного мнения по поводу максимального размера дефекта для применения указанного метода.
Steadman сообщал о хороших результатах при обширных дефектах хряща более 4 см² [14]. Однако Knutsen и соавт. получили неудовлетворительные результаты при таком же размере повреждения [17]. Ряд авторов все же отрицательно высказываются о необходимости выполнения микрофрактурирования, считая, что образующаяся хрящеподобная фиброзная ткань неустойчива к нагрузкам и довольно быстро лизируется [18].
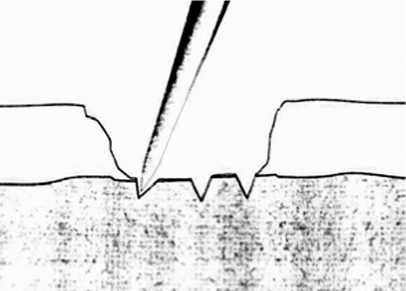
Рис. 4. Микрофрактурирование
Необходимо отметить, что упомянутые варианты стимуляции костного мозга позволяют получить хорошие результаты, но лишь на короткий период времени [11, 12].
Несмотря на то, что методики стимуляции костного мозга предложены более полувека назад, они остаются актуальными и сегодня ввиду легкости их выполнения и дешевизны. Мы считаем целесообразным использование метода микрофрактурирования при дефекте гиалинового хряща коленного сустава до 4 см² во время выполнения артроскопического вмешательства.
Методики восстановления хрящевого покрова
Сегодня разработаны, описаны, внедрены и продолжают активно развиваться методы пересадки алло– и аутоостеохондральных блоков, надкостницы и клеточные технологии, разные по содержанию и объёму хирургического вмешательства.
Пересадка костно-хрящевых аллотрансплантатов . Как правило, используются 2 вида трансплантатов – свежезаготовленные и замороженные. A. Gross в 1975 году первым выполнил трансплантацию “свежих” костно-хрящевых блоков при больших дефектах хряща коленного сустава, взятых от трупов не позднее 12 часов после смерти донора [7]. В 2008 году он же сообщил о 25-летней выживаемости выполненной трансплантации [19]. Сегодня показанием к подобной аллопластике могут быть костно-хрящевые дефекты диаметром более 3 см². Преимуществом указанной методики, бесспорно, является пересадка жизнеспособного, зрелого гиалинового хряща, который полностью восстанавливает анатомию и функцию сустава [20]. К недостаткам необходимо отнести ожидаемую конфликтную иммунологическую реакцию отторжения трансплантата и возможность передачи трансмиссивных заболеваний [21].
В некоторых исследованиях продолжительность хранения извлеченных костно-хрящевых блоков достигает 28 дней, что приводит к возможности создания банка костно-хрящевых блоков. W. Pearsall сообщает о 76 % хороших результатов в течение 4 лет после трансплантации замороженных блоков, а риск передачи трансмиссивных заболеваний и иммунологических реакций уменьшается [3]. Некоторые авторы считают, что консервированные или замороженные трансплантаты теряют пластичность, их белки денатурируют, и наблюдается гибель клеточных элементов [22]. По этой причине предпочтение может отдаваться использованию свежих трансплантатов [22].
Пересадка костно-хрящевых аутотрансплантатов. В 1992 году Hangodi L. опубликовал методику артроскопической аутотрансплантации костно-хрящевых блоков цилиндрической формы диаметром 4,5 мм, взятых из ненагружаемых зон мыщелков бедра. К преимуществам “мозаичной” аутохондропластики относится возможность полного закрытия дефекта и повышенная выживаемость гиалинового хряща с сохранением его истинной морфологической структуры. Данный метод пользуется большой популярностью ввиду получения хороших клинических результатов [23, 24, 25]. Тем не менее, некоторые авторы негативно высказываются о “мозаичной” аутохондропластике, сообщая о наличии таких недостатков как появление болезненности в донорской зоне, отсутствие надежной интеграции пересаженного блока и невозможности покрытия больших дефектов, частичный лизис с трансформацией трансплантатов в фиброзную ткань [11, 15]. Интересной представляется работа S. Ulstein [16], который, сравнивая результаты аутохондропластики с результатами микрофрактурирования, не увидел существенной разницы. Появились сообщения о хороших результатах аутотрансплантации блоков из проксимального тибио-фибулярного сочленения [26].
Пересадка надкостницы . Надкостница содержит в себе клетки с потенциалом для регенерации костной и хрящевой ткани. Она условно представляет собой матрицу для доставки факторов роста и их источником. Указанные условия позволяют использовать надкостницу в качестве материала для замещения дефектов гиалинового хряща. O’Driscoll впервые в эксперименте на животных показал, что надкостница может продуцировать хондроциты и, тем самым, служить источником восстановления дефектов гиалинового хряща. В дальнейшем подобные результаты нашли подтверждение у других авторов [27]. Сегодня нет единого мнения относительно положения и ориентации надкостницы в ложе дефекта. O’Driscoll и Fitzsimmons [28] считают, что камбиальный слой должен быть обращен в сторону суставной щели. Olivos-Meza A. сообщает о хороших результатах применения данного метода в сочетании с использованием факторов роста, особенно, при лечении дефектов гиалинового хряща надколенника [29]. Большинство авторов считают, что, несмотря на хорошие ранние результаты пересадки надкостницы, отдаленные результаты неудовлетворительны в связи с кальцификацией и секвестрацией трансплантата [30].
Трансплантация аутологичных хондроцитов (ACI). В 1994 г. шведские ученые Brittberg и Lindahl опубликовали результаты клинического применения ACI при лечении посттравматических дефектов гиалинового хряща коленного сустава [31]. Методика предполагает в обязательном порядке две этапные операции: 1) забор 200–300 мг хряща из ненагружаемой поверхности сустава, культивирование хондроцитов в течение 4–6 недель; 2) введение хондроцитов под закрытый надкостничным лоскутом дефект [12, 32]. Описанная техника является классической, используется при дефектах более 2,5 см², и, по данным ряда авторов, хорошие результаты наблюдаются у 80 % пациентов в течение 10 лет после операции [31]. К недостаткам относят высокий риск развития периостальной гипертрофии и артрофиброза, требующих ревизионных и мобилизирующих сустав вмешательств [32].
Ввиду описанных выше недостатков вместо аутонадкостницы для закрытия дефекта предпочтительно стали использовать разнообразные инертные коллагеновые мембраны [4, 33]. Второе поколение оперативных методик ACI включает дебридмент дефекта, закрытие его коллагеновой мембраной, подшиваемой викрилом к краям сохранного хряща, и герметизацию зоны дефекта фибриновым клеем. Хондроциты вводят шприцом под мембрану. Данный метод позволил получить хорошие результаты, однако осталась проблема неравномерного распределения хондроцитов в дефекте [11].
В 2012 году предложено третье поколение методик ACI, базирующихся на использовании биологических матриц. Последние способствуют поддержанию дифференцированного фенотипа хондроцитов и правильному распределению их в дефекте [34]. Биологические матрицы позволили исключить использование артротомии и выполнять все манипуляции артроскопически [35]. Тем не менее, результаты лечения пациентов с использованием 1 и 2 поколения методики ACI не имеют значимых отличий от исходов операций 3-го поколения [36].
Индуцированный матрицей аутогенный хондрогенез (AMIC). Операции AMIC выполняются с использованием матрицы, состоящей из свиного коллагена I и III типов. Такие матрицы состоят из двух слоев: первый слой – плотный, второй – пористый. Плотный слой выполняет защитную функцию, препятствуя выходу стволовых клеток за пределы мембраны. Пористый слой, обращенный в сторону субхондральной кости, способствует хондрогенезу [37]. Фиксация матрицы может осуществляться как швами, так и фибриновым клеем. К преимуществам данной методики относится одноэтапность операции без предварительного забора хряща и экономическая целесообразность, ввиду отсутствия необходимости в культивировании хондроцитов [38]. Сегодня многие авторы сообщают о лучших результатах методики AMIC при сравнении с методиками ACI 1 и 2 поколений [39, 40]. По данным Ferruzzi и соавторов, методика AMIC позволяет добиться лучших результатов в сравнении с артроскопической методикой ACI 3-го поколения. При этом отмечается высокий уровень результативности в обоих случаях. По данным одного из университетов Бельгии, AMIC показывают лучшие результаты при поражении пателло-феморального сочленения [41].
Мезенхимальные стволовые клетки (MSC) . Некоторые авторы считают, что мезенхимальные стволовые клетки являются хорошей альтернативой ACI и AMIC [38, 42]. Клетки выделяют из костного мозга, синовиальных оболочек, периоста, жировой ткани и под воздействием различных факторов направляют их дальнейшую дифференциацию в сторону хондрогенеза [43, 44]. В экспериментальных исследованиях на животных и клинических наблюдениях доказан высокий потенциал этих клеток в концепции хондрогенеза [45]. MSC вводятся в сустав при наличии дефекта хряща на какой-либо матрице либо в виде инъекций при дегенеративном заболевании [44, 46]. По данным некоторых авторов, внутрисуставное введение мезенхимальных стволовых клеток при гонартрозе позволяет добиться хороших пролонгированных клинических результатов в сроки от 12 до 27 месяцев [47]. Появляются сообщения об успешном применении хондроцитов, полученных из мезенхимальных стволовых клеток, для восполнения локальных дефектов хряща различных размеров [48, 49]. Высокая эффективность применения MSC не исключает и целый ряд недостатков, связанных с возможностью неконтролируемой экспрессии различных генов в организме, которые могут иметь непредсказуемые последствия, и высокой ценой метода [50].
ЗАКЛЮЧЕНИЕ
Несомненно, что наиболее распространенным методом лечения дефектов гиалинового хряща коленного сустава является мозаичная аутохондропластика. Мы считаем, что данная технология эффективна при дефекте хряща более 4 см², однако необходимо отметить, что, по нашим данным, около 10 % пациентов отмечают болевой синдром в области донорских участков. Сегодня активно развиваются технологии хондрогенеза с использованием покровных мембран и специализированных матриц для заполнения дефектов гиалинового хряща. Последние поколения таких методик показывают хорошие отдаленные результаты, однако дороговизна и сложность выполнения не позволяют внедрить эти технологии повсеместно. Использование клеточных технологий, по нашему мнению, несет в себе высокий риск аутоиммунных реакций и требует дальнейшего исследования.
Методы хирургического лечения дефектов гиалинового хряща продолжают активно развиваться, однако последующие поколения технологий имеют все более высокую стоимость. Учитывая экономическую целесообразность и хорошие клинические результаты, не стоит отказываться от таких уже классических методов как микрофракту-рирование или мозаичная аутохондропластика.
Список литературы Методы хирургического лечения локальных дефектов гиалинового хряща крупных суставов (обзор литературы)
- Бейдик О.В., Левченко К.К., Киреев С.И. Артроскопия коленного сустава. Перспективы развития//Сборник тезисов VIII съезда травматологов-ортопедов России: в 2 т. Самара, 2006. Т. 1. С. 139-140.
- Cartilage injuries: a review of 31,516 knee arthroscopies/W.W. Curl, J. Krome, E.S. Gordon, J. Rushing, B.P. Smith, G.G. Poehling//Arthroscopy. 1997. Vol. 13, N 4. P. 456-460.
- Pearsall A. IV, Madanagopal S., Tucker J. The Evaluation of Refrigerated and Frozen Osteochondral Allografts in the Knee//Surgical Science. 2011. Vol. 2, N 5. P. 232-241 DOI: 10.4236/ss.2011.25052
- Божокин М.С., Божкова С.А., Нетылько Г.И. Возможности современных клеточных технологий для восстановления поврежденного суставного хряща (аналитический обзор литературы)//Травматология и ортопедия России. 2016. № 3. С. 122-134.
- Винокуров В.А., Норкин И.А. Хирургическая коррекция деформации коленного сустава и регенерация гиалинового хряща//Ортопедия, травматология и восстановительная хирургия детского возраста. 2015. Т. 3, № 4. С. 37-43.
- Pridie K.H. A method of resurfacing osteoarthritic knee joints. J. Bone Joint Surg. Br. 1959. Vol. 41. P. 618-619.
- Allotransplantation of partial joints in the treatment of osteoarthritis of the knee/A.E. Gross, F. Langer, J. Houpt, K. Pritzker, G. Friedlaender//Transplant. Proc. 1976. Vol. 8, N 2 Suppl. P. 129-132.
- Muller S., Breederveld R.S., Tuinebreijer W.E. Results of osteochondral autologous transplantation in the knee//Open Orthop. J. 2010. Vol. 4. P. 111-114 DOI: 10.2174/1874325001004020111
- Малюк Б.В. Остеоперфорации субхондральной кости при рассекающем остеохондрите мыщелков бедра коленного сустава: автореф. дис. … канд. мед. наук. Минск, 2014. С. 15-16.
- Экспериментальные аспекты изучения репаративной регенерации суставного хряща в условиях туннелирования субхондральной зоны с введением аутологичного костного мозга/В.И. Шевцов, В.Д. Макушин, Т.А. Ступина, М.А. Степанов//Гений ортопедии. 2010. № 2. С. 5-10.
- MACI -a new era?/M. Jacobi, V. Villa, R.A. Magnussen, P. Neyret//Sports Med. Arthrosc. Rehabil. Ther. Technol. 2011. Vol. 3, N 1. P. 10 DOI: 10.1186/1758-2555-3-10
- Articular cartilage: structure and regeneration/J. Becerra, J.A. Andrades, E. Guerado, P. Zamora-Navas, J.M. López-Puertas, A.H. Reddi//Tissue Eng. Part B Rev. 2010. Vol. 16, N 6. P. 617-627 DOI: 10.1089/ten.TEB.2010.0191
- Autologous chondrocyte implantation: an overview of technique and outcomes/L. Batty, S. Dance, S. Bajaj, B.J. Cole//ANZ J. Surg. 2011. Vol. 81, N 1-2. P. 18-25 DOI: 10.1111/j.1445-2197.2010.05495.x
- Outcomes of microfracture for traumatic chondral defects of the knee: average 11-year follow-up/J.R. Steadman, K.K. Briggs, J.J. Rodrigo, M.S. Kocher, T.J. Gill, W.G. Rodkey//Arthroscopy. 2003. Vol. 19, N 5. P. 477-484 DOI: 10.1053/jars.2003.50112
- Is microfracture of chondral defects in the knee associated with different results in patients aged 40 years or younger?/P.C. Kreuz, C. Erggelet, M.R. Steinwachs, S.J. Krause, A. Lahm, P. Niemeyer, N. Ghanem, M. Uhl, N. Südkamp//Arthroscopy. 2006. Vol. 22, N 11. P. 1180-1186 DOI: 10.1016/j.arthro.2006.06.020
- Microfracture technique versus osteochondral autologous transplantation mosaicplasty in patients with articular chondral lesions of the knee: a prospective randomized trial with long-term follow-up/S. Ulstein, A. Årøen, J.H. Røtterud, S. Løken, L. Engebretsen, S. Heir//Knee Surg. Sports Traumatol. Arthrosc. 2014. Vol. 22, N 6. P. 1207-1215 DOI: 10.1007/s00167-014-2843-6
- Autologous chondrocyte implantation compared with microfracture in the knee. A randomized trial/G. Knutsen, L. Engebretsen, T.C. Ludvigsen, J.O. Drogset, T. Grøntvedt, E. Solheim, T. Strand, S. Roberts, V. Isaksen, O. Johansen//J. Bone Joint Surg. Am. 2004. Vol. 86-A, N 3. P. 455-464.
- The extent of matrix damage and chondrocyte death in mechanically traumatized articular cartilage explants depends on rate of loading/B.J. Ewers, D. Dvoracek-Driksna, M.W. Orth, R.C. Haut//J. Orthop. Res. 2001. Vol. 19, N 5. P. 779-784 DOI: 10.1016/S0736-0266(01)00006-7
- Fresh osteochondral allografts for posttraumatic knee defects: long-term followup/A.E. Gross, W. Kim, F. Las Heras, D. Backstein, O. Safir, K.P. Pritzker//Clin. Orthop. Relat. Res. 2008. Vol. 466, N 8. P. 1863-1870 DOI: 10.1007/s11999-008-0282-8
- Do fresh osteochondral allografts successfully treat femoral condyle lesions?/Y.D. Levy, S. Görtz, P.A. Pulido, J.C. McCauley, W.D. Bugbee//Clin. Orthop. Relat. Res. 2013. Vol. 471, N 1. P. 231-237 DOI: 10.1007/s11999-012-2556-4
- Demange M., Gomoll A.H. The use of osteochondral allografts in the management of cartilage defects//Curr. Rev. Musculoskelet. Med. 2012. Vol. 5, N 3. P. 229-235 DOI: 10.1007/s12178-012-9132-0
- Fresh stored allografts for the treatment of osteochondral defects of the knee/R.J. Williams 3rd, A.S. Ranawat, H.G. Potter, T. Carter, R.F. Warren//J. Bone Joint Surg. Am. 2007. Vol. 89, N 4. P. 718-726 DOI: 10.2106/JBJS.F.00625
- Clinical experiences with autologous osteochondral mosaicplasty in an athletic population: a 17-year prospective multicenter study/L. Hangody, J. Dobos, E. Baló, G. Pánics, L.R. Hangody, I. Berkes//Am. J. Sports Med. 2010. Vol. 38, N 6. P. 1125-1133 DOI: 10.1177/0363546509360405
- Osteochondral autografting (mosaicplasty) in articular cartilage defects in the knee: results at 5 to 9 years/E. Solheim, J. Hegna, J. Oyen, O.K. Austgulen, T. Harlem, T. Strand//Knee. 2010. Vol. 17, N 1. P. 84-87 DOI: 10.1016/j.knee.2009.07.007
- Results at 10 to 14 years after osteochondral autografting (mosaicplasty) in articular cartilage defects in the knee/E. Solheim, J. Hegna, J. Oyen, O.K. Austgulen, T. Harlem, T. Strand//Knee. 2013. Vol. 20, N 4. P. 287-290 DOI: 10.1016/j.knee.2013.01.001
- Osteochondral transplantation using autografts from the upper tibiofibular joint for the treatment of knee cartilage lesions/J. Espregueira-Mendes, H. Pereira, H. Sevivas, P. Varanda, M.V. da Silva, A. Monteiro, J.M. Oliveira, R.L. Reis//Knee Surg. Sports Traumatol. Arthrosc. 2012. Vol. 20, N 6. P. 1136-1142 DOI: 10.1007/s00167-012-1910-0
- Transplantation of free tibial periosteal grafts for the repair of articular cartilage defect: An experimental study/R. Singh, V. Chauhan, N. Chauhan, S. Sharma//Indian J. Orthop. 2009. Vol. 43, N 4. P. 335-41 DOI: 10.4103/0019-5413.55973
- O'Driscoll S.W., Fitzsimmons J.S. The role of periosteum in cartilage repair//Clin. Orthop. Relat. Res. 2001. N 391 Suppl. P. S190-S207.
- Pretreatment of periosteum with TGF-beta1 in situ enhances the quality of osteochondral tissue regenerated from transplanted periosteal grafts in adult rabbits/A. Olivos-Meza, J.S. Fitzsimmons, M.E. Casper, Q. Chen, K.N. An, T.J. Ruesink, S.W. O’Driscoll, G.G. Reinholz//Osteoarthritis Cartilage. 2010. Vol. 18, N 9. P. 1183-1191 DOI: 10.1016/j.joca.2010.06.003
- Smith G.D., Knutsen G., Richardson J.B. A clinical review of cartilage repair techniques//J. Bone Joint Surg. Br. 2005. Vol. 87, N 4. P. 445-449 DOI: 10.1302/0301-620X.87B4.15971
- Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation/M. Brittberg, A. Lindahl, A. Nilsson, C. Ohlsson, O. Isaksson, L. Peterson//N. Engl. J. Med. 1994. Vol. 331, N 14. P. 889-895 DOI: 10.1056/NEJM199410063311401
- Козадаев М.Н. Применение матриц на основе поликапролактона для стимуляции регенерации суставного хряща в условиях эксперимента//Теоретические и прикладные аспекты современной науки. 2014. № 3-2. С. 128-130.
- Нерешённые вопросы регенерации хрящевой и костной ткани (обзорно-аналитическая статья)/М.Ю. Ежов, И.Ю. Ежов, А.К. Кашко, А.Ю. Каюмов, А.А. Зыкин, С.А. Герасимов//Успехи современ. естествознания. 2015. № 5. С. 126-131.
- Redifferentiation of dedifferentiated human articular chondrocytes: comparison of 2D and 3D cultures/M.M. Caron, P.J. Emans, M.M. Coolsen, L. Voss, D.A. Surtel, A. Cremers, L.W. van Rhijn, T.J. Welting//Osteoarthritis Cartilage. 2012. Vol. 20, N 10. P. 1170-1178 DOI: 10.1016/j.joca.2012.06.016
- Autologous chondrocyte implantation the knee using fibrin/M.K. Kim, S.W. Choi, S.R. Kim, I.S. Oh, M.H. Won//Knee Surg. Sports Traumatol. Arthrosc. 2010. Vol. 18, N 4. P. 528-534 DOI: 10.1007/s00167-009-0905-y
- Clinical application of scaffolds for cartilage tissue engineering/J. Iwasa, L. Engebretsen, Y. Shima, M. Ochi//Knee Surg. Sports Traumatol. Arthrosc. 2009. Vol. 17, N 6. P. 561-577 DOI: 10.1007/s00167-008-0663-2
- Benthien J.P., Behrens P. Autologous matrix-induced chondrogenesis (AMIC): combining microfracturing and a collagen I/II matrix for articular Cartilage resurfacing//Cartilage. 2010. Vol. 1, N 1. P. 65-68 DOI: 10.1177/1947603509360044
- Khan W.S., Johnson D.S., Hardingham T.E. The potential of stem cells in the treatment of knee cartilage defects//Knee. 2010. Vol. 17, N 6. P. 369-374 DOI: 10.1016/j.knee.2009.12.003
- Autologous chondrocyte implantation using the original periosteum-cover technique versus matrix-associated autologous chondrocyte implantation: a randomised clinical trial/F. Zeifang, D. Oberle, C. Nierhoff, W. Richter, B. Moradi, H. Schmitt//Am. J. Sports Med. 2010. Vol. 38, N 5. P. 924-933.
- Evaluation of cartilage repair tissue after matrix-associated autologous chondrocyte transplantation using a hyaluronic-based or a collagen based scaffold with morphological MOCART scoring and biochemical T2 mapping: preliminary results/G.H. Welsch, T.C. Mamisch, L. Zak, M. Blanke, A. Olk, S. Marlovits, S. Trattnig//Am. J. Sports Med. 2010. Vol. 38, N 5. P. 934-942 DOI: 10.1177/0363546509354971
- Treatment of patellofemoral cartilage defects in the knee by autologous matrix-induced chondrogenesis (AMIC)/A. Dhollander, K. Moens, J. van der Maas, P. Verdonk, K.F. Almqvist, J. Victor//Acta Orthop. Belg. 2014. Vol. 80, N 2. P. 251-259.
- Перспективы использования мультипотентных мезенхимных стромальных клеток костного мозга и жировой ткани в регуляции регенерации опорных тканей/А.С. Тепляшин, С.З. Шарифуллина, Н.И. Чупикова, Р.И. Сепиашвили//Аллергология и иммунология. 2015. Т. 16, № 1. С. 138-148.
- Демжанова Г., Каржауов М.Р., Сарсенова М.А. Комбинированное влияние мезенхимальных стволовых клеток, гиалуроновой кислоты и ростовых факторов tgf-β1 и bmp-4 на регенерацию дефектов хряща у кроликов//Материалы 54-й Международной научной студенческой конференции МНСК-2016. Новосибирск, 2016. С. 24.
- Sources of adult mesenchymal stem cells applicable for musculoskeletal applications -a systematic review of the literature/R. Mafi, S. Hindocha, P. Mafi, M. Griffin, W.S. Khan//Open Orthop. J. 2011. Vol. 5, N Suppl. 2. P. 242-248 DOI: 10.2174/1874325001105010242
- Аутотрансплантация мезенхимальных стволовых клеток для регенеративного восстановления повреждений суставного хряща (экспериментальное исследование)/Д.В. Букач, А.В. Белецкий, О.Л. Эйсмонт, М.Т. Мохаммади, Я.И. Исайкина//Весцi Нацыянальнай акадэмii навук Беларусi. Серыя медыцынскiх навук. 2015. № 1. С. 5-11.
- Mesenchymal stem cells display different gene expression profiles compared to hyaline and elastic chondrocytes/L.J. Zhai, K.Q. Zhao, Z.Q. Wang, Y. Feng, S.C. Xing//Int. J. Clin. Exp. Med. 2011. Vol. 4, N 1. P. 81-90.
- Tanaka Y. Human mesenchymal stem cells as a tool for joint repair in rheumatoid arthritis//Clin. Exp. Rheumatol. 2015. Vol. 33, N 4 Suppl. 92. P. S58-S62.
- Assessment of clinical and MRI outcomes after mesenchymal stem cell implantation in patients with knee osteoarthritis: a prospective study/Y.S. Kim, Y.J. Choi, S.W. Lee, O.R. Kwon, D.S. Suh, D.B. Heo, Y.G. Koh//Osteoarthritis Cartilage. 2016. Vol. 24, N 2. P. 237-245 DOI: 10.1016/j.joca.2015.08.009
- Adipose-derived mesenchymal stem cells with microfracture versus microfracture alone: 2-year follow-up of a prospective randomized trial/Y.G. Koh, O.R. Kwon, Y.S. Kim, Y.J. Choi, D.H. Tak//Arthroscopy. 2016. Vol. 32, N 1. P. 97-109 DOI: 10.1016/j.arthro.2015.09.010
- Tan Q., Lui P.P., Rui Y.F. Effect of in vitro passaging on the stem cell-related properties of tendon-derived stem cells-implications in tissue engineering//Stem Cells Dev. 2012. Vol. 21, N 5. P. 790-800 DOI: 10.1089/scd.2011.0160


