Методы санитарного контроля животноводческой продукции. Сообщение VI. Иммуноферментный анализ левомицетина
Автор: Буркин М.А., Кононенко Г.П., Буркин А.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Корма и кормопроизводство: биологические основы
Статья в выпуске: 4 т.47, 2012 года.
Бесплатный доступ
Оптимизированы условия непрямого иммуноферментного анализа (ИФА) на основе поликлональных кроличьих антител, полученных к конъюгату сукцината левомицетина с бычьим сывороточным альбумином. Чувствительность определения левомицетина с твердофазными антигенами, гетерологичными иммуногену по белковому носителю (яичный альбумин, кроличий сывороточный альбумин и желатин), составила 0,1 нг/мл. Обсуждается возможность применения разработанных иммуноферментных тест-систем для контроля за остатками левомицетина в молоке, мясе и яйцах.
Левомицетин, молоко, мясо, яйца, иммуноанализ
Короткий адрес: https://sciup.org/142133321
IDR: 142133321 | УДК: 636/639:614.31
Текст научной статьи Методы санитарного контроля животноводческой продукции. Сообщение VI. Иммуноферментный анализ левомицетина
Антибиотик левомицетин (ЛМ) (или хлорамфеникол) уже многие годы широко используется в России в составе ветеринарных препаратов (1). По данным отечественных исследователей, контроль его остаточного содержания в молоке и мясе можно осуществлять методом непрямого твердофазного конкурентного иммуноферментного анализа (ИФА) при условии надежного устранения матричных эффектов, например посредством введения 1 % казеина в буферные растворы или разбавления образца (2, 3). В настоящее время проблема снижения порогов чувствительности при определении ЛМ становится особенно актуальной, поскольку с 2012 года допустимая норма для его содержания в продукции снижена с 10 мкг/кг до 0,3 мкг/кг (4).
Целью нашего исследования была разработка высокочувствительного приема непрямого твердофазного конкурентного иммуноферментного анализа, соответствующего современным требованиям контроля остаточных количеств левомицетина в основных видах животноводческой продукции.
Методика. В работе использовали хлорамфеникол (C-0378), хлорамфеникол основание (C-0135), натриевую соль сукцината хлорамфеникола (C-3787), глюкуронид хлорамфеникола (C-9899), N-гидроксисукцинимид (H-7377), водорастворимый карбодиимид (Е-7750), полный адъювант Фрейнда (F-5881) («Sigma», США), сухое обезжиренное молоко (СМ, # 70166, «Fluka», Германия), бычий сывороточный альбумин (БСА), кроличий сывороточный альбумин (КСА), яичный альбумин (ЯА), желатин (Жел) отечественного производства. Антивидовой ферментный конъюгат получали из пероксидазы хрена (КФ 1.11.1.7) и антисыворотки осла к иммуноглобулинам кролика в соответствии с описанной методикой (5). ИФА выполняли на высокосвязывающих полистирольных планшетах (# 9018, «Co-star», США) с использованием фотометра АКИ-Ц-01 (Россия). УФ-спектры регистрировали на приборе Hitachi-557 («Hitachi», Япония). Синтез белковых конъюгатов осуществляли методом активированных эфиров с соблю- дением общей процедуры согласно G.T. Hermanson (6).
Для получения конъюгатов альбуминов с 25- и 50-кратными избытками ЛМ - БСА-ЛМ(25), БСА-ЛМ(50), КСА-ЛМ(25), КСА-ЛМ(50), ЯА-ЛМ(25), ЯА-ЛМ(50) к раствору, содержащему 8 мг ( ~ 18 мкмоль) сукцината ЛМ в 0,5 мл диметилформамида, добавляли 4 мг ( ~ 36 мкмоль) N-гидроксисукцинимида и 3,5 мг ( ~ 18 мкмоль) водорастворимого карбодиимида и перемешивали при комнатной температуре в течение 1 ч. Затем эту смесь в соответствующей пропорции приливали к растворам 7,0 мг БСА, 6,5 мг КСА, 4 мг ЯА (0,1 мкмоль каждого) в 0,5 мл карбонатного буфера (рН 9,6), перемешивали в течение 14 ч и диализовали. Для получения конъюгатов Жел с 5-, 10- и 25-кратными избытками ЛМ — Жел-ЛМ(5), Жел-ЛМ(10) и Жел-ЛМ(25) к 3 мг (6,7 мкмоль) сукцината ЛМ добавляли 1,15 мг (10 мкмоль) N-гидроксисукцинимида и 2,9 мг (15 мкмоль) водорастворимого карбодиимида, перемешивали при комнатной температуре в течение 3 ч. Далее эту смесь в соответствующей пропорции вносили каплями в раствор желатина (8 мг в 1,5 мл карбонатного буфера, рН 9,6), перемешивали 1 ч при комнатной температуре и в течение ночи при 4 ° С, затем диализовали. Диализ выполняли против трех смен 1000-кратного объема 0,5 % раствора хлористого натрия в течение 2 сут, после чего к продуктам реакций приливали равные объемы глицерина и хранили при - 10... - 15 ° С.
Процедуры иммунизации кроликов, тестирования антисывороток и выполнения ИФА не отличались от описанных нами ранее (7). Рабочий раствор ЛМ для конкурентного анализа готовили разбавлением в ацетонитриле исходного раствора антибиотика, проверенного спектрофотометрически (С = 20 мкг/мл, X = 274±1 нм; s = 9156±245, n = 3). Градуировочные графики в координатах «степень связывания антител-концентра-ция раствора ЛМ» ( n = 10) получали в условиях промежуточной прецизионности ежедневно или с интервалом 1-2 сут. Для проверки идентичности и индивидуальности ЛМ и сукцината ЛМ использовали спектрофотометрию и тонкослойную хроматографию на пластинках Силуфол UV 254 (Чехия) в подвижной фазе хлороформ:метанол (9:1).
Исследовали образцы мышечной ткани и внутренние органы (сердце, печень) у кур. Одной особи (живая масса 1,44 кг) зондом в пищевод вводили раствор 300 мг сукцината ЛМ в 25 мл воды двумя равными порциями с интервалом 24 ч, другой (контрольной, живая масса 1,50 кг) — одновременно такие же порции воды. Через 5 ч после второго введения кур декапитировали, отбирали пробы, образцы гомогенизировали и хранили в морозильнике до анализа. Кроме того, объектами исследования были пробы молока, мяса и яиц из торговой сети г. Москвы. Подготовку проб для анализа выполняли, как описано ранее (8, 9).
Данные приведены со средними стандартными отклонениями.
Результаты . Идентичность и индивидуальность ЛМ и сукцината ЛМ, использованных в работе, была подтверждена спектрометрическим анализом и тонкослойной хроматографией. Значения хроматографической подвижности (R f ) для ЛМ и сукцината ЛМ составили соответственно 0,3 и 0,4. УФ-спектры имели максимумы УФ-поглощения и значения удельного поглощения, близкие к описанным (10).
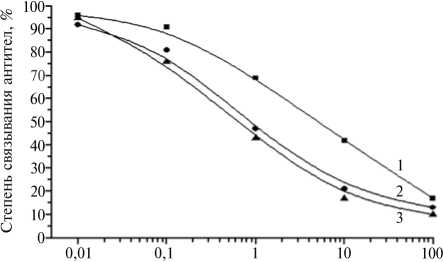
Выбранный для иммунизации конъюгат БСА-ЛМ(50) уже после 2-го введения (при 1-м отборе крови) обеспечил получение антител с рабочим титром 1:25 000, который возрос до 1:50 000 при двух последующих отборах. Дальнейшая динамика иммунного ответа носила плавный харак- тер (рис. 1). Антисыворотки от 5-7-го отбора крови по результатам тести рования не различались.
Концентрация ЛМ, нг/мл
Рис. 1. Степень связывания антител к БСА-ЛМ(50), полученных при 2-м (1) , 4-м (2) и 5-7-м (3) отборах крови, с твердофазным антигеном Жел-ЛМ(5) в присутствии ЛМ в буфере ФСБ-т : БСА, Жел, ЛМ - бычий сывороточный альбумин, желатин, левомицетин; ФСБ-т — фосфатно-солевой буферный раствор, содержащий Твин 20 (ИФА).
В конкурентном анализе с антителами от 3-го отбора крови три иммобилизо ванных конъюгата — Жел-ЛМ(5), КСА-ЛМ(25) и ЯА-ЛМ(25) превосходили все остальные твердофазные антигены (табл. 1). Использование этих конъюгатов для нанесения на твердую фазу из растворов с концентрацией 0,05 мкг/мл обеспечивало возможность определения ЛМ до концентрации 0,1 нг/мл при разведении фосфатно-солевым буфером, содержащим Твин 20 (ФСБ-т).
1. Степень связывания (%) антител к БСА-ЛМ(50) в сыворотке от 3-го отбора крови с различными иммобилизованными антигенами в присутствии ЛМ (ИФА)
|
Иммобилизованный антиген (С = 0,05 мкг/мл) |
ЛМ, нг/мл |
||||
|
100 |
10 |
1 1 1 |
0,1 |
0,01 |
|
|
БСА-ЛМ(25) |
20 |
44 |
64 |
90 |
100 |
|
БСА-Лм(50) |
34 |
61 |
83 |
97 |
99 |
|
КСА-ЛМ(25) |
14 |
27 |
50 |
81 |
96 |
|
КСА-ЛМ(50) |
28 |
52 |
71 |
94 |
104 |
|
ЯА-ЛМ(25) |
16 |
36 |
60 |
84 |
98 |
|
ЯА-ЛМ(50) |
74 |
90 |
100 |
104 |
101 |
|
Жел-ЛМ(5) |
17 |
42 |
69 |
91 |
102 |
|
Жел-ЛМ(10) |
41 |
65 |
85 |
96 |
100 |
|
Жел-ЛМ(25) |
50 |
74 |
87 |
100 |
99 |
П р и м е ч а н и е. ЛМ, БСА, КСА, ЯА, Жел — соответственно левомицетин, бычий сывороточный альбумин, кроличий сывороточный альбумин, яичный альбумин, желатин.
Выбор иммобилизованного антигена в непрямом ИФА часто имеет решающее значение для функционирования тест-систем. Как правило, наилучшие аналитические показатели достигаются при его гетерологичности иммуногену и сниженной эпитопной плотности, как в случае Жел-ЛМ(5). Эквивалентные характеристики КСА-ЛМ(25) и ЯА-ЛМ(25) представляют собой скорее исключение: высокую чувствительность анализа обеспечивал конъюгированный антиген с почти такой же гаптенной нагрузкой, как у иммуногена, и близким по структуре альбумином, использованным в качестве белкового носителя. Попытка применения конъюгата, гетерологичного по методу синтеза, в качестве твердофазного антигена была предпринята в 1984 году американскими исследователями, однако в тест-системе с антителами к конъюгату сукцината хлорамфеникола с ге-мицианином улитки и иммобилизованным антигеном, полученным реакцией смешанных ангидридов (белковым носителем антигена служил БСА), порог чувствительности 1 нг/мл преодолеть не удалось (11).
Результаты оценки перекрестной реактивности антител в отношении производных ЛМ (табл. 2) показали более высокую степень узнавания сукцината ЛМ, что вполне ожидаемо в связи с его использованием в качестве гаптена в иммуногене. Как особо важный следует отметить тот факт, что использованная нами тест-система способна обеспечивать близкое взаимодействие с модифицированной (глюкуронид) и свободной формами ЛМ, которые, как известно, могут совместно участвовать в контаминации биологических жидкостей и тканей животных.
2. Перекрестная реактивность антител к БСА-ЛМ(50) в сыворотке от 3-го отбора крови в отношении производных ЛМ и его структурных аналогов с иммобилизованным антигеном Жел-ЛМ(5) (ИФА)
|
Вещество |
1 ИК 50 , нг/мл |
| Реактивность, % |
|
ЛМ |
0,64 |
100 |
|
Сукцинат ЛМ |
0,29 |
218 |
|
Глюкуронид ЛМ |
0,50 |
128 |
|
ЛМ основание |
492 |
0,13 |
|
Тиамфеникол |
> 1000 |
< 0,01 |
|
Флорфеникол |
> 1000 |
< 0,01 |
П р и м е ч а н и е. ЛМ, БСА, Жел — соответственно левомицетин, бычий сывороточный альбумин, же латин. ИК50 — концентрация, приводящая к 50 % торможению связывания антител.
Аналоги ЛМ, у которых в молекуле вместо нитрогруппы находится метилсульфонильная группа (тиамфеникол и флорфеникол), не узнавались антителами даже в концентрации 1000 нг/мл, то есть перекрестная реактивность у них была ниже 0,01 %. Доступные сведения о перекрестной реактивности коммерческих тест-систем, широко используемых в России для целей санитарного контроля, весьма ограничены. Например, у тест-системы Ridascreen («R-BioPharm», Германия) заявленная производителем реактивность в отношении ЛМ основания равняется 0,5 %, тиамфеникола — менее 0,05 %, к флорфениколу чувствительность отсутствует; набор ИФА-ХАФ (ЗАО «НВО Иммунотех», Россия) проявляет реактивность в отношении сукцината, составляющую 25 %, для антибиотиков из других групп этот показатель не превышает 1 % .
Таким образом, использование антисыворотки к БСА-ЛМ(50) и твердофазных конъюгатов ЯА-ЛМ(25), КСА-ЛМ(25) или Жел-ЛМ(5) позволяло определять ЛМ в растворах до концентрации 0,1 нг/мл. При многократном повторении анализа значения степени связывания антител имели относительное стандартное отклонение не более 0,05, что указывало на стабильный характер функционирования тест-системы в лабораторных условиях при обычных колебаниях внешних факторов.
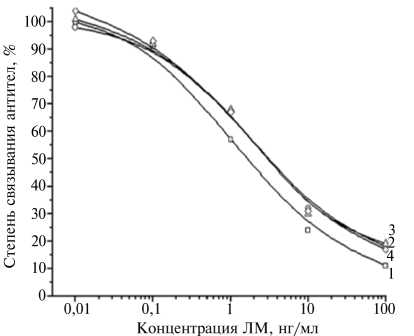
Рис. 2. Калибровочные графики ИФА ЛМ с антисывороткой к БСА-ЛМ(50) от 7-го отбора крови и твердофазным антигеном Жел-ЛМ(5) в имитаторе фона СМ при 3-кратном разбавлении ФСБ-т (1) , в смеси ацетонитрила с водой при 10-кратном разбавлении ФСБ-т (2) , в водно-ацетонит-рильных экстрактах проб мяса и яиц кур при 10-кратном разбавлении ФСБ-т (соответственно 3 и 4): ЛМ, БСА, Жел, СМ и ФСБ-т — соответственно левомицетин, бычий сывороточный альбумин, желатин, сухое молоко и фосфатно-солевой буферный раствор, содержащий Твин 20.
Внесение имитатора фона (раствор СМ в ФСБ-т) в нулевую и контрольную лунки, а также в калибровочные растворы позволяло про водить анализ молока, разведенного ФСБ-т в 3 раза (рис. 2).
Эксперименты с введением добавок ЛМ в молоко в концентрациях 0,4; 2 и 10 мкг/кг показали, что правильность определения при использо- вании предложенной нами системы в среднем составляет 104 % (табл. 3).
-
3. Результаты определения ЛМ в пробах молока с внесением разного количества антибиотика при выполнении ИФА с антисывороткой к БСА-ЛМ(50) от 7-го отбора крови и иммобилизованным антигеном Жел-ЛМ(5)
Внесено ЛМ, нг/г | Обнаружено ЛМ, нг/г ( X ± х , и = 4) Правильность определения, %
10 11,6±1,3116
2 2,13±0,30106
0,4 0,36±0,0590
П р и м е ч а н и е. ЛМ, БСА, Жел — соответственно левомицетин, бычий сывороточный альбумин, желатин.
Результаты, полученные в экспериментах по оценке показателей повторяемости и промежуточной прецизионности анализа образцов при изменении факторов «время», «оператор» и «оборудование», оказались вполне удовлетворительными. В среднем в условиях повторяемости относительное стандартное отклонение составило 0,13, в условиях промежуточной прецизионности — 0,16. Проведение анализа молока с имитатором фона и разведением средней пробы буферным раствором в 3 раза обеспечивало нижний предел измерения ЛМ, равный 0,3 мкг/кг.
Анализ 20 случайно отобранных проб сырого, пастеризованного и стерилизованного молока не выявил случаев контаминации ЛМ — степень связывания антител была равна 90 % или более. Для семи исследованных проб сухого молока этот показатель варьировал от 99 до 107 %. Однако в 2008-2009 годах с помощью ИФА-теста в ходе обследования 106 проб молока из разных регионов страны в тр е х был выявлен ЛМ в количестве 10, 12 и 26 мкг/кг (12).
За рубежом до настоящего времени продолжается дискуссия относительно выбора методов контроля остаточных количеств ЛМ в пищевых продуктах, начатая еще в 1990-е годы (13, 14). Однако уже не вызывает сомнений тот факт, что подходы, основанные на сочетании иммунотестов и хроматографического анализа, уступают ИФА по трудозатратам и стоимости. В связи с тем, что необходимый уровень обнаружения остатков ЛМ в продукции в странах Евросоюза снижен до 0,3 мкг/кг (15), в последние годы возобновлены усилия по поиску реагентов для уменьшения порога выявления указанного антибиотика в условиях ИФА (16). В Европе, США и Канаде для животных, предназначенных на пищевые цели, введен категорический запрет на применение ЛМ, поскольку он оказывает на человека специфическое и особо опасное токсическое действие — вызывает нарушение функций костного мозга и необратимую апластическую анемию. В России также продолжаются работы по улучшению аналитических свойств антител к ЛМ для смещения нижнего предела измерения его остаточных количеств до значений < 0,1 мкг/кг (17).
Исследование образцов мышечной ткани и внутренних органов кур в эксперименте по внутрижелудочному введению ЛМ подтвердило, что тест-система способна обеспечить обнаружение этого антибиотика в вод-но-ацетонитрильных экстрактах. У особи, не получавшей антибиотик (контроль), экстракты мышечной ткани после разведения буферным раствором в 10 раз не дали фоновых эффектов (см. рис. 2). Уровни загрязненности тканей после введения ЛМ (опыт) составили 635±5 мкг/кг (мясо), 330 мкг/кг (печень) и 250 мкг/кг (сердце). Через 5 ч после 2-кратного введения общей дозы, равной 200 мг/кг живой массы, остаточное количество ЛМ в мясе и внутренних органах равнялось 0,5 мг/кг, то есть составило 0,25 % от введенного.
Как было показано нами ранее, анализ мясной продукции и яиц на содержание антибиотиков, в частности бацитрацина и гентамицина, можно проводить после предварительного высушивания и экстракции водным ацетонитрилом при его эквивалентном избытке по отношению к навеске гомогената (8, 9). В варианте с использованием водно-ацетонит-рильных экстрактов мяса и яиц кур после такого высушивания не наблюдалось каких-либо препятствий для применения разработанной тест-системы (см. рис. 2). В этих условиях нижний предел измерения ЛМ в исследованных образцах составил 1 мкг/кг (см. рис. 2).
Итак, твердофазный иммуноферментный анализ (ИФА) на основе поликлональных кроличьих антител к левомицетину (ЛМ), конъюгированному с бычьим сывороточным альбумином, и иммобилизованных антигенов — конъюгатов ЛМ с яичным альбумином, кроличьим сывороточным альбумином или желатином позволяет измерять количество ЛМ в растворах до концентрации 0,1 нг/мл и проводить определение этого антибиотика в молоке — с чувствительностью 0,3 мкг/кг, в мясе и яйцах — 1 мкг/кг, используя простую процедуру подготовки проб. Разработка этой новой линии иммуноферментных аналитических тест-систем, обеспечивающей высокоспецифичное выявление ЛМ и пригодной для практического использования, — безусловно, важный этап повышения эффективности санитарного контроля животноводческой продукции.


