Методы санитарного контроля животноводческой продукции. Сообщение VII. Иммуноферментный анализ стрептомицина
Автор: Буркин М.А., Гальвидис И.А., Кононенко Г.П.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Санитария, экология, микробиология
Статья в выпуске: 6 т.47, 2012 года.
Бесплатный доступ
Поликлональные кроличьи антитела к стрептомицину, конъюгированному с бычьим сывороточным альбумином в реакции с диглицидиловым эфиром 1,4-бутандиола, показали высокую специфичность в отношении стрептомицина и его ближайшего структурного аналога дигидрострептомицина. В условиях непрямого конкурентного иммуноферментного анализа с иммобилизованными антигенами, гетерологичными иммуногену по белковому носителю и методам синтеза, предел определения стрептомицина составил 0,1 нг/мл. Показана возможность применения разработанных иммуноферментных тест-систем для контроля за остатками антибиотика в молоке и яйцах — с чувствительностью 10 мкг/кг, в мясе — 20 мкг/кг.
Стрептомицин, молоко, яйца, мясо, иммуноанализ
Короткий адрес: https://sciup.org/142133352
IDR: 142133352 | УДК: 636/639:614.31:619
Текст научной статьи Методы санитарного контроля животноводческой продукции. Сообщение VII. Иммуноферментный анализ стрептомицина
Стрептомицин (СМ), антибиотик группы аминогликозидов, несмотря на опасные побочные эффекты в виде аллергических реакций, нарушений нервно-мышечной проводимости и ототоксичности, многие годы широко применяется в нашей стране и за рубежом в составе препаратов для лечения острых инфекционных заболеваний животных (1, 2). В настоящее время для практического контроля его остаточного содержания в продукции животноводства все более востребованным становится иммуно-ферментный анализ (ИФА). В ряде стран уже завершены разработки аналитических тест-систем в разных форматах, в том числе с использованием биосенсорной технологии (3-12). Российскими исследователями также предложена тест-система на основе прямого ИФА и оценочный тест с использованием иммунохроматографии для контроля СМ в молоке и молочных продуктах (13, 14).
Нашей целью было получение специфических иммунореагентов на основе стрептомицина, оптимизация условий непрямого конкурентного твердофазного иммуноферментного анализа и оценка возможности его применения для контроля за содержанием остатков этого антибиотика в молоке, яйцах и мясе.
Методика . В работе использовали сульфат стрептомицина, дигли-цидиловый эфир 1,4-бутандиола, дигидразид адипиновой кислоты, гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (КДИ), трансферрин человека (ТЧ) («Sigma», США), боргидрид натрия («Serva», Германия), дигидрострептомицин (НИИ новых антибиотиков им. Г.Ф. Гаузе, г. Москва), диметилформамид («Fluka», Германия), бычий сывороточный альбумин (БСА), желатин (Жел) и антивидовой ферментный конъюгат, полученный согласно описанию (15) из пероксидазы хрена (КФ 1.11.1.7) и антисыворотки осла к иммуноглобулинам кролика, периодат натрия отечественного производства. ИФА выполняли на высокосвязывающих поли-стирольных планшетах («Costar», США) с применением фотометра Dy-natech MR 5000 («Dynatech», Германия).
Для получения в реакции с диглицидиловым эфиром 1,4-бутандиола конъюгатов СМ с БСА и Жел - БСА-СМ(100)э, Жел-СМ(10)э, Жел-СМ(30)э и Жел-СМ(100)э к 6,8 мг сульфата СМ (10 мкмоль) в 1 мл 1 % NaHCO3 добавляли 14 мкл (10 мкмоль) 10 % раствора диглицидилового эфира 1,4-бутандиола в диметилформамиде и перемешивали смесь при комнатной температуре в течение 1 сут. Затем к 4 мг БСА (0,06 мкмоль) в 0,5 мл 0,05 М карбонат-бикарбонатного буфера (КББ, рН 9,5) добавляли 600 мкл этой смеси (100-кратный мольный избыток гаптена), а к трем порциям по 4 мг Жел (0,025 мкмоль) в 0,5 мл КББ — соответственно 25; 75 и 250 мкл (10-, 30- и 100-кратные мольные избытки), после чего перемешивали в течение 3 ч и подвергали диализу.
Для получения с помощью дигидразида адипиновой кислоты конъюгатов СМ с БСА и Жел — БСА-СМ(100)г, Жел-СМ(10)г, Жел-СМ(30)г и Жел-СМ(100)г сначала к 4 мг БСА (0,06 мкмоль) и 12 мг Жел (0,075 мкмоль) соответственно в 0,5 и 1,5 мл воды добавляли КДИ (навески 15 и 30 мг), перемешивали в течение 30 мин и смесь с Жел разделяли на 3 равные порции. Затем в водный раствор 6,8 мг сульфата СМ (10 мкмоль) вносили 1,8 мг дигидразида адипиновой кислоты и перемешивали при комнатной температуре в течение ночи. Далее к порции с БСА добавляли 600 мкл смеси, содержащей продукт взаимодействия дигидразида адипиновой кислоты с СМ (100-кратный мольный избыток), а к порциям с Жел — соответственно 25; 75 и 250 мкл (10-, 30- и 100-кратные мольные избытки), после чего перемешивали в течение 2 ч при комнатной температуре и подвергали диализу.
Методика получения конъюгатов ТЧ-СМ(30) и ТЧ-СМ(100) не отличалась от описанной ранее (16). К 20 мг ТЧ (0,26 мкмоль) в 3 мл воды добавляли 17 мг периодата натрия и перемешивали на магнитной мешалке 15 мин. Продукт диализовали против 5 л 10 мМ ацетатного буфера (рН 5,0) в течение 1 сут при 4 ° С. Полученный диализат делили на 2 равные порции, добавляли к ним соответственно 2,6 и 8,8 мг сульфата СМ (30- и 100-кратные мольные избытки) в 1 мл КББ и инкубировали 2 ч при перемешивании. Затем в реакционные смеси вносили по 100 мкл водного раствора боргидрида натрия с концентрацией 2 мг/мл и перемешивали еще 2 ч.
Продукты реакций диализовали против двух смен воды (по 5 л), после чего к диализатам добавляли равный объем глицерина и хранили при температуре - 10^ - 15 ° С. Иммунизацию кроликов-самцов серой масти (2-3 кг) проводили конъюгатами БСА-СМ(100)э, БСА-СМ(100)г и ТЧ-СМ(100). В 1-ю и 2-ю инъекцию животные получали по 200 мкг иммуногена в полном адъюванте Фрейнда подкожно в 10-15 точек области спины, во все последующие — по 100 мкг иммуногена в физиологическом растворе. Через 7 сут после каждой повторной инъекции, осуществляемой с интервалом 1 мес, у животных из краевой вены уха отбирали кровь, отделяли сыворотку, добавляли равный объем глицерина и хранили при - 10..-15 ° С. Тестирование сывороток, оценка специфичности антител, испытания конъюгатов в качестве твердофазных антигенов и ИФА не отличались от описанных ранее (17).
Для анализа использовали пробы молока, яиц, мяса из торговой сети г. Москвы. Молоко и гомогенизированное содержимое яиц (белок и желток) перед анализом разбавляли ФСБ-т в 100 раз. Мясо (говядина) тщательно измельчали, навески гомогената помещали в градуированные пробирки и добавляли 0,15 М фосфатно-солевой буфер (рН 7,5), состоящий из 0,01 М Na2HPO4, 0,14 M NaCl и содержащий 0,05 % Твина 20 (ФСБ-т), из расчета 1 г в 5 мл, интенсивно встряхивали и оставляли на 110
1 сут при 4 ° C. Далее пробирку с содержимым инкубировали при 60 ° C в течение 10 мин и центрифугировали. Порцию надосадочной жидкости разбавляли ФСБ-т в 40 раз и использовали в ИФА. Для оценки метрологических показателей методик измеряли количество СМ, внесенное в пробы молока, яиц и мяса.
Результаты . В специальной литературе описаны несколько вариантов синтеза иммуногенов с целью получения антител к СМ, и в каждом случае на их основе создавались тест-системы для контроля продукции животноводства. В 1993 году были выделены антитела на белковые конъюгаты СМ, модифицированного карбоксиметилоксимом по альдегидной группе (3, 4, 8, 12, 13). Позднее применялись реакция СМ с глутаровым альдегидом и карбодиимидная конденсация (9), связывание по метиламиногруппе с хлорангидридом циануровой кислоты (11, 14) и модификация СМ дигидразидом адипиновой кислоты (6, 7, 10).
Белковые конъюгаты, синтезированные в реакции СМ по метиламиногруппе с другим бифункциональным реагентом — диглицидиловым эфиром 1,4-бутандиола, были использованы в качестве улавливающих иммунореагентов, а также иммобилизованных антигенов и показали при этом высокую реактивность (5, 9, 11).
В настоящей работе кроликам вводили иммуногены на основе БСА, синтезированные разными способами, и конъюгат СМ с предварительно окисленным трансферрином человека, полученный методом восстановительного аминирования. Ранее с помощью подобного иммуногена выделяли антитела к неомицину (16).
СМ с БСА, а также с Жел конъюгировали с использованием двух бифункциональных реагентов — диглицидило-вого эфира 1,4-бутандиола и дигидразида адипиновой кислоты по упрощенным модифицированным методикам. В отличие от приема, описанного в работе R.A. Abuknesha с соавт. (11), реакцию СМ-сульфата с диглицидиловым эфиром 1,4-бутандиола осуществляли в водной среде без добавления диметилсульфоксида и продукт не очищали экстракцией в хлороформ. Реакционную смесь инкубировали с растворами белков 3 ч вместо 16 ч. При конъ-югировании СМ с дигидрази
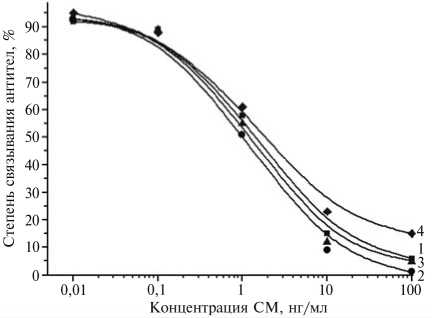
Рис. 1. Степень связывания антител к БСА-СМ(100)э, полученных при 2-5-м отборах крови (1-4), с твердофазным антигеном Жел-СМ(30)г в присутствии СМ в буфере ФСБ-т: БСА, Жел, СМ — соответственно бычий сывороточный альбумин, желатин, стрептомицин, ФСБ-т — фосфатно-солевой буферный раствор, содержащий Твин 20 (ИФА).
ном адипиновой кислоты на первой стадии вместо 90 мин кипячения смеси веществ в водном метаноле и выделения продукта реакции в кристаллическом виде согласно описанию (6, 10) их просто перемешивали при комнатной температуре 2 ч. Карбоксильные группы белков активировали одним реагентом (КДИ), а не двумя (N-гидроксисукцинимид и КДИ) в растворе ацетата натрия. На заключительной стадии реакция с белками вместо ночи продолжалась 2 ч при комнатной температуре.
В связи с тем, что спектрофотометрически подтвердить и оценить степень гаптенной нагрузки в конъюгатах не представлялось воз- можным из-за отсутствия у СМ поглощения в УФ-области, в качестве иммуногенов были взяты конъюгаты БСА и ТЧ с наибольшим избытком гаптена в реакции - БСА-СМ(100)г, БСА-СМ(100)э и ТЧ-СМ(100). Остальные синтезированные конъюгаты использовали в качестве твердофазных антигенов.
Антисыворотки к БСА-СМ(100)г и ТЧ-СМ(100) активно взаимодействовали со всеми иммобилизованными конъюгатами, но присутствие свободного антибиотика даже в концентрации 1 мкг/мл не тормозило связывания. Напротив, иммунизация конъюгатом БСА-СМ(100)э позволила уже при 1-м отборе крови получить антисыворотку, содержащую антитела, которые распознавали свободный СМ (рис. 1). Третье введение иммуногена животным (2-й отбор крови) обеспечило получение антител с рабочим титром 1:2000-1:3000 и возможность определения СМ в растворах до концентрации 0,1 нг/мл. Продолжение процедуры иммунизации до 5-го получения сыворотки крови сопровождалось снижением рабочего титра антител до 1:500 при незначительном изменении чувствительности анализа (табл. 1).
1. Характер взаимодействия антител к БСА-СМ(100)э в сыворотках от 2-5го отборов крови с разными иммобилизованными антигенами в присутствии СМ (ИФА)
|
Отбор крови |
Иммобилизованный антиген |
|||
|
Жел-СМ(30)г |
ТЧ-СМ(100) |
|||
|
рабочий титр |
1 ИК 50 |
рабочий титр | |
ИК 50 |
|
|
2-й |
1:2000 |
1,4 |
1:3000 |
1,1 |
|
3-й |
1:1000 |
1,0 |
1:1000 |
0,9 |
|
4-й |
1:800 |
1,2 |
1:800 |
0,9 |
|
5-й |
1:500 |
1,9 |
1:500 |
0,9 |
|
П р и м е ч а н и |
е. СМ, БСА, Жел, ТЧ |
— соответственно стрептомицин, бычий сывороточный альбумин, |
||
|
желатин, трансферрин человека. ИК 50 |
— концентрация, приводящая к 50 % торможению |
связывания |
||
|
антител. |
||||
В качестве твердофазных антигенов иммунореактивными оказались все синтезированные конъюгаты, однако чувствительность анализа СМ была несколько выше при использовании гетерологичных иммуногену конъюгатов Жел-СМ(30)г и ТЧ-СМ(100).
Оценка специфичности антител показала, что в отношении дигидрострептомицина (ближайшего структурного аналога СМ) перекрестная реактивность оказалась в 2 раза выше и составила 200 %. По данным литературы, для поликлональных антител на конъюгаты СМ с альбуминами, полученные разными методами, перекрестная реактивность с дигидрострептомицином была сопоставимой: при синтезе по метиламиногруппе с помощью хлорангидрида циануровой кислоты — 75 % (11), при использовании дигидразида адипиновой кислоты — 80 % (10) и 103 % (7), при связывании по альдегидной группе с карбоксиметилоксимом — 85,7 % (3), 118 % (12) и 149 % (4). У полученных нами антител необычно высокое узнавание дигидроаналога, возможно, связано с особенностями ориентации гаптена на БСА в иммуногене из-за выбранных условий конъюгирования с помощью диглицидилового эфира 1,4-бутандиола. С другими аминогликозидами (неомицин, гентамицин, сизомицин, канамицин, тобрамицин, амикацин и апрамицин) даже в концентрации 10 000 нг/мл торможения связывания не наблюдали.
Калибровочные графики ИФА СМ в вариантах с антисывороткой от 4-го отбора крови и твердофазными антигенами Жел-СМ(30)г и ТЧ-СМ(100) не различались. Аналитические показатели ( n = 4), полученные в лаборатории в условиях промежуточной прецизионности ежесуточно или с интервалом 1-2 сут, имели относительное стандартное отклонение не бо-112
лее 0,05, что указывало на стабильный характер функционирования тест-
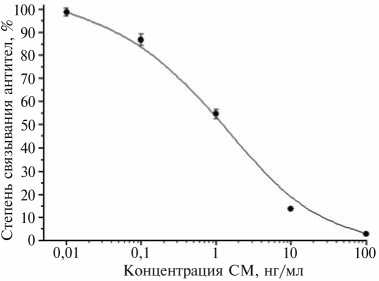
Рис. 2. Калибровочный график ИФА СМ ( n = 4) при использовании антисыворотки к БСА-СМ(100)э от 4-го отбора крови и иммобилизованного Жел-СМ(30)г. БСА, Жел, СМ — соответственно бычий сывороточный альбумин, желатин, стрептомицин.
систем при обычных колебаниях внешних факторов (рис. 2). Чувствительность определения СМ 0,1 нг/мл была сравнима с приведенной H. Watanabe с соавт. (8) и превосходила указанную во всех остальных сообщениях по непрямым и прямым ИФА-системам, иммунохроматогра-фическому анализу и иммуноанализу на основе оптических биосенсоров. Для дигидрострептомицина достигался близкий предел определения (учитывая, что специфичность антител к этому антибиотику была выше всего в 2 раза).
Специфичность и высокая чувствительность определения СМ, а также стабильное функционирование разработанных тест-систем позволили
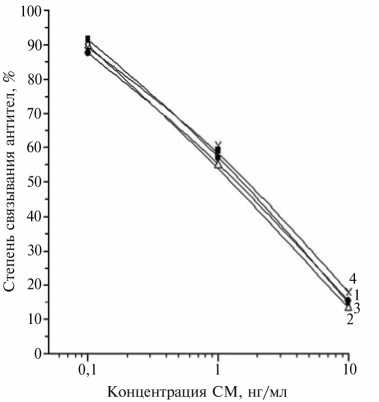
Рис. 3. Калибровочные графики для ИФА СМ с антисывороткой к БСА-СМ(100)э от 4-го отбора крови и твердофазным антигеном Жел-СМ(30)г в буфере ФсБ-т (1) , в молоке при 100-кратном разбавлении ФСБ-т (2) , в гомогенате яйца при 100-кратном разбавлении ФСБ-т (3) и в экстракте мяса при 40-кратном разбавлении ФСБ-т (4) . БСА, Жел, СМ, ФСБ-т — соответственно бычий сывороточный альбумин, желатин, стрептомицин, фосфатносолевой буферный раствор, содержащий Твин 20.
изучить возможность их применения для контроля животноводческой продукции — молока, яиц и мяса. Калибровочные графики, полученные в ФСБ-т и в молоке, разбавленном этим буфером в 100 раз (рис. 3), практически не различались и обеспечивали измерения СМ в диапазоне концентраций от 0,1 до 10 нг/мл. При проверке загрязненности молока с помощью такого метода за 3,5-4,0 ч можно обследовать десятки проб на содержание СМ в количестве от 10 до 1000 мкг/кг (действующий норматив составляет не более 200 мкг/кг, или 0,2 мг/кг) (18).
В гомогенатах яиц после разведения ФСБ-т в 100 раз калибровочный график также не изменялся (см. рис. 3). Проверка выборки из 37 образцов продукции, произведенной в 28 птицеводческих хозяйствах, не выявила СМ в количествах более 10 мкг/кг.
При оценке возможности определения СМ в говядине калибровочные графики для экстрактов го могенизированных образцов, полученных с ФСБ-т и затем разбавленных в 40 раз, практически не отличались от таковых для буферного раствора (см. рис. 3). В варианте с описанной пробоподготовкой значения для нижней и верхней границы определения СМ составляли соответственно 20 и 2000 мкг/кг. Согласно действующим рекомендациям, остатки СМ, которые допускаются в мясе и печени всех видов убойных животных (500 мкг/кг), а также в почках (1000 мкг/кг) (18), находятся в пределах достигаемого диа- пазона измерений.
Оценка метрологических показателей методик продемонстрировала вполне удовлетворительную сходимость результатов и правильность определения (табл. 2).
2. Результаты определения СМ в пробах молока, яиц и мяса с внесением разных количеств антибиотика при выполнении ИФА с антисывороткой к БСА-СМ(100)э от 4-го отбора крови и иммобилизованным антигеном Жел-СМ(30)г ( n = 4)
|
Образец |
Внесено СМ, нг/г |
Обнаружено СМ, нг/г |
Правильность определения, % |
|
Молоко |
100 |
100±16 |
100 |
|
200 |
212±36 |
106 |
|
|
Яйцо |
250 |
288±8 |
115 |
|
500 |
637±6 |
127 |
|
|
1000 |
1157±130 |
116 |
|
|
Мясо |
500 |
452±40 |
90 |
|
Примечание. СМ, БСА, Жел — стрептомицин, бычий сывороточный альбумин, желатин. |
|||
По коэффициентам вариации (или относительным стандартным отклонениям) было получено среднее значение 12,5 %, что указывает на отсутствие существенного влияния изменений в условиях на аналитический результат. Отклонение найденных количеств СМ от номинальных в относительном выражении составило в среднем по вариантам эксперимента 12,3 %, что свидетельствует о корректности выполняемых измерений.
Таким образом, поликлональные кроличьи антитела к стрептомицину, конъюгированному с бычьим сывороточным альбумином в реакции с диглицидиловым эфиром 1,4-бутандиола, показали высокую специфичность в отношении стрептомицина (СМ) и его ближайшего структурного аналога дигидрострептомицина. В условиях непрямого конкурентного им-муноферментного анализа (ИФА) с иммобилизованными антигенами, гетерологичными иммуногену по белковому носителю и методам синтеза, предел определения стрептомицина составил 0,1 нг/мл. Возможность определения СМ в продукции животноводства с помощью простых приемов пробоподготовки и непрямого иммуноферментного анализа открывает перспективы разработки соответствующих методик и тест-систем для практического использования. Наш успешный опыт применения простых двухстадийных методических схем, состоящих из экстракции и непрямого варианта ИФА, в отношении большого спектра противомикробных препаратов (антибиотики тетрациклиновой группы, бацитрацин, гентамицин, ципрофлоксацин и его аналоги, сульфадимидин, левомицетин, стрептомицин) свидетельствует о возможности создания в России унифицированной методологической базы для контроля за остаточным содержанием антибиотиков в продукции животноводства и внедрения ее в практику работы испытательных лабораторий.


