Микробиологические аспекты технологии напитков на основе порошкообразных солодовых экстрактов
Автор: Новикова И.В., Коротких Е.А., Агафонов Г.В., Яковлева С.Ф.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 4 (62), 2014 года.
Бесплатный доступ
Разработка пищевых продуктов для обеспечения здорового питания с расширением ассортимента выпускаемых новых продуктов с повышенной пищевой ценностью, улучшенными и заранее заданными свойствами для снабжения организма необходимыми нутриентами чрезвычайно актуальна. Исследования связаны с контролем физико-химических показателей квасного сусла, приготовленного на различном исходном сырье до и после брожения; изучением влияния рецептурных компонентов напитков на продолжительность брожения квасов с обоснованием применения в технологии напитков лакто- и бифидобактерий, определяющих их функциональные свойства. Применение в технологии напитков бактерий вида plantarum рода Lactobacillus штамма 8Р-3А позволяет: уменьшить период брожения с 16-18 ч (по классической схеме производства кваса) до 12,5-14,5 ч; увеличить стойкость кваса до 6 суток, по сравнению с утвержденным ГОСТ 5 суток для кваса, разлитого в бутылки; увеличить срок годности готового кваса до 16 суток, при температуре хранения от 0 до +6 оС, по сравнению с образцами кваса, приготовленных с применением B.longum №1-п, видимо, за счет синтеза бактериоцинов. Применение в технологии напитков бактерий вида bifidum рода Bifidobacterium штамма №1 позволяет: уменьшить период брожения с 16-18 ч (по классической схеме производства кваса) до 12,5-14,0 ч; увеличить стойкость кваса до 7 суток, увеличить срок годности готового кваса до 18 суток, при температуре хранения от 0 до +6 оС, по сравнению с образцами кваса, приготовленных с применением B.longum 1-п и L.рlantarum. Анализ полученных данных позволяет выявить перспективы применения в технологии квасов бактерий вида bifidum рода штамма №1, что приведет к увеличению стойкости напитков по сравнению с характеристикой, утвержденной стандартом.
Гречишный солод, дрожжи, квас, молочнокислые бактерии, бифидобактерии
Короткий адрес: https://sciup.org/14040303
IDR: 14040303 | УДК: 663.88
Текст научной статьи Микробиологические аспекты технологии напитков на основе порошкообразных солодовых экстрактов
Разработка пищевых продуктов для обеспечения здорового питания с расширением ассортимента выпускаемых новых продуктов – с повышенной пищевой ценностью, улучшенными и заранее заданными свойствами для снабжения организма необходимыми нутриентами чрезвычайно актуальна.
Напитки – наиболее удобная модель для проектирования продуктов с применением различного натурального сырья, самый технологичный и приемлемый продукт для создания нового вида функционального питания. Расширение ассортимента «полезных» напитков, обладающих набором функциональных свойств, раскрывает возможности управления процессом поступления в организм человека биологически активных веществ.
Важным моментом, отражающим необходимость изменения направленности питания в современных условиях, является снижение поступления в организм пробиотиков в виде молочнокислых бактерий (далее – МКБ), би-фидобактерийи продуктов их метаболизма. Это вызвано, с одной стороны, реализацией повышенных гигиенических требований к выпускаемым продуктам питания, с другой – жесткими рекомендациями логистики товарного обращения[1, 2].
Безалкогольные напитки на основе зернового сырья, предлагаемые производителямина рынке с тривиальным названием «квасы брожения», предполагают участие в технологическом процессе только дрожжевой монокультуры. Необходимая величина кислотности достигается не в результате жизнедеятельности молочнокислых бактерий, а внесением пищевых органических кислот – молочной или лимонной.
Процесс приготовления кваса предусматривает обязательное использование МКБ, часто без реализации технологических стадий фильтрации и пастеризации. Полезный напиток должен быть только «живым» и свежим, хорошо осветленным с помощью седиментации и декантации при низкой температуре с естественным процессом спиртового и гетеро-ферментативного молочнокислого брожения, приготовленным с тщательным соблюдением санитарно-гигиенических требований[3].
Квас относится к группе безалкогольных напитков с ярко выраженными полезными свойствами, он богат витаминами, в том числе группы В. Пищевая ценность этого напитка брожения дополняется присутствием органических кислот и других продуктов жизнедеятельности дрожжей и МКБ.
Совместное существование дрожжей и бактерий оказывает взаимное влияние на жизнедеятельность этих микроорганизмов. Между ними складываются симбиотические взаимоотношения, при которых бактерии продуцируют кислоты до рН 5,0-5,5 полезных для дрожжей, а продукты их автолиза,в частности, аминокислоты, пептиды и витамины, служат питание для бактерий.
Квасное сусло, приготовленное по традиционной технологии из концентрата квасного сусла (далее – ККС), является неполноценной средой для размножения дрожжей и МКБ: для дрожжей снижена доля растворимого азота, а для МКБ завышено количество углеводных компонентов углеводов.
При разработке напитков для приготовления квасного сусла применяли порошкообразные солодовые экстракты на основе свеже-проросших солодов:ППЭ-1 – гречихи, кукурузы, ячменя; ППЭ-2 – гречихи, гороха, ячменя; ПГрСЭ – гречихи; ПГСЭ – гороха, обладающие высокой пищевой и биологической ценностью [4, 5, 6].
Цель аналитического этапа работы – предварительное обобщение данных для изучения целесообразности и возможности применения молочнокислых и бифидобактерий наряду с дрожжами в технологии квасов с последующим исследованием влияния рецептурных компонентов на продолжительность сбраживания квасного сусла и стойкость готовых напитков, в конечном итоге – с разработкой рецептур квасов на основе порошкообразных солодовых экстрактов, обладающих функциональными свойствами.
Основные объекты исследования, предоставленные Российской биотехнологической компанией ЗАО «Партнер»– лиофилизированная биомасса бактерий (субстанции) – очищенные от среды культивирования и лиофиль-но высушенные с сахарозо-желатиновой защитной средой смешанные с лактозой: Lactobacillus plantarum штамма 8Р – А3, Bifidobacterium bifidum штамма №1, Bifidobacterium longum штамма №1-п.
Для сбраживания сусла применяли чистые культуры дрожжей вида Saccharomyces cerevisiae расы XII (кафедра биохимии и биотехнологии ФГБОУ ВПО «Воронежский государственный университет инженерных технологий»).
Направления исследований – контроль физико-химических показателей квасного сусла, приготовленного на различном исходном сырье до и после брожения; изучение влияния рецептурных компонентов напитков на продолжительность брожения квасов с обоснованием применения в технологии напитков лакто- и бифидобактерий, определяющих их функциональные свойства; разработка рецептур квасов на основе порошкообразных солодовых экстрактов, обладающих функциональными свойствами; контроль физикохимических, органолептических показателей полученных образцов квасов.
Основные ингредиенты рецептуры кваса согласно классической технологии обозначены в таблице 1 (реализуемые этапы технологии кваса: приготовление и сбраживание квасного сусла;охлаждение и купажирование напитка).
Т а б л и ц а 1
|
Рецепту |
ра на квас хлебный (на 100 дал) |
|||
|
Наименование сырья |
Единица измерения |
Показатели сырья |
На кон-цен-трате квасного сусла (ККС) |
|
|
Влажность, % |
Содержание сухих веществ, % |
|||
|
Сахар |
кг |
0,14 |
99,86 |
50 |
|
Концентрат квасного сусла (ККС) |
кг |
30 |
70 |
29,4 |
|
Дрожжи хлебопекарные |
кг |
8 |
92 |
0,2 |
Для проведения эксперимента готовили 5 образцов квасного сусла по традиционной технологии: на основе ККС – в качестве образца сравнения; на основе ППЭ-1 – образец №1, на основе ППЭ-2– образец №2, на основе ПГрСЭ – образец №3 и на основе ПГСЭ – образец №4.
Квасное сусло готовили с использованием 70 % ККС от расчетного количества. ККС разбавляли водой температурой 30-35 ºС в соотношении 1:2 – 1:2,5. Затем доводили водой до содержания сухих веществ 1,4-1,6 %, вносили сахарный сироп – 25 % от расчетного количества, чтобы не допустить избыточного накопления спирта при брожении с массовой долей (СВ) в сусле не менее 2,5 %. Квасы на основе экстрактов готовили по рецептурам (таблица 2) [4].
Сусло на основе солодового и полисоло-дового экстрактов готовили с использованием порошкообразного экстракта с учетом пересчета на массовую долю (СВ) в сусле. Экстракт разбавляли водой температурой 30-35 оС в со- отношении 1:3 – 1:3,5, затем добавляли воду до содержания сухих веществ 1,4-1,6 %. Вносили сахарный сироп – 25 % от расчетного количества. Содержание сухих веществ в сусле для кваса, приготовленного на основе порошкообразного экстракта составляло не менее 2,5 %.
Т а б л и ц а 2
Рецептура кваса на основе солодовых и полисолодовых экстрактов (на 100 дал)
|
Наименование сырья |
Единица измерения |
Показ сы |
атели рья |
На готовый напиток |
|
Влажность, % |
Содержание сухих веществ, % |
|||
|
Сахар |
кг |
0,14 |
99,86 |
50 |
|
ПГрСЭ |
кг |
3 |
97 |
21,22 |
|
ППЭ-1 |
кг |
3 |
97 |
21,22 |
|
ППЭ-2 |
кг |
3 |
97 |
21,22 |
|
ПГСЭ |
кг |
3 |
97 |
21,22 |
|
Дрожжи сухие хлебопекарные |
кг |
8 |
92 |
0,018 |
|
Закваска бактерий |
кг |
10 |
90 |
1 уч. ед. лиофилизированной культуры |
Сбраживание квасного сусла дрожжами проводили до снижения массовой доли сухих веществ на 1,0 % по сахаромеру и достижения значения кислотности не ниже 1,5 см3 раствора NaOH концентрацией 1 моль/дм3 на 100 см3 кваса. Продолжительность брожения при этих условиях составляла13-18 часов.
Затем квас охлаждали до температуры 67 ºС для седиментации дрожжевых клеток и купажировали.
Квасное сусло для получения кваса готовили таким образом, чтобы во всех образцах массовая доля (СВ) была одинаковой. При использовании ПГрСЭ с массовой долей (СВ), отличающейся от приведенной в рецептуре, проводили соответствующий пересчет расхода экстракта. рН квасного сусла в образце сравнения и в остальных образцах №1, №2, №3, №4 не оптимальны для жизнедеятельности дрожжей, поэтому для подкисления среды применяли лимонную кислоту, рН доводили до значения 4,5-5,0 (таблица 3).
Т а б л и ц а 3
Физико-химические показатели образцов квасного сусла
|
Наименование показателя |
Значение показателя |
||||
|
Образец сравнения |
Образец №1 |
Образец №2 |
Образец №3 |
Образец №4 |
|
|
Массовая доля сухих веществ, % (по ГОСТ 6687.2 – 90) |
4 |
4 |
4 |
4 |
4 |
|
Кислотность, к.ед (по ГОСТ 6687.4 – 86) |
0,9 |
0,85 |
0,87 |
0,7 |
0,75 |
|
рН (по ГОСТ 6687.4 – 86) |
4,65 |
4,8 |
4,9 |
4,6 |
4,7 |
|
Массовая доля редуцирующих сахаров, % (по ТИ-18-6-47-85) |
- |
2,52 |
2,54 |
2,65 |
2,58 |
Брожение образцов сусла осуществляли при температуре 30 ºС.
Динамика уменьшения массовой доли (СВ) на 1,0 % по сахаромеру при сбраживании сусла дрожжами приведена на графике (рисунок 1).
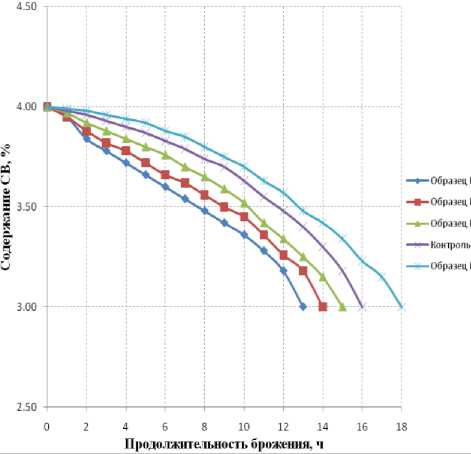
Рисунок 1. Динамика изменения сухих веществ в процессе брожения квасного сусла на основе ККС - образец сравнения, ППЭ-1 – образец №1, ППЭ-2 – образец №2, ПГрСЭ – образец №3, ПГСЭ – образец №4.
Более интенсивное снижение массовой доли (СВ) при брожении наблюдали в образцах квасного сусла на основе порошкообразных солодовых экстрактов из ППЭ-1, ПГрСЭ,
ППЭ-2, по сравнению с образцом сравнения продолжительность брожения при этом меньше на 3 ч, 2 ч, 1 ч. соответственно.
Видимо, данное обстоятельство обусловлено более высоким содержанием сбра- живаемых углеводов и мальтозы в исходном сырье в образцах №1, №2 и №3, что стимулирует перестройку обмена веществ дрожжевых клеток с аэробного на анаэробный метаболизм.
Для проведения экспериментальных исследований применяли ампулы с лиофилизированной культурой бактерий, предоставленные ЗАО «Партнер». Лиофилизированная биомасса бактерий (субстанция) представляет собой очищенные от среды культивирования и лиофильно высушенные с сахарозожелатиновой защитной средой клетки бифидобактерий Bifidobacterium bifidum №1, Bifidobacterium longum №1-п и Lactobacillus plantarum 8Р-А3, смешанные с лактозой. Одна ампула предназначена для выработки одной партии продукта, из расчета 1 учетная единица (1 уч. ед.) на 1000 кг нормализованной смеси. Морфологические признаки бактерий представлены в таблице 4.
Подготовку проб квасного суслас целью биологического подкисления в процессе молочнокислого брожения проводили в два этапа: активизация лиофилизата бактерий, сбраживание квасного сусла.
Т а б л и ц а 4
Морфологические признаки исследуемых видов бактерий *
|
Показатели |
Bifidobacterumbifidum № 1 |
Bifidobacterinlongum 1-n |
Lactobacillusplantarum 8P-A3 |
|
1 |
2 |
3 |
4 |
|
Размер клеток, мкм |
2,0-4,5 |
2,0-4,5 |
5,5-1,0 |
|
Оптимальная температура роста, о С |
38±1 |
37±1 |
37±1 |
|
Отношение к Граму |
Г+ |
Г+ |
Г+ |
|
Отношение к кислороду |
Строгий анаэроб |
Облигатный анаэроб |
Факультативный анаэроб |
|
КОЕ/г в учетной единице |
9*10 10 |
2,9*10 10 |
10,4*10 10 |
|
Образуемые колонии |
|||
|
на твердой среде Блаурокка: |
"гвозди", "крошки" белого цвета, полупрозрачные плоские округлые с волнистыми краями |
"шарики" |
выпуклые, круглые с ровным краем белого цвета |
П р о д о л ж е н и е т а б л. 4
|
1 |
2 |
3 |
4 |
|
на жидкой среде |
рыхлая масса с прозрачной верхней частью среда |
||
|
Размер образуемых колоний: |
|||
|
среда Блаурокка, мм |
2-3мм |
2-3мм, зона аэробиоза 10% |
0,5-2,5 |
|
жидкая среда, % |
зона аэробиноза 10% |
||
* - по Определителю бактерий Берджи. В 2-х т. Т. 1: Пер. с англ./Под ред. Дж. Хоулта, Н. Крига, П. Снита, Дж. Стейли, С. Уилльямса. – М.: Мир, 1997. – 432 с. ил.].
Активизацию лиофилизата бактерий проводили на кафедре биохимии и биотехнологии в подготовленном стерильном боксе. В каждую ампулу с культурой вводили по 10 см3физраствора и ставили в термостат при температуре 37 оС на 3 часа для кратковременного активизирования бактерий.
В колбы с подготовленным стерильным квасным суслом вводили активизированные бактерии с соблюдением всех правил микробиологической стерильности.
1 ампула с бактериями содержит 10 см3 суспензии. Данная учетная единица рассчитана на 1000 кг готового продукта, тогда на 1 дм3 готового кваса необходимо внести 0,01 см3 бактериальной суспензии.
Количество бактерий, вносимых в сусло (из расчета на 1 дм3 готового напитка), составляло: Bifidobacterium bifidum № 1: КОЕ/см3 9*107; Bifidobacterium longum №1-п: КОЕ/см3 2,9*107; Lactobacillus plantarum 8Р-А3: КОЕ/см3 10,4*107.После засева колбы с суслом помещали в термостат при 37 оС для осуществления процесса молочнокислого брожения в течение 24 ч.
В ходе брожения контролировали изменение кислотности квасного сусла в процессе жизнедеятельности бифидо- и лактобактерий.
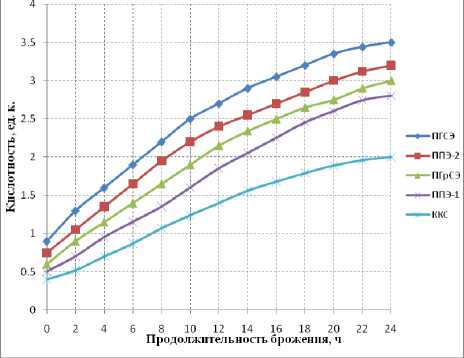
Рисунок 2. Динамика изменения кислотности при сбраживании квасного сусла бактериями Bifidobacterium longum №1-п.
Анализ экспериментальных данных позволяет сделать вывод о наиболее интенсив- ном возрастании величины кислотности в процессе жизнедеятельности бактерий L. plantarum и B. longum (максимально – в случае сбраживания сусла на основе ПГСЭ и ППЭ-2). В случае подкисления L. plantarum кислотность сусла (из ПГрСЭ и ППЭ-2) с 0,9 ед.к. возросла до 3,2 ед.к., в случае подкисления B. longum кислотность сусла (из ПГрСЭ и ППЭ-2) с 0,75 ед.к. возросла до 2,5 ед.к, что связано с более высоким содержанием белковых веществ в образцах по сравнению с суслом на основе ККС и превращением присутствующих сахаров в молочную кислоту.
В ходе сбраживания квасного сусла из различных видов солодового экстракта бактериями, массовая доля (СВ) снижается на 0,4-0,5%.
Осуществляли микробиологический контроль дрожжевых клеток перед внесением их в подкисленное бактериями квасное сусло.
Проводили количественную оценку культуры дрожжей с помощью камеры Горяева методом подсчета клеток под микроскопом и исследовали их способность к размножению в квасном сусле на основе порошкообразных солодовых экстрактов в процессе брожения, определяли упитанность клеток по гликогену, контролировали количество нежизнеспособных и почкующихся клеток согласно стандартным методикам (таблица 5).
Т а б л и ц а 5
Микробиологические показатели дрожжей *
|
Показатели |
Saccharomycescerevisia e раса XII |
|
На момент засева |
|
|
КОЕ/см3 |
9,12*107 |
|
Упитанность по гликогену, % |
59,8 |
|
Количество почкующихся клеток, % |
43,0 |
|
Количество мертвых кле ток, % |
1,4 |
|
На 6-й чассбраживания в подкисленном бактериями сусле |
|
|
КОЕ/см3 |
2,3*108 |
|
Упитанность по гликогену, % |
78,3 |
|
Количество почкующихся клеток, % |
67,5 |
|
Количество мертвых клеток, % |
1,1 |
*- методы исследования по ГОСТ 30712-2001.
Исследовали процесс сбраживания дрожжами подкисленного бактериями квасного сусла.
Для сбраживания квасного сусла, подкисленного после 24 ч культивирования бифидо- и лактобактерий, использовали пробирку с чистой культурой дрожжей Saccharomyces cerevisiae расы XII на пивном сусле-агаре.
В пробирку с чистой культурой дрожжей вносили 5 см3 стерильногофизраствора. Энергично встряхивали пробирку и помещали жидкую фракцию в колбу с суслом.
Брожение подкисленного сусла с помощью дрожжей проводили при температуре 30 оС до уменьшения массовой доли (СВ) сусла на 1,0 %.Наблюдали более интенсивное сбраживание подкисленного бактериями сусла по сравнению с образцом без применения бактерий.
При исследовании динамики сбраживания дрожжами подкисленного бактериями квасного сусла более интенсивное снижение массовой доли (СВ) наблюдали в образцах подкисленного бактериями B. bifidum №1 квасного сусла на основе порошкообразных солодовых экстрактов из ПГрСЭ, ППЭ-2, ПГСЭ и ППЭ-1 по сравнению с образцом сравнения, продолжительность брожения составила 12,5 ч, 13,0 ч, 13,5 ч и 14,0 ч соответственно.
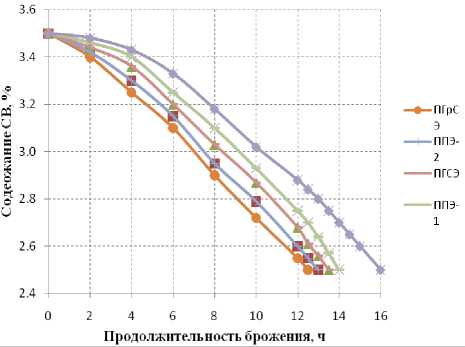
Рисунок 3. Динамика сбраживания подкисленных бактериями B. bifidum №1 образцов квасного сусла дрожжами
Исследовали физико-химические показатели образцов готовых квасов в процессе хранения.
По окончании брожения сброженный квас охлаждали до температуры 6-7 ºС для седиментации дрожжевых клеток и осветления кваса. Затем квас декантировали и вносили 75 % сахарного сиропа (от общего количества) и 30 % 1,5 %-го водного раствора порошкообразного солодового экстракта, предусмотренных рецептурой.
В готовом напитке контролировали физико-химические и органолептические показатели. Органолептические показатели полученных образцов кваса соответствовали требованиям ГОСТ Р 53094 – 2008: внешний вид – непрозрачная пенящаяся жидкость, без посторонних включений; вкус – освежающий кислосладкий; аромат – сброженного напитка. По степени насыщения диоксидом углерода в соответствии с ГОСТ 28188 – 89 полученные образцы кваса относились к среднегазированным, о чем свидетельствует наличие высокой и стойкой пены, что оказывает положительное влияние на оценку внешнего вида напитков.
Образцы квасов соответствовали физико-химическим показателям ГОСТ Р 530942008 «Квасы. Общие технические условия».
Контролировали стойкость образцов кваса. Можно сделать вывод о более продолжительной стойкости в случае применения бактерий B. bifidum и дрожжей и по сравнению с L. рlantarum и B.longum 1-п и дрожжевой закваски (максимально - в случае образцов на основе ПГрСЭ и ППЭ-2), о чем свидетельствует небольшое изменение величины кислотности в процессе хранения при температуре 20 оС. Период стойкости кваса с указанным видом бактерий составил 7 суток.
Исследовали влияние применения бактерий на некоторые физико-химические показатели образцов.
Из представленных и изученных образцов квасов выбирали те, стойкость которых была увеличена по сравнению с квасом на основе ККС. Выбранная партия содержит три вида кваса на основе ППЭ-1 с применением комбинированной закваски бактерий.
Количественно определяли присутствие бактерий в готовом напитке к концу срока годности. Из исследуемых образцов готовили мазки, окрашивали метиленовым синим и рассматривали под микроскопомс увеличением x1350 .
Интерпретация результатов микробиологического исследования представляла собой информацию о количестве КОЕ/см3 исследуемых бактерий на момент засева, в готовом напитке и по окончании срока годности. Данные представлены в таблице 6.
Количественную оценку культуры бактерий по окончании срока годности проводили методом высева. Метод заключается в проведении серийных разведений и высевом их на питательную твердую среду с последующим культивированием. Для создания анаэробных условий в чашку Петри после застывания среды вкладывали специальный агент.
По истечении продолжительности культивирования на чашке Петри подсчитывали количество выросших колоний и проводили расчет результатов по формуле.Фото препарата с колониями Bifidobacterium bifidum № 1представлены на рисунке 4, результаты расчетов иведены в таблице 6.
Рисунок 4. Фотография препарата мазков
Bifidobacterin bifidum № 1.
Т а б л и ц а 6
Количественная оценка культур бактерий
|
КОЕ/см3 |
B.bifidum№1 |
B.longum 1-п |
L.рlantarum 8Р-А3 |
|
Засеяно в сусло |
1,3*105 |
4,1*105 |
1,5*105 |
|
В готовом напитке |
2,9*108 |
1,1*108 |
3,1*108 |
|
На конец срока годности |
3,3*106 |
1*106 |
2,3*106 |


