Микробиом человека и его роль в гемопоэзе и в развитии множественной миеломы
Автор: Чеботкевич В.Н., Кулешова А.В., Киселева Е.Е., Бессмельцев С.С.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Передовая статья
Статья в выпуске: 3 т.17, 2021 года.
Бесплатный доступ
Микробиом под которым понимают совокупность микроорганизмов, включающих бактерии, вирусы и грибы, колонизирующие человеческий организм, образует экологическую систему, критически важную для здоровья человека. На протяжении последнего десятилетия микробное сообщество (микробиом) организма человека было признано фундаментальным фактором, определяющим его физиологию и патологию. Исследования последних лет выявили важную роль микробиоты кишечника в гемопоэзе. Нарушение баланса кишечного микробиома, дисбиоз, приводит к развитию различных нарушений, таких как воспалительные заболевания кишечника, ожирение. Ведущим фактором, способствующим возникновению дисбиоза у больных, является антибиотикотерапия. В последние несколько лет исследуется роль микробиома при гематологических заболеваниях. Активно изучается участие микробиоты в патогенезе гемобластозов, в частности множественной миеломы.
Микробиом, гемопоэз, гемобластозы, множественная миелома
Короткий адрес: https://sciup.org/170175827
IDR: 170175827
Текст научной статьи Микробиом человека и его роль в гемопоэзе и в развитии множественной миеломы
Введение. В 2010 году в журнале «Nature» была опубликована работа под названием «Наш другой геном» (Our ‘other’ genome). Именно тогда начался активный пересмотр патогенеза ряда инфекционных и неинфекционных заболеваний человека с учетом новых данных о микробиоме человека. Важно осознать тот факт, что классические микробиологические (культуральные) методы оказались несостоятельны для исследования микробиоты человека. Более 70% видов микроорганизмов не поддаются микробиологическому культивированию, то есть не могут быть выделены в чистой культуре на искусственных питательных средах и идентифицированы. Поэтому основными методами изучения микробиоты явились некультуральные методы, в частности метагеномика, а также секвенирование микробиома.
Под термином «микробиом» понимают весь leads to the development of various disorders such as inflammatory bowel diseases, obesity. The leading factor contributing to the onset of dysbiosis in patients is antibiotic therapy. In the past few years, the role of microbiome in hematological diseases has been investigated. The participation of microbiota in the pathogenesis of hemoblastosis, in particular multiple myeloma is being actively studied.
набор микроорганизмов, включая бактерии, вирусы, грибы и археи, которые колонизируют человеческий организм, образуя экологическую систему, критически важную для здоровья человека [1]. Микробное сообщество (микробиом) организма человека было признано фундаментальным фактором, определяющим его физиологию и патологию. Триллионы бактерий, обитающих в желудочно-кишечном тракте людей, значительно расширяя возможности генома хозяина. Это означает, что c помощью микроорганизмов человек способен выполнять функции, которые не кодируются собственным геномом, например, защита от инвазивных патогенов, синтез ключевых молекул для развития собственных клеток и тканей, взаимодействие с системой иммунитета и участие в гемопоэзе [2]. В последние годы активно исследуется роль микробиоты при гематоло-
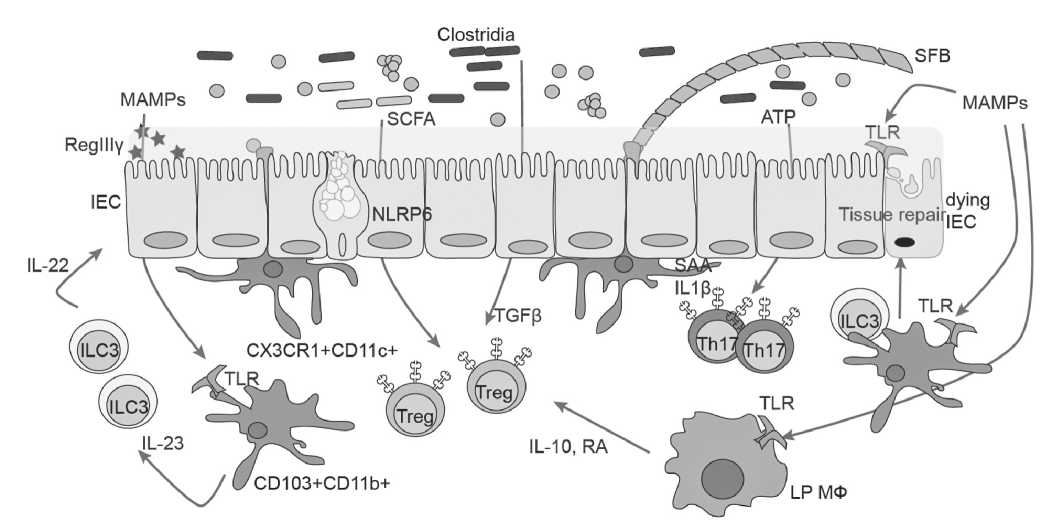
Рис 1. Микробиота в роли регулятора иммунной системы [12].
Обозначения: SCFA – короткоцепочечные жирные кислоты, TLR – толл-подобные рецепторы, Treg– регуляторные Т-лимфоциты, RegIIIγ – антибактериальный лектин, MAMPs – микробоассоциированные молекулярные паттерны, IL – интерлейкины, tissue repair – тканевое восстановление в кишечнике, RA – ретиноевая кислота, IEC(dying) – клетка кишечного эпителия (погибшая) SFB – иммуностимулирующая сегментированная филаментная бактерия, ATF – аденозинтрифосфат, ILC3 – лимфоидная клетка врожденного иммунитета, Th17 – Т-хелперы 17-го типа, SAA – сывороточный амилоид А, TGF-β – трансформирующий ростовой фактор β, CD – кластер дифференцировки, NLRP – Nod подобные рецепторы гических заболеваниях, в частности при множественной миеломе [3, 4, 5, 6].
Микробиом и гемопоэз
Характер питания оказывает большое влияние на состав, разнообразие и плотность кишечной микробиоты. Устоявшиеся пищевые привычки человека ведут к определённым сдвигам в его микробиоме, в частности, повышенное потребление животных белков и жиров стимулирует рост представителей рода Bacteroides, а повышенное потребление растительных углеводов увеличивает численность рода Prevotella. Показано, что недостаток растительной клетчатки в рационе питания у мышей, колонизированных человеческой микробиотой, приводит к стойкому уменьшению микробного разнообразия, которая не возвращалась в норму даже при нормализации диеты [7].
Растительные волокна и метаболиты, продуцируемые Bacteroides thetaiotaomicron, способствуют дифференциации бокаловидных клеток кишечника и экспрессии генов, ответственных за синтез муцина. С другой стороны, Faecalibacterium prausnitzii потребитель ацетата и продуцент бутирата, снижает стимулирующий эффект ацетата на слизеобразование и предотвращает перепроизводство слизи, тем самым сохраняя гомеостаз кишечного эпителия [8].
Обеспечение возможности проживания большого количества видов симбионтных бактерий на слизистых рассматривается как отдельная и независимая функция иммунной системы, направленная не на уничтожение, а на создание и постоянное поддержание иммунологической толерантности к антигенам нормальной микробиоты, сохранение и передачу полезных бактерий своему потомству.
Несмотря на строгий иммунный контроль, микробиота кишечника успешно сохраняет за собой право на данную территорию, в том числе регулируя функции подлежащей ткани кишечника. С другой стороны, непосредственная близость популяции бактерий к слизистым и наружным покровам человека создает потенциальный риск инвазии, поэтому иммунная система наиболее тщательно контролирует бактерии, колонизирующие просвет кишечника.
Показано, что антибиотикотерапия осложняет течение экспериментального колита у мышей за счет снижения количества микробных лигандов, ассоциированных с толл-подобными рецепторами (TLR), что обеспечивает в норме экспрессию медиаторов тканевого гомеостаза и восстановления поврежденных тканей [9].
Маргарет МакФалл-Нгай американская иссле- довательница, внесшая фундаментальный вклад в иммунологию симбиотических отношений, выдвинула концепцию, согласно которой движущей силой формирования адаптивного иммунитета в эволюции является не борьба с патогенами, а установление взаимоотношений с симбионтны-ми микроорганизмами, и предложила заменить основное понятие микробного распознавания – патогенассоциированные молекулярные паттерны (PAMPs), введенное Чарльзом Дженуэем [10] более широким термином – микробоассоциированные молекулярные паттерны (MAMPs) для обозначения взаимодействия и с патогенами, и с симбионтными бактериями [11]. Для распознавания растворимых MAMPs, клетки кишечника экспрессируют паттерн-распознающие рецепторы TLR (толл-подобные рецепторы) и NLRP (Nod-подобные рецепторы).
Основные системы иммунитета полагаются на сигналы MAMPs для правильной работы, в частности, калибровки уровня ответа и поддержания напряженности иммунитета, как в отношении симбиотических организмов, так и патогенов (рис.1).
Многое из того, что в настоящее время известно о связи между микробиотой и кроветворением, получено в исследованиях на лабораторных мышах. Так, у безмикробных (GF) мышей, содержащихся в стерильных условиях, имеются хорошо известные нарушения клеток костного мозга [13, 14, 15,16, 17] – уменьшена популяция гемопоэтических стволовых и клеток-предшественников (HSPC), аномальное количество мезенхимальных клеток и нарушены функции Т-клеток, по сравнению с SPF мышами (контроль) [7,9.10]. Эти эффекты не зависели от продолжительности введения антибиотиков, их адсорбции и типа используемого антибиотика [18]. Важно отметить, что биологически значимые концентрации антибиотиков не токсичны для HSPC в условиях культивирования in vitro, что свидетельствует против прямого действия антибиотиков на гемопоэз [19].
Дисбиоз или, точнее, дисбаланс микробиомы кишечника связан также с супрессией гемопоэза у человека. Важно подчеркнуть, что, под термином дисбиоз подразумевается именно дисбаланс микробиоты кишечника, а не присутствие специфических микробных патогенов, которые конечно могут вызвать определенные гематологические нарушения [2]. Речь идет о дисбалансе кишечных бактерий – комменсалов и характеризуется воспалительными заболеваниями кишечника (ВЗК), включая уменьшение бактериального разнообразия, увеличение количества бактериофагов и повышение титра условно патогенных микробов [20, 21]. Интересно отметить, что воспалительные заболевания кишечника оказались независимо связаны с немедикаментозной апластичесой анемией [22, 23]. Нарушения метаболизма также имеют общую связь с дисбалансом микробиоты и гематологическими заболеваниями. Например, ожирение связано как с дисбиозом, так и с гематологическими нарушениями [24, 25]. Недоедание также связано с изменениями микробных сообществ кишечника [26, 27], а также с серьезными гематологическими нарушениями [28, 29].
Более прямая связь между микробным дис-биозом и изменениями гемопоэза наблюдается у пациентов, получающих антибиотики. Лечение антибиотиками вызывает дисбиоз кишечника. Устранение определенных классов бактерий связано с рядом гематологических аномалий. О развитии цитопении, включая нейтропению, анемию, тромбоцитопению при антибиотико-терапии сообщалось в ряде исследований. Например, ретроспективный анализ показал, что у 5-15% пациентов развилась нейтропения, определяемая как <1000 нейтрофилов на мм3 через 10 или более дней после лечения лактамными антибиотиками [30]. Из общего числа пациентов, у которых развилась нейтропения, у 94% восстановилось число нейтрофилов после прекращения лечения антибиотиками. Эти исследования указывают, что нарушения микробиома кишечника значительно влияет на гемопоэз.
Выделенный из микробиоты липополисахарид (ЛПС) поддерживает экспрессию базального уровня RegIII-γ (бактерицидный лектин C-типа) в эпителиальных клетках кишечника и клетках Панета. К примеру, RegIIIγ не обнаружен у стерильных (безмикробных) лабораторных мышей [31], и даже кратковременная антибиотикоте-рапия ухудшает его экспрессию у нестерильных мышей, что делает их восприимчивыми к инфекции, вызванной ванкомицин-резистентыми энтерококками (VRE), при этом данный дефект является обратимым при пероральном введении ЛПС [32]. Подобным образом флагеллин бактерий кишечника способствует поддержанию экспрессии RegIIIγ в клетках человека. Именно фла-геллин, посредством воздействия на рецепторы TLR5 дендритных клеток слизистой оболочки кишечника, стимулирует выделение ИЛ-22 и последующую экспрессию RegIIIγ в эпителиальных клетках кишечника [33, 34]. Гранулоциты также контролируются сигналами бактерий-комменсалов, чьи медиаторы имеют эффект в том числе и на клетки костного мозга человека. В эксперименте NOD1-опосредованное воздействие на ме-зодиаминопимелевую кислоту (мезо-ДАПК), как часть пептидогликана бактерий, способствовало усилению нейтрофильной реакции на патогены, а именно Staphylococcus aureus и Streptococcus pneumoniae [35]. У изначально стерильных мышей мезо-ДАПК появлялась в крови и костном мозге в течение трех суток после колонизации
E. coli в эксперименте, тем самым доказывая, что бактериальные лиганды из просвета кишечника характеризуются системным распределением и, следовательно, приводят к системным эффектам [35]. Кроме того, перинатальное введение антибиотиков в эксперименте отрицательно влияло на количество и функции нейтрофилов у мышей, ухудшая продукцию гранулоцитарного колониестимулирующего фактора (Г-КСФ) и ИЛ-17, а также повышая риск сепсиса, вызванного E. coli или K. Pneumoniae [36]. Подобным образом, антибактериальная терапия приводила к нарушениям в базофильном ростке костного мозга и крови у мышей, реализуя отрицательный эффект посредством цепи Th2-ИЛ-4-IgE, что приводило к осложнённым аллергическим синдромам [37]. Функция антиген-презентирующих клеток (АПК) также зависит от бактерий микробиоты. К примеру, показано, что миграция дендритных клеток и продукция ИЛ-1β/ИЛ-18 нарушены у пролеченных антибиотиками мышей на фоне инфицирования их вирусом гриппа [38]. Логично, что в данном эксперименте уровни иммуноглобулинов, количество Т-клеток и продукция интерферона-γ были также снижены, что привело к увеличению титров вируса. Весьма интересно, что введение в кишечник агонистов TLR-рецепторов восстанавливало иммунный ответ в дыхательной системе лабораторных животных в этом исследовании, указывая на то, что микробные сигналы из кишечника способны регулировать и восстанавливать системный иммунный ответ, в том числе опосредованный другими органами и тканями.
Опубликованы данные о том, что антибиотики нарушают иммунный ответ против вируса лимфоцитарного хориоменингита у мышей, снижая экспрессию антивирусных генов в макрофагах легочной ткани, что приводит к дефектам функции CD8+ Т-клеток, а также снижению продукции интерферона-γ/ФНО-α и иммуноглобулинов класса G [39]. В другом исследовании сообщалось, что макрофаги селезенки у стерильных и пролеченных антибиотиками мышей теряли способность к адекватному взаимодействию с NK-клетками из-за недостатка хроматина в промоторной области генов, кодирующих важные цитокины, такие как интерфероны (α, β), ИЛ-6 и ФНО-α [40]. Таким образом, в результате введения антибиотиков лабораторные животные не могли контролировать уровень вируса на фоне экспериментального инфицирования цитомегаловирусом мыши. Функция Т-лимфоцитов так же страдает при нарушении взаимодействия между иммунной системой и микробиотой, как и B-клеточное звено иммунитета. Действительно, было показано, что титры иммуноглобулинов ниже у мышей, получавших антибиотики до момента развития вирусной инфекции [38, 39]. Более того, продемонстрировано, что наличие ЛПС бактериальной природы необходимо для созревания B1-субпопуляции лимфоцитов в селезенке и для поддержания базального уровня циркулирующих иммуноглобулинов класса М, которые оказывают защитную роль в экспериментальных моделях сепсиса у мышей [41].
Микробиом человека и множественная миелома
Представленные выше материалы демонстрируют выраженное влияние микробиомы кишечника на гемопоэз и на иммунный ответ организма. В этой связи важным представляется изучение участия микробиома в патогенезе гематологических заболеваний и возможности использования этих знаний для повышения эффективности их терапии.
В последние годы появился ряд исследований по изучению роли микробиома при множественной миеломе (ММ), частота которой составляет 10-13% всех гематологических опухолей [42].
Микробиом кишечника находится под постоянным контролем иммунной системы и, следовательно, изменения в этой экосистеме может привести к местным и/или системным воспалениям. Местная иммунная стимуляция возникает в lamina propria и в лимфатической системе. Активация системного иммунитета происходит несколькими путями, которые еще недостаточно изучены. Растущее количество фактов указывают на то, что местная иммунная активность микробиома кишечника может воздействовать на отдаленные органы, в частности, на клетки костного мозга (КМ) и его микроокружение [5]. Микроокружение КМ включает как клеточные, так и внеклеточные компоненты и регулирует пролиферацию гемопоэтических стволовых клеток (ГСК). Специализированные клетки микроокружения влияют друг на друга как посредством клеточных контактов, так и растворимых метаболитов, и вся система находится в динамическом равновесии [43].
Несмотря на значительные успехи в лечении, ММ остается неизлечимой. Заболевание обычно возникает из предопухолевого состояния, называемого моноклональной гаммапатией неопределенного значения (MGUS). Клон миеломы эво-люцинирует от MGUS через тлеющую миелому к миеломе симптоматической.
Исследователи из университета Осло выявили, что плазматические клетки, особенно те, у которых отсутствует экспрессия CD19 и CD45, потенциально могут жить десятилетиями в кишечнике, в тесном контакте с микробиотой [44].
Характер микробиоты кишечника влияет на степень антигенной стимуляции этих клеток и может играть определенную роль в их мутациях и клональной эволюции. Состав микробиоты и ее метаболиты также влияют на микроокружение
КМ [4].
Ahmed и соавт. отмечают, что существует несколько путей воздействия микробиоты на окружение КМ [5]. Один из них связан с синтезом биоактивных метаболитов, таких как короткоцепочечные жирные кислоты (SCFA). SCFA могут подавлять ядерный фактор легкой цепи каппа, усиливающий активность В-клеток (NF-κB) и провоспалительных цитокинов, таких как ИЛ-6 и фактор некроза опухоли (TNF-альфа). И наоборот, они могут повышать уровень ИЛ-10, Тh17 и Th1.
В другом исследовании показало, что у пациентов с ММ по сравнению с контролем уровень SFCA-продуцирующих бактерий понижен, а азот-продуцирующих бактерий увеличен [45]. Имеются исследования, указывающие на то, что кишечная микробиота влияет на результаты лечения пациентов с ММ [46]. Так, в работе Сalcinotto A. и соавт. [46] установлено, что пациенты без МОБ (минимальная остаточная болезнь) после индукционной терапии имели тенденцию к более высокому уровню Eubacterium hallii по сравнению с больными, имеющими МОБ. В другом исследовании [47] было показано, что пациенты, у которых наблюдался более высокий уровень Bacteroides в образцах кала, на 7-й день после ауто-ТГСК имели менее выраженную диарею.
Имеются данные о том, что микробиота может влиять на эффективность лечения ММ. Так, Huang
E.Y. и соавт. установили, что лечение ММ дексоме-тазоном связано со снижением продукции ИЛ-17 [48]. Поскольку продукция ИЛ-17 зависит и от кишечной флоры, изменения в микробиоте, вызванные лечением дексаметазоном, могут влиять на активность этого препарата при лечении ММ.
Таким образом приведенные исследования указывают на участие микробиома в патогенезе и клиническом течении ММ. Однако значение этих взаимосвязей требует дальнейшего всестороннего исследования. Можно надеяться, что в будущем мы сможем получить более ясное представление об роли микробиома при ММ.
Конфликты интересов
Источник финансирования
Исследование не имело источника финансирования
Вклад авторов
Концепция и дизайн: все авторы
Сбор и обработка данных: все авторы
Представление материалов исследования: все авторы
Анализ и интерпретация: все авторы
Подготовка рукописи: все авторы
Окончательное одобрение рукописи: Чеботке-вич В.Н., Бессмельцев С.С.
Список литературы Микробиом человека и его роль в гемопоэзе и в развитии множественной миеломы
- Belkaid, Y., Harrison, O.J. Homeostatic immunity and the microbiota // Immunity. – 2017. – Vol. 46, № 4. – P. 562-576.
- Yan, H., Baldridge, M.T., King, K.Y. Hematopoiesis and the bacterial microbiome // Blood. – 2018. – Vol. 132, № 6. – P. 559-564.
- Manzo, V.E., Bhatt, A.S. The human microbiome in hematopoiesis and hematologic disorders // Blood. – 2015. – Vol. 126, № 3. – P. 311-318.
- Alkharabsheh, O. et al. The human microbiota in multiple myeloma and proteasome inhibitors // Acta Haematol. – 2020. – Vol. 143. – P. 118-123.
- Ahmed, N. et al. Influence of gut microbiome on multiple myeloma: friend or foe? // J. Immunother Cancer. – 2020. – Vol. 8:e000576. doi:10.1136/jitc-2020-000576.
- Чеботкевич, В.Н., Кулешова, А.В., Киселева, Е.Е. и др. Этиопатогенетические особенности инфекций у больных гемобластозами при трансплантации гемопоэтических стволовых клеток // Вестник Новгородского Государственного Университета. – 2020. – Т. 3, № 119. – С. 62-66.
- Sonnenburg, E.D. et al. Diet-induced extinctions in the gut microbiota compound over generations // Nature. – 2016. – Vol. 529, № 7585. – P. 212–215.
- Wrzosek, L. et al. Bacteroides thetaiotaomicron and Faecalibacterium prausnitzii influence the production of mucus glycans and the development of goblet cells in the colonic epithelium of a gnotobiotic model rodent // BMC biology. – 2013. – Vol. 11, – P. 61. 98.
- Rakoff-Nahoum, S. et al. Recognition of commensal microflora by toll-like receptors is required for intestinal homeostasis // Cell. – 2004. – Vol. 118, № 2. – P. 229.
- Medzhitov, R., Janeway, C.A. Decoding the patterns of self and nonself by innate immune system // Science. – 2002. – Vol. 296. – P. 298-300. doi: 10.1126/science.1068881
- Koropatnick, T.A. et al. Microbial factor-mediated development in a host-bacterial mutualism // Science. – 2004. – Vol. 306. – P. 1186–1188.
- Becattini, S. Taur, Y., Pamer, E.G. Antibiotic-Induced Changes in the Intestinal Microbiota and Disease // Trends in Molecular Medicine. – 2016. – Vol. 22, № 6. – P. 458-478.
- Balmer, M.L. et al. Microbiota-derived compounds drive steady-state granulopoiesis via MyD88/TICAM signaling // J Immunol. – 2014. – Vol. 193, № 10. – P. 5273-5283.
- Khosravi, A. et al. Gut microbiota promote hematopoiesis to control bacterial infection // Cell Host Microbe. – 2014. – Vol. 15, № 3. – P. 374-381.
- Iwamura, C. et al. Sensing of the microbiota by NOD1 in mesenchymal stromal cells regulates murine hematopoiesis // Blood. – 2017. – Vol. 129, № 2. – P. 171-176.
- Inagaki, H. et al. Increased susceptibility to primary infection with Listeria monocytogenes in germfree mice may be due to lack of accumulation of L-selectin+ CD44+ T cells in sites of inflammation // Infect Immun. – 1996. – Vol. 64, № 8. – P. 3280-3287.
- Tada, T, et al. Level of myelopoiesis in the bone marrow is influenced by intestinal flora // Cell Immunol. – 1996. – Vol. 173, № 1. – P. 155-161.
- Zhang, D. et al. Neutrophil ageing is regulated by the microbiome // Nature. – 2015. – Vol. 525, № 7570. – P. 528-532.
- Josefsdottir, K.S. et al. Antibiotics impair murine hematopoiesis by depleting the intestinal microbiota // Blood. – 2017. – Vol. 129, № 6. – P. 729-739.
- Kostic, A.D., Xavier, R.J., Gevers, D. The microbiome in inflammatory bowel disease: current status and the future ahead // Gastroenterology. – 2014. – Vol. 146, № 6. – P. 1489-1499.
- Norman, J.M. et al. Disease-specific alterations in the enteric virome in inflammatory bowel disease // Cell. – 2015. – Vol. 160, № 3. – P. 447-460.
- Kishikawa, H. et al. Ulcerative colitis associated with aplastic anemia // Dig Dis Sci. – 2003. – Vol. 48, № 7. – P. 1376-1379.
- Sharma, B.C. et al. Hypoplastic anemia associated with ulcerative colitis in a child // J Pediatr Gastroenterol Nutr. – 1996. – Vol. 23, № 3. – P. 326-328.
- Herishanu, Y. et al. Leukocytosis in obese individuals: possible link in patients with unexplained persistent neutrophilia // Eur J Haematol. – 2006. – Vol. 76, № 6. – P. 516-520.
- Bellows, C.F. et al. Influence of BMI on level of circulating progenitor cells // Obesity (Silver Spring). – 2011. – Vol. 19, № 8. – P. 1722-1726.
- Blanton, L.V. et al. Childhood undernutrition, the gut microbiota, and microbiota-directed therapeutics // Science. – 2016. – Vol. 352, № 6293. – P. 1533.
- Smith, M.I. et al. Gut microbiomes of Malawian twin pairs discordant for kwashiorkor // Science – 2013. – Vol. 339, № 6119. – P. 548-554.
- el-Nawawy, A. et al. Evaluation of erythropoiesis in protein energy malnutrition // East Mediterr Health J. – 2002. – Vol. 8, № 2-3. – P. 281-289.
- Santos, E.W. et al. Hematological alterations in protein malnutrition // Nutr Rev. – 2017. – Vol. 75, № 11. – P. 909-919.
- Neftel, K.A., Hauser, S.P., Müller, M.R. Inhibition of granulopoiesis in vivo and in vitro by beta-lactam antibiotics // J Infect Dis. – 1985. – Vol. 152, № 1. – P. 90-98.
- Cash, H.L. et al. Symbiotic bacteria direct expression of an intestinal bactericidal lectin // Science (New York, N.Y.). – 2006. – Vol. 313, № 5790. – P. 1126–1130.
- Brandl, K. et al. Vancomycin-resistant enterococci exploit antibiotic-induced innate immune deficits // Nature. – 2008. – Vol. 455, № 7214. – P. 804–807.
- Kinnebrew, M.A. et al. Interleukin 23 production by intestinal CD103(+)CD11b(+) dendritic cells in response to bacterial flagellin enhances mucosal innate immune defense // Immunity. – 2012. – Vol. 36, № 2. – P. 276–287.
- Kinnebrew, M.A. et al. Bacterial flagellin stimulates Toll-like receptor 5-dependent defense against vancomycin-resistant Enterococcus infection // The Journal of Infectious Diseases. – 2010. – Vol. 201, № 4. – P. 534–543.
- Clarke, T.B. et al. Recognition of peptidoglycan from the microbiota by Nod1 enhances systemic innate immunity // Nature Medicine. – 2010. – Vol. 16, № 2. – P. 228–231.
- Deshmukh, H.S. et al. The microbiota regulates neutrophil homeostasis and host resistance to Escherichia coli K1 sepsis in neonatal mice // Nature Medicine. – 2014. – Vol. 20, № 5. – P. 524–530.
- Hill, D.A. et al. Commensal bacteria-derived signals regulate basophil hematopoiesis and allergic inflammation // Nature Medicine. – 2012. – Vol. 18, № 4. – P. 538–546.
- Ichinohe, T. et al. Microbiota regulates immune defense against respiratory tract influenza A virus infection // Proceedings of the National Academy of Sciences of the United States of America. – 2011. – Vol. 108, № 13. – P. 5354–5359.
- Abt, M.C. et al. Commensal bacteria calibrate the activation threshold of innate antiviral immunity // Immunity. – 2012. – Vol. 37, № 1. – P. 158–170.
- Ganal, S.C. et al. Priming of natural killer cells by nonmucosal mononuclear phagocytes requires instructive signals from commensal microbiota // Immunity. – 2012. – Vol. 37, № 1. – P. 171–186.
- Proietti, M. et al. ATP-gated ionotropic P2X7 receptor controls follicular T helper cell numbers in Peyer’s patches to promote host-microbiota mutualism // Immunity. – 2014. – Vol. 41, № 5. – P. 789–801.
- Бессмельцев, С.С., Абдулкадыров, К.М. Множественная миелома: руководство для врачей /М.: МК. – 2016. – 504 с.
- Семенова, Н.Ю., Артюхина, З.Е., Бессмельцев, С.С. Роль микроокружения костного мозга и сигнальные пути CXCR4/CXCL12 в развитии множественной миеломы // Вестник гематологии. – 2021. – Т. XVII, № 1. – С. 36-46.
- Landsverk, O.J. et al. Antibody-secreting plasma cells persist for decades in human intestine // J Exp Med. – 2017. – Vol. 214, № 2. – P. 309–317.
- Jian X, Zhu Y, Ouyang J, et al. Alterations of gut microbiome accelerate multiple myeloma progression by increasing the relative abundances of nitrogen-recycling bacteria // Microbiome– 2020.–Vol.8, №1. – P.74.
- Calcinotto A, Brevi A, Chesi M, et al. Microbiota-driven interleukin-17-producing cells and eosinophils synergize to accelerate multiple myeloma progression.// Nat Commun. – 2018. – Vol.9, №1.– Р. 4832. doi:10.1038/s41467-018-07305-8
- El Jurdi N, Filali-Mouhim A, Salem I, et al. Gastrointestinal Microbiome and Mycobiome Changes during Autologous Transplantation for Multiple Myeloma: Results of a Prospective Pilot Study // Biol Blood Marrow Transplant. – 2019. – Vol. 25, № 8. – P.1511-1519.
- Huang EY, Inoue T, Leone VA, et al. Using corticosteroids to reshape the gut microbiome: implications for inflammatory bowel diseases // Inflamm Bowel Dis. 2015 – Vol. 21, №5. – P. 963-972.


