Микробиом мочи и его влияние на стабильность коллоидных свойств у больных уролитиазом
Автор: Четвериков Андрей Валерьевич, Голощапов Евгений Тихонович, Белозеров Евгений Степанович
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 4, 2019 года.
Бесплатный доступ
Цель работы - изучить взаимосвязь микробиома мочи и структуры белка Тамма-Хорсфалла (БТХ) при уролитиазе, а также возможность их коррекции у больных с рецидивирующим течением заболевания. Материалы и методы. Клинико-лабораторный анализ проведен у 273 пациентов с мочекаменной болезнью, в т.ч. у 144 (52,8 %) мужчин и 129 (47,2 %) женщин возрастной группы 21-76 лет. Среди наблюдаемых пациентов у 142 (52,1 %) определен первичный уролитиаз, 131 (47,9 %) больной имел рецидивирующее течение, односторонний процесс отмечался у 210 (76,3 %) чел., билатеральный -у 63 (23,7 %). В рамках исследования из общего числа пациентов были отобраны 12 больных с рецидивирующим течением уролитиаза для проведения комплексной противорецидивной терапии, среди которых 7 (58,3 %) мужчин и 5 (41,7 %) женщин в возрасте 37-52 лет. У 3 (25 %) пациентов имело место спонтанное отхождение конкрементов после литокинетической терапии, 9 пациентов - после перенесенного оперативного лечения (8 пациентов после КУЛТ, 1 пациент после ПНЛТ), все пациенты имели длительность заболевания >3 лет...
Мочекаменная болезнь, уролитиаз, коррекция микробиоты при уролитиазе, микробиота мочи, белок тамма-хорсфалла
Короткий адрес: https://sciup.org/14116404
IDR: 14116404 | УДК: 616.6-082 | DOI: 10.34014/2227-1848-2019-4-74-81
Текст научной статьи Микробиом мочи и его влияние на стабильность коллоидных свойств у больных уролитиазом
Введение. Ранее проведенные нами исследования показали [1, 2], что в стране на фоне роста общей заболеваемости населения и заболеваемости мочеполовой системы прослеживается рост показателей инцидентности и превалентности мочекаменной болезни. Показатели первичной заболеваемости и распро- страненности в Санкт-Петербурге выше, чем показатели по Северо-Западному федеральному округу, уровень которых в свою очередь превышает таковые по Российской Федерации. При этом заболеваемость мочекаменной болезнью в Санкт-Петербурге характеризуют следующие показатели:
– среди больных 98,1 % составляет взрослое население: на возрастную группу 30– 59 лет приходится 78 % больных;
-
– имеют место весенний и осенний подъемы регистрации больных;
-
– больные мочекаменной болезнью составляют 29 % пациентов урологического стационара;
-
– среди госпитализированных мужчин чаще встречаются пациенты возрастной группы 40–49 лет, среди женщин – 50–59 лет.
Среди удаленных мочевых камней в 82 % случаев были кальциевые, в 9 % – струвитные, в 7 % – мочекислые, в 2 % – цистиновые; среди кальциевых камней 88 % были представлены оксалатами кальция, 8 % – фосфатами кальция и 4 % – смешанными вариантами.
У пациентов, госпитализированных в урологический стационар по поводу мочекаменной болезни, инфекционно-воспалительные заболевания мочевыводящих путей диагностированы по данным клинической картины в 53,8 % случаев, при проведенном тщательном клинико-лабораторном обследовании с использованием стандартных бактериологических методов – в 82,8 % случаев и при использовании газовой хроматографии – масс-спектрометрии (ГхМС), выполненной в лицензированной специализированной лаборатории, – в 100 % случаев. При этом микробные маркеры 57 представителей бактерий, вирусов и грибов методом ГхМС выявляются во всех химических видах мочевых камней с существенным отличием по количественным показателям в зависимости от характеристики микробиоты мочи.
Исследованиями последних лет в патогенезе уролитиаза установлена роль инфекционного фактора, введено понятие «инфекционные камни» [3, 4], показана роль белка Тамма– Хорсфалла (уромодулина) как основного стабилизатора коллоидных свойств мочи, обладающего протективными свойствами в отношении уропатогенов [5, 6]. Также доказано, что в процессе камнеобразования происходит нарушение гемодинамики в виде гиповолемии различного генеза, изменений антикоагулянтной и фибринолитической активности крови [7, 8].
Однако до сих пор отсутствует единая концепция процессов литогенеза. Большин- ство ученых считает, что мочекаменная болезнь является мультикомпонентным заболеванием [9–11], имеющим сложные многообразные механизмы развития и различные химические формы мочевых камней. Описано свыше 200 различных патологических состояний, которые могут сопровождаться образованием конкрементов в органах мочевой системы [12, 13].
Мы разделяем взгляд ученых, акцентирующих внимание на роли мочевой микробиоты, представляющей собой совокупность микроорганизмов, которые в норме и при патологии сосуществуют в мочевом тракте, участвуют в физиологических и патофизиологических реакциях [14–16]. Дисбаланс представителей микробиоты может быть одним из ключевых звеньев патогенеза мочекаменной болезни [17], воздействуя на который возможно повысить эффективность лечения и ме-тафилактики заболевания.
Цель исследования. Изучить взаимосвязь микробиома мочи и структуры белка Тамма–Хорсфалла (БТХ) при уролитиазе, а также возможность их коррекции у больных с рецидивирующим течением заболевания.
Материалы и методы. Клинико-лабораторный анализ проведен у 273 пациентов с мочекаменной болезнью (МКБ), в т.ч. у 144 (52,8 %) мужчин и 129 (47,2 %) женщин возрастной группы 21–76 лет. Среди наблюдаемых пациентов у 142 (52,1 %) определен первичный уролитиаз, 131 (47,9 %) больной имел рецидивирующее течение, односторонний процесс диагностирован у 210 (76,3 %) чел., билатеральный – у 63 (23,7 %).
В рамках исследования из общего числа пациентов были отобраны 12 больных с рецидивирующим течением уролитиаза для проведения комплексной противорецидивной терапии: 7 (58,3 %) мужчин и 5 (41,7 %) женщин в возрасте 37–52 лет. У 3 (25 %) пациентов имело место спонтанное отхождение конкрементов после литокинетической терапии, 9 пациентов – после перенесенного оперативного лечения (8 пациентов после КУЛТ, 1 пациент после ПНЛТ), все пациенты имели длительность заболевания не менее 3 лет. Контрольную группу составили 35 практически здоровых лиц.
Пациентам, наряду со стандартным клиническим исследованием, принятым в рутинной урологической практике, проводилось определение микробиоты мочевых камней и мочи с использованием ГхМС с определением микробных маркеров бактерий (в т.ч. анаэробных), вирусов, грибов. Для определения размеров и структуры комплексов БТХ использовали метод динамического светорассеивания (ДСР) при программируемом охлаждении пробы мочи.
Результаты и обсуждение. Исследование мочи пациентов с уролитиазом, проведенное методом ГхМС, показало, что у всех пациентов заболевание протекает на фоне высо- кого уровня общей бактериальной нагрузки, а микробиом представлен большой группой микроорганизмов (вирусов, бактерий, грибов): облигатными патогенами, факультативными и транзиторными микроорганизмами. В моче здоровых людей из 57 изучаемых микробных маркеров не выявлено 26 (45,6 %).
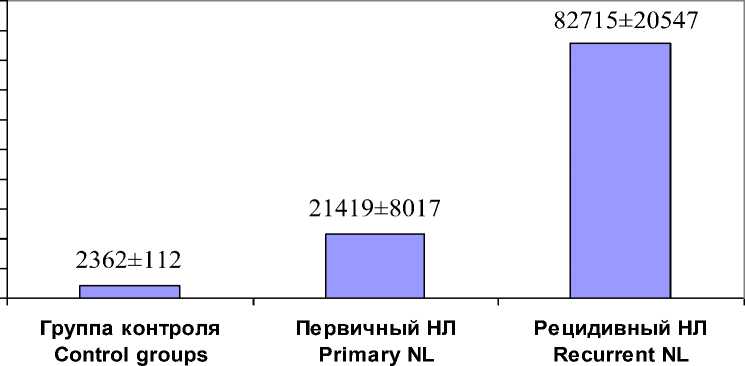
Определено, что в моче группы контроля общая бактериальная нагрузка составляет 2362±1125 к.ед., а моча пациентов с рецидивирующим уролитиазом характеризуется крайне высокой общей бактериальной нагрузкой, которая составила 82715±20547 к.ед., в то время как у пациентов с первичным уролитиазом этот показатель ниже – 21419±8017 к.ед. (рис. 1).
э 60000
ЕС 50000
10000 0
-
□ Общая бактериальная нагрузка Total bacterial load
Рис. 1. Показатель общей бактериальной нагрузки в исследуемых группах (к.ед.)
Fig. 1. Total bacterial load in the studied groups (number of units)
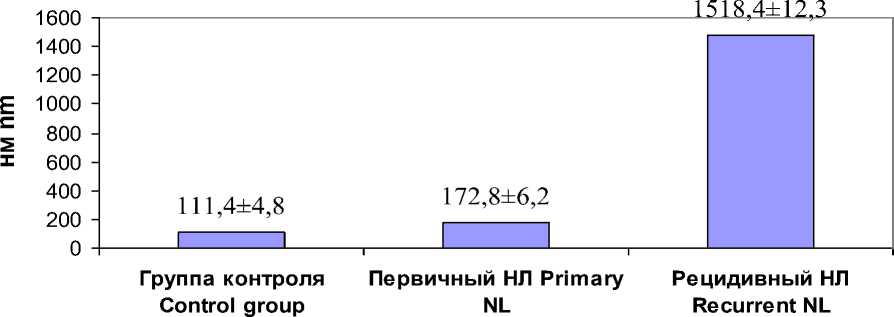
Применив метод динамического свето-рассеивания, мы получили схожие результаты и определили, что у пациентов с первичным уролитиазом размер молекулы БТХ составляет 172,8±6,2 нм, а у больных с рецидивирующим течением значимо больше – 1518,4±12,3 нм, тогда как в контрольной группе – 111,4±4,8 нм (рис. 2).
В качестве комплексной терапии мы применили следующую схему: амид никотиновой кислоты 250 мг 1 р./сут (длительность приема –
30 дней) + СМТ-терапия № 10 (длительность сеанса – 20 мин), через 5 дней к лечению добавили «Канефрон Н» по 2 драже 3 р./сут (длительность приема – 30 дней) + урологические сборы по 1/2 стакана 4 р./сут (длительность приема – 20 дней), спустя еще 10 дней добавили «Блемарен» (целевое рН 6,4–6,8) и спустя 5 дней – «Фуразидин» по 100 мг 3 р./сут в течение 10 дней с последующим снижением дозировки до 50 мг 3 р./сут в течение еще 5 дней (рис. 3).
□ Размер молекул БТХ The size of THP molecules
Рис. 2. Размер молекулы БТХ в исследуемых группах, нм
Fig. 2. THP molecule size in the studied groups, nm
Амид никотиновой кислоты 250 мг/день, 30 дней Nicotinic acid amide 250 mg/day, 30 days
+
СМТ-терапия № 10
Сеанс 20 мин
SMT-therapy No. 10
Session 20 minutes
Через 5 дней добавили к лечению After 5 days added to the treatment
Экстракт золототысячника, любистока, розмарина
-
2 драже × 3 р./день, 30 дней Extract of millennia, lovage, rosemary
-
2 dr. × 3 times/day, 30 days
+
Фитосборы урологические по 1/2 стакана × 4 р./день, 20 дней
Herbal tea urological 1/2 cup × 4 times/day, 20 days
Через 10 дней добавили к лечению After 10 days added to the treatment
Цитратная смесь (лимонная кислота, калия бикарбонат, натрия цитрат) (целевое pH 6,4–6,8) Citrate mixture (citric acid, potassium bicarbonate, sodium citrate) (target pH of 6.4 to 6.8)
Через 10 дней добавили к лечению After 10 days added to the treatment
Фуразидин 100 мг × 3 р./день, 10 дней, затем 50 мг × 3 р./день, 5 дней Furazidine 100 mg × 3 times/day, 10 days, then 50 mg × 3 times/day, 5 days
Рис. 3. Схема использованной комплексной противорецидивной терапии
Fig. 3. The scheme of complex anti-relapse therapy
После проведенного курса лечения по данным метода ГхМС отмечено статистически значимое снижение уровня общей бактериальной нагрузки до 6317±239 к.ед., а по данным метода ДСР определено существенное уменьшение размеров комплексов БТХ до значений 177,6±6,4 нм.
Выводы. На основании полученных в результате исследования данных можно гово- рить о наличии прямой корреляционной связи между уровнем общей бактериальной нагрузки и размерами комплексов белка Тамма– Хорсфалла. Использование комплексной противорецидивной терапии позволяет снизить показатели общей бактериальной нагрузки мочи, что приводит к повышению стабильности молекулы БТХ и позволяет уменьшить частоту рецидивов мочекаменной болезни.
Список литературы Микробиом мочи и его влияние на стабильность коллоидных свойств у больных уролитиазом
- Белозеров Е.С., Четвериков А.В. Инфекционный компонент мочекаменной болезни. Научный медицинский вестник. 2016; 2 (4): 17-27.
- Четвериков А.В., Белозеров Е.С. К вопросу инфекционного фактора в генезе и течении мочекаменной болезни. Ульяновский медико-биологический журнал. 2017; 2.
- Miano R., Germani S., Vespasiani G. Stones and urinary tract infections. Urol. Int. 2007; 79 (suppl. 1): 32-36.
- Чухловин А.Б., Эмануэль Ю.В., Напалкова О.В., Ланда С.Б., Эмануэль В.Л. Роль локальных инфекций в генезе мочекаменной болезни. Нефрология. 2011; 15 (3): 11-17.
- Zasloff M. Antimicrobial peptides, innate immunity and the normally sterile urinary tract. J. Am. Soc. Nephrol. 2007; 18 (11): 2810-2816.
- Голощапов Е.Т., Лукичев Г.Б., Игнашов Ю.А. Особенности нарушения гемостаза и фибринолиза при различных клинических формах мочекаменной болезни. Урологические ведомости. 2013; 3 (1): 8-11.
- Голощапов Е.Т., Глазунова Е.В., Савенкова Т.А. Профилактика камнеобразования при двустороннем рецидивирующем нефролитиазе. Нефрология. 2008; 12 (3): 89-94.
- Шестаев А.Ю., Паронников М.В., Протощак В.В. Метаболизм оксалата и роль oxalobacter formigenes в развитии мочекаменной болезни. Экспериментальная и клиническая урология. 2013; 2: 68-72.
- Голощапов Е. Т. Прогнозирование и доклиническая диагностика риска мочевого камнеобразования с использованием биофизических технологий. Урологические ведомости. 2016; 2: 11-15.
- Балалаева И.Ю., Ширяева Л.И., Швырев А.П., Буданова М.В., Стольникова Т.Г., Евтухова О.В. Частота и возможные причины мочекаменной болезни у детей и подростков с сахарным диабетом. Прикладные информационные аспекты медицины. 2016; 19 (4): 151-155.
- Аляев Ю.Г., Руденко В.И. Современные аспекты медикаментозного лечения пациентов с мочекаменной болезнью. Эффективная фармакотерапия. 2016; 41: 10-15.
- Knoll T. Epidemiology, Pathogenesis, and Pathophysiology of Urolithiasis. Eur. Urol. Suppl. 2010; 9: 802-806.
- Ченина И.Н., Неймарк А.И., Неймарк Б.А. Патогенное минералообразование в почках и слюнных железах. Экспериментальная и клиническая урология. 2010; 4: 30-31.
- Никонов Е.Л., Гуревич К.Г. Микробиота различных локусов организма: научный доклад. М.; 2017. 38.
- Кунгурцева Е.А., Лещенко О.Я., Приставка А.А. Сравнительная характеристика микробиоты носоглотки и вагинального биотопа у женщин с репродуктивными нарушениями. Acta Biomedica Scientifica. 2016; 5 (111): 160-164.
- Cox A.J. Obesity, inflammation, and the gut microbiota. Lancet Diabetes Endocrinol. 2015; 3: 207-215.
- Кунгурцева Е.А., Лещенко О.Я., Джиоев Ю.П., Аталян А.В., Немченко У.М. Детекция генов патогенности симбионтной микрофлоры смежных биотопов у женщин с хроническим эндометритом и репродуктивными нарушениями. Acta Biomedica Scientifica. 2015; 3 (103): 43-47.


