Микробиота кишечника - новое звено в патогенезе остеоартрита (обзор литературы)
Автор: Корнева Ю.С., Борисенко М.В., Деев Р.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Обзоры и лекции
Статья в выпуске: 1 т.39, 2024 года.
Бесплатный доступ
Кишечная микробиота (КМБ) может опосредованно на системном уровне влиять на протекание остеартрита (ОА) за счет стимуляции хронической неспецифической воспалительной реакции в синовиальной оболочке и субхондральной кости. Ее причиной является повышение количества циркулирующих липополисахаридов (ЛПС) бактериальной стенки. КМБ может также провоцировать развитие метаболического синдрома, что связывает две необходимые составляющие патогенеза ОА. Результатом прямого воздействия КМБ является формирование синдрома повышенной кишечной проницаемости (leaky gut syndrome) с активацией ЛПС бактериальной стенки и слабовыраженного воспаления, провоцирующего выработку провоспалительных цитокинов. Их воздействие активирует синовиоциты и хондроциты с последующей продукцией IL-6 и IL-8, что способствует персистенции воспаления. Корреляционный анализ показал связь трех таксонов с поражением суставов ОА. Порядок Desulfovibrionales и род Ruminiclostridium 5 связан с ОА коленного сустава, семейство Methanobacteriaceae - как с ОА коленного сустава, так и ОА любой локализации. Появление и степень обсемененности родом Streptococcus коррелировали с выраженностью болевого синдрома. Метаболический синдром может как провоцировать развитие дисбактериоза, так и являться его следствием. Изменение состава микробиоты в виде преобладания рода Clostridium и вида Staphylococcus aureus при снижении разнообразия микроорганизмов ассоциировано с увеличением количества жировой ткани в организме, дислипидемией, инсулинорезистентностью с нарушениями углеводного обмена. Низкие уровни ЛПС в крови обнаруживаются у пациентов с ожирением даже при отсутствии явного очага инфекции из-за нарушений в КМБ, они подают сигналы на TLR-4, запуская системное воспаление. В исследованиях было показано положительное влияние назначения прои пребиотиков на течение ОА, что делает КМБ перспективной мишенью лечения и профилактики ОА.
Остеоартрит, дисбактериоз, метаболический синдром, кишечная микробиота
Короткий адрес: https://sciup.org/149144793
IDR: 149144793 | УДК: 616.72-002-092:616.34-008.87 | DOI: 10.29001/2073-8552-2024-39-1-38-43
Текст обзорной статьи Микробиота кишечника - новое звено в патогенезе остеоартрита (обзор литературы)
Корнева Ю.С., Борисенко М.Б., Деев Р.В. Микробиота кишечника – новое звено в патогенезе остеоартрита (обзор литературы). Сибирский журнал клинической и экспериментальной медицины. 2024;39(1):38–43.
Korneva Yu.S., Borisenko M.V., Deev R.V. Gut microbiota – a new link in the pathogenesis of osteoarthritis (literature review). The Siberian Journal of Clinical and Experimental Medicine. 2024;39(1):38–43.
Остеоартрит (ОА) является одним из наиболее распространенных заболеваний опорно-двигательного аппарата, которое характеризуется прогрессирующим течением с постепенным нарушением статодинамической функции у пациента и значительным снижением качества жизни. Около 240 млн человек в мире страдают от этого заболевания [1, 2]. Экономическая составляющая значимости ОА обусловлена дороговизной лечения из-за невысокой эффективности консервативной терапии и прогрессирующего разрушения суставных поверхностей, требующего протезирования пораженных суставов [3].
В патогенезе ОА описаны несколько последовательных этапов. В ответ на патологическое воздействие изначально происходит реактивная гипертрофия хондроцитов, которая сопровождается повышением секреции катаболических факторов с уменьшением синтеза хрящевых протеогликанов. В процессе дегенерации хряща наблюдается активация остеокластов с разрушением субхондральной кости. Патологические регенеративные изменения включают образование остеофитов, дегенерацию связок и менисков и утолщение суставной капсулы [4, 5]. Основными клиническими проявлениями у пациента являются боль и снижение подвижности сустава.
Клеточный состав синовиальной жидкости при ОА классифицируется как «невоспалительный», но количественное содержание лейкоцитов в ней может варьировать в широком диапазоне (т. е. от 100 до 2000 на мл, но не выше этих значений) [6], в основном они представлены макрофагами и Т-лимфоцитами, которые также определяются в инфильтрате синовиальной оболочки. Однако воспалительные изменения в тканях суставов больных ОА доказаны с помощью современных методов визуализа- ции, но проявления их намного менее выражены по сравнению с другими артритами. Связь выраженности воспалительных изменений с прогрессированием заболевания также доказана, а многие цитокины уже используются в качестве биомаркеров степени тяжести ОА. Несмотря на имеющуюся доказательную базу, остается открытым вопрос, какие механизмы преобладают при развитии и прогрессировании воспаления в суставе при ОА и как наиболее эффективно их скорректировать терапевтически [6].
Доказано, что кишечная микробиота (КМБ) участвует в регулировании и поддержании гомеостаза, процессов основного обмена, функций иммунной системы, а также выработке цитокинов и нейромедиаторов [7]. На системном уровне она может опосредованно влиять на протекание ОА за счет стимуляции хронической неспецифической воспалительной реакции на иммунной основе как в жировой ткани, так и в синовиальной оболочке и субхондральной кости, причиной которой является повышение количества циркулирующих липополисахаридов (ЛПС) бактериальной стенки [8–10], а также провоцировать развитие метаболического синдрома, что связывает две необходимые составляющие патогенеза ОА [11]. Учитывая необходимость определения профилактических и терапевтических вмешательств, нацеленных на модификацию патогенеза ОА, Европейское общество по клиническим и экономическим аспектам остеопороза, остеоартрита и заболеваний опорно-двигательного аппарата (ESCEO) созвало рабочую группу экспертов для рассмотрения потенциального вклада КМБ в развитие ОА, поскольку роль КМБ подтверждается исследованиями как на животных моделях ОА, так и у людей [11].
Цель данного обзора: систематизация данных о роли микробиоты кишечника в патоморфогенезе ОА, связанной с активацией воспалительного процесса в суставе при влиянии других установленных факторов риска, в первую очередь ожирения.
Факторы риска и их патогенетическое значение для ОА
Выделяют следующие факторы риска развития ОА: возраст старше 65 лет, нарушение соотношения суставных поверхностей, травмы в анамнезе, хирургические вмешательства на суставах, избыточная масса тела, сопровождающаяся увеличением объема адипоцитов, стимулирующих выработку провоспалительных цитокинов [12], и накоплением в жировой ткани макрофагов провос-палительного фенотипа (М1), а также развитие эндотелиальной дисфункции.
Провоспалительные макрофаги жировой ткани способны запускать развитие хронического системного и местного воспаления с повышением содержания про-воспалительных цитокинов, в том числе в синовиальной жидкости [12, 13]. Среди цитокинов, выделяемых жировой тканью у пациентов с избыточной массой тела, способных активировать выработку провоспалительных факторов и матриксных металлопротеиназ, выделяют адипоцитокины (лептин, адипонектин, резистин, чеме-рин, IL-6, TNF-α), рецепторы к которым экспрессируют хондроциты, макрофаги и лимфоциты. Таким образом, адипоцитокины способствуют воспалению синовиальной оболочки, дегенерации хряща и разрушению субхондральной кости, обусловливая патогенез ОА [13].
Дополнительным фактором выработки адипокинов является увеличение количества жировой ткани с воз- растом, в том числе в интрапателлярных жировых отложениях, которые являются основным источником адипоцитокинов в коленном суставе. С возрастом клетки суставов подвергаются старению, вызванному репликативным истощением, укорочением теломер, окислительным стрессом и повреждением хроматина во время ОА. Одной из характерных особенностей стареющих клеток является то, что они экспрессируют факторы секреторного фенотипа, связанные со старением (SASPs) [14]. Количество IL-6 и TNF-α – адипоцитокинов, определяемых как истинные SASPs, повышается в синовиальной жидкости при ОА [4], они легко проникают в хрящ и активируют дегенеративный каскад [13]. С возрастом наблюдается снижение бактериального разнообразия КМБ, а также изменение доминирующих видов и снижением количества полезных с преобладанием бактероидов и обилия Clostridium [15], что обосновывает возраст как фактор риска развития ОА с точки зрения изменения КМБ.
Патогенетическое обоснование участия микробиоты кишечника в становлении и прогрессии ОА
КМБ – это совокупность популяций кишечных микробов, обладающих множеством местных и отдаленных эффектов на организм. В норме ее основными представителями являются Firmicutes и Bacteroidetes , за которыми следуют Verrucomicrobia, Actinobacteria, Fusobacteria, Proteobacteria и Cyanobacteria [16]. КМБ обладает прямыми и опосредованными эффектами, оказывающими системное влияние при ОА. Результатом прямого воздействия является формирование синдрома повышенной кишечной проницаемости – leaky gut syndrome [17] с активацией ЛПС бактериальной стенки слабовыра-женного воспаления, провоцирующего выработку про-воспалительных цитокинов [7], воздействие которых на синовиоциты и хондроциты приводит к их активации с последующей продукцией IL-6 и IL-8, что способствует персистенции воспаления при снижении активности регуляторных T-лимфоцитов [18].
Z. Huang и V.B. Kraus (2016) сформулировали модель «двойного удара» патогенеза ОА, в которой первым фактором является активация макрофагов ткани сустава посредством ЛПС через Toll-like receptor 4 (TLR-4), а второй – это активация макрофагов молекулярными паттернами, связанными со структурным повреждением суставов [19]. Было показано, что уровень ЛПС от КМБ в крови и синовиальной жидкости коррелировал с тяжестью течения ОА и выраженностью воспаления [20].
Среди цитокинов, поддерживающих хроническое воспаление, выделяют IL-1β, IL-6, IL-8, TNF-a, IL-2, IL-7, IL-15, IL-21 и MIP-1α, которые активируют матриксную металлопротеиназу-13, вызывающую дегенерацию хрящевой ткани, что замыкает цепь патогенеза [7, 17, 21]. В исследованиях было показано, что истощение КМБ, вызванное приемом антибиотиков, может облегчить прогрессирование ОА [21]. По мнению других исследователей, наоборот, истощение КМБ может замедлить развитие ОА за счет уменьшения степени воспаления и снижения экспрессии белков, модулирующих сигнальный путь Wnt [22].
X.-H. Yu и соавт. (2021) в исследовании использовали сводные статистические данные крупномасштабных общегеномных ассоциативных исследований (GWAS) для оценки причинно-следственной связи между составом микробиоты кишечника и риском развития ОА. Путем корреляционного анализа была доказана связь трех таксонов с поражением суставов ОА, а именно порядок Desulfovibrionales и род Ruminiclostridium 5 – с ОА коленного сустава, семейство Methanobacteriaceae – как с ОА коленного сустава, так и с ОА любой локализации [23]. Появление и степень обсемененности родом Streptococcus коррелировали с выраженностью болевого синдрома [24]. Y. Zhao и соавт. (2018) подтвердили наличие бактериальных нуклеиновых кислот в синовиальной жидкости и синовиальной оболочке пациентов с ОА. Вполне вероятно, что эти бактерии, выявляющиеся в суставах, переносятся из кишечника через поврежденный кишечный барьер [25].
Связь ОА с нарушением микробиоты кишечника и метаболическим синдромом
Опосредованным механизмом, благодаря которому нарушение состава КМБ может способствовать развитию ОА, является развитие метаболического синдрома, для которого характерны абдоминальное ожирение, инсулиноре-зистентность и гиперлипидемия. Метаболический синдром может как провоцировать развитие дисбактериоза, так и являться его следствием. Низкие уровни ЛПС в крови обнаруживаются у пациентов с ожирением даже при отсутствии явного очага инфекции из-за нарушений в КМБ, они подают сигналы на TLR-4, запуская системное воспаление [6].
Изменение состава микробиоты в виде преобладания рода Clostridium и вида Staphylococcus aureus при снижении разнообразия микроорганизмов ассоциировано с увеличением количества жировой ткани в организме, дислипидемией, инсулинорезистентностью с нарушениями углеводного обмена. Изменения микробиоты приводят к повышению количества циркулирующих ЛПС бактериальной стенки и, как следствие, к развитию хронической неспецифической воспалительной реакции на иммунной основе в жировой ткани, синовиальной оболочке, субхондральной кости [8–10].
При метаболическом синдроме измененный состав микробиоты кишечника способствует повышению проницаемости кишечного эпителия, а снижение количества бифидобактерий подавляет продукцию глюкагоноподобного пептида-2, вследствие чего уменьшается количество плотных контактов в эпителии, что способствует развитию эндотоксемии с выходом ЛПС в кровоток [17]. Помимо этого жировая ткань содержит резидентные макрофаги, которые способны поддерживать системное воспаление низкой степени активности за счет выделения провоспа-лительных цитокинов IL-1β, TNF-α, IL-23 [17].
Исследование K. H. Collins и соавт. (2015) в моделях на крысах показало связь между началом метаболических изменений, составом микробиоты и развитием ОА. При увеличении количества жировой ткани в организме происходило уменьшение числа бактерий вида Lactobacillus casei при увеличении количества представителей рода Methanobrevibacter, вследствие чего увеличивалось количество циркулирующих ЛПС, наблюдалось системное воспаление жировой ткани с последующим повышением содержания провоспалительных цитокинов (IL-1α, CXCL-10, MIP-1), что запускало воспалительный процесс в суставе [26]. Z. Huang и соавт. (2020) трансплантировали в кишечник стерильных мышей с моделированным посттравматическим ОА образцы кала от пациентов с ОА без метаболического синдрома и пациентов с ОА и метаболическим синдромом, что усугубляло гистопатологические изменения в поврежденных суставах [27].
Схематично роль КМБ в патогенезе ОА представлена на рисунке 1.
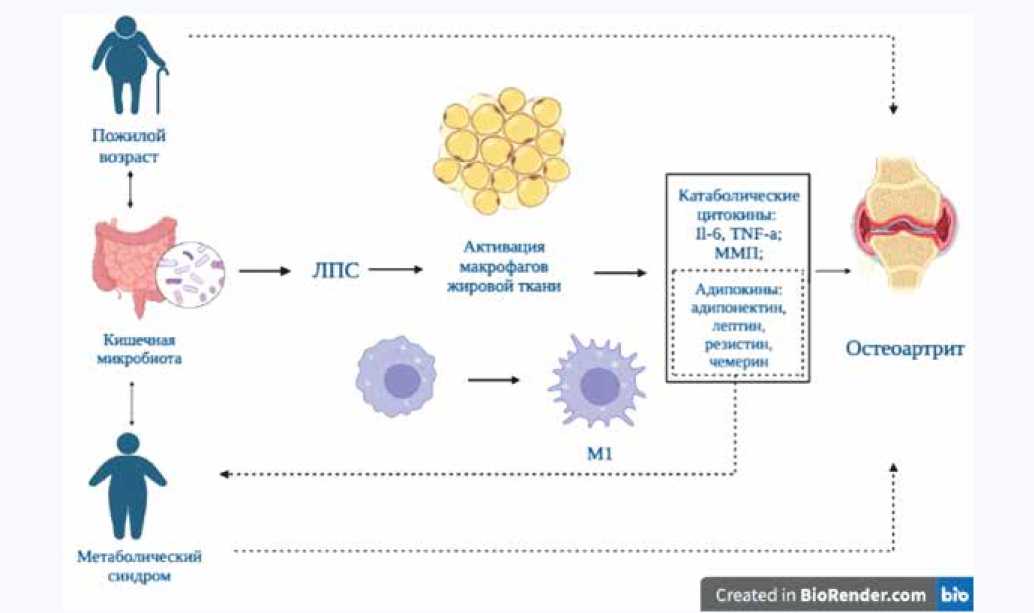
Рис. 1. Схематическое представление участия кишечной микробиоты в потенцировании факторов риска и патогенезе остеартрита
Fig. 1. Schematic representation of intestinal microbiota participation in potentiation of risk factors and pathogenesis of ostearthritis
Новые методы профилактики и лечения ОА, основанные на модулировании состава микробиоты
Вышеописанная и подтвержденная в эксперименте роль КМБ в патогенезе ОА дает обоснование для разработки новых способов профилактики, либо потенциальных методов влияния на течение воспалительных и дегенеративных изменений синовиальной оболочки, хряща и субхондральной кости [13]. Введение в рацион пациентов пробиотиков и пребиотиков оказывает влияние на различные звенья патогенеза и клиническое течение ОА.
Так, снижению проницаемости эпителиального барьера кишечника и развитию эндотоксемии способствует применение в качестве пребиотиков смеси ксилоолигосахаридов (XOS), инулина и пребиотической клетчатки, которые стимулируют рост колоний бифидобактерий. Эффектом применения данной комбинации является снижение эндотоксемии и воспаления жировой ткани, а также циркуляции в крови таких воспалительных цитокинов, как IL-1, IL-6, что предотвращает прогрессирование метаболических нарушений и уменьшает проявления изменений в пораженном суставе [10, 28]. Полиненасыщен-ные жирные кислоты в составе пребиотиков стимулируют колонизацию кишечника синбиотическими бактериями и уменьшают местное и системное воспаление, связанное с ОА, замедляя разрушение хряща и изменение субхондральной кости [29].
Положительным эффектом в отношении уменьшения системного воспаления обладают культуры Bifidobacterium longum, Lactobacillus reuteri и Lactobacillus rhamnosus, которые снижают содержание провоспали-тельных цитокинов (IL-1β, IL-2, IL-6, IL-12, IL-17, интерфе-рона-гамма (IFN-δ), циклооксигеназы 2 (COX-2) и TNF-α) в сыворотке крови, что препятствует прогрессированию деструкции хряща и снижает выраженность инфильтрации синовиальной оболочки клетками воспаления [30–33]. Способность синбиотических бактерий Bifidobacterium breve ферментировать олигосахариды с образованием короткоцепочечных жирных кислот, которые обладают провоспалительным эффектом, также облегчает клиническое течение ОА за счет вышеперечисленных механизмов [24, 34–36].
Использование пробиотиков c Lactobacillus acidophilus уменьшает выраженность болевого синдрома при ОА за счет участия в подавлении синтеза матриксных металлопротеиназ, провоспалительных цитокинов (IL-1β, TNF-α, NFκ-B и NLRP3) , ноцицептивных медиаторов (VEGF, NGF, артемин и GFRα-3), катаболических ферментов (RUNX2 и MMP13) в моделях на мышах [37]. Было отмечено клинически значимое снижение болевых ощущений у пациентов с ОА при применении Lactobacillus rhamnosus , Saccharomyces cerevisiae и Bifidobacterium animalis ssp. lactis [38].
Заключение
КМБ, вероятно, является одним из факторов, влияющих на патогенез и клиническое течение ОА. Изучение изменений качественного и количественного состава микробиоты может впоследствии выделить их в качестве прогностических маркеров и использовать как возможную мишень для профилактики развития и прогрессирования ОА, а также ослабления влияния факторов риска развития ОА. Необходимы дальнейшие исследования, нацеленные на изучение КМБ или ее метаболитов, чтобы перейти от симптоматического лечения ОА к индивидуальным вмешательствам, направленным на его патогенез.
Список литературы Микробиота кишечника - новое звено в патогенезе остеоартрита (обзор литературы)
- Katz J.N., Arant K.R., Loeser R.F. Diagnosis and Treatment of Hip and Knee Osteoarthritis: A Review. JAMA. 2021;325(6):568-578. https://doi.org/10.1001/jama.2020.22171.
- Vina E.R., Kwoh C.K. Epidemiology of osteoarthritis: literature update. Curr. Opin. Rheumatol. 2018;30(2):160-167. https://doi.org/10.1097/BOR.0000000000000479.
- Glyn-Jones S., Palmer A.J., Agricola R., Price A.J., Vincent T.L., Weinans H. et al. Osteoarthritis. Lancet. 2015;386(9991):376-387. https://doi.org/10.1016/S0140-6736(14)60802-3.
- Xia B., Di C., Zhang J., Hu S., Jin H., Tong P. Osteoarthritis pathogenesis: a review of molecular mechanisms. Calcif. Tissue Int. 2014;95(6):495- 505. https://doi.org/10.1007/s00223-014-9917-9.
- Robinson W.H., Lepus C.M., Wang Q., Raghu H., Mao R., Lindstrom T.M. et al. Low-grade inflammation as a key mediator of the pathogenesis of osteoarthritis. Nat. Rev. Rheumatol. 2016;12(10):580-592. https://doi.org/10.1038/nrrheum.2016.136.
- Scanzello C.R. Role of low-grade inflammation in osteoarthritis. Curr. Opin. Rheumatol. 2017;29(1):79-85. https://doi.org/10.1097/BOR.0000000000000353.
- Huang Z., Chen J., Li B., Zeng B., Chou C.H., Zheng X. et al. Faecal microbiota transplantation from metabolically compromised human donors accelerates osteoarthritis in mice. Ann. Rheum. Dis. 2020;79(5):646- 656. https://doi.org/10.1136/annrheumdis-2019-216471.
- Le Chatelier E., Nielsen T., Qin J., Prifti E., Hildebrand F., Falony G. et al. Richness of human gut microbiome correlates with metabolic markers. Nature. 2013;500(7464):541-546. https://doi.org/10.1038/nature12506.
- Ghoshal S., Witta J., Zhong J., de Villiers W., Eckhardt E. Chylomicrons promote intestinal absorption of lipopolysaccharides. J. Lipid Res. 2009;50(1):90-97. https://doi.org/10.1194/jlr.M800156-JLR200.
- Cani P.D., Neyrinck A.M., Fava F., Knauf C., Burcelin R.G., Tuohy K.M., et al. Selective increases of bifidobacteria in gut microflora improve highfat-diet-induced diabetes in mice through a mechanism associated with endotoxaemia. Diabetologia. 2007;50(11):2374-2383. https://doi.org/10.1007/s00125-007-0791-0.
- Biver E., Berenbaum F., Valdes A.M., Araujo de Carvalho I., Bindels L.B., Brandi M.L. et al. Gut microbiota and osteoarthritis management: An expert consensus of the European society for clinical and economic aspects of osteoporosis, osteoarthritis and musculoskeletal diseases (ESCEO). Ageing Res. Rev. 2019;55:100946. https://doi.org/10.1016/j.arr.2019.100946.
- Azamar-Llamas D., Hernández-Molina G., Ramos-Ávalos B., Furuzawa-Carballeda J. Adipokine contribution to the pathogenesis of osteoarthritis. Mediators Inflamm. 2017;2017:5468023. https://doi.org/10.1155/2017/5468023.
- Xie C., Chen Q. Adipokines: new therapeutic target for osteoarthritis? Curr. Rheumatol. Rep. 2019;21(12):71. https://doi.org/10.1007/s11926-019-0868-z.
- Mobasheri A., Matta C., Zákány R., Musumeci G. Chondrosenescence: definition, hallmarks and potential role in the pathogenesis of osteoarthritis. Maturitas. 2015;80(3):237-244. https://doi.org/10.1016/j.maturitas.2014.12.003.
- O’Toole P.W., Jeffery I.B. Gut microbiota and aging. Science. 2015;350(6265):1214-1215. https://doi.org/10.1126/science.aac8469.
- Hao X., Shang X., Liu J., Chi R., Zhang J., Xu T. The gut microbiota in osteoarthritis: where do we stand and what can we do? Arthritis Res. Ther. 2021;23(1):42. https://doi.org/10.1186/s13075-021-02427-9.
- Ramires L.C., Santos G.S., Ramires R.P., da Fonseca L.F., Jeyaraman M., Muthu S. et al. The Association between gut microbiota and osteoarthritis: Does the disease begin in the gut? Int. J. Mol. Sci. 2022;23(3):1494. https://doi.org/10.3390/ijms23031494.
- Chow Y.Y., Chin K.Y. The role of inflammation in the pathogenesis of osteoarthritis. Mediators Inflamm. 2020;2020:8293921. https://doi.org/10.1155/2020/8293921.
- Huang Z., Kraus V.B. Does lipopolysaccharide-mediated inflammation have a role in OA? Nat. Rev. Rheumatol. 2016;12(2):123-129. https://doi.org/10.1038/nrrheum.2015.158.
- Huang Z.Y., Stabler T., Pei F.X., Kraus V.B. Both systemic and local lipopolysaccharide (LPS) burden are associated with knee OA severity and inflammation. Osteoarthr. Cartil. 2016;24(10):1769-1775. https://doi.org/10.1016/j.joca.2016.05.008.
- Guan Z., Jia J., Zhang C., Sun T., Zhang W., Yuan W. et al. Gut microbiome dysbiosis alleviates the progression of osteoarthritis in mice. Clin. Sci. (Lond.). 2020;134(23):3159-3174. https://doi.org/10.1042/CS20201224.
- Mendez M.E., Murugesh D.K., Sebastian A., Hum N.R., McCloy S.A., Kuhn E.A. et al. Antibiotic treatment prior to injury improves post-traumatic osteoarthritis outcomes in mice. Int. J. Mol. Sci. 2020;21(17):6424. https://doi.org/10.3390/ijms21176424.
- Yu X.H., Yang Y.Q., Cao R.R., Bo L., Lei S.F. The causal role of gut microbiota in development of osteoarthritis. Osteoarthr. Cartil. 2021;29(12):1741-1750. https://doi.org/10.1016/j.joca.2021.08.003.
- Li M., Van Esch B.C.A.M., Wagenaar G.T.M., Garssen J., Folkerts G., Henricks P.A.J. Pro- and anti-inflammatory effects of short chain fatty acids on immune and endothelial cells. Eur. J. Pharmacol. 2018;831:52- 59. https://doi.org/10.1016/j.ejphar.2018.05.003.
- Zhao Y., Chen B., Li S., Yang L., Zhu D., Wang Y. et al. Detection and characterization of bacterial nucleic acids in culture-negative synovial tissue and fluid samples from rheumatoid arthritis or osteoarthritis patients. Sci. Rep. 2018;8(1):14305. https://doi.org/10.1038/s41598-018-32675-w.
- Collins K.H., Paul H.A., Reimer R.A., Seerattan R.A., Hart D.A., Herzog W. Relationship between inflammation, the gut microbiota, and metabolic osteoarthritis development: studies in a rat model. Osteoarthr. Cartil. 2015;23(11):1989-1998. https://doi.org/10.1016/j.joca.2015.03.014.
- Huang Z., Chen J., Li B., Zeng B., Chou C.H., Zheng X. et al. Faecal microbiota transplantation from metabolically compromised human donors accelerates osteoarthritis in mice. Ann. Rheum. Dis. 2020;79(5):646- 656. https://doi.org/10.1136/annrheumdis-2019-216471.
- Green M., Arora K., Prakash S. Microbial medicine: prebiotic and probiotic functional foods to target obesity and metabolic syndrome. Int. J. Mol. Sci. 2020;21(8):2890. https://doi.org/10.3390/ijms21082890.
- Saltzman E.T., Thomsen M., Hall S., Vitetta L. Perna canaliculus and the Intestinal Microbiome. Mar. Drugs. 2017;15(7):207. https://doi.org/10.3390/md15070207.
- Jhun J., Cho K.H., Lee D.H., Kwon J.Y., Woo J.S., Kim J. et al. Oral administration of Lactobacillus rhamnosus ameliorates the progression of osteoarthritis by inhibiting joint pain and inflammation. Cells. 2021;10(5):1057. https://doi.org/10.3390/cells10051057.
- So J.-S., Kwon H.-K., Lee C.-G., Yi H.J., Park J.A., Lim S.Y. et al. Lactobacillus casei suppresses experimental arthritis by down-regulating T helper 1 effector functions. Mol. Immunol. 2008;45(9):2690-2699. https://doi.org/10.1016/j.molimm.2007.12.010.
- Amdekar S., Singh V., Singh R., Sharma P., Keshav P., Kumar A. Lactobacillus casei reduces the inflammatory joint damage associated with collagen-induced arthritis (CIA) by reducing the pro-inflammatory cytokines. J. Clin. Immunol. 2011;31(2):147-154. https://doi.org/10.1007/s10875-010-9457-7.
- Henrotin Y., Patrier S., Pralus A., Roche M., Nivoliez A. Protective actions of oral administration of Bifidobacterium longum CBi0703 in spontaneous osteoarthritis in dunkin hartley guinea pig model. Cartilage. 2021;13(2_suppl.):1204S-1213S. https://doi.org/10.1177/1947603519841674.
- Holscher H.D. Dietary fiber and prebiotics and the gastrointestinal microbiota. Gut Microbes. 2017;8(2):172-184. https://doi.org/10.1080/19490976.2017.1290756.
- Primec M., Klemenak M., Di Gioia D., Aloisio I., Bozzi Cionci N., Quagliariello A. et al. Clinical intervention using Bifidobacterium strains in celiac disease children reveals novel microbial modulators of TNF-α and short-chain fatty acids. Clin. Nutr. 2019;38(3):1373-1381. https://doi.org/10.1016/j.clnu.2018.06.931.
- Li M., Van Esch B.C.A.M., Henricks P.A.J., et al. The anti-inflammatory effects of short chain fatty acids on lipopolysaccharide- or tumor necrosis factor α-stimulated endothelial cells via activation of GPR41/43 and inhibition of HDACs. Front. Pharmacol. 2018;9:533. https://doi.org/10.3389/fphar.2018.00533.
- O-Sullivan I., Natarajan Anbazhagan A., Singh G., Ma K., Green S.J., Singhal M. et al. Lactobacillus acidophilus mitigates osteoarthritis-associated pain, cartilage disintegration and gut microbiota dysbiosis in an experimental murine OA model. Biomedicines. 2022;10(6):1298. https://doi.org/10.3390/biomedicines10061298.
- Taye I., Bradbury J., Grace S., Avila C. Probiotics for pain of osteoarthritis; An N-of-1 trial of individual effects. Complement. Ther. Med. 2020;54:102548. https://doi.org/10.1016/j.ctim.2020.102548.


