Микробный фон и концентрация водородных ионов нативного цеолита
Автор: Чернов А.Н., Афордоаньи Д.М., Халиллуллина Г.Р., Газизов Р.Р.
Статья в выпуске: 4 т.244, 2020 года.
Бесплатный доступ
По результатам проведенных бактериологических исследований установлено, что в нативном цеолите отсутствуют грибы продуценты микотоксинов. КОЕ культуры бактерий на корнях растений колебались от минимального значения в первой отобранной пробе 3,88*107 до 4,97*107 во второй отобранной пробе, всего было выделено 24 изолята бактерий. С целью подтверждения проведенных исследований, использован метод качественной ПЦР для определения наличий грибов и бактерий в нативном цеолите и на корнях растений, который дал также отрицательный результат. Концентрация водородных ионов у нативного цеолита, в зависимости от времени, была больше на 9 через 30 сек., 10 мин. и 15 мин. при соотношении цеолита с дистиллированной водой 1:6, и 1:8. При этом при соотношении 1:1 максимальная концентрация водородных ионов имела значение - 8,51.
Природные цеолиты, грибы продуценты микотоксинов, концентрация водородных ионов, биологическая безопасность
Короткий адрес: https://sciup.org/142226073
IDR: 142226073 | УДК: 636.09:620.1:602, | DOI: 10.31588/2413-4201-1883-244-4-232-237
Текст научной статьи Микробный фон и концентрация водородных ионов нативного цеолита
Минеральные вещества, являются незаменимыми веществами и должны поступать в организм животных в определенных количествах. Объем потребления природных агроминералов у диких животных в естественных условиях колеблется, и может достигать у некоторых видов за раз до 5 % от массы тела [1].
Микробная популяция зависит от различных условий в окружающей среде. В естественных условиях микроорганизмы растут, обеспечивая питательными веществами свои потребности [2, 3].
Биологическая безопасность агроминералов является важным звеном в кормлении животных. Грибы как сапрофиты участвуют в деградации органических веществ, выделяя внеклеточные ферменты для роста растений. Сапрофитные грибы составляют самую большую группу почвенных микробных сообществ, но патогенные грибы оказывают наиболее разрушительное воздействие на урожайность сельскохозяйственных культур и могут влиять на здоровье животных, и поэтому необходим контроль за ними [5, 8, 14, 15].
Фитопатогенам, по сравнению с патогенными биологическими агентами животных, уделено больше исследований по секвенированию генома. Природный цеолит, как и красная глина эффективно сорбирует металлы, поглощает Pb, Cd и Zn [4, 6, 9]. За способности повышать рН почвы и антимикробные свойства агроминералы нашли применение в сельскохозяйственном земледелии [11, 12]. Эффект прорас- тания растений различных видов, где применяли агроминералы, показали замечательные результаты [13].
Применение синтетического цеолита для микробной фильтрации и антимикробного действия было продемонстрировано в большинстве научных публикаций. Интересны исследования противогрибковых свойств цеолита фаужазита с серебром на бактерии и изоляты грибов [7]. Известно, что цеолит поглощает бактериальные клетки в зависимости от рН за счет поверхностной гидрофобности бактериальной клетки [10].
Экологизация, биологическая безопасность в области сельского хозяйства остается очень важным аспектом развития любого государства. Расширение сфер использования нативных агроминералов, в частности цеолита, в животноводстве требует их изучения.
Цель исследования – определить микробный фон и концентрацию водородных ионов нативного цеолита.
Материал и методы исследований. Использованные в исследованиях пробы и оборудование: пять растений с участка добычи природного цеолита, нативный (неактивированный) цеолит, шейкер-инкубатор (Biosan ES-20, Орбитальный шейкер-инкубатор). Определяли КОЕ бактерий и грибов на корнях растений с использованием среды LB агар. Для определения наличий грибов и бактерий в нативном цеолите и на корнях растений был использован метод качественной ПЦР.
Нативный цеолит и корни растений переносили в ступку с жидким азотом и перемалывали стерильным пестиком до состояния гомогенного порошка, постоянно приливая жидкий азот для охлаждения. Порцию перемолотой массы весом 100 мг переносили в пробирку эппендорф объемом 2 мл, содержащую 1 мл раствора 2 % бромида гексадекатриметиламмониума, 100 Мм Tris-HCl (рН 8.0), 1.4 М NaCl и 20 Мм EDTA, поставленные ООО «Компания Хеликон» (Москва, РФ), и инкубировали при 60 °C в течение 20 минут. К смеси приливали 500 мкл хлороформа (ЗАО «База №1 Химреактивов», Москва, РФ) и перемешивали переворачиванием в течение 1 минуты. Для разделения фаз пробирки центрифугировали при 13000 об/мин в течение 5 минут. Верхнюю фазу объемом 500 мкл отбирали в новую пробирку и приливали к ней 300 мкл (0,6 объема) изопропилового спирта. После перемешивания пробирки центрифугировали при 13000 об/мин в течение 5 минут. Осадки дважды промывали 70 % этанолом и высушивали. Далее осадки растворяли в 100 мкл буфера STE pH 8.0 с добавлением РНКазы (Thermo, США) в концентрации 2 мг/мл при 60 °C в течение 20 минут. Для дальнейшей очистки использовали набор Cleanup mini (ООО «Евроген», Москва, РФ) в соответствии с рекомендациями производителя. Для определения наличий грибов и бактерий в нативном цеолите и на корнях растений был использован метод качественной ПЦР. В качестве мишени использовались последовательности гена β-актина и рибозомалного гена 16S. Объем реакционной смеси составлял 20μl: 2μl Taq буфер, 0.4 μl в концентрации 10мМ dNTP, 0.2μl mix праймеров в концентрации 100 pmol/μl – к гену β-актина, ACT 512-F (5’ ATGTGCAAGGCCGGTTTCGC 3’) и ACT 783-R (5’ TACGAGTCCTTCTGGCCCAT 3’) (Carbone & Kohn, 1999); к гену 16Sбактерий, 27fm (5′‐AGA GTT TGA TCM TGG CTC AG‐3′) and 1522R (5′‐AAG GAG GTG ATC CAG CCG CA‐3′) [15], 0.4μl Taq полемераза, 14μl mQ H2O и 5μl ДНК матрицы (в концентрации 1нг/мл). Условия амплификации: 1 цикл предварительной денатурации и активации полиме- разы – 95 °C 10 мин; 40 циклов – денатурация 95 °C 15с, отжиг 55 °C 20 с, элонгация 72 °C 4 мин. Измерения флуоресценции проводились в конце каждого цикла отжига и в дополнительной точке на 80 °C (за 1 с), для детекции образовавшихся димеров праймеров в процессе амплификации. Анализ кривой плавления был сделан за счет повышения температуры от 65 до 95 °C ступенчато в 0.5 °C за 5 с в каждом цикле.
Изучали концентрацию водородных ионов нативного цеолита с разведением в дистиллированной воде в соотношении 1:1, 1:2, 1:4, 1:6, 1:8 с периодом экспозиции 30 сек, 10 мин, 15 мин, 30 мин. Использовали: прибор Ph-метр Hanna edge (копании Hanna Instruments); дистиллированная вода рH – 6,9. Температура в ходе эксперимента не менялась и составляла 25 0С.
Результаты исследований. Пять растений были отобраны с участка добычи природного цеолита Дрожжановский район, Республика Татарстан, Россия (Рисунок 1). Далее определили колониеобразующие единицы (КОЕ) бактерий и грибов. Для этого отобранные 200 мг образцы корня растений помещали в 10 мл стерильного фосфатного буферного раствора (PBS) и перемешивали в течение 10 минут в шейкер-инкубаторе. КОЕ бактерий и грибов определяли путем нанесения 100 мкл серийных разведений до 10-5 и 10-4 на чашки Петри с cредой LB агар. В чашечки с LB агаром для культивирования грибов добавляли цефтриаксонадо в концентрации до 100 мкг/мл, а для роста бактерий в концентрацию добавляли нистатин до 150 мкг/мл для предотвращения роста грибов. Контролем служила ростовая среда с LB агаром с внесением в него фосфатнобуферного раствора (Рисунок 2 а, б, в).
Нами установлено, что на всех чашках Петри грибкового роста грибов нет. С целью подтверждения полученных результатов нами проведены выделение ДНК и количественная ПЦР на присутствие бактерий и грибов в нативном цеолите.
Электрофорез фрагментов ДНК, полученных в ходе амплификации методом Box-PCR представлен на рисунке 3.

Рисунок 1 – Растения на месте добычи цеолита
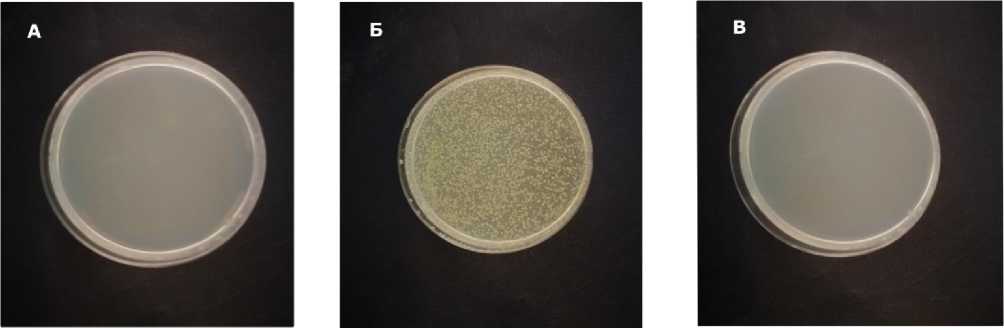
Рисунок 2 – Среда с LB агаром а) контроль б) бактерии в) грибкового мицелия нет.
М 1 2 3 4 5 6 7 8 м 9 10 11 12 13 14 15 16 М
15Мп н
ЫЮп.н.
2UUn .м.
IMn.h.
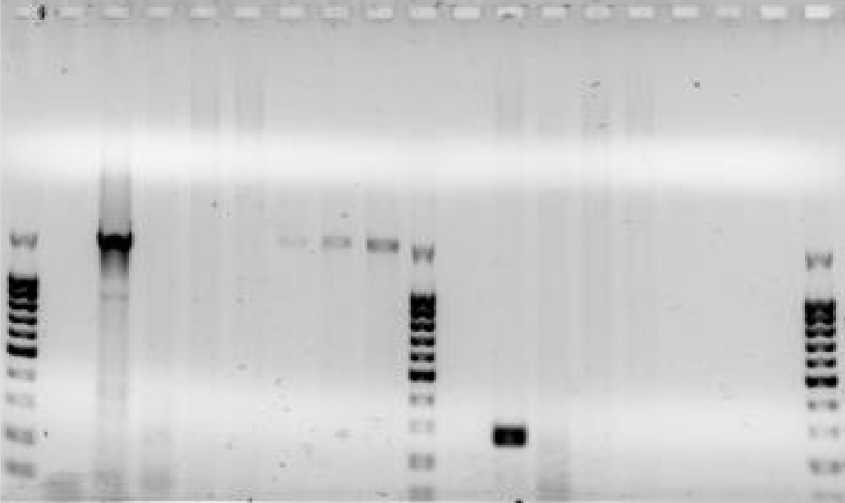
Рисунок 3 – Электрофорез фрагментов ДНК, полученных в ходе амплификации гена16S (1– 8) и гена β-актин (9– 16). Дорожка М – маркеры молекулярной массы ДНК 100b (ЗАО «Евроген», Москва, РФ), дорожки 1, 9 – отрицательный контроль с водой, 2 –положительный контроль с бактериальной ДНК, дорожки 3, 4, 5, 11, 12,13 – ДНК из нативного цеолита, дорожки 6, 7, 8, 14, 15, 16 – ДНК из корней растений.
Электрофорез геля показывает наличие бактерий из ДНК, извлеченной из корней растений, выкорчеванных с места добычи цеолита из фрагмента 16S (1600п.н.) в положении 1500b.p. на рисунке 2, дорожки 6, 7, и 8, что также видно из положительного контроля с бактериальной ДНК. Бактериальные ДНК, выделенные из нативного цеолита (дорожки 3, 4, и 5), отсутствовали. Во всех образцах ДНК (до- рожки 11, 12, 13, 14 и 16), выделенные из корней растений, так и из нативных цеолитов с места добычи, грибковая ДНК отсутствовала. Это видно по количественному ПЦР-фрагменту грибного β-актина (дорожка 10), показанному в положении 200b.p. положительного контроля с ДНК Fusarium oxysporum. Исследования бактерий на корнях растений на КОЕ, представлены в таблице 1.
Таблица 1 – КОЕ культуры бактерий на корнях растений
|
Растения |
КОЕ |
|
1 |
3,88×107 |
|
2 |
4,97×107 |
|
3 |
4,42×107 |
|
4 |
3,94×107 |
|
5 |
4,14×107 |
Как видно из таблицы КОЕ культуры бактерий на корнях растений колебались от минимального значения в первой отобранной пробе 3,88×107, до 4,97×107 у второй отобранной пробы, всего было вы- делено 24 изолята бактерий. На следующем этапе провели исследования нативного цеолита, в соотношении с дистиллированной водой, с различным временем экспозиции (Таблица 2).
Таблица 2 – Концентрации водородных ионов в растворе нативного цеолита, в различных разведениях и времени экспозиции
|
Отношение цеолит : вода |
рН цеолитного раствора, в зависимости от времени |
|||
|
30 сек |
10 мин |
15 мин |
30 мин |
|
|
1:1 |
8,50 |
8,51 |
8,51 |
8,48 |
|
1:2 |
8,74 |
8,55 |
8,61 |
8,64 |
|
1:4 |
8,88 |
8,84 |
8,76 |
8,76 |
|
1:6 |
9,00 |
9,04 |
9,00 |
8,87 |
|
1:8 |
9,04 |
9,02 |
9,00 |
8,91 |
Как видно из таблицы, рН раствора из нативного цеолита, в зависимости от времени была больше на 9 через 30 сек, 10 мин и 15 мин при соотношении цеолита с дистиллированной водой 1:6, и 1:8. При этом при соотношении 1:1 максимальная концентрация водородных ионов имела значение – 8,51.
Заключение. Биологическая безопасность агроминералов является важным звеном в кормлении животных. Сапрофитные грибы составляют самую большую группу почвенных микробных сообществ, но патогенные грибы оказывают наиболее разрушительное воздействие на урожайность сельскохозяйственных культур и мо- гут влиять на здоровье животных. По результатам проведенных бактериологических исследований установлено, что в нативном цеолите отсутствуют грибы продуценты микотоксинов. С целью подтверждения проведенных исследований, использован метод качественной ПЦР для определения наличий грибов и бактерий в нативном цеолите и на корнях растений, который дал также отрицательный результат. Концентрация водородных ионов у нативного цеолита, в зависимости от времени была больше на 9 через 30 сек., 10 мин. и 15 мин., при соотношении цеолита с дистиллированной водой 1:6, и 1:8. При этом при соотношении 1:1 макси- мальноя концентрация водородных ионов имела значение – 8,51. Таким образом, нативный цеолит не содержит микроскопических грибов, в том числе и грибов продуцентов микотоксинов, и при добавлении дистиллированной воды концентрация водородных ионов находится в значениях – 8,48-9,04. Данные исследования будут продолжены.
Резюме
По результатам проведенных бактериологических исследований установлено, что в нативном цеолите отсутствуют грибы продуценты микотоксинов. КОЕ культуры бактерий на корнях растений колебались от минимального значения в первой отобранной пробе 3,88×107 до 4,97×107 во второй отобранной пробе, всего было выделено 24 изолята бактерий. С целью подтверждения проведенных исследований, использован метод качественной ПЦР для определения наличий грибов и бактерий в нативном цеолите и на корнях растений, который дал также отрицательный результат. Концентрация водородных ионов у нативного цеолита, в зависимости от времени, была больше на 9 через 30 сек., 10 мин. и 15 мин. при соотношении цеолита с дистиллированной водой 1:6, и 1:8. При этом при соотношении 1:1 максимальная концентрация водородных ионов имела значение – 8,51.
Список литературы Микробный фон и концентрация водородных ионов нативного цеолита
- Макарцев, Н.Г. Кормление сельскохозяйственных животных / Н.Г. Макарцев. - Калуга: Издательство Ноосфера, 2017 - 460 с.
- Равилов, А.З. Микробиологические среды / А.З. Равилов, Р.Я. Гильмутдинов, М.Ш. Хусаинов. - Казань: Издательство "Фэн". - 1999. - С. 168
- Телишевская, А.Я. Белковые гидролизаты: получение, состав, применение / А.Я. Телишевская. - М.: Издательство "Россельхозакадемия". - 2000. - С.128.
- Bertocchi, A.F., Red mud and fly ash for remediation of mine sites contaminated with As, Cd, Cu, Pb and Zn / A.F. Bertocchi, M. Ghiani, R. Peretti, A. Zucca // J. Hazard. Mater. - 2006. - V. 134. - С. 112-119.
- Carbone, I.A Method for designing primer sets for speciation studies in filamentous ascomycetes / I. Carbone, L. M. Kohn // Mycologia. - 1999. - Т. 91. - №. 3. - С. 553556.
- Castaldi, P. Heavy metal immobilization by chemical amendments in a polluted soil and influence on white lupin growth / P. Castaldi, L. Santona, P. Melis // Chemosphere. - 2005. - V. 60. - P. 365-371.
- Ferreira, L. Antimicrobial activity of faujasite zeolites doped with silver / L. Ferreira, A. M. Fonseca, G. Botelho, C. Almeida-Aguiar, I.C. Neves // Microporous and Meso-porous Materials. - 2012. - V. 160. - P. 126132.
- Gladieux, P. Fungal evolutionary genomics provides insight into the mechanisms of adaptive divergence in eukaryotes / P. Gladieux, J. Ropars, H. Badouin [et al.] // Molecular ecology. - 2014. - P. 753-773.
- Gray, C.W. Fields evaluation of in situ remediation of a heavy metalcontaminated soil using lime and red-mud / C.W. Gray, S. J. Dunham, P.G. Dennis [et al.] // Environ. Pollut. - 2006. - V. 142. - P. 530-539.
- Kubota, M. Selective adsorption of bacterial cells onto zeolites / M. Kubota, T. Nakabayashi, Y. Matsumoto [et al.] // Colloids and Surfaces B: Biointerfaces. - 2008. - V. 64 - P. 88-97.
- Lee, Y. J. Effect of pH on microbial hydrogen fermentation / Y.J. Lee, T. Miyahara, T. Noike // Journal of Chemical Technology & Biotechnology. - 2002. - P. 694-698
- Passaglia, E. Zucchine e meloni su zeolitite, piu resa e meno concimazione / E. Passaglia, T. Bellarmi, A. Guidetti, F. Merlotti // L'Informatore Agrario. - 2005. - № 50, - P. 55-57.
- Prisa, D. Germination Of Vegetable and Grassland species With Micronized chabazitic-Zeolites And Endophytic Fungi / D. Prisa // IOSR Journal Of Agriculture And Veterinary Science (IOSR-JAVS). E-ISSN. -2019. - P. 2319-2380.
- Varnai A. Carbohydrate-binding modules of fungal cellulases: occurrence in nature, function, and relevance in industrial biomass conversion (Advances in applied microbiology) / A. Varnai, M.R. Makela, D.T. Djajadi [et al.] // Academic Press. - 2014. -Т. 88. - P.103-165.
- Weisburg, W.G. 16S ribosomal DNA amplification for phylogenetic study / W. G. Weisburg, S.M. Barns, D.A. Pelletier, D.J. Lane // Journal of bacteriology. - 1991. -Т. 173. - №. 2. - P. 697-703.


