Микроэкологические и иммунологические аспекты формирования нарушений репродуктивной функции
Автор: Сетко Нина Павловна, Михайлова Елена Алексеевна, Воронина Людмила Григорьевна, Штиль Ольга Олеговна, Генелес Лариса Нахимовна
Рубрика: Влияние экологии на внутренние болезни
Статья в выпуске: 1-7 т.13, 2011 года.
Бесплатный доступ
Изучены особенности микробиоценоза и локального иммунитета репродуктивного тракта фертильных и бесплодных мужчин. Были выявлены отличия в видовом составе, пенетрантности и экспрессии иммунодепрессивных свойств микрофлоры изучаемого биотопа, а также в уровне факторов антимикробной защиты. Результаты могут быть использованы в ранней диагностике патоспермии.
Микроэкология, иммунитет, эякулят, бесплодие
Короткий адрес: https://sciup.org/148100722
IDR: 148100722 | УДК: 616:612.017.1
Текст научной статьи Микроэкологические и иммунологические аспекты формирования нарушений репродуктивной функции
Состояние репродуктивного здоровья населения России привлекает все большее внимание специалистов, что обусловлено неблагоприятной демографической ситуацией. По данным ВОЗ [11] в 32,1% бесплодных супружеских пар репродуктивная функция нарушена у мужчин. Одним из факторов нарушения фертильности и развития патоспермии является инфицирование внутренних гениталий различными микроорганизмами [10]. При этом частым явлением оказывается формирование смешанной инфекции, обусловленной одновременным присутствием в урогенитальном тракте трех и более возбудителей, являющихся представителями нормальной микрофлоры. Показано снижение оплодотворяющей способности сперматозоидов под действием внутриклеточно паразитирующих возбудителей (хламидий, уреаплазм) и их метаболитов [5]. В то же время вопрос о роли условно-патогенных бактерий в патофизиологических механизмах развития бесплодия остается открытым. С одной стороны, данные микроорганизмы являются представителями эубиоза репродуктивной системы и, препятствуя заселению патогенов, обеспечивают колонизационную резистентность экологической ниши. С другой стороны, приобретая агрессивные потенции, они могут явиться этиологическим фактором воспалительного процесса в гениталиях [3, 4].
Особое место при рассмотрении роли смешанной урогенитальной инфекции в развитии бесплодия принадлежит выяснению механизмов,
Сетко Нина Павловна, доктор медицинских наук, заведующая кафедрой эпидемиологии и гигиены
Генелес Лариса Нахимовна, заведующая лабораторией Оренбургского центра планирования семьи определяющих восходящий характер инфекционного процесса и, таким образом, ведущих к формированию осложнений, непосредственно ведущих к утрате или снижению репродуктивной функции. Длительный симбиоз с макроорганизмом предполагает наличие у возбудителя факторов противостояния механизмам защиты хозяина, приводящее к формированию иммунодефицитного состояния, что, в свою очередь, также способно негативно сказываться на оплодотворяющей способности спермы.
Цель работы: изучение видового состава, иммунонейтрализующих свойств микрофлоры эякулята и факторов местной противоинфекци-онной защиты эякулята фертильных мужчин и больных бесплодием.
Материалы и методы. Обследовано 50 здоровых фертильных мужчин и 68 мужчин репродуктивного возраста, находящихся в бесплодном браке 1 год и более. У бесплодных мужчин на момент исследования не было клинических данных, свидетельствующих о воспалительных процессах в гениталиях. Женский фактор бесплодия был исключен. Отсутствие специфического инфекционного процесса устанавливали при проведении бактериологического исследования на гонококк в соответствии с приказом МЗ РФ № 415 «Об утверждении протокола ведения больных «Гонококковая инфекция» от 20.08.2003 г. Наличие микоплазм и уреаплазм определяли как с помощью ПИФ, так и путем посева на официнальные элективные питательные среды. Хламидии выявляли методом прямой иммунофлюоресценции и ПЦР, трихомонады – окраской мазков по Граму. Больные с положительными результатами тестов были исключены из дальнейшего обследования. Лабораторное исследование эякулята проводили согласно рекомендациям ВОЗ [11]. Лизоцим в эякуляте определяли по скорости лизиса М. luteus [2], функциональную активность комплемента – по лизису эритроцитов барана [1]. Для бактериологического исследования эякулята материал засевали на плотные питательные среды. Идентификацию выделенных микроорганизмов до уровня вида осуществляли общепринятыми методами на основании морфологических, тинкториальных, культуральных, биохимических и антигенных свойств. Биохимический профиль оценивали с помощью тест-систем «Lachema» («Lachema diagnostica», Брно, Чехия) и определителя бактерий Bergey [7]. Способность микроорганизмов к инактивации лизоцима – антилизоцимную активность (АЛА) – определяли кинетическим методом [2]. Для изучения антикомплементарной активности (АКА) исследуемых штаммов применялась методика, основанная на способе кинетического титрования комплемента [1] с измерением максимальной скорости лизиса сенсибилизированных эритроцитов барана. Источником комплемента служил препарат комплемента для РСК.
Результаты и обсуждение. При лабораторном исследовании установлено, что у здоровых мужчин объем эякулята составил 3,6±0,7 мл (2,5-6,2 мл), общее количество сперматозоидов (х106/мл) – 70,0±3,2 (62-75), из них активно подвижных 61,8±6,6% (50-75%). У больных бесплодием объем эякулята составил 3,3±0,8 мл (1,0-5,1 мл), общее количество сперматозоидов (х106/мл) – 45,0±4,2 (10-70), из них активно подвижных форм 12,3±3,7% (0-25%). Уровень лизоцима в эякуляте здоровых мужчин был равен 6,1±0,33 (4,5-7,2) мкг/мл. Содержание лизоцима в сперме больных бесплодием составило 0,73±0,14 (0,41,2) мкг/мл. При исследовании уровня комплемента в эякуляте выявлено, что у здоровых данный фактор антимикробной защиты составлял 4180±430 ед. СН 50. В сперме бесплодных мужчин концентрация комплемента была 3880±401 ед. СН 50.
Изучение взаимоотношений между анализируемыми лабораторными данными позволило выявить достоверную (p<0,01) положительную корреляционную зависимость (r=0,8) между содержанием лизоцима в эякуляте и подвижностью сперматозоидов. В тоже время было установлено отсутствие зависимости между уровнем лизоцима, комплемента, объемом эякулята и общим количеством сперматозоидов. Показатель микробной обсемененности (ПМО) эякулята здоровых мужчин не превышал 101 КОЕ/мл, тогда как интенсивность бактериоспермии у больных бесплодием колебалась в пределах 103-104 КОЕ/мл. Изучение микрофлоры эякулята показало, что от здоровых мужчин выделялась грампозитивная флора (рис. 1). При анализе видового состава микроорганизмов, выделенных из эякулята здоровых мужчин, было установлено, что коагула-зоотринательные стафилококки (S. epidermidis, S. capitis, S. saprophyticus, S. hominis) и стрептококки (Str. agalactiae) составляли 46,5%, a энтерококки (E. faecalis, E. faecium) – 21,3% микробиоценоза. Коринеформные микроорганизмы и лактобактерии составляли соответственно 10,5% и 8,2% микрофлоры эякулята здоровых мужчин. Высевались также анаэробные микроорганизмы (5,1%) и дрожжевые грибы (1,1%). В спектре микрофлоры эякулята больных бесплодием преобладали коагулазоотрицательные представители рода Staphylococcus (S. epidermidis, S. haemo-lyticus, S. hominis) и Streptococcus (Str. agalactiae), которые составляли 57,9% микробиоценоза. Появились энтеробактерии (Е. coli, Kl. pneimoniae, Е. cloacae. Proteus spp.) – 12,5%, а энтерококки (Е. faecalis, С. faecium, Е. gallinaiuu) и микрококки составляли соответственно 12,1% и 2,8% микрофлоры эякулята больных бесплодием. По сравнению со здоровыми из эякулята бесплодных обследуемых с большей частотой высевались анаэробы (2,4%) грибковая флора (12,3%).
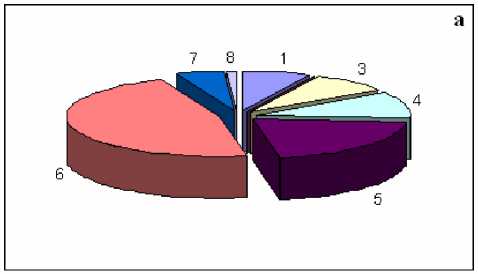
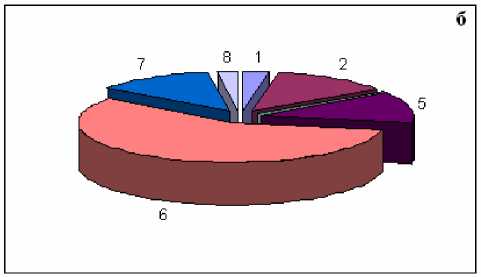
Рис. 1. Видовая характеристика микрофлоры эякулята здоровых мужчин (а) и больных бесплодием (б):
1 – микрококки, 2 – энтеробактерии, 3 – лактобактерии, 4 – коринебактерии, 5 – энтерококки, 6 – стафилококки и стрептококки, 7 – анаэробный микроорганизмы, 8 – дрожжевые грибы
Представленные результаты традиционного бактериологического исследования эякулята обследованных мужчин позволили сделать заключение, что: во-первых, несмотря на различия в микробной обсемененности эякулята здоровых мужчин и больных бесплодием, степень бактериоспермии у инфертильных мужчин в большинстве случаев не достигала диагностически значимого уровня; во-вторых, в видовой структуре изолированной микрофлоры у групп обследованных мужчин доминировали условно-патогенные грампози-тивные микроорганизмы, представленные коагулазоотрицательными стафилококками, условно патогенными стрептококками и энтерококками. Указанные обстоятельства, безусловно, осложняют клиническую оценку бактериологических данных и обусловливают необходимость поиска дополнительных информативных критериев индикации этиологически и диагностически значимых показателей.
В связи с этим нами был проведен сравнительный анализ частоты встречаемости и выраженности иммунонейтрализующих свойств у изолированных аэробных штаммов бактерий. У выделенных из исследуемого материала штаммов микроорганизмов от двух групп обследованных были определены антилизоцимная, антикомпле-ментарная активности (табл. 1), которые участвуют в формировании микробного биоценоза [2]. При анализе частоты встречаемости и уровня выраженности АЛА у штаммов бактерий, выделенных из эякулята здоровых и больных бесплодием, были установлены существенные межвидовые различия. У стафилококков, стрептококков и энтеробактерий в 100% случаев выявлялась АЛА, а ее выраженность была в 2,5-4 раза выше, чем у микрококков и энтерококков. Так, средние (2-3 мкг/мл) и высокие (3-5 мкг/мл) значения АЛА были отмечены у подавляющего количества штаммов энтеробактерий, стафилококков и стрептококков, при этом микрококки и энтерококки в большинстве случаев обладали АЛА, равной 0-1 мкг/мл.
Таблица 1. Уровень экспрессии АЛА (мкг/мл.ед.ОП) и АКА у бактериальной микрофлоры эякулята здоровых и бесплодных мужчин
|
Группа обследуемых |
Здоровые мужчины |
Бесплодные мужчины |
||
|
Биологическое свойство |
Уровень АЛА (мкг/мл) |
Уровень АКА (106анти-ЛЕК) |
Уровень АЛА (мкг/мл) |
Уровень АКА (106анти-ЛЕК) |
|
условнопатогенные стрептококки |
0,09±0,20 |
1,21±0,30 |
3,11±0,20* |
1,30±0,33 |
|
коринебактерии |
0,19±0,10 |
0,74±0,05 |
нет роста |
|
|
КОС |
0,60±0,19 |
1,18±0,40 |
4,61±0,51* |
1,13±0,11 |
|
лактобактерии |
0,32±0,10 |
0,54±0,04 |
Нет роста |
|
|
энтеробактерии |
нет роста |
нет роста |
3,74±0,59 |
2,89±0,41* |
|
энтерококки |
0,28±0,10 |
0,64±0,05 |
1,03±0,20* |
0,58±0,10 |
|
микрококки |
0,19±0,10 |
- |
0,15±0,09 |
- |
Примечание: * - р < 0,05
Кроме лизоцима микроорганизмы способны деградировать комплемент, который среди прочих факторов естественной резистентности организма усиливает силу проявления защитных свойств хозяина в отношении патогена. Из таблицы видно, что этой способностью обладали все (кроме микрококков) микроорганизмы, выделенные из биоценоза здоровых мужчин. Наиболее высокий уровень активности (табл. 1), определялся у энтеробактерий, которые обладали АКА в 58,8% случаев. Условно-патогенные стафилококки, изолированные от мужчин с бесплодием, по сравнению со штаммами, выделенными от здоровых, не отличались по частоте встречаемости и выраженности АКА. Выраженность АКА и встречаемость этого признака у энтерококков была такой же, как и у штаммов от здоровых лиц. Как и в группе здоровых, у энтерококков, изолированных от бесплодных мужчин, уровень выраженности АКА был самым низким среди всех видов. Стрептококки имели АКА в половине случаев, уровень активности был таким же, как у микроорганизмов данного таксона, выделенных от здоровых мужчин.
Проведенный анализ данных выявил достоверную (р<0,05) связь между выраженностью АЛА персистирующей флоры и низкой концентрацией лизоцима в эякуляте (рис. 2). В отношении АКА микроорганизмов и уровня комплемента в сперме выявлена аналогичная тенденция, однако достоверно значимая зависимость не определена.
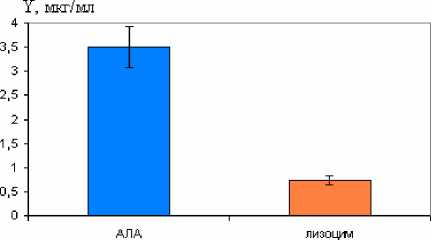
Рис. 2. Сравнительная характеристика содержания лизоцима в сперме и уровня АЛА микрофлоры эякулята у больных бесплодием
Как видно из представленных результатов, сперма больных бесплодием характеризуется более высокой степенью обсемененности микроорганизмами, что может косвенно указывать на этиологическую роль бактерий в формировании патоспермии. В микробиоценозе эякулята больных с бесплодием выявлены существенные различия в видовом многообразии, частоте встречаемости и силе выраженности свойств микроорганизмов, обеспечивающих инактивацию локальных антимикробных факторов защиты слизистой оболочки урогенитального тракта. Однако количество микроорганизмов в сперме может повышаться по причинам, не связанным с инфертильностью, например, вследствие контаминации во время сбора материала, при недиагностированных уретритах и др. [6, 8]. Изменения в видовой структуре микрофлоры эякулята (дефицит лактобактерий и коринеформных микроорганизмов, увеличение коагулазоотрицательных стафилококков и энтеробактерий) позволяют сделать вывод о развитии урогенитального дисбиоза у больных бесплодием. Широкая распространенность и выраженность антилизоцимного признака обеспечивает микроорганизмам возможность длительного переживания в организме хозяина [2]. В то же время персистенция бактерий, способных инактивировать лизоцим, по-видимому, формирует дефицит лизоцима в сперме. С одной стороны, снижение концентрации лизоцима в сперме вследствие его деградации микроорганизмами отражается на подвижности сперматозоидов, с другой – лизоцимдефицитное состояние эякулята, возможно, уменьшает вероятность прохождения сперматозоидов через цервикальную слизь [4, 9].
Выводы: у больных бесплодием высокая обсемененность спермы микроорганизмами, их видовое разнообразие, широкая распространенность и выраженность антилизоцимного признака, высокая антикомплементарная активность свидетельствуют об определенной роли перси-стируюшей микрофлоры в формировании патос-пермии и ухудшении фертильной функции. Определение низкого уровня лизоцима в сперме может служить диагностическим признаком при оценке её фертильности.
Список литературы Микроэкологические и иммунологические аспекты формирования нарушений репродуктивной функции
- Брудастов, Ю.А. Антикомплементарная активность бактерий: автореф. дис.. канд. мед. наук/Ю.А. Брудастов. -Челябинск, 1992. 22 с.
- Бухарин, О.В. Механизмы выживания бактерий/О.В. Бухарин, А.Л. Гинцбург, Ю.М. Романова, Г.И. Эль-Регистан. -М.: Медицина, 2005. 366 с.
- Зиганшин, О.Р. Механизмы антимикробной резистентности репродуктивных органов мужчин/О.Р. Зиганшин, И.И. Долгушин. -Челябинск: Изд-во «Челябинская Государственная медицинская академия», 2001. 188 с.
- Репродуктивное здоровье/Под ред. Л.Г. Кейта, Г.С. Бергера, Д.А. Эдельмана: Пер. с англ. -М., 1988, Т. 1-2. C. 312-390/
- Тиктинский, О.Л. Заболевания половых органов у мужчин/О.Л. Тиктинский, П.Ф. Новиков, В.В. Михайличенко. -Л., 1985. 293 с.
- Щеплев, П.А. Простатит/П.А. Щеплев, Л.С. Страчунский, В.В. Рафальский и др. -М., 2004. C.1-254.
- Bergey's Manual of Determinative Bacteriology/F.d J.G. Hull. 9-th Ed. Vol. 1-2. -Baltimore. 2004.
- Galdiero, F. Toxic effect on human spermatozoa by Chlamydia trachomatis purified lipopolysacchide/F. Galdiero, L. Sommesc, F. Gorga el al.//FEMS Microbiol Lett. 1994. Vol. 115, N 2-3. P. 197-200.
- Kelly, D. Commensal gut bacteria: mechanism of immune modulation/D. Kelly, S. Conway, R. Aminov//Trends Immunol. 2005. Vol. 26, № 6. P. 326-333.
- Nickel, J.C. The Prostatitis Manual: A Practical Guide to Management of Prostatitis/Chronic Pelvic Pain Syndrome. -Bladon Medical Publishing, 2002. P.1-116.
- WHO. Laboratory Manual for the Examination of Human Semen and Semen Cervical Mucus Interaction. Fifth edition -Cambridge, 2010. 125 p.


