Микрокапсулирование пепсина и оценка его протеолитических свойств
Автор: Кудряшов Л.С., Тихонов С.Л., Тихонова Н.В., Дьячкова А.В.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Рубрика: Технология мясных, молочных и рыбных продуктов и холодильных производств (технические науки)
Статья в выпуске: 3 (74), 2019 года.
Бесплатный доступ
В статьеприведены результаты исследований и апробациипредлагаемой технологиии микрокапсулированияфермента пепсина в матрицу мальтодекстрина в псевдокипящем слое. Для проведения исследования был разработан специальный аппарат для микрокапсулирования, в котором размер капсул может регулироваться. Установлено влияние толщины слоя мальтодекстрина на активность фермента: по мере уменьшения толщины защитного покрытия фермент быстрее теряет свою первоначальную активность, что обусловлено меньшей степенью защиты слоя от воздействия внешней среды. Показано, что иммобилизация пепсина мальтодекстрином сдвигает максимальную активность примерно на 2 рН в щелочную сторону.Выявлено, что хранение иммобилизованного фермента при температуре 0 - 2 оС сохраняет его протеолитическую активность по сравнению с чистым ферментом практически в 2 раза. По результатам исследования можно рекомендовать микрокапсулирование пепсина с использованием мальтодекстрина при производстве пищевых продуктов.
Микрокапсулирование, пепсин, мальтодекстрин, псевдокипящий слой
Короткий адрес: https://sciup.org/142228768
IDR: 142228768 | УДК: 557.15
Текст научной статьи Микрокапсулирование пепсина и оценка его протеолитических свойств
Современная мировая пищевая индустрия активно внедряет протеолитические ферменты в целях обеспечения качества продуктов питания и их биологической ценности. Сегодня протеазы, в том числе микробного происхождения, составляют более половины мирового рынка ферментных препаратов. Сохранность структуры и активность ферментов в пищевых продуктах обеспечивается за счет их микрокапсулирования [1, 2, 3].
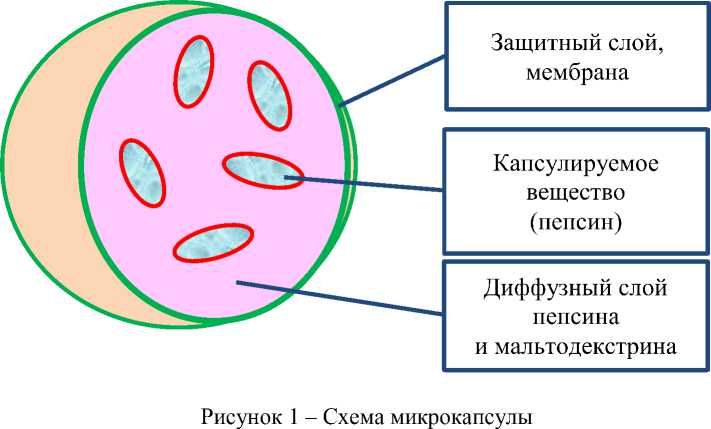
Так, ферменты, например пробиотики (пепсин), выступают в качестве ядра (рис. 1), которое капсулируется защитным покрытием (мембраной) в один или несколько слоев, при этом 35
в зависимости от свойств капсулирующего вещества оболочка может быть жесткой или эластичной [4]. Капсулы размером от микрометра до миллиметра считают микрокапсулами. Мембрана, защитный слой, способна уменьшать повреждение клеток, вызванное факторами окружающей среды, с регулируемой скоростью высвобождения при определенных заданных условиях [2, 5].
В качестве защитных веществ (капсулантов), как правило, используют вещества с высокими пленкообразующими и эмульгирующими свойствами, обладающие низкой вязкостью при высоком содержании твердых сухих веществ [6], например мальтодекстрины различного декстрозного эквивалента [7], модифицированные крахмалы, гуммиарабик и некоторые белки [8, 9, 10, 11]. Они должны: иметь высокие реологические свойства и легко обрабатываться во время инкапсуляции; обладать свойствами эмульсии и дисперсии с высокой стабильностью; быть инертными по отношению к капсулируемому веществу в процессе нанесения и при хранении капсул; иметь хорошую растворимость; быть доступными и недорогими.
Одними из важных свойств мальтодекстрина являются его высокая растворимость в воде и низкая вязкость. Применение мальтодекстринов при капсулировании обеспечивает высокую твердость стенок капсулы, кроме того, растворы мальтодекстрина бесцветны, недороги и широко используются при производстве пищевых продуктов [12, 13, 14]. В настоящее время мальтодекстрины могут использоваться отдельно или в сочетании с другими материалами.
Одним из перспективных методов микрокапсулирования ферментов является нанесение на них защитного покрытия в псевдокипящем слое дисперсии мальтодекстрина. Такая обработка позволяет равномерно распределить пленкообразующее вещество по всей поверхности фермента. Нанесение защитного фонтанирующего слоя используется в различных технологиях производства пищевых продуктов [15, 16, 17, 18]. При этом преимущество указанной технологии псевдокипящего слоя заключается в диффузии газа в твердые частицы активного вещества, например фермента, что обеспечивает равномерное нанесение капель защитного вещества в виде газа на поверхность фонтанирующих частиц.
Несмотря на то что имеются многочисленные современные исследования, касающиеся технологий микрокапсулирования [4, 12, 15, 16, 17, 19], многие технологии капсулирования биологически активных веществ являются экономически нецелесообразными в силу своей дороговизны или низкой эффективности, а потому вряд ли смогут найти широкое применение в пищевой промышленности.
В связи с вышеизложенным целью данного исследования являются разработка технологии микрокапсулирования пепсина в матрицу мальтодекстрина в псевдокипящем слое и оценка протеолитических свойств полученных микрокапсул.
Материал и методика исследований
Для эксперимента использовали животный фермент пепсин, в качестве защитного слоя - 10%-ный водный раствор мальтодекстрина, полученный ферментативным методом из кукурузного крахмала в результате его частичного гидролиза и эквивалентного веса декстрозы, представляющий собой несладкий питательный полисахарид, состоящий из связанной D-глюкозы. При температуре 100 °C и 4,0–5,0 рН кукурузный крахмал разрушается, и в результате этого получаются мальтодекстрин и кукурузный сироп. Соотношение твердого вещества к жидкому (Т/Ж) выдерживали в диапазоне 10/1 ÷ 11,5/1. Ожижающим агентом, в том числе и в режиме сушки, был воздух комнатной температуры, прокачиваемый через аппарат.
Для проведения микрокапсулирования ферментов был разработан специальный аппарат (рис. 2).
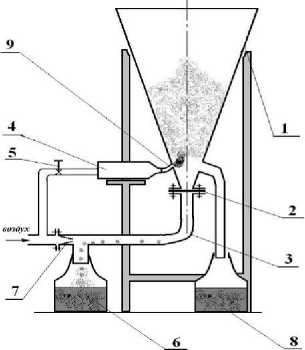
Рисунок 2 – Устройство для микрокапсулирования ферментов
Устройство (см. рис. 2) состоит из стеклянного корпуса (1) конической формы и имеет сменные шайбы (2) на патрубке (3) для ввода с воздухом потока частиц, диспергируемых с помощью сопла (7). Струйное диспергирующее устройство (4) через патрубок (9) обеспечивает ввод в аппарат капель мальтодекстрина необходимого размера и работает от того же воздуха из компрессора (на рисунке 1 не показан) с расходом, регулируемым вентилем (5). Емкости (6) и (8) служат для порций исходных частиц и готового продукта соответственно.
Для эксперимента готовили пять образцов: некапсулированный фермент пепсин, капсулированные ферменты с толщиной слоя мальтодекстрина 2, 3, 4, 6 мкм. Толщину слоя мальтодекстрина определяли с помощью электронного микроскопа в лаборатории Уральского федерального университета им. Первого президента РФ Б.Н. Ельцина. Для определения микроструктуры ферментов использовали программное обеспечение IncaFeature.
Активность пепсина определяли в диапазоне от 1,5 до 5,0 рН по количеству тирозина, образующегося в результате гидролиза казеина. В качестве субстрата использовали казеин по Гамерстену по методике M.L. Anson [19]. Количество тирозина определяли спектрофотометрическим методом при длине волны 280 нм на спектрофотометре СФ-46.
Каждое экспериментальное исследование выполняли в 5-кратной повторяемости. Статистическую обработку данных проводили с использованием программного пакета Statistica 9. Уровень доверительной вероятности составил 0,95 (p≤0,05).
Результаты исследования и их обсуждение
Для проведения настоящего исследования был разработан экспериментальный аппарат. Отличие его от ранее созданных состояло в том, что за счет диффузии мальтодекстрина в фермент обеспечивается его высокая длительная активность.
Разработанная технология микрокапсулирования состоит в следующем (см. рис. 2). К патрубку (3) аппарата герметично подсоединяется емкость (6) с ферментом, затем в патрубок
(3) подается от компрессора (не показан) воздух (газ), который, проходя через сменные сопла (7) различных диаметров, забирает частицы из емкости (6). Далее частицы в турбулентном потоке подсушиваются и поступают в корпус (1) аппарата с псевдокипящим слоем в виде фонтанирующих потоков. Высота и диаметр корпуса (1) исключают вынос из аппарата самых мелких частиц (менее 10 мкм) при еще бурном «витании» самых крупных из них (0,5 мм). После предварительной подсушки частиц в патрубке (3) и в фонтанирующих потоках аппарата (удаляется влага с частиц и устраняется их слипание) открывается вентиль (5) и воздух поступает в диспергатор (4) для жидких компонентов, предварительно заполненный их порцией. Диспергатор снабжен сменными соплами различных диаметров. Выбором одного из них обеспечивают диспергирование капель необходимых размеров, которые (в виде тумана) показаны на рисунке 2, через патрубок (9) вводят в фонтанирующие потоки донной части корпуса (1). Размер капель должен создать суммарную поверхность порции жидких компонентов, равную или несколько большую, чем суммарная поверхность порции твердых частиц в фонтанирующих потоках аппарата. Процесс покрытия фермента каплями интенсивен и скоротечен, он сопровождается и началом сушки прилипших капель за счет фонтанирующих потоков, омывающих частицы со всех сторон. После выдачи всей порции жидких компонентов вентиль (5) закрывается. По окончании сушки нижнюю горловину корпуса (1) перекрывают затвором с заслонкой (не показана) и порция капсулированного фермента самотеком ссыпается в емкость (8). Затем заслонку открывают, и цикл работы с новыми порциями твердого и жидкого компонентов повторяется в той же последовательности.
Микрокапсулы можно получать разных размеров (от 10 до 0,5 мм) за счет регулировки диаметров отверстий шайб (2).
Апробирование разработанного аппарата было реализовано проведением технологией микрокапсулирования ферментного препарата пепсина в три этапа. Первый этап включал прокачку микросфер по патрубку (3) (см. рис. 2) воздухом снизу в аппарат с предварительной подсушкой их в нем (патрубке) в псевдокпиящем слое в течение 2-3 мин. На втором этапе происходило распыление раствора мальтодекстрина в струйном диспергаторе (4), обеспечивающим за счет трех сменных сопел размер капель (до 90%) в диапазоне: 5 ÷ 10, 3 ÷ 5 и 0,5 ÷ 3 мкм. Продолжительность выдачи заданного количества каждой партии капель в аппарат колебалось от 3 до 6 мин, дольше с мелкими каплями. На третьем этапе шла сушка продукта в аппарате с псевдокпиящим слоем до готовности. Время сушки составило 5-8 мин. Соотношение защитного вещества (мальтодекстрин) и капсулируемого вещества (пепсин) было в диапазоне от 1:4 до 1:6.
У полученных микрокапсул были оценены протеолитические свойства. Установлено, что толщина защитного слоя из мальтодекстрина зависит от продолжительности его обработки в аппарате для микрокапсулирования (рис. 3).
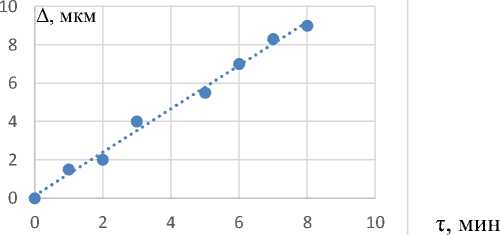
Рисунок 3 – Зависимость толщины поверхностного слоя мальтодекстрина от продолжительности его нанесения на пепсин
В проведенных опытах была получена линейная зависимость средней толщины нанесения раствора мальтодекстрина на гранулу пепсина и продолжительности нанесения. Графическое представление опытных данных в системе координат Δ = f (τ) показало, что экспериментальные точки укладываются в прямую линию (p≤0,05). Как видно из рисунка 3, уже через две минуты обработки раствором мальтодекстрина на грануле пепсина образуется более 25% толщины защитного поверхностного слоя от его среднего значения, а после 6 мин обработки – до 70 %. При этом расчетная скорость воздушного потока с раствором мальтодекстрина в узком сечении конуса рабочей камеры равнялась критической скорости витания крупных частиц пепсина и составила 0,17 м/с. По уравнению неразрывности потока и с учетом скоростей витания и уноса частиц пепсина расчетный размер широкой части конуса аппарата при нанесении раствора мальтодекстрина определяли из соотношения:
dm = 4,4 • dy, где dш – диаметр широкой части конуса рабочей камеры; dу – диаметр узкой части конуса рабочей камеры.
Анализ результатов исследований активности пепсина от толщины покрытия фермента (2, 4, 6 мкм) мальтодекстрином показал, что, чем толще слой мальтодектрина, тем дольше сохраняется его первоначальная активность (рис. 4).
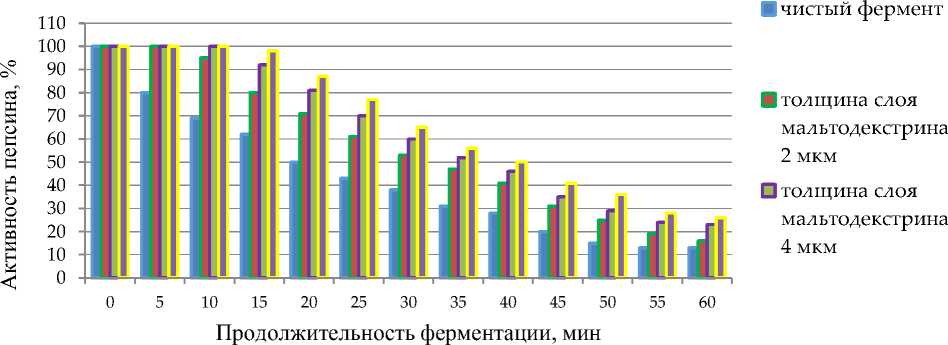
Рисунок 4 - Влияние толщины покрытия пепсина мальтодекстрином на его активность
По мере уменьшения толщины защитного покрытия фермент быстрее теряет свою первоначальную активность, что обусловлено меньшей степенью защиты слоя от воздействия внешней среды. Так, активность пепсина наиболее стабильна при толщине слоя мальтодекстрина - 6 мкм. Максимальная активность пепсина, иммобилизованного в растворе мальтодекстрина, сдвигается примерно на 2 ед. рН в щелочную сторону по сравнению со свободным ферментом. По всей вероятности, это может быть обусловлено как ограничением диффузии субстрата, когда отсутствует распределение протонов, так и ограничением их диффузии. Установлено, что иммобилизация фермента с использованием мальтодекстрина стабилизирует его активность практически в течение 6 мес., в то время как у чистого фермента активность уменьшается уже через 3 мес.
Эксперимент подтвердил, что мальтодекстрин обеспечил высокую твердость стенок капсулы, целостность не была нарушена. Полученные выводы позволяют использовать только мальтодекстрин как самодостаточный и эффективный капсулирующий материал без дополнительных добавок.
Выводы
На основании результатов исследований предложен способ иммобилизации фермента пепсина путем присоединения его к инертной матрице – мальтодекстрину. Установлено влияние толщины слоя мальтодекстрина на активность фермента, показано, что иммобилизация пепсина мальтодекстрином сдвигает максимальную активность примерно на 2 ед. рН в щелочную сторону. Установлено, что хранение иммобилизованного фермента при температуре 0-2 оС сохраняет его протеолитическую активность по сравнению с чистым ферментом практически в 2 раза.
Учитывая полученные результаты, можно рекомендовать осуществлять микрокапсулирование протеолитического фермента пепсина с использованием мальтодекстрина, что позволит расширить возможности использования иммобилизованных ферментов при производстве пищевых продуктов.
Список литературы Микрокапсулирование пепсина и оценка его протеолитических свойств
- Gharsallaoui A.; Roudaut G.; Chambin O. et al. Application of spray-drying in microencapsulation of food ingredients //An overview. Food Res. Int. 2007. P. 40.P. 1107-1121.
- Pavli F., Tassou C., Nychas G.-J.E. et al. Probiotic Incorporation in Edible Films and Coatings: Bioactive Solution for Functional Foods //Int. J. Mol. Sci. 2018.
- Emese B.;,Zsolt B.; Beáta A.Effect of microencapsulation on viability and survival in simulated gut conditions of probiotic bacteria. Romanian Biotechnological Letters: Preprint. December 2018.
- Jeyakumari A., Zynudheen A.A., Parvathy U. Microencapsulation of bioactive food ingredients and controlled release-a review ICAR-Mumbai research of centre of Central Institute of Fisheries Technology. 2016. Vol. 2, Issue 6,N 07. P. 1-9.
- Ying D., Sanguansri L., Weerakkody R. et al. Effect of encapsulant matrix on stability of microencapsulated probiotics // J. Funct. Foods. 2016. N25. P. 447-458.


