Микротрансплантация гаплоидентичных гемопоэтических стволовых клеток периферической крови при острых миелоидных лейкозах
Автор: Бондаренко С. Н., Морозова Е. В., Смирнова А. Г., Власова Ю. Ю., Залялов Ю. Р., Смыкова О. Г., Федорова Л. В., Бейнарович А. В., Цветков Н. Ю., Канунников М. М., Алянский А. Л., Бархатов И. М., Бабенко Е. В., Гиндина Т. Л., Певцов Д. Э., Моисеев И. С., Кулагин А. Д., Афанасьев Б. В.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 1 т.17, 2021 года.
Бесплатный доступ
Аллогенная трансплантация гемопоэтических стволовых клеток (аллоТГСК) после немиелоаблативного кондиционирования с целью достижения транзиторного микрохимеризма — микротрансплантация (микроТГСК) — является одним из новых те- рапевтических подходов в группе высокого риска трансплантационной летальности при остром миелоидном лейкозе (ОМЛ).
МикроТГСК, острый миелоидный лейкоз, гаплоидентичная трансплантация ГСК
Короткий адрес: https://sciup.org/170175040
IDR: 170175040
Текст научной статьи Микротрансплантация гаплоидентичных гемопоэтических стволовых клеток периферической крови при острых миелоидных лейкозах
В течение длительного времени возможность аллогенных иммунокомпетентных клеток индуцировать иммунный ответ в организме хозяина изучалась на животных [12, 13]. В этих исследованиях было продемонстрировано улучшение выживаемости лабораторных животных после введения аллогенных клеток посредством активации клеток хозяина. В других экспериментах наличие противоопухолевого ответа сохранялось без длительного приживления и после утраты химеризма [14, 15]. Мышам проводились аллогенные трансплантации после кондиционирования циклофосфамидом, моноклональными антителами к C 4 и C 8, облучением тимуса с достижением смешанного химеризма. Инфузия донорских лимфоцитов приводила к достижению полного химеризма, а инфузия лимфоцитов реципиента к его полной утрате, однако все равно имел место противо-пухолевый эффект.
Подобный эффект был описан при сочетанной трансплантации ГСК и почки от HLA-совместимого сиблинга у пациентки с множественной миеломой и терминальной стадией почечной недостаточности. После немиелоаблативного кондиционирования был достигнут смешанный химеризм, который был утрачен после дня 100. Иммуносупрессивная терапия была отменена, однако отторжения трансплантата почки не последовало, и пациентка длительное время находилась в состоянии полной ремиссии по основному заболеванию [16]. Возможность достижения ремиссии несмотря на утрату химеризма была продемонстрирована при проведении аллоТГСК с немиелоаблативным кондиционированием с последующим введением донорских лимфоцитов у пациентов с продвинутыми стадиями гемобластозов [17–19].
Результаты экспериментов на животных и полученные клинические данные привели к появлению исследований, целью которых является достижение противоопухолевого ответа без длительного приживления трансплантата. Содержание менее 1 % клеток донора в периферической крови реципиента в таких работах называется микрохимеризмом. Аллогенная трансплантация гемопоэтических стволовых клеток после немиело-аблативного кондиционирования с целью достижения микрохимеризма называется микроТГСК [20, 21].
В первое проспективное исследование по сравнению эффективности микроТГСК и стандартной химиотерапии (ХТ) вошло 58 пациентов старше 60 лет с впервые выявленным ОМЛ [22]. Индукционная ХТ включала митоксантрон 8–10 мг/м2 в течении 3 дней и цитарабин 150 мг/м2 в течении 7 дней. Исследуемая группа получала инфузию гапло-идентичных стволовых клеток периферической крови через 36 часов после окончания ХТ. Частота ремиссий была выше в группе микроТГСК как в целом, 80 % против 42,8 % (р = 0.006), так и в подгруппе пациентов старше 70 лет, 92,8 % против 12,5 % (р = 0.0003). Также отмечено более раннее восстановление нейтрофилов, 11 день против 16 дня, и тромбоцитов, 14,5 дней против 20 дней (р = 0.02), а также меньшая частота тяжелых инфекционных осложнений, 26,7 % против
57,5 % (р = 0.03). После достижения ремиссии проводилось еще 2 аналогичных курса консолидации. ОВ в исследуемой группе составила 39,3 % против 10,3 % в контрольной группе (р = 0.01). Микрохимеризм был зарегистрирован у всех пациентов, случаев развития РТПХ не было.
В следующем исследовании те же авторы оценивали эффективность микроТГСК как консолидации ремиссии у пациентов благоприятной и промежуточной прогностических групп ОМЛ [23]. В анализ вошел 101 пациент в возрасте от 9 до 65 лет. Режим кондиционирования состоял из высоких доз цитарабина, через 24ч проводилась инфузия СКПК от га-плоидентичного донора. Шестилетняя общая выживаемость (ОВ) составила 89,5 % в благоприятной прогностической группе и 65,2 % в промежуточной. Содержание C 3 + клеток в трансплантате более 1,1 х 10 8 /кг ассоциировалось с более высокой ОВ, 82,1 % против 55,3 % (р = 0.091).
В качестве возможных механизмов противоопухолевого эффекта обсуждаются как прямое цитотоксическое действие аллоре-активных Т-лимфоцитов и NK -клеток, так и активация C 4+ — клетками донора C 8+ и антиген-презентирующих клеток хозяина.
Другая группа китайских ученых провела сравнение результатов микроТГСК и ал-лоТГСК от HLA-совместимого родственного донора при ОМЛ у пациентов промежуточной и неблагоприятной прогностической группы. Медиана возраста составила 56 (19–65) лет и 53 (45–62) года, соответственно. Режим кондиционирования состоял из высоких доз цитарабина при микроТГСК и циклофосфамида с бусульфаном при родственной HLA-совместимой аллоТГСК. Двухлетняя ОВ после микроТГСК составила 34,5 % против 74,1 % (р = 0.001), частота рецидивов 62,3 % против 17,6 % (р = 0.0001) и ЛНР 4,2 % против 10,9 % (р = 0.251). В исследуемой группе восстановление гемопоэза происходило быстрее и было меньше инфекционных осложнений.
Необходимость использования новых методов для лечения российской популяции пациентов ОМЛ обусловлена значительной долей пациентов с высоким индексом ко-морбидности, более высокой токсичностью при проведении курсов высокодозной ХТ, что требует модификации протоколов, рекомендованных европейскими и американскими руководствами [24]. Реализация совмести- мых родственных аллоТГСК у больных старшего возраста затруднена ввиду малого количества сиблингов в семьях, у возрастных пациентов сиблинги также зачастую имеют значимую сопутствующую патологию, что не позволяет рассматривать их в качестве доноров ГСК. Поиск совместимого неродственного донора не всегда оправдан с учетом длительности и высокого риска рецидива у пожилых больных [25].
Цель . Определение роли микротрансплантация гаплоидентичных гемопоэтических стволовых клеток периферической крови в терапии острого миелоидного лейкоза у пациентов старшей возрастной группы.
Материалы и методы . Микротрансплантация гаплоидентичных гемопоэтических стволовых клеток периферической крови выполнена 33 пациентам в возрасте 55–75 лет (медиана 64 года) с диагнозом ОМЛ (кроме ОМЛ t (15;17), M3 FAB) в первой (n23, 70 %) или второй ремиссии (n10, 30 %). Индукционная химиотерапия проводилась вне клиники НИИ ДОГиТ им. Р. М. Горбачевой и была различной интенсивности: «7 + 3», «5 + 2» или «МДЦ».
В исследование включались пациенты после достижения морфологической ремиссии ОМЛ. При достижении ремиссии пациенты оценивались по индексу коморбидности, проводилось HLA-типирование. Пациентам старше 55 лет, с индексом HCT-C > 3 и отсутствием HLA-совместимого донора аллоТГСК не была рекомендована, они рассматривались как кандидаты на консолидацию ремиссии методом микроТГСК от гаплоидентичного донора. С учетом более молодого возраста в качестве доноров предпочтение отдавалось детям пациентов. Донорами были гаплоидентичные по HLA генам и класса — дети (10 дочерей и 22 сына), у 1 пациента, не имевшего детей, донором был гаплоидентичный брат.
Старше 60 лет был 21 пациент, 12 пациентов в возрасте от 55 до 60 лет. Женщин было 19 (57 %), мужчин — 14 (43 %). Медиана наблюдения составила 21 месяц (4–64 мес).
Согласно молекулярно-генетической классификации ELN2017 к благоприятной прогностической группе относилось 3 (9 %) пациента, к промежуточной — 22 (67 %) и неблагоприятной — 8 (24 %) пациентов (рисунок 1).
ГРУППЫ РИСКА СОГЛАСНО ELN2017
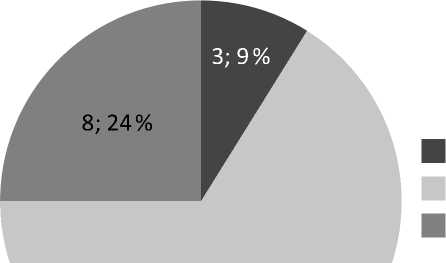
22; 67 %
благоприятный (n3) промежуточный (n22) неблагоприятный (n8)
Рисунок 1. Распределение реципиентов микроТГСК в зависимости от молекулярно-генетической прогностической групп ELN2017
ОМЛ de novo был у 30 (91 %) пациентов, МДС и у 1 пациента ОМЛ, связанный с пред-у 3 (9 %) — вторичный ОМЛ: у 2 пациентов из шествующей терапией (таблица 1).
Характеристика пациентов микроТГСК
Таблица 1.
|
Пациенты |
n33 |
|
Возраст |
медиана 64 года (55–75) |
|
Пол |
Жен — n = 19 (57 %) Mуж — n = 14 (43 %) |
|
Молекулярно-генетическая группа риска ELN2017 |
Благоприятный — n = 3 (9 %), Промежуточный — n = 22 (67 %) Неблагоприятный — n = 8 (24 %) |
|
Статус заболевания |
Ремиссия 1 — n = 23 (70 %) Ремиссия 2 — n = 10 (30 %) |
Медиана времени от постановки диагноза до проведения микроТГСК составила 95 дней (59–150). Медиана времени от достижения ремиссии до проведения микроТГСК составила 41 день (14–114).
Консолидация ремиссии проводилась цитарабином в дозе 500–1000 мг/м2 2 раза в дни Д-4, Д-3, Д-2 (суммарная доза 3–6 г/м2). Иммуносупрессивная терапия не проводилась. Затем следовала 36 часовая пауза (Д-1). Инфузия донорских ГСК выполнялась на Д0, премедикация проводилась антипиретиками и антигистаминными препаратами, без глюкокортикостероидов (рисунок 2).
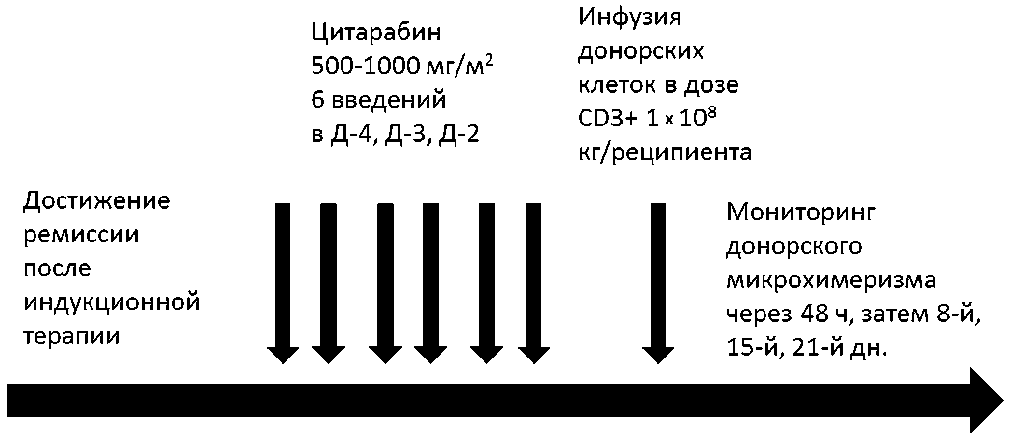
Рисунок 2. Схема микроТГСК
Заготовка ГСК проводилась из периферической крови с помощью аппарата COBE SPECTRA методом лейкоцитафереза. Афере-зу предшествовало назначение для мобилизации ГСК рекомбинантного Г-КСФ в дозе 10 мкг/кг/дн в течение 5 дней. Оптимальная клеточность трансплантата оценивалась по количеству C 3 + клеток на кг массы тела пациента, нижней границей считали 1 х 10 8 / кг. Контроль клеточности осуществлялся методом проточной цитометрии с использованием моноклональных антител анти-C 56+ , анти-C 3+ , анти-C 45+ и анти-C 34+ .
Клеточность трансплантата по содержанию:
-
• CD3 + от 0,5 до 2,5 х 10 8 кг/реципиента (медиана 1,4).
-
• CD34+ от 0,7 до 15,0 х 10 6 кг/реципиента (медиана 3,4).
-
• NK-клетки от 3,6 до 19,0 х 10 8 кг/реципиента (медиана 7,4).
Донорский микрохимеризм определялся методом количественной РВ-ПЦР на основе полиморфизма nsertion/deletion (indel) с чувствительностью 104–105. Микрохимеризм оценивался через 48 часов после инфузии клеток, затем на Д + 8, Д + 15, Д + 21 и далее до исчезновения микрохимеризма.
Результаты. Три микроТГСК проведено 11 (33 %) пациентам, 16 (49 %) пациентам две микротрансплантации и 6 (18 %) пациентам одна. Интервал между микроТГСК составил от 35 до 77 дней (медиана 52 дня). Различия в сроках восстановления гемопоэза в зависимости от порядкового номера микроТГСК были незначительны (таблица 2).
Восстановление кроветворения после микроТГСК
Таблица 2.
|
1-я микроТГСК |
2-я микроТГСК |
3-я микроТГСК |
|
|
Нейтрофилы > 0,5 х 10 9 /л, дни, медиана (интервал) |
13 (4–21) |
14 (6–20) |
16 (11–19) |
|
Тромбоциты > 20 х 10 9 /л, дни, медиана (интервал) |
7 (2–27) |
8 (2–18) |
7 (4–14) |
В благоприятной прогностической группе ELN2017 из 3 пациентов 1 умер в рецидиве, 1 жив в рецидиве, 1 (33 %) жив в ремиссии; в промежуточной группе из 22 пациентов 9 умерло в рецидиве, 13 (59 %) живы в ремис-сии;в неблагоприятной группе из 8 пациентов 2 умерло в рецидиве, 2 живы в рецидиве, 4 (50 %) живы в ремиссии.
В зависимости от количества, проведенных микроТГСК в настоящее время:
-
• после 3-х микроТГСК из 11 пациентов —
-
3 умерло в рецидиве, 1 жив в рецидиве, 7 (64 %) жив в ремиссии;
-
• после 2-х микроТГСК из 16 пациентов —
-
7 умерло в рецидиве, 1 жив в рецидиве, 8 (50 %) живы в ремиссии;
-
• после одной микроТГСК из 6 пациентов —
-
2 умерло в рецидиве, 1 живы в рецидиве, 3 (50 %) живы в ремиссии.
Влияния уровня C 3 + клеток в трансплантате на результаты микроТГСК в нашем исследовании установлено не было.
Донорский микрохимеризм определялся у 31 (94 %) пациента. Медиана персистенции донорского микрохимеризма составила 8 дней (от 2 до 57 дней) (рисунок 3).
Кинетика донорского микрохимеризма после введения ГаплоГСК
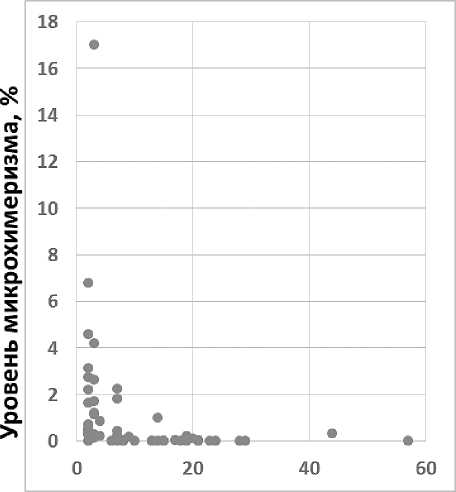
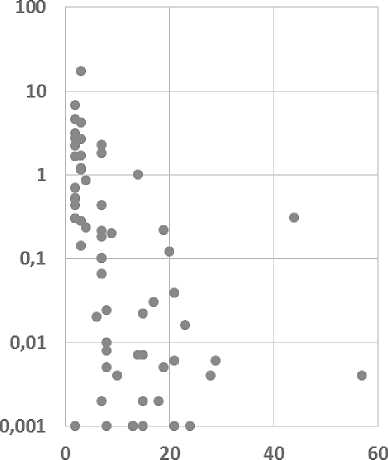
Время, дни Время, дни
Рисунок 3. Кинетика донорского микрохимеризма
Летальных исходов, связанных с проведением микроТГСК, не было. Осложнения, возникшие во время проведения микротранс- плантации, можно разделить на 3 группы: иммунные (лихорадка в первые 48 часов после введения ГСК, РТПХ), токсические (кожная сыпь при введении цитарабина), инфекционные (фебрильная нейтропения, энтеропатия, бактериальная пневмония, бактериальный сепсис) и сердечно-сосудистые (ТЭЛА, парок сизм фибрилляции предсердий) (таблица 3).
Осложнения после микроТГСК
|
n = 71 |
|
|
Лихорадка в первые 48 часов |
66 (92 %) |
|
РТПХ кожи 2 ст . |
2(2 %) |
|
Сыпь |
14 (19 %) |
|
Фебрильная нейтропения |
28 (39 %) |
|
Бактериальная пневмония |
6 (9 %) |
|
Сепсис ( E. coli, St. epidirmidis, Kl. pneumoniae ) |
7 (11 %) |
|
Энтеропатия |
2 (2 %) |
|
ТЭЛА мелких ветвей |
1 (1 %) |
|
Пароксизм фибрилляции предсердий |
1 (1 %) |
Таблица 3.
Лихорадка после введения ГСК купировалась введением антипиретиков. РТПХ кожи 2 ст. была подтверждена гистологически у 2 пациентов на 5 и 7 день от введения ГСК и была купирована ГКС в дозе 1 мг/кг в течение 3 и 5 дней.
Для сравнения результатов микроТГСК использовали пациентов двух групп:
1–21 пациент в возрасте 55–67 лет, получивший программную химиотерапию, медиана возраста составила 59 лет. В анализ не включены пациенты, прожившие менее, чем медиана времени от диагноза д о проведения микроТГСК (95 дней).
2–21 пациент в возрасте 55–70 лет, получивший аллоТГСК от HLA-совместимого донора в первой или второй ремиссии, медиана возраста составила 58 лет. Старше 60 лет было 4пациента, от 55 до 60 лет 17 пациентов.
Двухлетняя ОВ после аллоТГСК составила 66 % (95 % ДИ 46–86), 42 % (95 % ДИ 20–64) (медиана 31 мес.) после микроТГСК и 23 % (95 % ДИ 3–43) (медиана 17 мес.) при ХТ (р = 0.05) (рисунок 4).
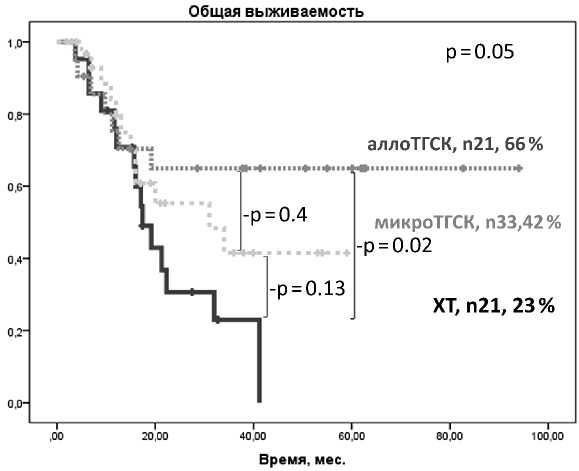
Рисунок 4. Двухлетняя ОВ у пациентов с ОМЛ в возрасте старше 55 лет в зависимости от метода консолидации ремиссии (ХТ, аллоТГСК, микроТГСК)
Двухлетняя безрецидивная выживаемость после аллоТГСК составила 65 % (95 % ДИ 46–84), 35 % (95 % ДИ 16–54) (медиана 18 мес.) после микроТГСК и 19 % (95 % ДИ 1–38) (медиана 12,4 мес.) при ХТ (р = 0.05) (рисунок 5).
От осложнений аллоТГСК умерло 2 пациента, один в результате инфаркта, второй от инфекционных осложнений на фоне тяжелой РТПХ. Во время проведения ХТ 1 пациент умер от острой сердечно-сосудистой недостаточности, второй от сепсиса.
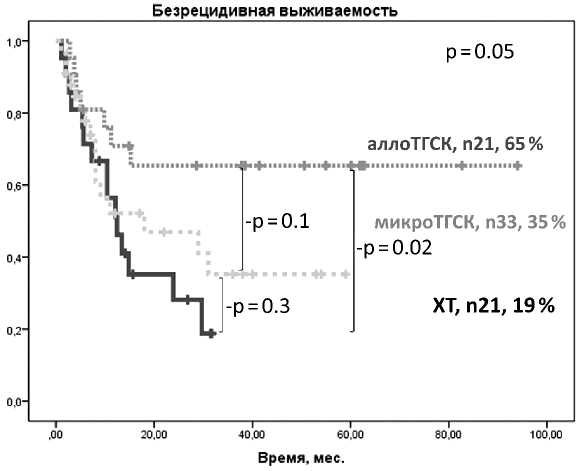
Рисунок 5. Двухлетняя БРВ ОМЛ в возрасте старше 55 лет в зависимости от метода консолидации ремиссии (ХТ, аллоТГСК, микроТГСК)
Обсуждение . Большинство пациентов с ОМЛ старше 60 лет на момент дебюта заболевания, что ограничивает терапевтические возможности в этой группе [25, 26, 27]. Для пациентов старшей возрастной группы, находящихся в удовлетворительной физической форме и не имеющих значимой сопутствующей патологии может рассматриваться проведение аллоТГСК от HLA-совместимого донора. В анализируемой группе двухлетняя ОВ пациентов в возрасте 55–70 лет после аллоТГСК составила 66 %, безреци-дивная — 65 %. Аналогичные результаты получены и в других исследования, в частности 50 % и 48 % [28], и 66 % и 64 % [29]. Это свидетельствует о возможности проведения аллоТГСК при отсутствии противопоказаний независимо от возраста. Однако значительная доля больных не являются кандидатами для проведения интенсивной ХТ и аллоТГСК. Помимо перспектив использования таргет-ных препаратов, в этой возрастной группе проводятся исследования эффективности риск-адаптированных трансплантаций с транзиторным химеризмом — микроТГСК
[30]. По результатам одного из наиболее крупных исследований uo по эффективности ми-кроТГСК у пациентов с впервые выявленным ОМЛ двухлетняя ОВ в возрастной группе от 60 до 70 лет составила 64–67 % [31]. Основной причиной неудач были рецидивы заболевания — до 40 %, тогда как летальность, не связанная с рецидивом, не превышала 10 %. В нашей работе двухлетняя ОВ составила 42 %, БРВ 35 %, причем все летальные исходы были обусловлены рецидивами ОМЛ.
Заключение . Таким образом, ОВ после аллоТГСК выше, чем после микроТГСК, однако при наличии противопоказаний к проведению аллоТГСК пациентам старшего возраста может рассматриваться микроТГСК в качестве эффективной и безопасной альтернативы ХТ. Для определения оптимальных режимов кондиционирования, изучения влияния клеточного состава трансплантата, длительности микрохимеризма, степени HLA -несовместимости, пола донора на эффективность микротрансплантации требуются дальнейшие исследования.
Конфликты интересов отсутствует
Источник финансирования
Исследование не имело источника финансирования
Вклад авторов
Концепция и дизайн : С. Н. Бондаренко,, Л. С. Зубаровская, И. С. Моисеев, А. Д. Кулагин, Б. В. Афанасьев
Сбор и обработка данных: С. Н. Бондаренко, А. Г. Смирнова, О. Г. Смыкова
Предоставление материалов исследования: Ю. Ю. Власова, Ю. Р. Залялов, О. Г. Смыкова, Л. В. Федорова, А. В. Бейнарович, Н. Ю. Цветков, М. М. Канунников, А. Л. Алянский, И. М. Бархатов, Е. В. Бабенко, Т. Л. Гиндина, Д. Э. Певцов
Анализ и интерпретация: С. Н. Бондаренко, Е. В. Морозова, И. С. Моисеев
Подготовка рукописи: С. Н. Бондаренко, А. Г. Смирнова
Окончательное одобрение рукописи: С. Н. Бондаренко, Б. В. Афанасьев
Список литературы Микротрансплантация гаплоидентичных гемопоэтических стволовых клеток периферической крови при острых миелоидных лейкозах
- Kekre, N. Hematopoietic stem cell transplantation donor sources in the 21st century: choosing the ideal
- donor when a perfect match does not exist. / N. Kekre, J. Antin // Blood. — 2014 Jul 17. — Vol. 124, № 3. —
- P. 334–343.
- Passweg, J. R. European Society for Blood and Marrow Transplantation (EBMT). Hematopoietic SCT
- in Europe 2013: recent trends in the use of alternative donors showing more haploidentical donors but
- fewer cord blood transplants. / J. R. Passweg, H. Baldomero, P. Bader, C. Bonini, S. Cesaro et al. // Bone
- Marrow Transplant. — 2015 Apr. — Vol. 50, № 4. — P. 476–482.
- Baker, M. Comparative Outcomes after Haploidentical or Unrelated Donor Bone Marrow or Blood
- Stem Cell Transplantation in Adult Patients with Hematological Malignancies. / M. Baker, H. Wang,
- S. D. Rowley, L. Cai, A. L. Pecora et al. // Biol Blood Marrow Transplant. — 2016 Nov. — Vol. 22, № 11. —
- P. 2047–2055.
- Lee, C. J. Haploidentical hematopoietic cell transplantation for adult acute myeloid leukemia:
- a position statement from the Acute Leukemia Working Party of the European Society for Blood
- and Marrow Transplantation. / C. J. Lee, B. N. Savani, M. Mohty, M. Labopin, A. Ruggeri et al. //
- Haematologica. — 2017 Nov. — Vol. 102, № 11. — P. 1810–1822.
- Gupta, V. Nonmyeloablative stem cell transplantation for myelodysplastic syndrome or acute myeloid
- leukemia in patients 60 years or older. / V. Gupta, A. Daly, J. H. Lipton, W. Hasegawa, K. Chun et al. // Biol
- Blood Marrow Transplant. — 2005 Oct. — Vol. 11, № 10. — P. 764–772.
- Shimoni, A. Long-term survival and late events after allogeneic stem cell transplantation from HLA-matched
- siblings for acute myeloid leukemia with myeloablative compared to reduced-intensity conditioning:
- a report on behalf of the acute leukemia working party of European group for blood and marrow
- transplantation. / A. Shimoni, M. Labopin, B. Savani, L. Volin, G. Ehninger et al. // J Hematol Oncol. — 2016
- Nov 8. — Vol. 9, № 1. — P. 118.
- Devillier, R. Low incidence of chronic GVHD after HLA-haploidentical peripheral blood stem cell
- transplantation with post-transplantation cyclophosphamide in older patients. / R. Devillier, A. Granata,
- S. Furst, S. Harbi, C. Faucher et al. // Br J Haematol. — 2017 Jan. — Vol. 176, № 1. — P. 132–135.
- Muffly, L. Increasing use of allogeneic hematopoietic cell transplantation in patients aged 70 years
- and older in the United States. / L. Muffly, M. C. Pasquini, M. Martens, R. Brazauskas, X. Zhu et al. //
- Blood. — 2017 Aug 31. — Vol. 130, № 9. — P. 1156–1164.
- Сёмочкин, С. В. Клинико-эпидемиологическая характеристика острых миелоидных лейкозов
- у взрослых по данным муниципальных отделений гематологии Москвы. / С. В. Сёмочкин, Т. Н. Тол-
- стых, Н. В. Архипова, В. Л. Иванова, О. В. Клюева и др. // Терапевтический архив. — 2015. — Т. 87,
- № 7. — С. 26–32.
- Ахмерзаева, З. Х. Эпидемиологическое исследование острых лейкозов в пяти регионах Российской
- федерации. / З. Х. Ахмерзаева, Е. Н. Паровичникова, М. А. Русинов, Е. Н. Зотина, Л. В. Гаврилова и др. //
- Гематология и трансфузиология. — 2017. — Т. 62, № 1. — С. 46–51.
- Siegel, R. L. Cancer statistics, 2019. / R. L. Siegel, K. D. Miller, A. Jemal // CA Cancer J Clin. — 2019 Jan. —
- Vol. 69, № 1. — P. 7–34.
- Katz, D. H. Resistance of guinea pigs to leukemia following transfer of immunocompetent allogeneic
- lymphoid cells. / D. H. Katz, L. Ellman, W. E. Paul, I. Green, B. Benacerraf // Cancer Res. — 1972 Jan. —
- Vol. 32, № 1. — P. 133–140.
- Ellman, L. Mechanisms involved in the antileukemic effect of immunocompetent allogeneic lymphoid cell
- transfer. / L. Ellman, D. H. Katz, I. Green, W. E. Paul, B. Benacerraf // Cancer Res. — 1972 Jan. — Vol. 32,
- № 1. — P. 141–148.
- Rubio, M. T. Antitumor effect of donor marrow graft rejection induced by recipient leukocyte infusions
- in mixed chimeras prepared with nonmyeloablative conditioning: critical role for recipient-derived
- IFN-gamma. / M. T. Rubio, Y. M. Kim, T. Sachs, M. Mapara, G. Zhao et al. // Blood. — 2003 Sep 15. — Vol. 102,
- № 6. — P. 2300–2307.
- Rubio, M. T. Role of indirect allo- and autoreactivity in anti-tumor responses induced by recipient leukocyte
- infusions (RLI) in mixed chimeras prepared with nonmyeloablative conditioning. / M. T. Rubio, G. Zhao,
- J. Buchli, M. Chittenden, M. Sykes // Clin Immunol. — 2006 Jul. — Vol. 120, № 1. — P. 33–44.
- Spitzer, T. R. Combined histocompatibility leukocyte antigen-matched donor bone marrow and renal
- transplantation for multiple myeloma with end stage renal disease: the induction of allograft tolerance
- through mixed lymphohematopoietic chimerism. / T. R. Spitzer, F. Delmonico, N. Tolkoff-Rubin, S. McAfee,
- R. Sackstein et al. // Transplant. — 1999 Aug 27. — Vol. 68, № 4. — P. 480–484.
- Spitzer, T. R. Intentional induction of mixed chimerism and achievement of antitumor responses after
- nonmyeloablative conditioning therapy and HLA-matched donor bone marrow transplantation for
- refractory hematologic malignancies. / T. R. Spitzer, S. McAfee, R. Sackstein, C. Colby, H. C. Toh et al. // Biol
- Blood Marrow Transplant. — 2000. — Vol. 6, № 3A. — P. 309–320.
- Dey, B. R. Successful allogeneic stem cell transplantation with nonmyeloablative conditioning in patients
- with relapsed hematologic malignancy following autologous stem cell transplantation. / B. R. Dey,
- S. McAfee, R. Sackstein, C. Colby, S. Saidman et al. // Biol Blood Marrow Transplant J Am Soc Blood Marrow
- Transplant. — 2001. — Vol. 7, № 11. — P. 604–612.
- Dey, B. R. Anti-tumour response despite loss of donor chimaerism in patients treated with non-myeloablative
- conditioning and allogeneic stem cell transplantation. / B. R. Dey, S. McAfee, C. Colby, K. Cieply, M. Caron et
- al. // Br J Haematol. — 2005 Feb. — Vol. 128, № 3. — P. 351–359.
- Cai, B. Microtransplantation: clinical applications and mechanisms. / B. Cai, M. Guo, H. Ai // Curr Opin
- Hematol. — 2018 Nov. — Vol. 25, № 6. — P. 417–424.
- Guo, M. HLA-Mismatched Microtransplant in Older Patients Newly Diagnosed With Acute Myeloid
- Leukemia. / M. Guo, N. J. Chao, J-Y. Li, D. A. Rizzieri, Q-Y. Sun et al. // JAMA Oncol. — 2018 Jan. — Vol. 4,
- № 1. — P. 54–62.
- Guo, M. Infusion of HLA-mismatched peripheral blood stem cells improves the outcome of chemotherapy
- for acute myeloid leukemia in elderly patients. / M. Guo, K. X. Hu, C. L. Yu, Q. Y. Sun, J. H. Qiao et al. // Blood. —
- 2011 Jan 20. — Vol. 117, № 3. — P. 936–941.
- Guo, M. HLA-mismatched stem-cell microtransplantation as postremission therapy for acute myeloid
- leukemia: long-term follow-up. / M. Guo, K. X. Hu, G. X. Liu, C. L. Yu, J. H. Qiao et al. // J Clin Oncol. — 2012
- Nov 20. — Vol. 30, № 33. — P. 4084–4090.
- Савченко, В. Г. Национальные клинические рекомендации по диагностике и лечению острых мие-
- лоидных лейкозов взрослых. / В. Г. Савченко, Е. Н. Паровичникова, Б. В. Афанасьев и др. // Гемато-
- логия и трансфузиология. — 2014. — Т. 59. № 1. — С. 2–29.
- Appelbaum, F. R. Age and acute myeloid leukemia. / F. R. Appelbaum, H. Gundacker, D. R. Head, M. L. Slovak,
- C. L. Willman et al. // Blood. — 2006 May 1. — Vol. 107, № 9. — P. 3481–3485.
- Itzykson, R. Impact of post-remission therapy in patients aged 65–70 years with de novo acute myeloid
- leukemia: a comparison of two concomitant randomized ALFA trials with overlapping age inclusion
- criteria. / R. Itzykson, C. Gardin, C. Pautas, X. Thomas, P. Turlure et al. // Haematologica. — 2011 Jun. — Vol.
- 96, № 6. — P. 837–844.
- Webster, J. A. Aсute myeloid leukemia in the elderly: therapeutiс options and сhoiсe / J. A. Webster,
- K. W. Pratz // Leuk Lymphoma. — 2018 Feb. — Vol. 59, № 2. — P. 274–287.
- Devillier, R. HLA-Matched Sibling versus Unrelated versus Haploidentical Related Donor Allogeneic
- Hematopoietic Stem Cell Transplantation for Patients Aged Over 60 Years with Acute Myeloid Leukemia:
- A Single-Center Donor Comparison. / R. Devillier, F. Legrand, J. Rey, L. Castagna, S. Furst et al. // Biol Blood
- Marrow Transplant. — 2018 Jul;24(7):1449–1454.
- Huang, J. Haploidentical related donor vs matched sibling donor allogeneic hematopoietic stem cell
- transplantation for acute myeloid leukemia and myelodysplastic syndrome aged over 50 years: A singlecenter
- retrospective study. / J. Huang, F. Huang, Z. Fan, N. Xu, L. Xuan et al. // Cancer Med. 2020 Jul
- 20;9(17):6244–6255.
- Kong, X. Effect of the microtransplantation of allogeneic hematopoietic stem cells as maintenance therapy for elderly patients with acute leukemia. / X. Kong, Y. Chen, L. Wang, Y. Zhou, Y. He et al. // Oncol Lett. — 2015 May. — Vol. 9, № 5. — P. 2331–2334.
- Guo, M. HLA-Mismatched Microtransplant in Older Patients Newly Diagnosed With Acute Myeloid
- Leukemia: Results From the Microtransplantation Interest Group. // M. Guo, N. J. Chao, J-Y. Li D. Rizzieri,
- Q. Sun et al. // Oncol. 2018; 4(1):54–62.


