Миокардит при инфекции COVID-19: патогенетические механизмы, сложности диагностики (обзор)
Автор: Сергеева В. А., Липатова Т. Е.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Кардиология
Статья в выпуске: 3 т.17, 2021 года.
Бесплатный доступ
В обзоре обобщена актуальная информация по воспалительному миокардиальному повреждению при инфекции COVID-19. В качестве литературных источников использованы наиболее актуальные работы 2020–2021 гг., а также более ранние источники, содержащие фундаментальные сведения соответствующей тематики; наиболее значимая информация по обсуждаемой проблеме приведена в статье (всего 50 работ). Использованы запросы: «миокардит», «миокардиальное повреждение», «COVID-19» — в поисковых системах PubMed / MedLine, eLibrary. Анализ актуальной международной литературы продемонстрировал убедительные доказательства возможного развития миокардита в рамках новой коронавирусной инфекции. Значительные сложности представляет гистологическая верификация миокардиального повреждения, ассоциированного с COVID-19, так как в условиях тяжелого течения инфекции выполнение эндомиокардиальной биопсии не всегда возможно. В связи с этим статистические данные не отражают полной информации о распространенности миокардитов, ассоциированных с COVID-19. Не окончательно прояснены все механизмы патогенеза воспалительного повреждения миокарда. Для улучшения прогноза пациентов с миокардитом при инфекции COVID-19 требуется дальнейшее изучение проблемы и выработка унифицированных подходов к диагностике и лечению
COVID-19, SARS-CoV-2, миокардит, миокардиальное повреждение, сердечно-сосудистая система.
Короткий адрес: https://sciup.org/149138157
IDR: 149138157 | УДК: 616.127–002: [616.98:578.834.1] –07
Текст научной статьи Миокардит при инфекции COVID-19: патогенетические механизмы, сложности диагностики (обзор)
1 Введение. Миокардит — воспалительное заболевание сердца, вызываемое преимущественно вирусами [1, 2]. В актуальных европейских и российских рекомендациях острый миокардит характеризуется развертыванием клинической картины до постановки диагноза в срок до одного месяца. При развитии на фоне воспаления миокарда дисфункции сердца в виде дилатационной кардиомиопатии или фиброза без сохранения воспаления заболевание трактуется как воспалительная кардиомиопатия [3, 4]. Взаимодействие вирусов с кардиомиоцитами при этом до конца не прояснено. Известно о как прямом повреждающем действии вирусов на клетки миокарда, так и иммуноопосредованном. Кардиотропность вирусов подтверждается их возможностью проникать в клетки миокарда и вызывать воспаление. Для идентификации внутриклеточной локализации вируса используют гистологическую верификацию биоптата с помощью метода полимеразной цепной реакции (ПЦР) с обратной транскрипцией, при котором выявляют присутствие вирусного генома и определяют клинический порог, позволяющий дифференцировать и активную вирусную инфекцию, и латентную. Не все вирусы обладают способностью к прямому повреждению кардиомиоцитов. Интерес с этой точки зрения представляет вирус SARS-CoV-2, являющийся причиной сегодняшней пандемии.
Целью настоящей работы является обобщение актуальной информации по воспалительному миокардиальному повреждению при инфекции COVID-19.
Для написания обзора использованы запросы: «миокардит», «миокардиальное повреждение», «COVID-19» — в поисковых системах PubMed/Med-Line, eLibrary. Проанализированы результаты международных научных публикаций по представленной тематике, содержащие актуальные сведения по интересующей проблеме. Обработано более 450 различных литературных источников, содержащих информацию по воспалительному миокардиальному поражению при инфекции COVID-19. Наиболее информационно значимые 50 источников, включающие сведения за 2020–2021 гг., приводятся в данном обзоре.
Вероятные патогенетические механизмы развития миокардиального повреждения при COVID-19. В настоящее время в литературе встречается по крайне мере шесть патогенетических механизмов повреждения сердечно-сосудистой системы в рамках инфекции COVID-19:
-
1. Прямое повреждающее действие вируса SARS-CoV-2 связывают с проникновением в кардиомиоциты через ангиотензинпревращающий фермент-2 (АПФ-2) рецептора, что приводит к развитию вероятного миокардита [5].
-
2. Формирование патологического системного воспалительного ответа, называемого еще «цитоки-новым штормом», при котором отмечается гиперпродукция цитокинов: интерлейкинов (ИЛ) ИЛ-6, ИЛ-7, ИЛ-22, ИЛ-17 и др., что приводит к развитию повреж-
- Ответственный автор — Сергеева Виктория Алексеевна
Тел.: +7 (937) 8007081
-
3. Поражение микроциркуляторного русла, ведущую роль в котором играет прямое повреждающее действие вируса на клетки эндотелия и развитие эндотелиальной дисфункции [8].
-
4. Метаболический дисбаланс потребности миокарда в кислороде и его доставки вследствие гипоксемии на фоне повреждения легочной ткани [8].
-
5. Развитие протромботического состояния на фоне системного воспалительного процесса, клиническими проявлениями которого являются тромбоэмболия системы легочных артерий (ТЭЛА), тромбозы глубоких вен (ТГВ), ишемический инсульт, острый коронарный синдром (ОКС) [9].
-
6. Нарушение работы ренин-ангиотензин-аль-достероновой системы (РААС), связанное со снижением экспрессии рецепторов АПФ-2 при высокой вирусной нагрузке SARS-CoV-2, и повышение концентрации ангиотензина-2, реализующего свои системные эффекты (активация симпатоадреналовой системы, повышение артериального давления, увеличение кислородной потребности миокарда, вазоконстрикция, развитие фиброза, активация ряда воспалительных цитокинов и нарушения в системе гемостаза) [10].
дения ткани миокарда и полиорганной недостаточности [6, 7].
Электролитный дисбаланс, преимущественно гипокалиемия, у пациентов с коронавирусной инфекцией развивается под воздействием целого ряда перечисленных патогенетических механизмов (гипоксемия, гипертермия, гиперкатехоламинемия, ишемия) и способствует развитию аритмий, в том числе жизнеугрожающих [11]. Особенно тяжелая ситуация наблюдается у коморбидных и пожилых пациентов, у которых могут быть дополнительные факторы риска развития нарушения сердечного ритма [8, 12]. В свете негативного влияния на сердечно-сосудистую систему в литературе широко обсуждается вопрос о кардиотоксичности ряда медикаментозных препаратов, использующихся в лечении инфекции COVID-19 (антивирусные, антимикробные и противомалярийные препараты, кортикостероиды и др.) [13, 14].
Среди представленных патогенетических механизмов, оказывающих влияние на вовлечение в патологический процесс сердечно-сосудистой системы, для развития непосредственно миокардиального воспаления наибольшее значение придается прямому повреждающему действию вируса SARS-CoV-2 на кардиомиоциты, т. е. его кардиотропности и системному воспалительному ответу — «цитокиново-му шторму», развитие которого определяет тяжесть состояния пациентов и обусловливает полиорганные поражения (рисунок).
Представители семейства бета-коронавирусов SARS-CoV, ставшего причиной развития тяжелого острого респираторного синдрома (ТОРС) в Китае в 2002 г., и MERS-CoV, который был идентифицирован как причина респираторного синдрома Среднего Востока в 2012 г., продемонстрировали кардиотроп-ность [15, 16]. Близкое родство вируса SARS-CoV-2, вызывающего новую коронавирусную инфекцию, с этими вирусами позволило высказать гипотезу о наличии у него тех же свойств. Однако в ряде за-
Эндотелиальная дисфункция (повреждение микроциркуляторного
Прямое повреждающее воздействие вируса SARS-CoV-2
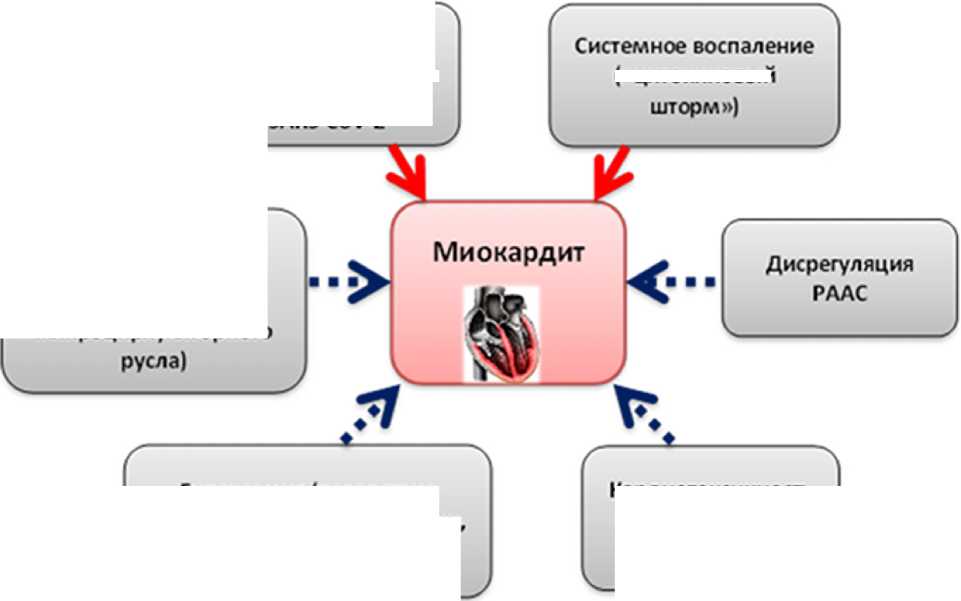
Кардиотоксичность препаратов для лечения COVID-19
Вероятные механизмы развития миокардита при инфекции COVID-19 (красные стрелки отражают основные механизмы, синие пунктирные — дополнительные негативные воздействия на состояние миокарда;
РААС — ренин-ангиотензин-альдостероновая система)
(«цитокиновый
Гилоксемия (вследствие повреждения легочной ткани, гемическая гипоксия)
рубежных клинических наблюдений подвергается сомнению тот факт, что вирус SARS-CoV-2 обладает прямым повреждающим действием на кардиомиоциты и способен вызывать миокардит. Так, по результатам исследования гистологического материала, полученного в ходе эндомиокардиальной биопсии (ЭМБ) прижизненно и аутопсии у пациентов, умерших от COVID-19, в большинстве случаев удалось установить наличие лимфоцитарной инфильтрации, фокального некроза и интерстициального отека; было выявлено присутствие вирусных частиц в тканевых макрофагах, но непосредственно в кардиомиоцитах они обнаружены не были [17, 18]. Предположительно, выявление вирусных частиц в макрофагах можно объяснить фазой виремии или миграцией зараженных альвеолярных макрофагов за пределы легочной ткани [17–20].
Публикации отечественных авторов не многочисленны, однако, судя по последним данным, исследователям удалось обнаружить геном вируса SARS-CoV-2 внутриклеточно в ходе аутопсии при исследовании ткани миокарда умерших от инфекции COVID-19 с клиническим диагнозом «миокардит». Отмечено также, что помимо вовлечения миокарда в патологический процесс наблюдается развитие эндо-и перикардита, коронариита и ДВС-синдрома [21]. Представляют интерес результаты небольших клинических наблюдений немецких ученых из Берлина, в которых факт наличия внутриклеточной РНК SARS-CoV-2 также установлен [22]. Их коллеги из Гамбурга сообщают, что присутствие SARS-CoV-2 в сердечной ткани не обязательно вызывает воспалительную реакцию, соответствующую клиническому миокардиту, таким образом отмечая диссоциацию клинических проявлений миокардиального повреждения и гисто- логической картины в миокарде [23]. L. Chen с со-авт. высказывают гипотезу, что помимо возможности получения ложноотрицательных результатов ПЦР во время отбора образцов ткани для гистологического исследования, учитывая низкую общую экспрессию рецептора АПФ-2 в клетках миокарда, есть вероятность того, что тропизм SARS CoV-2 для сердца маловероятен [6]. Отдельный интерес представляет единичное клиническое наблюдение эозинофильного миокардита, выявленного по данным аутопсийного исследования, у погибшего от новой коронавирусной инфекции 17-летнего афроамериканца. Патологический процесс в миокарде мог развиваться независимо от инфекционного процесса, при этом течение его усугубилось на фоне тяжелой формы инфекции COVID-19, что способствовало развитию летального исхода [24]. Ввиду неоднородности данных и недостаточного объема публикаций с результатами гистологических исследований сделать окончательный вывод о наличии или отсутствии прямого повреждающего механизма воздействия SARS-CoV-2 на кардиомиоциты не представляется возможным. Вследствие этого ведущим механизмом, приводящим к поражению миокарда в рамках инфекции COVID-19, в литературе чаще рассматривается активация клеточного и гуморального иммунного ответа.
Иранские ученые из Керманского университета и их коллеги из Индии считают «цитокиновый шторм» ключевым звеном в патогенезе новой коронавирусной инфекции [7]. Взаимодействие вируса SARS-CoV-2 с АПФ-2 — рецепторами моноцитов и макрофагов нарушает их адаптивные иммунные ответы против вируса. При заражении моноциты мигрируют в ткани, где становятся инфицированными резидентными макрофагами, позволяя вирусам распространяться по всем органам. Данные ЭМБ и аутопсии в большинстве приведенных клинических наблюдений пациентов с COVID-19 подтверждают это [17–20]. Моноциты и макрофаги, инфицированные SARS-CoV-2, могут продуцировать большое количество различных типов провоспалительных цитокинов и хемокинов, которые способствуют локальному воспалению тканей и опасной системной воспалительной реакции, называемой «цитокиновым штормом». И локальное воспаление тканей, и цитокиновый шторм играют фундаментальную роль в развитии осложнений, связанных с COVID-19, таких как миокардиальное повреждение и острый респираторный дистресс-синдром (РДС), который является основной причиной смерти пациентов с COVID-19 [25]. Многочисленные исследования демонстрируют, что у пациентов, инфицированных SARS-CoV-2 отмечаются высокие концентрации ИЛ-1b, интерферона гамма (ИФ-c), регуляторного фактора интерферона-10 (РФИ-10) и моноцитарного хемотаксического белка — 1 (МХБ-1) [25, 26]. У пациентов с наиболее тяжелым течением инфекционного процесса выявлены высокие концентрации колониестимулирующего фактора гранулоцитов, РФИ-10, МХБ-1, макрофагального воспалительного белка — 1А (МВБ-1А) и фактора некроза опухоли альфа (ФНО-a), что подтверждает взаимосвязь цитокинового шторма и тяжести течения инфекции COVID-19 [7]. При миокардиальном повреждении отмечены высокие уровни С-реактивного белка (СРБ), прокальцитонина, ИЛ-1b, ИЛ-2, ИЛ-6, ИЛ-7, ИЛ-10, ФНО-a [26–28]. Гиперпродукция и активация этих провоспалительных цитокинов может быть ответственна за апоптоз или некроз кардиомиоцитов. Немногочисленные описания в литературе фульминантных форм миокардита при инфекции COVID-19 также обусловлены развитием цитокиново-го шторма [20].
Немаловажное значение в развитии миокардиального повреждения в целом играет фактор регионарной ишемии, который может быть обусловлен несколькими патогенетическими механизмами. Во-первых, в литературе приводятся данные о взаимодействии вируса SARS-CoV-2 с эндотелиальными клетками, вследствие чего развивается эндотелиальная дисфункция и повреждение микроциркуляторного русла. Гистологически такая картина напоминает микроваскулит [8]. Во-вторых, состояние ишемии может быть следствием гипоксемии, связанной со значительным поражением легочной ткани в рамках инфекции COVID-19 [28]. В-третьих, есть небольшое количество работ, опирающихся на предположение о воздействии вируса SARS-CoV-2 на эритроциты. По мнению L. Wenzhong и L. Hualan, поверхностные белки SARS-CoV-2 способны связываться с бета-цепью гидроксигемоглобина, в результате чего порфирин диссоциирует от железа, что приводит к гемической гипоксии. Это состояние сопровождается повышением уровня ферритина в сыворотке крови [29].
Нарушение работы РААС вносит весомый вклад в прогрессирование миокардиального повреждения и способствует усугублению имеющейся сопутствующей сердечно-сосудистой патологии. По мнению некоторых авторов, окончательное понимание взаимодействия вируса SARS-CoV-2 с РААС позволит прояснить клиническую картину и спрогнозировать исход заболевания [10]. В настоящее время известно, что вхождение вируса SARS-CoV-2 в клетку происходит благодаря связыванию spike-белка вируса с рецептором АПФ-2. Известно, что АПФ-2 — это трансмембранный гликопротеин I типа, который представлен практически во всех органах (высокий уровень экспрессии АПФ-2 отмечен на поверхности альвеолярных клеток II типа, в сердце, почках, сосудистом эндотелии, головном мозге, печени, яичках и кишечнике) [6, 8, 10]. Вирус SARS-CoV-2 вызывает дисбаланс в системе АПФ-2, сопровождающийся снижением уровня защитного ангиотензина (АТ) — 1–7 на фоне роста количества АТ II, который вызывает вазоконстрикцию, цитокиноподобную активность, задержку натрия и развитие фиброза. В ряде источников закрепился термин «АТ II шторм» [30]. В результате первоначально вызванное коронавирусом SARS-CoV-2 острое повреждение легких, миокарда, сосудов и других органов может усиливаться. Многочисленные литературные обзоры и метаанализы демонстрируют, что пациенты старшей возрастной группы, мужского пола, а также имеющие коморбид-ные состояния в виде артериальной гипертензии, хронической обструктивной болезни легких, сахарного диабета и анамнез сердечно-сосудистых событий имеют риск тяжелого течения COVID-19 [11,12]. Примечательно, что все эти факторы ассоциированы с нарушением работы РААС и снижением АПФ-2 [10].
Одним из актуальных предметов обсуждения проблемы миокардиального поражения является кардиотоксичность используемых при лечении инфекции COVID-19 лекарственных средств. По мнению некоторых авторов, применение определенных препаратов может инициировать развитие лекарственного миокардита [31]. Наиболее часто в литературе упоминаются противомалярийные препараты (хлорохин, гидроксихлорохин) и их комбинация с антибактериальными препаратами (азитромицин), которые способствуют удлинению продолжительность интервала QT, в результате чего может развиться полиморфная желудочковая тахикардия и фибрилляция желудочков [13]. Сходный побочный эффект отмечен у противовирусного препарата лопинавир (ритонавир). Нежелательными являются также лекарственные взаимодействия фавипиравира с антикоагулянтами, статинами, антиаритмиками [14].Описаны прямые кардиотоксичные влияния интерферонов a и b [31]. Использование метилпреднизолона может привести к задержке жидкости, повышению артериального давления, электролитным нарушениям [31]. Перспективный для лечения тяжелых форм инфекции COVID-19 ингибитор ИЛ-6 тоцилизумаб способен вызывать артериальную гипертензию, повышать метаболизм статинов [31]. Очевидно, применение указанных препаратов может усугубить патологический процесс при наличии миокардита или иного варианта миокардиального повреждения, поэтому при их назначении рекомендован строгий мониторинг состояния пациента и осторожное титрование доз.
Подходы к диагностике миокардита в рамках инфекции COVID-19. N. Hendren с соавт. предложил ввести новое понятие для обозначения кардиологических проявлений новой коронавирусной инфекции: острый COVID-19-ассоциированный сердечно-сосудистый синдром (acute COVID-19 cardiovascular syndrome, ACovCS), включающий широкий спектр сердечно-сосудистых и тромботических осложнений инфекции, вызываемой SARS-CoV-2 [32]. В состав острого COVID-19-ассоциированного сердечно-сосудистого синдрома входят аритмии (фибрилляция предсердий, желудочковая тахикардия и фибрилляция желудочков), острое миокардиальное повреждение, фульминантный миокардит, выпотной перикардит, тампонада сердца, артериальные и венозные тромботические нарушения в виде ОКС, инсульт, ТЭЛА, ТГВ. У большинства больных выявляются признаки легочной гипертензии [32].
В условиях ковидных клиник ЭМБ и гистологическая верификация характера поражения миокарда проводятся в единичных случаях, в связи с этим частота встречаемости миокардитов среди пациентов с новой коронавирусной инфекцией остается не изученной. Есть лишь отдельные публикации, посвященные этому. Так, проанализировав доступные литературные источники, содержащие результаты ЭМБ и аутопсий пациентов с новой коронавирусной инфекцией, Kawakami R. с соавт. пришли к выводу о том, что миокардит в рамках COVID-19 является достаточно редким клиническим проявлением; частота подтвержденного миокардита в образцах ткани миокарда суммарно составила 4,5% [33]. По другим источникам, около 7% смертей пациентов с COVID-19 обусловлено миокардитом [20].
Наиболее часто зарубежные авторы пользуются термином «myocardial injury» — «миокардиальное повреждение»; встречаются формулировки: «клинически ожидаемый» или «вероятный миокардит», ассоциированный с инфекцией COVID-19 [5, 6, 34]. По имеющейся статистике, от 15 до 35% пациентов с COVID-19 имеют различные формы миокардиального повреждения [34]. Анализ значительного числа клинических наблюдений показал, что диагноз миокардиального повреждения устанавливается преимущественно на основании повышенного уровня тропонинов I, Т (TI, ТТ) [35]. Естественно, что повышению уровня кардиоспецифичных маркеров может способствовать широкий спектр патологических процессов в миокарде, поэтому ряд авторов предлагает расширить спектр диагностических подходов определением мозгового натрийуретического пептида (НУП) и неинвазивными инструментальными методами (электрокардиографией (ЭКГ), эхокардиографией (ЭхоКГ), а при наличии возможностей — магнитнорезонансным исследованием сердца (МРТ)) [36–38].
Первоначально авторы одного из самых цитируемых китайских исследований продемонстрировали, что повышение высокочувствительного тропонина I (ВЧ-TI) у пациентов с инфекцией COVID-19 ассоциировалось с острым повреждением миокарда [39]. H. Yang с коллегами отмечали поражение сердца при повышении уровня ВЧ-TI в сыворотке крови, превышающего верхний предел референсного диапазона (>28 пг/мл) [40]. Их коллеги из Китая сообщили об остром повреждении миокарда, определяемом при значении тропонина Т (TT), превышающем верхний предел 99-го перцентиля [41]. P Deng с коллегами предлагают использовать, помимо ВЧ-TI, также показатели креатинфосфокиназы MB-фракции (КФК-MB), миоглобин, N-терминальный про-мозговой натрийуретический пептид (про-НУП) и креатинин как маркеры высокого риска госпитальной летальности и считают их определение необходимым для прогнозирования выживания пациентов с миокардиальным повреждением [42]. В рамках опубликованного совместно итальянскими и австралийскими учеными крупного системного обзора и метаанализа, проведенного по результатам 55 исследований и охватившего более 11 тысяч пациентов с COVID-19, оценивали роль маркера КФК-МВ в прогностическом плане миокардиального повреждения. Было продемонстрировано, что сывороточные концентрации КФК-МВ, измеренные в течение 24-48 часов с момента поступления, практически во всех исследованиях были статистически значимо выше у пациентов с тяжелым течением COVID-19, у которых отмечалось прогрессирование заболевания, имелась потребность в искусственной вентиляции легких, а также у тех, кто не выжил во время наблюдения [43].
Мозговой натрийуретический пептид B-типа (НУП) и N-терминальный промозговой натрийуретический пептид (про-НУП) являются количественными биомаркерами плазмы, обычно отражающими гемодинамический кардиальный стресс и в настоящее время играют центральную роль в диагностике сердечной недостаточности (СН) [44]. Высказано предположение, что повышение уровня натрийуретических пептидов может быть связано с сопутствующим нарушением сердечной функции при COVID-19. В крупном испанском обзоре в группе госпитализированных пациентов с инфекцией COVID-19 высокая летальность отмечена среди лиц с наиболее высоким значением про-НУП. Среди них также наблюдались более частые декомпенсации СН и незначительная тенденция к развитию аритмий во время наблюдения [45]. Это исследование в целом подтверждает результаты предыдущего обзора итальянских авторов, также оценивающих роль НУП и про-НУП в прогнозировании исходов пациентов с COVID-19 [43]. Впрочем, в обоих обзорах не уточняется преобладающий механизм повреждения миокарда, приведший к повышению данных биомаркеров.
Среди инструментальных диагностических методик пациентам с миокардиальным повреждением в рамках инфекции COVID-19 повсеместно проводится ЭКГ Данный метод не обладает высокой специфичностью, при миокардитах часто отмечаются псевдоинфарктные изменения конечной части сегмента ST, различные нарушения ритма и проводимости [35, 36]. В большинстве клинических наблюдений пациентов с миокардиальным повреждением в рамках COVID-19 результаты ЭКГ не были специфичными, отмечались подъемы сегмента ST, нарушения внутрижелудочкового проведения, синусовая тахикардия, инверсия зубцов Т в переднегрудных отведениях [36]. У некоторых пациентов отмечались преходящие атриовентрикулярные блокады [35].
ЭхоКГ — важный неинвазивный диагностический тест первой линии при обследовании на миокардит. Трансторакальная ЭхоКГ может помочь исключить другие причины СН, такие как инфаркт миокарда и клапанные пороки сердца [4]. Признаками миокардита по ЭхоКГ могут быть расширение полостей, диффузный гипокинез, снижение фракции выброса левого желудочка [4]. По данным обзора американских авторов, в большинстве представленных клинических наблюдений пациентов с COVID-19 и вероятным миокардитом при выполнении ЭхоКГ чаще всего отмечались снижение фракции выброса левого желудочка и диффузный гипокинез. Перикардиальный выпот наблюдался в 42% случаев [35]. Канадское общество эхокардиографии рекомендует проведение ЭхоКГ как начальный скрининговый тест пациентам с подтвержденной инфекцией COVID-19 или при подозрении на нее [46].
МРТ миокарда с парамагнитным контрастным усилением на сегодняшний день является самым информативным методом томографической визуализации очагов воспаления в миокарде, повреждения и некроза кардиомиоцитов [4]. Использование критериев Lake Louise имеет специфичность до 91 % и чувствительность 67% для диагностики миокардита [4]. Однако не всегда техническое оснащение ковидного госпиталя позволяет провести данное исследование, часто тяжесть состояния пациента не позволяет его выполнить. Обычно противопоказаниями служат: нестабильность гемодинамики, желудочковые нарушения ритма, АВ-блокада высокой градации [47]. Если препятствий для проведения исследования нет, то МРТ сердца можно безопасно использовать в качестве диагностического инструмента первой линии при обследовании пациентов с COVID-19 и подозрением на миокардиальное повреждение [25]. Следует отметить, что, несмотря на отсутствие значимых отклонений по результатам ЭКГ и ЭхоКГ, нормальные уровни биомаркеров повреждения миокарда и минимальный набор клинических симптомов или даже их отсутствие, данные МРТ могут свидетельствовать в пользу имеющегося миокардиального повреждения [47]. Основными проявлениями воспаления миокарда при МРТ у пациентов с COVID-19, по оценке различных авторов, были диффузный интерстициальный отек, позднее усиление гадолинием, наличие локального гипокинеза [34]. По наблюдению отечественных авторов, МРТ-признаки острого миокардита могут фиксироваться не только у пациентов с тяжелым течением COVID-19 [48].
ЭМБ с последующей гистологической верификацией является наиболее точным методом подтверждения воспалительного характера миокардиального повреждения и определения его этиологии. У пациентов с инфекцией COVID-19 проведение данной диагностической процедуры бывает в большинстве случаев затруднительно. В литературе присутствуют ограниченные данные ЭМБ у таких пациентов. Наиболее частыми находками были Т-лимфатические инфильтраты с дегенерацией кардиомиоцитов и неишемическим некрозом [47]. Как уже было отмечено, не во всех образцах ткани миокарда обнаруживалась внутриклеточная РНК вируса SARS-CoV-2, наиболее часто вирусные частицы присутствовали в интерстициальных макрофагах [17, 18, 47]. Кроме того, есть свидетельства, что миокардит может быть случайной находкой на аутопсии у пациентов, прижизненно не имеющих в рамках новой коронавирусной инфекции клинических проявлений со стороны сердечнососудистой системы [24, 47].
Компьютерно-томографическая коронарография (КТК) — современное неинвазивное диагностическое исследование, позволяющее определить наличие атеросклеротического поражения коронарных артерий, может быть полезно в сложных диагностических случаях, когда требуется исключение наличия у пациента ишемической болезни сердца (ИБС) при проведении дифференциальной диагностики миокардиального повреждения у пациентов с COVID-19 [48].
В настоящее время аккумулируется информация о внелегочных полиорганных проявлениях новой коронавирусной инфекции. Очевидно, что пациенты, имеющие исходно коморбидные состояния, находятся в зоне риска в отношении прогноза на выздоровление. Миокардиальное повреждение, развивающееся при инфекции COVID-19, находится в зоне особого внимания исследователей, так как увеличивает летальность [49]. Предположительно несколько патогенетических механизмов ответственны за развитие миокардита, ассоциированного с COVID-19. Наиболее вероятен иммуноопосредованный механизм в рамках цитокинового шторма, продолжается обсуждение и прямого цитопатического воздействие вируса на кардиомиоциты. Дополнительное воздействие оказывают: эндотелиальная дисфункция, нарушение работы РААС, негативное медикаментозное воздействие препаратов, назначаемых по поводу инфекции SARS-CoV-2 [5–14].
Установление диагноза «миокардит» с учетом особенностей работы ковидных клиник и тяжести состояния пациентов представляет значительные трудности. Термин «миокардиальное повреждение», базирующийся в основном, по данным литературы, на определении повышения уровня сердечного тропонина, является, по сути, более емким понятием, чем миокардит, так как может включать также состояния, обусловленные ишемией миокарда и кардиомиопатию Такоцубо. Для подтверждения диагноза «миокардит» необходим дополнительный набор диагностических манипуляций: ЭКГ, ЭхоКГ, МРТ и в конечном итоге ЭМБ, проведение которых не всегда возможно в условиях ковидного стационара. Опубликованные немногочисленные данные гистологических исследований миокарда при инфекции COVID-19 позволяют свидетельствовать о возможном бессимптомном течении миокардита, ассоциированного с новой коронавирусной инфекцией [23].
Заключение. Проведенный обзор литературных источников продемонстрировал актуальность изучения патогенетических механизмов развития поли-органных поражений в рамках инфекции COVID-19. Диагностические подходы к ведению пациентов с миокардитом, ассоциированным с COVID-19, в настоящий момент требуют глубокого систематического анализа. Необходима разработка унифицированных облегченных алгоритмов диагностики воспалительного поражения миокарда ввиду особенностей работы ковидных клиник и подчас невозможности осуществления трудных диагностических манипуляций. Ответы на многие вопросы могут быть получены в рамках проведения эпидемиологического исследования пациентов с миокардитом, ассоциированным с новой коронавирусной инфекцией.
Список литературы Миокардит при инфекции COVID-19: патогенетические механизмы, сложности диагностики (обзор)
- Dominguez F, Kuhl U, Pieske B, et al. Update on myocarditis and inflammatory cardiomyopathy: reemergence of endomyocardial biopsy. Rev Esp Cardiol 2016; 69: 178–87.
- Trachtenberg BH, Hare JM. Inflammatory cardiomyopathic syndromes. Circ Res 2017; 121: 803–18.
- Caforio AL, Pankuweit S, Arbustini, et al. Current state of knowledge on etiology, diagnosis, management, and therapy of myocarditis: A position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J 2013; 34: 2636–48. URL: http://dx.doi.org/ 10.1093 / eurheartj / eht210
- Official website of the Russian Society of Cardiology. URL: http://www.scardio.ru / content / Guidelines / 2020 / Clinic_rekom_Miokardit. pdf
- Xiong TY, Redwood S, Prendergast B, Chen M. Coronaviruses and the cardiovascular system: acute and longterm implications. Eur Heart J 2020; 0: 1–3. URL: https://doi.org / 10.1093 / eurheartj / ehaa231
- Chen L, Li X, Chen M, et al. The ACE2 expression in human heart indicates new potential mechanism of heart injury among patients infected with SARS-CoV-2. Cardiovasc Res 2020; 116: 1097–100.
- Jafarzadeh A, Chauhan P, Saha B, et al. Contribution of monocytes and macrophages to the local tissue inflammation and cytokine storm in COVID-19: Lessons from SARS and MERS, and potential therapeutic interventions. Life Sci 2020; 257: 118–102. URL: https://doi.org / 10.1016 / j. lfs. 2020.118102
- Sergienko IV, Rezinkina PK. New coronavirus infection COVID-19 and cardiovascular diseases. Features of therapy. The Journal of Atherosclerosis and Dyslipidemias 2021; 2 (43): 5–23. Russian (Сергиенко И. В., Резинкина П. К. Новая коронавирусная инфекция COVID-19 и сердечно-сосудистые заболевания: особенности терапии. Атеросклероз и дислипидемии 2021; 2 (43): 5–23). DOI: 10.34687 / 2219–8202. JAD.021.02.0001.
- Sardu C, Gambardella J, Morelli MB, et al. Hypertension, thrombosis, kidney failure, and diabetes: Is COVID-19 an endothelial disease? A comprehensive evaluation of clinical and basic evidence. J Clin Med 2020; 9 (5): 1417. DOI:10.3390 / jcm9051417.
- Verdecchia P, Cavallini C, Spanevello A, Angeli F. The pivotal link between ACE2 deficiency and SARS-CoV-2 infection. Eur J Intern Med 2020; 76: 14–20. DOI: 10.1016 / j. ejim. 2020.04.037.
- Lazzerini PE, Boutjdir M, Capecchi PL. COVID-19, arrhythmic risk and inflammation: mind the gap. Circulation 2020; 142 (1): 7–9. DOI: 10.1161 / CIRCULATIONAHA. 120.047293.
- Zheng YY, Ma YT, Zhang JY, Xie X. COVID-19 and the cardiovascular system. Nature Reviews Cardiology 2020; 17 (5): 259–60.
- Cortegiani A, Ingoglia G, Ippolito M, et al. A systematic review on the efficacy and safety of chloroquine for the treatment of COVID-19. J Crit Care 2020; 57: 279–83. DOI: 10.1016 / j. jcrc.2020.03.005.
- Chinello P, Petrosillo N, Pittalis S, et al. QTc interval prolongation during favipiravir therapy in an Ebolavirus-infected patient. PLoS Negl Trop Dis 2017; 11 (12): e0006034. DOI: 10.1371 / journal. pntd. 0006034.
- Su S, Wong G, Shi W, et al. Epidemiology, genetic recombination and pathogenesis of coronaviruses. Trends Microbiol 2016; 24: 490–502.
- Alhogbani T. Acute myocarditis associated with novel Middle East respiratory syndrome coronavirus. Ann Saudi Med 2016; 36: 78–80.
- Tavazzi G, Pellegrini C, Maurelli M, et al. Myocardial localization of coronavirus in COVID-19 cardiogenic shock. Eur J Heart Fail 2020; 22 (5): 911–5. DOI: 10.1002 / ejhf. 1828.
- Basso C, Leone O, Rizzo S, et al. Pathological features of COVID-19 associated myocardial injury: a multicenter cardiovascular pathology study. Eur Heart J 2020; 41: 3827–35.
- Dolhnikoff M, Ferreira Ferranti J, de Almeida Monteiro RA, et al. SARS-CoV-2 in cardiac tissue of a child with COVID-19‑related multisystem inflammatory syndrome [published correction appears in Lancet Child Adolesc Health 2020 Oct; 4 (10): e39]. Lancet Child Adolesc Health 2020; 4 (10): 790–94. DOI: 10.1016 / S2352–4642 (20) 30257–1.
- Ruan Q, Yang K, Wang W, et al. Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan. Intensive Care Med 2020; 46: 846–48.
- Kogan EA, Berezovskiy YuS, Blagova OV, et al. Miocarditis in patients with COVID-19 confirmed by immunohistochemical. Cardiology 2020; 60 (7): 4–10. Russian (Коган Е. А., Березовский Ю. С., Благова О. В. и др. Миокардит у пациентов с COVID-19, подтвержденный результатами иммуногистохимического исследования. Кардиология 2020; 60 (7): 4–10).
- Escher F, Pietsch H, Aleshcheva G, et al. Detection of viral SARS-CoV-2 genomes and histopathological changes in endomyocardial biopsies. ESC Heart Fail 2020; 7 (5): 2440–7. DOI: 10.1002 / ehf2.12805.
- Lindner D, Fitzek A, Bräuninger H, et al. Association of Cardiac Infection with SARS-CoV-2 in Confirmed COVID-19 Autopsy Cases. JAMA Cardiol 2020; 5 (11): 1281–5. DOI: 10.1001 / jamacardio. 2020.3551.
- Craver R, Huber S, Sandomirsky M, et al. Fatal Eosinophilic Myocarditis in a Healthy 17‑Year-Old Male with Severe Acute Respiratory Syndrome Coronavirus (SARSCoV-2c). Fetal and Pediatric Pathology 2020; 39 (3): 263–8. [Epubahead of print]. DOI: 10.1080 / 15513815.2020.1761491.
- Huang C, Wang Y, Li X, et. al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. The Lancet 2020; 395 (10223): 497–506. DOI: http://doi.org / 10.1016 / s0140–6736 (20) 30183–5.
- Fu Y, Cheng Y, Wu Y. Understanding SARS-CoV-2‑mediated inflammatory responses: from mechanisms to potential therapeutic tools. Virol Sin 2020; 35 (3): 266–71.
- Liu B, Li M, Zhou Z, et al. Can we use interleukin-6 (IL-6) blockade for coronavirus disease 2019 (COVID-19) — induced cytokine release syndrome (CRS). J Autoimmun 2020; 111: 102452. URL: https://doi.org / 10.1016 / j. jaut. 2020.102452.
- Tajbakhsh A, Hayat SMG, et al. COVID-19 and cardiac injury: clinical manifestations, biomarkers, mechanisms, diagnosis, treatment, and follow up. Expert Review of Antiinfective Therapy 2021; 19 (3): 345–57. DOI: 10.1080 / 14787210 .2020.1822737.
- Wenzhong L, Hualan L. COVID-19: Attacks the 1‑Beta Chain of Hemoglobin and Captures the Porphyrin to Inhibit Human Heme Metabolism. Available at: URL: https:// chemrxiv.org. Accessed 2021 Oct 14.
- Ramos SG, Rattis B, Ottaviani G, et al. ACE2 Down-Regulation May Act as a Transient Molecular Disease Causing RAAS Dysregulation and Tissue Damage in the Microcirculatory Environment Among COVID-19 Patients. Am J Pathol 2021; 191: 1154–64. DOI: 10.1016 / j. ajpath. 2021.04.010.
- Driggin E, Madhavan MV, Bikdeli B et al. Cardiovascular considerations for patients, health care workers, and health systems during the COVID-19 pandemic. J Am Coll Cardiol 2020; 75 (18): 2352–71. DOI: 10.1016 / j. jacc. 2020.03.031.
- Hendren NS, Drazner MH, Bozkurt B, et al. Description and proposed management of the acute COVID-19 cardiovascular syndrome. Circulation 2020; 141 (23): 1903–14. DOI: 10.1161 / CIRCULATIONAHA. 120.047349.
- Kawakami R, Sakamoto A, Kawai K, et al. Pathological evidence for SARS-CoV-2 as a cause of myocarditis: JACC Review Topic of the Week. J Am Coll Cardiol 2021; 77 (3): 314–25.
- Long B, Brady WJ, Koyfman A, et al. Cardiovascular complications in COVID-19. Am J Emerg Med 2020 Jul; 38 (7): 1504–7. DOI: 10.1016 / j. ajem. 2020.04.048.
- Sawalha K, Abozenah M, Kadado AJ, et al. Systematic Review of COVID-19 Related Myocarditis: Insights on Management and Outcome. Cardiovasc Revasc Med 2021 Feb; 23: 107–13. DOI: 10.1016 / j. carrev. 2020.08.028.
- Doyen D, Moceri P, Ducreux D, Dellamonica J. Myocarditis in a patient with COVID-19: a cause of raised troponin and ECG changes. Lancet 2020; 395 (10235): 1516. DOI: 10.1016 / S0140–6736 (20) 30912–0.
- D’Andrea A, Di Giannuario G, Marrazzo G, et al. The role of multimodality imaging in COVID-19 patients: from diagnosis to clinical monitoring and prognosis. G Ital Cardiol 2021; 21: 345–53.
- Esposito A, Palmisano A, Natale L et al. Cardiac magnetic resonance characterization of myocarditis-like acute cardiac syndrome in COVID-19. JACC Cardiovasc Imaging 2020; 13: 2462–5.
- Wang D, Hu B, Hu C, et. al. Clinical Characteristics of 138 Hospitalized Patients with 2019 Novel Coronavirus Infected Pneumonia in Wuhan, China. JAMA 2020; 323 (11): 1061. DOI: http://doi.org / 10.1001 / jama. 2020.1585.
- Yang X, Yu Y, Xu J, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med 2020; 8 (5): 475–81.
- Guo T, Fan Y, Chen M, et al. Association of cardiovascular disease and myocardial injury with outcomes of patients hospitalized with 2019‑coronavirus disease (COVID-19). JAMA Cardiol 2020; 5 (7): 811–8.
- Deng P, Ke Z, Ying B, et al. The diagnostic and prognostic role of myocardial injury biomarkers in hospitalized patients with COVID-19. Clin Chim Acta 2020; 510: 186–90.
- Zinellu A, Sotgia S, Fois AG, et al. Serum CK-MB, COVID-19 severity and mortality: An updated systematic review and meta-analysis with meta-regression. Advances in Medical Sciences 2021; 66 (2): 304–14. DOI: https://doi.org / 10.1016 / j.advms. 2021.07.001.
- Official website of the Russian Society of Cardiology. URL: https://www.scardio.ru / content / Guidelines / 2020 / Clinic_rekom_HSN. pdf
- Caro-Codón J, Rey JR, Buño A et al. Characterization of NT-proBNP in a large cohort of COVID-19 patients. Eur J Heart Fail 2021; 23: 456–64. URL: https://doi.org / 10.1002 / ejhf. 2095
- Practice of echocardiography during the COVID-19 pandemic: guidance from the Canadian Society of Echocardiography. [Internet] 2020: 1–4. URL: http://csecho.ca / wp-content / uploads / 2020 / 03 / CSE-COVID-19‑Guidance_English-1. pdf. Accessed Oct 8, 2021.
- Pirzada A, Mokhtar AT, Moeller AD. COVID-19 and Myocarditis: What Do We Know So Far? CJC Open 2020 May 28; 2 (4): 278–85. DOI: 10.1016 / j. cjco. 2020.05.005.
- Konopleva YuYu, Petrova EV. Heart Damage with COVID-19 (Clinical Observations). Radiology — Practice 2020; 6 (84): 61–7. Russian (Коноплева Ю. Ю., Петрова Е. В. Поражение сердца при COVID-19 (клинические наблюдения). Радиология — практика 2020; 6 (84): 61–7).
- Goha A, Mezue K, Edwards P, et al. COVID-19 and the heart: An update for clinicians. Clin Cardiol 2020; 43 (11): 1216– 22. DOI: 10.1002 / clc. 23406.


