Модель прогнозирования метаболического синдрома у женщин в постменопаузе
Автор: Данилова М.В., Усольцева Е.Н., Вереина Н.К., Никушкина К.В., Пыхова Л.Р.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Акушерство и гинекология
Статья в выпуске: 2 т.21, 2025 года.
Бесплатный доступ
Цель: разработать эффективную прогностическую модель развития метаболического синдрома (МС) у женщин в период ранней постменопаузы. Материал и методы. В исследование «случай — контроль» включены 82 женщины в возрасте 46–60 лет; 1‑ю группу составили 35 женщин с наличием МС, 2‑ю группу — 47 женщин без МС. Проводили сбор анамнеза по специально разработанной форме, антропометрию и лабораторные исследования, оценку тяжести климактерического синдрома по модифицированному менопаузальному индексу (ММИ). Результаты. У пациенток с МС в сравнении с контрольной группой индекс НОМА-IR (Homeostasis Model Assessment of Insulin Resistance), индекс висцерального ожирения и ММИ оказались значимо выше (р<0,001, р<0,001 и р=0,003 соответственно), уровни фолликулостимулирующего гормона (р=0,008) и пролактина (р=0,011) — ниже. С помощью метода множественной логистической регрессии разработана скрининговая модель для оценки вероятности развития МС у женщин, включающая 5 параметров: наличие соматической коморбидности, индекс висцерального ожирения, ММИ, уровни фолликулостимулирующего гормона и пролактина. Для оценки модели использовали ROC-кривую. Площадь под кривой ROC (AUC) модели составила 0,909; 95 % доверительный интервал 0,835–0,984 (чувствительность — 87,1 %, специфичность — 78,6 %). Заключение. Разработана прогностическая модель развития метаболического синдрома у женщин в период ранней постменопаузы, которая способствует выявлению пациенток с повышенным кардиометаболическим риском, что позволит своевременно начать персонифицированное лечение.
Прогнозирование, менопаузальный метаболический синдром, постменопауза, индекс висцерального ожирения
Короткий адрес: https://sciup.org/149148493
IDR: 149148493 | УДК: 618.173–06:616–008.9–036 | DOI: 10.15275/ssmj2102137
Текст научной статьи Модель прогнозирования метаболического синдрома у женщин в постменопаузе
EDN: BLLSYN
происходит переход от гиноидного к андроидному типу распределения жировой ткани, которая активно продуцирует маркеры воспаления с выраженными атерогенными свойствами [4]. Известно, что некоторые адипокины, секретируемые адипоцитами, включая адипонектин и лептин, ассоциированы с развитием МС [5]. Вместе с тем показано, что вазомоторные симптомы в период менопаузального перехода и ранней постменопаузы, особенно у пациенток со средней и тяжелой степенью МС, ассоциированы с повышением риска сердечно-сосудистых заболеваний (ССЗ) [6, 7].
К сожалению, по-прежнему остается низкая осведомленность о риске ССЗ у женщин после завершения репродуктивной функции. В связи с этим необходимо продолжить поиск информативных предикторов развития ММС для улучшения персонифицированной профилактики и, таким образом, обеспечить раннее управление риском заболеваний, ассоциированных с МС.
Цель — разработать эффективную прогностическую модель развития МС у женщин в период ранней постменопаузы.
Материал и методы. В исследование «случай — контроль» включены 82 женщины, которые подписали информированное согласие на участие в исследовании. Сбор данных проводили на базе отделения профилактики ГКБ № 1 г. Челябинска с 2022 по 2024 г. Исследование одобрено локальным этическим комитетом ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Минздрава России (протокол № 9 от 22.09.2022).
Первую группу («случаи») — составили 35 женщин с наличием МС, 2-ю («контроли») — 47 женщин без МС.
Критерии включения: женщины в период постменопаузы со стадиями репродуктивного старения «+1а, +1в, +1с», «+2» по классификации стадий репродуктивного старения женщин STRAW+10 (Stages of Reproductive Aging Workshop) [8]; возраст до 60 лет. Критерии невключения: прием препаратов для снижения веса, препаратов менопаузальной гормональной терапии (МГТ), системных глюкокортикостероидов в течение последних 6 мес; сахарный диабет 1-го и 2-го типов; аутоиммунные заболевания; при изучении биохимических маркеров — соматические и гинекологические заболевания в стадии обострения или декомпенсации.
У всех женщин оценивали возраст наступления менопаузы, акушерско-гинекологический анамнез, наличие хронических соматических заболеваний по данным амбулаторных карт; результаты антропометрии — вес, рост для расчета индекса массы тела (ИМТ, кг/м2). Окружность талии (ОТ, см) измеряли по среднеподмышечной линии на середине расстояния между вершиной гребня подвздошной кости и нижним краем последнего ребра, окружность бедер (ОБ, см) — по наибольшей окружности вокруг ягодиц. Для определения степени выраженности висцерального ожирения рассчитывали отношение ОТ/ОБ и индекс висцерального ожирения (ИВО) по формуле
ИВО = [ОТ/36,58 + (1,89 х ИМТ)] х (ТГ/0,81) х х (1,52/ХС ЛПВП), где ТГ — триглицериды, ХС ЛПВП — холестерин липопротеинов высокой плотности [9].
Для определения наличия и степени выраженности климактерического синдрома использовали модифицированный менопаузальный индекс (ММИ) Куппермана в модификации Е. В. Уваровой (1983). Лабораторные исследования включали определение биохимических показателей плазмы крови: глюкозы, мочевой кислоты, аланинаминотрансферазы, аспартатаминотрансферазы, общего ХС, ЛПВП, липопротеинов низкой плотности (ЛПНП), триглицеридов; гормональных показателей: фолликулостимулирующего гормона (ФСГ), пролактина, общего тестостерона, глобулина, связывающего половые гормоны (ГСПГ), тиреотропного гормона (ТТГ), инсулина. Индекс свободных андрогенов (ИСА) рассчитывали по формуле ИСА = общий тестостерон (нмоль/л)/ГСПГ (нмоль/л) х 100. Индекс HOmA-IR (Homeostasis Model Assessment of Insulin Resistance) рассчитывали по формуле HOMA-IR = глюкоза натощак (ммоль/л) х инсулин натощак (мМЕ/л)/22,5. Для определения биохимических показателей использовали автоматический биохимический анализатор ChemWell (Awareness Technology, США). Содержание ФСГ, пролактина, общего тестостерона, ГСПГ, ТТГ, инсулина определяли в сыворотке венозной крови на автоматическом иммуноферментном анализаторе Adaltis Personal Lab (Италия) методом твердофазного иммуноферментного анализа в соответствии с рекомендациями производителя наборов реактивов («Алькор-Био» и «Вектор-Бест», Россия).
Наличие МС устанавливали в соответствии с клиническими рекомендациями Минздрава России «Рекомендации по ведéнию больных с метаболическим синдромом» (2013).
Статистический анализ проводили с использованием программы StatTech v. 4.8.0 (разработчик — ООО «Статтех», Россия). Количественные показатели оценивали на предмет соответствия нормальному распределению с помощью критерия Шапиро — Уилка. Количественные показатели, распределение которых соответствовало нормальному, описывали с помощью средних арифметических величин ( M ) и стандартных отклонений ( SD ). В случае отсутствия нормального распределения количественные данные описывали с помощью медианы ( Me ) и нижнего и верхнего квартилей [ Q 1 ; Q 3 ]. Категориальные данные описывали с указанием абсолютных значений и процентных долей. Сравнение 2 групп по количественному показателю, распределение которого соответствовало нормальному, при равенстве дисперсий, выполняли с помощью t -критерия Стьюдента, в остальных случаях — использовали непараметрический U -критерий Манна — Уитни. Сравнение процентных долей при анализе четырехпольных таблиц сопряженности проводили с помощью критерия χ² Пирсона (при значениях ожидаемого явления более 10). Построение прогностической модели вероятности определенного исхода выполняли при помощи метода множественной логистической регрессии. Мерой определенности, указывающей на ту часть дисперсии, которая может быть объяснена с помощью логистической регрессии, служил коэффициент R ² Найджелкерка. Для оценки дискриминационной способности количественных признаков при прогнозировании определенного исхода применяли метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определяли по наивысшему значению индекса Юдена. Различия считали статистически значимыми при p <0,05.
Результаты. Медиана возраста женщин с МС составила 57 [54; 58] лет, женщин контрольной группы — 55 [51; 57] лет (p=0,057). Продолжительность постменопаузы не отличалась между группами и составила 6 [3; 9,5] лет 1-й группе и 5 [2; 7] лет — во 2-й группе (p=0,106). Антропометрические показатели и степень выраженности климактерического синдрома представлены в табл. 1. Пациентки с МС имели более высокие баллы ММИ в целом (р=0,003), а также по шкалам нейровегетативных (р=0,003) и обменно-эндокринных (р<0,001) симптомов.
АГ является одним из компонентов МС, поэтому закономерно ее частота в 1-й группе оказалась выше. Однако обращает на себя внимание более частое наличие соматической коморбидности в 1-й группе, наиболее характерным было сочетание АГ и желчнокаменной болезни (ЖКБ) (табл. 2). Анализ кардиометаболических показателей выявил более высокие средние концентрации глюкозы, инсулина, мочевой кислоты, триглицеридов и более низкие концентрации ЛПВП в группе женщин с МС. Вместе с тем эти показатели не выходили за пределы референсных значений в обеих группах. Тогда как показатели общего холестерина и ЛПНП были выше нормы в обеих группах. Анализ гормонального статуса выявил более низкие концентрации ФСГ (р=0,008) и пролактина (р=0,011) у женщин с МС по сравнению с контрольной группой. Уровни ТТГ, общего тестостерона, ГСПГ, а также ИСА значимо не отличались между группами (табл. 3).
Таблица 1
|
Показатель |
Группа |
р |
|
|
1-я: женщины с МС (n=35) |
2-я: женщины без МС (n=47) |
||
|
Масса тела, кг, Me [ Q 1; Q 3] |
80,00 [76,45; 89,00] |
64,50 [58,00; 73,50] |
|
|
ИМТ, Me [ Q 1; Q 3] |
31,23 [29,15; 34,09] |
23,92 [22,26; 26,91] |
|
|
ОТ, см, M ( SD ) |
99,14 (9,52) |
82,02 (9,05) |
<0,001 |
|
ОТ/ОБ, M ( SD) |
0,94 (0,08) |
0,83 (0,08) |
|
|
ИВО, Me [ Q 1; Q 3] |
1,91 [1,04; 3,27] |
1,08 [0,77; 1,41] |
|
|
ММИ, балл, Me [ Q 1; Q 3] |
23 [16,5; 27,5] |
15 [8,5; 22,5] |
0,003 |
|
Нейровегетативные симптомы, балл, Me [ Q 1; Q 3] |
11 [9,5; 16] |
7 [4; 13] |
|
|
Обменно-эндокринные симптомы, балл, Me [ Q 1; Q 3] |
5 [3; 6] |
3 [1; 4] |
<0,001 |
|
Психоэмоциональные симптомы, балл, Me [ Q 1; Q 3] |
5 [3; 7,5] |
5 [3; 6] |
0,368 |
Таблица 2
|
Заболевание |
Группа, абс. (%) |
р |
|
|
1-я: женщины с МС (n=35) |
2-я: женщины без МС (n=47) |
||
|
АГ |
26 (74,3) |
6 (12,8) |
<0,001 |
|
Остеоартрит |
5 (14,3) |
6 (12,8) |
1,000 |
|
Нарушение ритма сердца |
1 (2,9) |
2 (4,3) |
1,000 |
|
Ишемическая болезнь сердца, стенокардия |
2 (5,7) |
0 |
0,179 |
|
ЖКБ |
6 (17,1) |
3 (6,4) |
0,161 |
|
Заболевания щитовидной железы |
5 (14,3) |
6 (12,8) |
1,000 |
|
Заболевания органов дыхания |
4 (11,4) |
4 (8,5) |
0,718 |
|
Варикозная болезнь |
5 (14,3) |
6 (12,8) |
1,000 |
|
Анемия |
2 (5,7) |
5 (10,6) |
0,693 |
|
Наличие 2 соматических заболеваний и более |
24 (68,6) |
13 (27,7) |
<0,001 |
|
Сочетание АГ и ЖКБ |
5 (14,3) |
0 |
0,012 |
|
Сочетание АГ и заболеваний щитовидной железы |
4 (11,4) |
2 (4,3) |
0,394 |
Таблица 3
|
Показатель |
Группа |
р |
|
|
1-я: женщины с МС (n=35) |
1-я: женщины с МС (n=35) |
||
|
Глюкоза, ммоль/л, Me [ Q 1 ; Q 3 ] |
5,4 [5,1; 6,1] |
5,1 [4,7; 5,6] |
0,013 |
|
Инсулин, мМЕ/л, Me [ Q 1 ; Q 3 ] |
11,2 [8,0; 16,4] |
6,6 [4,9; 8,3] |
<0,001 |
|
НОМА-IR, Me [ Q 1; Q 3] |
2,8 [1,9; 4,4] |
1,5 [1,1; 2,0] |
|
Окончание табл. 3
|
Показатель |
Группа |
р |
|
|
1-я: женщины с МС (n=35) |
1-я: женщины с МС (n=35) |
||
|
Аланинаминотрансфераза, Ед/л, Me [ Q 1 ; Q 3 ] |
25,6 [18,2; 31,7] |
20,0 [16,8; 27,0] |
0,066 |
|
Аспартатаминотрансфераза, Ед/л, M ( SD ) |
23,4 (6,9) |
23,8 (5,9) |
0,854 |
|
Мочевая кислота, мкмоль/л, M ( SD ) |
295,6 (61,6) |
230,0 (69,0) |
<0,001 |
|
Общий ХС, ммоль/л, Me [ QQ 1 ; Q 3 ] |
6,7 [5,7; 7,9] |
6,2 [5,3; 6,9] |
0,090 |
|
ЛПНП, ммоль/л, Me [ Q 1 ; Q 3 ] |
4,5 [3,4; 5,2] |
3,9 [3,0; 4,5] |
0,074 |
|
ЛПВП, ммоль/л, M ( SD ) |
1,5 (0,4) |
1,7 (0,4) |
0,01 |
|
неЛПВП, ммоль/л, Me [ Q 1 ; Q 3 ] |
5,1 [4,0; 5,9] |
4,3 [3,6; 5,1] |
0,019 |
|
Триглицериды, ммоль/л, Me [ Q 1 ; Q 3 ] |
1,5 [0,9; 2,0] |
1,0 [0,8; 1,2] |
<0,001 |
|
ФСГ, мМЕ/мл, M ( SD ) |
67,9 (31,5) |
87,6 (33,0) |
0,008 |
|
Пролактин, мМЕ/л, Me [ Q 1 ; Q 3 ] |
189,0 [126,0; 279,5] |
273,0 [185,8; 421,6] |
0,011 |
|
Общий тестостерон, нмоль/л, Me [ Q 1 ; Q 3 ] |
0,8 [0,4; 1,0] |
0,5 [0,4; 0,9] |
0,391 |
|
ГСПГ, нмоль/л, Me [ Q 1 ; Q 3 ] |
31,8 [21,0; 50,2] |
37,4 [16,9; 82,7] |
0,536 |
|
ИСА, %, Me [ Q 1; Q 3] |
2,2 [1,2; 3,7] |
1,8 [0,8; 4,1] |
0,314 |
|
ТТГ, мкМЕ/мл, Me [ Q 1 ; Q 3 ] |
1,3 [0,9; 1,8] |
1,5 [0,8; 1,9] |
0,966 |
Таблица 4
Результаты логистической регрессии
|
Переменные |
ОШ |
95% доверительный интервал |
p |
|
Наличие 2 соматических заболеваний и более: |
9,108 |
1,828–45,422 |
0,007 |
|
ИВО |
5,345 |
1,470–19,453 |
0,011 |
|
ММИ, балл |
1,087 |
1,007–1,174 |
0,033 |
|
ФСГ, мМЕ/мл |
0,968 |
0,944–0,993 |
0,012 |
|
пролактин, мМЕ/л |
0,993 |
0,987–0,998 |
0,012 |
Антропометрические показатели и значения модифицированного менопаузального индекса исследуемых групп
Частота встречаемости основных хронических соматических заболеваний в группах
Межгрупповые сравнения по кардиометаболическим показателям и гормональному профилю
Разработана модель для количественной оценки связи клинических и лабораторных детерминант с вероятностью наличия ММС у женщин в период ранней постменопаузы методом множественной логистической регрессии (пошаговым исключением) (табл. 4).
Полученная регрессионная модель статистически значима ( p <0,001). Коэффициент детерминации Найджелкерка составил 64,4%. Наблюдаемая зависимость описывается следующим уравнением:
P =1/(1 + e -z)
z = –0,968 + 2,209X1+ 1,676X2+ 0,084X3– 0,033X4 – – 0,007X , где Р — оценка вероятности наличия МС; z — значение логистической функции, Х1 — наличие 2 соматических заболеваний и более; Х2 — индекс висцерального ожирения; Х3 — модифицированный менопаузальный индекс (балл); Х4— ФСГ (мМЕ/мл); Х5 — пролактин (мМЕ/л).
Для дополнительной оценки качества модели проведен ROC-анализ. Качество ROC-анализа оценивали исходя из площади под ROC-кривой: AUC составила 0,909; 95% доверительный интервал 0,8350,984 ( p <0,001) (рисунок).
Пороговое значение оценок вероятности P в точке cut-off, которому соответствовало наивысшее значение индекса Юдена, составило 0,352. Наличие МС прогнозировалось при значении оценок вероятности P выше данной величины или равном ей.
Чувствительность и специфичность полученной прогностической модели составили 87,1 и 78,6% соответственно.
Обсуждение. По данным масштабных исследований, проведенных среди различных популяций, ИВО — точный, недорогой и широкодоступный маркер скрининга МС [10, 11]. В нашем исследовании ИВО показал высокую прогностическую точность для определения риска МС у женщин в период ранней постменопаузы. Поскольку диагностика МС включает антропометрические и биохимические параметры, ИВО является более надежным инструментом, чем расчет отношения ОТ/ОБ, поскольку включает не только показатели массы тела и распределения жировой ткани (ИМТ и ОТ), но и биохимические параметры, такие как уровни ЛПВП и ТГ.
ММИ Куппермана в модификации Е. В. Уваровой, отдельно анализирующий 3 группы симптомов: нейровегетативные, обменно-эндокринные и психоэмоциональные, — позволяет более детально охарактеризовать клиническую картину КС и степень выраженности отдельных его компонентов, что имеет ряд преимуществ в комплексной оценке факторов риска ММС. В нашем исследовании ММИ показал более высокие баллы в целом, а также по его отдельным компонентам: нейровегетативным и обменно-эндокринным у женщин с ММС по сравнению с женщинами без данного синдрома.
Несколько исследований подтвердили более высокую распространенность МС у женщин
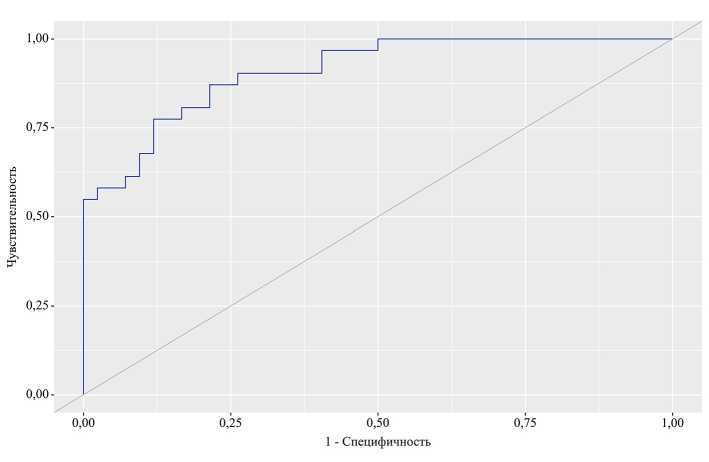
ROC-кривая, характеризующая дискриминационную способность регрессионной модели при прогнозировании менопаузального метаболического синдрома
в постменопаузе по сравнению с перименопаузой, что предполагает защитную роль половых гормонов в патогенезе ССЗ [2, 4]. В 2 систематических обзорах, оценивающих взаимосвязь между эндогенными эстрогенами и риском ССЗ, получены противоречивые результаты: некоторые исследования подтвердили ожидаемые кардиопротективные эффекты эстрогенов, другие — не смогли этого сделать, а некоторые из них показали, что эндогенные эстрогены могут быть связаны с более высоким риском ССЗ [12, 13]. Противоречивость полученных результатов может быть объяснена данными исследования SWAN (Study of Women’s Health Across the Nation), которые позволили выделить 4 различные траектории изменений уровня эстрадиола (E2) и 3 траектории изменений уровней ФСГ в период менопаузального перехода; они имели тесную корреляцию с ИМТ и этнической принадлежностью. Женщины с ожирением имели пологую траекторию (медленное снижение) E2 и медленное повышение ФСГ независимо от этнической принадлежности. Более высокие уровни E2 после менопаузы отражают увеличенную массу жировой ткани с ускоренной ароматизацией — превращения тестостерона в E2 — у женщин с ожирением, а повышенный ИМТ пациенток оказывает ингибирующее действие на секрецию гонадотропинов [14].
В нашем исследовании уровни ФСГ значимо ниже у женщин с МС по сравнению с женщинами без МС. Несколько исследований оценивали связь между уровнем ФСГ и МС. E. Jung и соавт. в 2020 г. установили, что уровни ФСГ в сыворотке имели отрицательную корреляцию с кардиометаболическими факторами риска у корейских женщин в постменопаузе, и исследователи предположили то, что низкий уровень ФСГ может быть предиктором ССЗ у женщин в постменопаузе [15]. S. W. Lee и соавт. показали, что уровень ФСГ имеет обратную связь с HOMA-IR, жировой массой тела по данным биоэлектрического импеданса и частотой МС и положительную связь с уровнем ади-понектина в сыворотке крови [16]. По данным исследования 2023 г. Y. Chen и соавт., высокие уровни сывороточного ФСГ и ЛГ связаны с более низким риском МС у женщин в постменопаузе [17]. Противоположные результаты получены в исследовании 2020 г. C. Zhang и соавт., в котором высокие уровни ФСГ имели положительную связь с риском МС у женщин в перименопаузе [18].
В нашем исследовании женщины с МС имели более низкие уровни пролактина по сравнению с женщинами без метаболических нарушений. Анализ исследований, проведенный Y. Macotela и соавт. в 2022 г., показал, что умеренно высокий уровень пролактина в сыворотке крови ассоциируется с более низкой частотой метаболических заболеваний [19]. В другом анализе представлено, что как низкие, так и высокие уровни пролактина связаны с метаболическими нарушениями и развитием МС [20]. Учитывая противоречивые результаты, демонстрирующие как положительные, так и отрицательные эффекты влияния пролактина на метаболический гомеостаз, его роль в развитии метаболических нарушений у женщин в постменопаузе требует уточнения.
Заключение. Разработанная прогностическая модель развития ММС с оценкой предикторов соматической коморбидности, менопаузальных симптомов, антропометрических и лабораторных показателей способствует выявлению пациенток с ММС в период ранней постменопаузы, а следовательно, с имеющимся повышенным кардиометаболическим риском, более тяжелым течением климактерического синдрома. Это необходимо учитывать для своевременного начала персонифицированного лечения. Ограничения нашего исследования обусловлены небольшой выборкой включенных пациенток, поэтому для дальнейшего подтверждения эффективности модели необходимы исследования с большей мощностью и длительным периодом наблюдения.


