Моделирование как подход к изучению хирургической патологии в условиях невесомости
Автор: Панченков Д.Н., Астахов Д.А., Алиханов Р.Б., Баранов А.В., Нечунаев А.А.
Журнал: Клиническая практика @clinpractice
Рубрика: Обзоры
Статья в выпуске: 3 (7), 2011 года.
Бесплатный доступ
Рассмотрены способы моделирования перитонита и эффектов микрогравитации. Представлена информация о вероятности развития заболеваний у космонавтов в условиях длительного космического полета
Перитонит, микрогравитация, моделирование редких событий, заболеваемость малых автономных групп
Короткий адрес: https://sciup.org/14338398
IDR: 14338398
Текст научной статьи Моделирование как подход к изучению хирургической патологии в условиях невесомости
Боль сопровождает около 70% всех известных заболеваний. Согласно данным эпидемиологических исследований, той или иной болью страдают до 64% в популяции. По результатам российских эпидемиологических исследований, хронические болевые синдромы наблюдаются не менее чем у 40% взрослого населения, и эти цифры имеют тенденцию к неуклонному росту. Отрицательное влияние боли проявляется не только на самих пациентах. Она также отражается и на их ближайшем окружении.
Еще одной сложной проблемой современной неврологии является спастичность. Спастичностью называют увеличение мышечного тонуса, сопровождающееся оживлением сухожильных рефлексов. Для спастичности характерно наличие клонусов, симптомов «складного ножа», а также «эластическое сопротивление» и максимальное сопротивление при пассивных движениях.
Клинически различают три типа спастического синдрома: 1 – тоническую спастичность, 2 – физическую спастичность, 3 – смешанный тип. Тоническая спастичность характеризуется постоянным повышением мышечного тонуса, который нарастает во время позно-тонических реакций и не усиливается при произвольных движениях. При физической спастичности, наоборот, тонус нарастает во время движений и относительно невысок в покое. В клинике речь чаще всего идет о смешанной форме с преобладанием того или иного типа нарушений.
Необходимо остановиться на современных представлениях о патофизиологии нейрогенных болевых и спастических синдромов.
Научные концепции физиологии боли появились в первые десятилетия XIX столетия.
Теория «воротного контроля» – одна из наиболее плодотворных концепций механизма боли. Основные ее положения состоят в том, что импульсы, проходящие по тонким (болевым) С и А-дельта периферическим волокнам, открывают «ворота» в нервную систему, чтобы достичь ее центральных отделов. Два обстоятельства могут закрыть «ворота»: прохождение импульсов по толстым (тактильным) волокнам и нисходящие влияния антиноцептивной системы высших отделов нервной системы.
Таким образом, боль, возникающую в глубоких тканях, таких как мышцы и суставы, можно уменьшить контрраздражением, которое распространяется по толстым миелиновым волокнам и «перекрывает ворота» для проведения боли.
Второй механизм (закрытие «ворот» изнутри) вступает в действие в случае активации ан-тиноцептивной системы. В этом случае импульсы, исходящие из вышележащих отделов антиноцептивной системы, через нисходящие волокна активируют интернейроны, расположенные в поверхностных слоях задних рогов, постсинаптически ингибирующих желатинозные клетки, предотвращая тем самым передачу информации выше. Это повлекло за собой изменение тактики лечения боли. [1, 2]
В настоящее время некоторые основные положения, касающиеся патофизиологических механизмов спастичности, пересматриваются. В качестве основных нарушений на сегментарном уровне у больных с «церебральной» спастичностью выделяют следующие:
-
1. Повышение возбудимости альфа-мотонейронов.
-
2. Снижение возбудимости интернейронов, ответственных за процессы:
-
а) пресинаптического торможения;
-
б) реципрокного торможения (1-а интернейроны);
-
в) 1-а облегчения.
-
3. Изменения возбудимости интернейронов, отвечающих за осуществление полисинапти-ческих рефлексов.
Знание этих патологических процессов легли в основу современных комплексных методов лечения хронической боли и спастичности и в частности хирургических методов лечения данных патологий.
Основной задачей лечения является приостановление этих процессов на более ранней стадии, до организации патологической системы с выраженной резистентностью к терапии.
Как и при любом заболевании, лечение этих синдромов начинается с консервативных методов, которые условно можно разделить на медикаментозные, рефлекторные и психологические. При безуспешности консервативного лечения переходят к хирургическим методам лечения.
Хирургическое лечение болевых и спастических синдромов в настоящее время включает три основных вида оперативных вмешательств:
-
1. Анатомические.
-
2. Деструктивные.
-
3. Методы хирургической нейромодуляции.
Анатомические операции представлены декомпрессией, транспозицией и невролизом. При наличии показаний они чаще выполняются на первом этапе хирургического лечения и являются во многих случаях патогенетически направленными.
Деструктивные операции – это вмешательства на различных отделах периферической и центральной нервной системы, целью которых является перерезка путей и разрушение структур болевой чувствительности.
К деструктивным оперативным вмешательствам относятся:
-
1. Нейротомия.
-
2. Ризотомия.
-
3. Ганглиотомия и ганглионэктомия.
-
4. DREZ-операция – селективная деструкция зоны входа задних корешков в задний рог.
-
5. Хордотомия
-
6. Миелотомия
-
7. Комиссуротомия.
-
8. Понтинная и мезенцефальная трактотомия.
-
9. Деструкция ядер таламуса.
Из этого ряда операций сегодня сохранили свою актуальность только DREZ-операции и в редких случаях хордотомия. Многолетний опыт применения деструктивных операций показал, что несмотря на их достаточно высокую эффективность в раннем периоде, в большинстве случаев есть тенденция к рецидиву. Это приводит к необходимости операций на более высоких уровнях нервной системы, часто с двух сторон.
Разрушение нервных структур само по себе может вести к формированию очагов патологической нейронной активности, что приводит к рецидиву и распространению патологического синдрома.
Даже после радикальных вмешательств, направленных на разрушение и пересечение болепроводящих путей головного и спинного мозга, в 50-60% случаев наступает рецидив болевого синдрома, часто в еще более жестоком виде. Кроме того, деструктивные операции в результате необратимого воздействия на нервные структуры в 30% случаев вызывают тяжелые неврологические, нередко необратимые осложнения (парезы, параличи, нарушения функций тазовых органов, болезненные парестезии и даже нарушения витальных функций) [3]. В настоящее время за рубежом деструктивные операции применяют только у ограниченного числа практически обреченных больных с тяжелыми формами данных патологий, которые не поддаются никаким другим методам воздействия.
Хирургическая нейромодуляция представлена малоинвазивными методами лечения, основанными на электрическом или медиаторном воздействии на структуры нервной системы. Она подразделяется на нейростимуляцию и хроническое эпидуральное или интратекаль-ное (подоболочечное, интравентрикулярное) введение лекарственных средств [4].
В данной работе мы подробно рассмотрим наиболее распространенную форму нейростимуляции – хроническую стимуляцию спинного мозга.
Первая имплантация нейростимулятора осуществлена нейрохирургом C.N. Shealy в
1967 г. для облегчения тяжелого болевого синдрома. За три года Shealy и соавт. произвели шесть операций. Сегодня во всем мире ежегодно выполняется более 25 000 операций при болевых синдромах.
После того, как A.W. Cook и S.P. Weinstein впервые сообщили в 1973 г. о снижении спастичности во время электростимуляции спинного мозга, началось клиническое применение данной методики для лечения спастичности. Наилучшие результаты опубликованы J.M. Waltz в 1982 г., который наряду с другим положительным воздействием электростимуляции отметил и исчезновение или значительное уменьшение болезненных спазмов и спастичности аддукторов у всех без исключения больных.
Показанием к применению данного метода лечения является наличие физической, тонической или смешанной форм спастичности в мышцах нижних конечностей без выраженных органических изменений в суставах. Нарушение трофики кожи и подкожной клетчатки при отсутствии гнойно-воспалительного процесса не может служить противопоказанием к применению данного метода. Несмотря на широкое использование хронической нейростимуляции спинного мозга в течение 35 лет, механизмы ее анальгетического воздействия все еще недостаточно ясны.
В целом основы обезболивающего действия стимуляции можно свести к следующему:
-
- электрофизиологическая блокада проведения болевых импульсов;
-
- выработка эндогенных антиноцептивных веществ (ГАМК, серотонин, глицин, норадреналин и др.) и усиление нисходящих влияний антиноцептивной системы;
-
- периферическая вазодилатация вследствие воздействия на симпатическую нервную систему.
В настоящее время большое значение придается «химической блокаде» ноцептивных сигналов как на сегментарном, так и на супра-сегментарном спинальном и супраспинальном уровне. Ведущее место в этих механизмах отводится ГАМК, эндорфинам, серотонину, дофамину и другим эндогенным биологическим активным соединениям. Одним из доказанных механизмов стимуляции является ее влияние на симпатическую нервную систему. Одним из доказательств этого механизма действия является улучшение кровообращения в конечности на фоне стимуляции, которое можно выявить при помощи допплерографии, тепловизионной термометрии и других методов исследования.
Для проведения нейростимуляции спинного мозга применяют полностью имплантируемые системы, которые состоят из эпидуральных электродов; соединительных кабелей-коннекторов; имплантируемого генератора импульса со встроенным элементом питания (рис. 1).

Рис. 1. Оборудование для проведения хронической нейростимуляции спинного мозга.
Имплантацию хронических эпидуральных электродов осуществляют либо на том же уровне транскутанно по игле Тuohi № 15 (рис. 2), либо открытым способом через микроламинэктомию на уровне L2-L3 (рис. 3).
В обоих случаях применяют рентгенологический контроль положения электрода в заднем эпидуральном пространстве на уровне Тh9-Тh11 позвонков. Открытый способ применяют для имплантации плоских 4-контактных электродов, закрытый – для имплантации цилиндрических 4- и 8-контактных электродов.
Преимуществом закрытого способа наряду с меньшей травматичностью является возможность использовать не только рентгенологический контроль, но и диагностическую интраоперационную электростимуляцию для более точной локализации контактных поверхностей электродов (рис. 4). Отчетливое снижение спастичности в ногах, а также возникновение парестезий в дерматомах Тh12-S1 с обеих сторон при диагностических электростимуляциях свидетельствуют о правильном положении стимулирующих электродов.
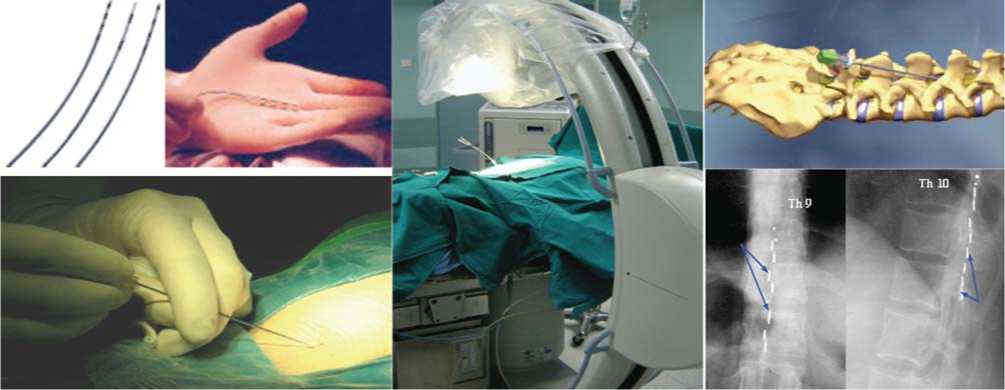
Рис. 2. Чрескожный подход установки электрода для хронической стимуляции спинного мозга.
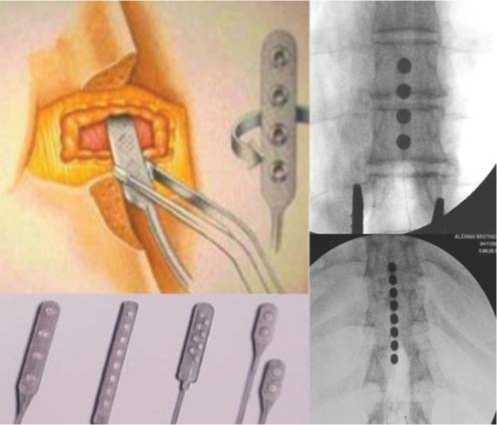
Рис. 3. Ламинэктомический подход установки электрода для хронической стимуляции спинного мозга.
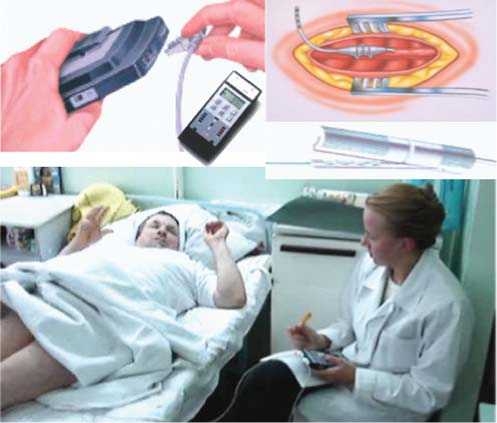
Рис. 4. 2-й этап – тестовый период – интраоперационная или послеоперационная стимуляция.
В некоторых случаях, особенно когда операция проводится под наркозом, эпидуральный электрод через временный коннектор выводят на кожу.
В течение 5-6 послеоперационных дней проводят диагностические электростимуляции для определения эффективности стимуляции. При получении желаемого результата временный коннектор удаляют, а электрод через постоянный коннектор соединяют с подкожным генератором импульсов. Если операция проводится под местной анестезией и эффекты интраоперационной диагностической стимуляции спинного мозга четкие и воспроизводимые, возможно соединение электродов с подкожным генератором в один этап. Подкожный генератор располагают либо в подкожной клет- чатке подвздошной области, либо в верхненаружном квадранте ягодичной области или в подключичной области при стимуляции шейного отдела спинного мозга. Толщина слоя кожи и подкожной клетчатки над генератором импульсов не должна превышать 10 мм во избежание больших потерь сигнала.
Имплантация системы – это только один из начальных этапов лечения (рис. 5, 6).Оконча-тельные результаты и их устойчивость во многом зависят от правильного программирования системы.
Программирование систем осуществляется с помощью специального устройства, врачебного программатора (рис. 7). Передача импульсов осуществляется с помощью радиочастотных волн, идущих от головки программатора
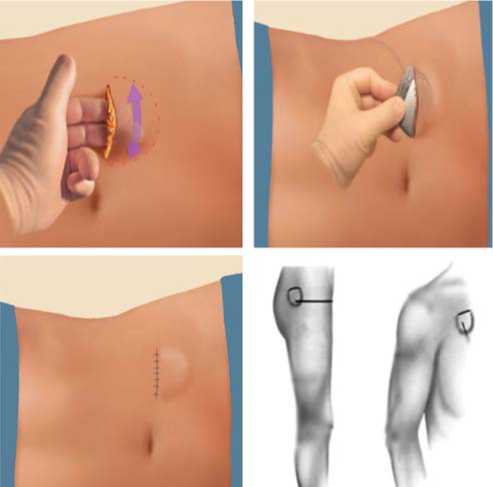
Рис. 5. 3-й этап – имплантация нейростимулятора.
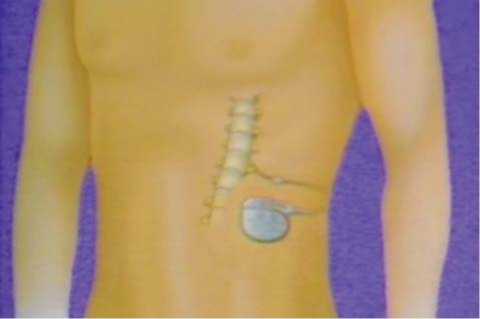
Рис. 6. Имплантация нейростимулятора.

Рис. 7. Программатор врача для подбора программы стимуляции спинного мозга.
через кожные покровы к нейростимулятору. Данные волны находятся в диапазоне безвредных для пациента частот.
Основные параметры нейростимулятора, которые программируются:
-
- полярность контактов и режим;
-
- амплитуда стимула (измеряется в вольтах) обусловливает силу воздействия;
-
- ширина (длительность) импульса измеряется в микросекундах;
-
- частота импульса (измеряется в герцах). Частота импульса подбирается индивидуально для каждого пациента. Оптимальной является стимуляция в границах 90-120 Гц.
Пациент управляет нейростимуляцией с помощью специального пульта управления системой, предназначенного для больного, благодаря которому пациент может менять параметры амплитуды стимула, частоту и ширину импульса.
В настоящее время хроническая нейростимуляция применяется при «синдроме оперированного позвоночника», при спастических синдромах у больных с позвоночно-спинальной травмой и ее последствиями, при нейропатических болях вследствие поражения одного или нескольких периферических нервов, постгерпетической невралгии, послеампутационных болях в культе конечности, других послеоперационных болевых синдромах (постторакотоми-ческий, постмастэктомический, постлапарото-мический болевые синдромы), болях в конечностях, обусловленных вазоспастическими состояниями и нейроваскулярными синдромами (болезнь Рейно, облитерирующий эндартериит, синдром Лериша и др.), стенокардии, болях в области малого таза и половых органов, не связанных с патологией внутренних органов [5-7].
Однако существуют и противопоказания к проведению нейростимуляции:
-
1. Тяжелая сопутствующая соматическая патология.
-
2. Некурабельная лекарственная зависимость.
-
3. Наличие в анамнезе суицидальных попыток, сопровождающих тяжелую психическую патологию.
-
4. Психические нарушения с явными признаками соматизации.
-
5. Интеллектуальная ограниченность пациента, препятствующая использованию системы для нейростимуляции.
Широкое внедрение и применение нейростимуляции спинного мозга в процессе лечения и реабилитации позволит оказывать эффективную медицинскую помощь больным с выраженными болевыми и спастическими синдромами.
В КБ № 83 ФМБА России с 2010 г. проводятся оперативные вмешательства по данной методике у больных с последствиям позвоночно-спинальной травмы с выраженными болевыми и спастическими синдромами.
В качестве иллюстрации приводим клинический случай.
На стационарном лечение в нейрохирургическом отделение находился больной С., 1980 г.р., с диагнозом: травматическая болезнь спинного мозга при переломе С5-позвонка. Состояние после переднего корпородеза С4-С6 (2004). Спастический тетрапарез, более выраженный в ногах. Нарушение функций тазовых органов по типу задержки.
Анамнез: позвоночно-спинальную травму получил в 2004 г. при нырянии в воду. Перенес переднюю корпорэктомию С4-С6. Больной неоднократно находился на лечении в неврологических и реабилитационных стационарах. В условиях реабилитационных отделений больному проводилось консервативное лечение, а также физиотерапевтические процедуры, ЛФК. Следует отметить, что у больного в условиях бассейна отмечалось снижение мышечного тонуса, спастичности в нижних конечностях, это позволяло больному проходить с нагрузкой около 150 м в воде.
При осмотре. Состояние удовлетворительное. Сознание ясное. Отмечается высокий тонус мышц в ногах и руках. Сухожильные рефлексы с рук D = S, с ног – D меньше S, живые, спастический тетрапарез, более выраженный в ногах. Гипоэстезия с уровня Тh3. Сила в руках – сгибание предплечья 5 баллов, разгибание предплечья 3 балла, в ногах – 1 балл. Тазовые нарушения по типу задержки функций.
Данные клинических исследований
При контрольной МРТ шейного отдела позвоночника выявляется посттравматическая киста спинного мозга на уровне С5.
Список литературы Моделирование как подход к изучению хирургической патологии в условиях невесомости
- Braun W. Mars Project/University of Illinois Press. Urbana. 1953.
- Horneck G., Facius R., Reichert M. et al. a study on the survivability and adaptation of humans to longduration exploratory missions, (ESA SP-1274)/Eur. Space Agency. Noordwijk, 2003.
- Sridhar K.R., Finn J.E., Kliss M.N. In-situ resource utilization technologies for Mars life support systems//Adv. Space Res. 2000. Vol. 25 (2). P. 249255.
- Zubrin R. The Mars direct plan//Sci. Am. 2000. Vol. 282 (3). P. 52-55.
- Строганов Л.Б., Горшков Л.А. Пилотируемая экспедиция к Марсу: концепция и проблемы//Acta Astronautica. 1991. Vol. 23. P. 279-289.
- Billica R.D., Pool S.L., Nicogossian A.E. Crew health care programs/In: Nicogossian A.E., Huntoon C.L., Pool S.L., eds. Space Physiology and Medicine. 3rd ed. Philadelphia, Pa: Lea & Febiger. 1994. P. 402-423.
- Houtchens B.A. Medical-care systems for longduration space missions//Clin Chem. 1993. Vol. 39 (1). P. 13-21.
- Гончаров И.Б., Ковачевич И.В., Жернавков А.Ф. Анализ заболеваемости в космическом полете//Косм. биол. и мед. 2001. № 4. С. 145-164.
- Бродский А.В., Новиков Д.Б., Падалко С.Н. и соавт. Общая схема автоматизированного медицинского контроля в СППР жизнеобеспечение длительных космических полетов//Вестник МАИ. Т. 17. № 2. С. 48.
- Григорьев А.И., Егоров А.Д. Теория и практика медицинского контроля в длительных космических полетах//Авиакосм. и экол. мед. 1997. Т. 30, № 1. С. 14-25.
- Григорьев А.И., Егоров А.Д., Потапов А.Н. Некоторые медицинские проблемы пилотируемой марсианской экспедиции//Авиакосм. и экол. мед. 2000. Т. 33, № 3. С. 6-12.
- Антипов В.В., Григорьев А.И., Хантун К.Л. Космическая биология и медицина. Т. III, кн. 1. Человек в космическом полете. М.: Наука, 1997. С. 58-230.
- Воробьев В.Е., Стажадзе Л.Л., Разиным А.С., Ивченко В.Ф. Изменение метаболизма при моделированной невесомости//Анестезиол. и реаниматол. 1990. № 3. С. 38-40.
- Гении A.M., Дакота Н.Г., Никое Л.И., Шаткое B.C. Новый вариант моделирования действия невесомости на человека//Косм. биол. и авиакосм. мед. 1988. № 5. С. 80-84.
- Григорьев Л.И., Моруков Б.В. 370-суточная антиортостатическая гипокинезия: Задачи и общая структура исследований//Косм. биол. и авиакосм. мед. 1989. № 5. С. 47.
- Погодин М.А., Донина Ж.А., Лаврова И.Н. и соавт. Влияние антиортостатического положения тела на некоторых показатели кровообращения и дыхания наркотизированных кошек//Рос. физиол. ж. им. И.М.Сеченова. 2000. Т. 86, № 12. С. 1587-1593.
- Щульженко Е.Б., Виль-Вильямс М.Ф. Возможность проведения длительной водной иммерсии методом "сухого" погружения//Косм. биол. и авиакосм. мед. 1976. № 9. С. 82-84.
- Банин И.Н. К вопросу о моделировании острого экспериментального перитонита//Бюл. эксп. и биол. мед. 2000. № 1. С. 7-11.
- Буянов В.М., Родоман Г.В., Белоус Г.Г. Экспериментальная модель острого гнойного перитонита//Хирургия. 1997. № 1. С. 72-73.
- Глухов А.А. Влияние температурного режима санации брюшной полости на течение синдрома постсанационной интоксикации при остром распространенном перитоните//Вестн. хир. им. И.И. Грекова. 2006. Т. 165. № 3. С. 98-102.
- Ременник С.С. К вопросу о создании экспериментальной модели перитонита//Здравоохр. Туркменистана. 1965. № 7. С. 21-25.
- Фавстов В.В. К вопросу о создании экспериментальной модели перитонита/Актуальные проблемы внутренней медицины и стоматологии. СПб, 1997. 140 с.
- Jacobi C.A., Ordemann J., Zieren H.U. et al. Increased systemic inflammation after laparotomy versus laparoscopy in an animal model of peritonitis//Arch. Surg. 1998. Vol. 133 (3). P. 258-262.
- Maleckas A., Daubaras V., Vaitkus V. et. al. Increased postoperative peritoneal adhesion formation after the treatment of experimental peritonitis with chlorhexidine//Langenbecks Arch. Surg. 2004. Vol. 389 (4). P. 256-260.
- Pross M., Mantke R., Kunz D. et al. Reduced neutrophil sequestration in lung tissue after laparoscopic lavage in a rat peritonitis model//World J. Surg. 2002. Vol. 26 (1). P. 49-53.
- Maier S., Traeger T., Entleutner M., et al. Cecal ligation and puncture versus colon ascendens stent peritonitis: two distinct animal models for polymicrobial sepsis//Shock. 2004. Vol. 21 (6). P. 505-511.


