Моделирование процесса гибки персонифицированных имплантатов, используемых при реконструкции дефектов нижней челюсти
Автор: Де Алваренга Р., Ерисов Я.А., Воробьев Д.И., Байриков А.И.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Машиностроение и машиноведение
Статья в выпуске: 6 т.23, 2021 года.
Бесплатный доступ
В настоящей работе с помощью моделирования методом конечных элементов проведено сравнение схем гибки стандартных реконструктивных перфорированных титановых пластин, используемых при реконструкции дефектов нижней челюсти. В настоящее время существует потребность в оборудовании для высокоточной гибки реконструктивных пластин с целью придания им заданной геометрии, повторяющей естественную кривизну нижней челюсти пациента. Персонификация имплантата позволяет восстановить естественную симметрию лица пациента, а, значит, и ускорить процесс его социальной реинтеграции. В статье проведено сравнение шести схем гибки, соответствующих различным направлениям изгиба, различным углу и плечу изгиба. Полученные результаты позволяют изучить особенности процесса, оценить его силовые характеристики, упругое пружинение после гибки, которые необходимы для разработки оборудования для гибки персонифицированных имплантатов.
Персонифицированный имплантат, реконструктивная перфорированная пластина, титановый сплав вт6, гибка, усилие, упругое пружинение, напряжения, деформации
Короткий адрес: https://sciup.org/148323286
IDR: 148323286 | УДК: 621.981.12 | DOI: 10.37313/1990-5378-2021-23-6-10-17
Текст научной статьи Моделирование процесса гибки персонифицированных имплантатов, используемых при реконструкции дефектов нижней челюсти
Переломы костей лицевого черепа составляют около 2,5% от числа повреждений костей скелета человека. Переломы нижней челюсти являются самыми распространенными, составляя до 80% от общего числа повреждений костей лицевого скелета. Данные переломы могут возникать вследствие различных ситуаций, как правило, связаны с бытовой травмой – 48,9%; транспортный травматизм – 20,5%; производственная травма – 15,2%; спортивная травма – 10,3%; огнестрельные переломы – 5% [1, 2].
(0,5%). Сложность лечения онкологии в данной области обусловлены строением челюсти и жизненно важными для человека функциями органов головы и шеи, а также их анатомическим взаимодействием. Особенности строения челюсти подталкивают быстрое распространение процесса разрастания опухоли по полостным структурам и мягким тканям, из-за этого лучевая и химиолучевая терапия не дает высоких результатов в лечении онкологии челюстнолицевого отдела. На данный момент основным методом лечения является хирургический, посредством установки имплантата [3].
Проблема реконструкции нижней челюсти при сложных переломах, огнестрельных ранениях, злокачественных новообразованиях методом эндопротезирования и остеосинтеза является одной из самых актуальных в реконструктивной хирургии челюстно-лицевой области. Функциональные и косметические нарушения, связанные с дефектами нижней челюсти, стимулировали неоднократные попытки врачей уменьшить или вообще исключить обезображивающее следствие травм при помощи различных методов реконструкции. Основной целью реконструкции является восполнение дефекта нижней челюсти и функции жевания. Нижняя челюсть определяет привычный эстетический вид человека, обеспечивает акты пережевывания пищи, глотания, речи и дыхания.
В настоящее время для закрытия дефектов костей нижней челюсти самыми распространенными типами реконструктивных операций являются: эндопротезирование и остеосинтез, которые подразумевают имплантацию специальных, чаще всего металлических, конструкций. Основной задачей данных операций протезирования является восстановление формы, а также функций совершенно утраченных или полуразрушенных органов.
Самыми распространенными материалами для изготовления имплантатов являются био-совместимые титановые сплавы, пористая биоактивная керамика и титановый порошок из-за сочетания таких свойств, как прочность, долговечность, гибкость, пластичность и упругость.
Для создания эндопротезов из биоактивной керамики применяется метод шликерного литья. Благодаря особым свойствам биоактивной керамики (ее текучести на этапе создания формы) можно получать имплантаты сложной пространственной формы и дизайна, что является необходимым условием в реконструкции сложных дефектов челюстно-лицевой области. После всех технологических этапов, связанных со спеканием готового изделия, получается эндопротез с прочностными характеристиками, близкими к костной ткани челюстно-лицевой области [2].
Однако, имплантаты из биоактивной керамики имеют ряд недостатков, связанных с длительностью их производства, необходимостью долгого компьютерного моделирования для придания имплантату максимально точной геометрии, а также возможностью возникновения литейных дефектов.
Имплантаты из титанового порошка изготавливаются методом порошковой металлургии. Из порошка никелида и титана прессуется заготовка, которая обрабатывается методом самораспространяющегося высокотемпературного синтеза в режиме послойного горения. Полученная заготовка обрабатывается на станке алмазными и вулканитовыми дисками, чтобы получить копию с шаблона эндопротеза. На пластине вырезаются V образные зубцы, и задается память формы нагреванием, на шейке эндопротеза вырезается канавка по всему ее периметру. Фиксация осуществляется за счет эффекта термопамяти фиксаторов [4]. Также используют технологию селективного лазерного спекания титанового порошка [5].
К недостаткам данных методов изготовления имплантатов стоит отнести высокую стоимость титанового порошка, а также высокую стоимость и сложность оборудования для производства имплантатов.
В настоящее время наиболее широко используется методика реконструкции дефектов нижней челюсти при помощи титановых реконструктивных пластин (рисунок 1). Применение конструктивно разных реконструктивных титановых пластин различных систем и производителей для восполнения дефекта нижней челюсти, с одной стороны, является доступным и простым способом, а с другой - при применении по четким показаниям позволяет добиться приемлемых функциональных и эстетических показателей [6].
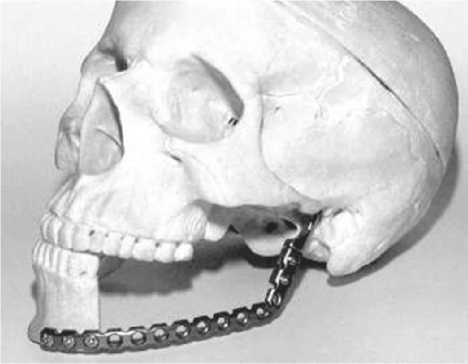
Рис. 1. Реконструкция дефекта нижней челюсти при помощи реконструктивной перфорированной титановой пластины
Недостатком данной методики является необходимость интраоперационного адаптирования хирургом пластины по протяженности и форме дефекта. То есть гибка перфорированной титановой пластины производится вручную во время оперативного вмешательства, что, во-первых, увеличивает его продолжительность, а, во-вторых, не всегда обеспечивает получение требуемой формы имплантата. Это в свою очередь может приводить к задержке развития нижней челюсти в целом и образованию выраженной ее деформации. Велика вероятность атрофии мягких тканей и кожи вокруг пластины с появлением дефектов, значительно ухудшающих вид лица. Подобные изъяны в подавляющем большинстве клинических случаев ведут к очередным хирургическим вмешательствам.
Активное развитие компьютерной и магнитно-резонансной томографии позволяет в настоящее время получать компьютерные (трехмерные) модели нижней челюсти пациента, на основании которых можно спроектировать компьютерную модель имплантата для реконструкции дефекта, полностью соответствующую по форме и размерам особенностям пациента и отвечающую выполнению функциональных и эстетических показателей.
Очевидно, что изготовить такой персонифицированный имплантат вручную, с использованием доступных на данный момент специальных приспособлений для ручной гибки, практически невозможно.
Решить данную проблему можно за счет разработки автоматического оборудования, которое будет осуществлять гибку реконструктивной перфорированной титановой пластины по параметрам, рассчитанным на основании компьютерной модели персонифицированного имплантата. Это позволит повысить точность изготовления имплантата, а значит и вероятность возникновения указанных ранее сопутствующих дефектов.
Для выполнения поставленной цели необходимо разработать методику расчета технологических параметров процесса гибки реконструктивной перфорированной титановой пластины на основе компьютерной модели персонифицированного имплантата, то есть рассчитать углы гибки с учетом упругого пружинения и сформировать программу для управления автоматическим оборудованием.
В связи с этим, в настоящей работе с помощью моделирования методом конечных элементов проведено сравнение схем гибки перфорированной пластины с целью оценки силовых характеристик процесса и величины упругого пружинения после гибки.
МЕТОДИКА МОДЕЛИРОВАНИЯ
Компьютерное моделирование процесса гибки перфорированных титановых пластин методом конечных элементов выполнено в программе LS-DYNA. Для расчетов использовался неявный решатель.
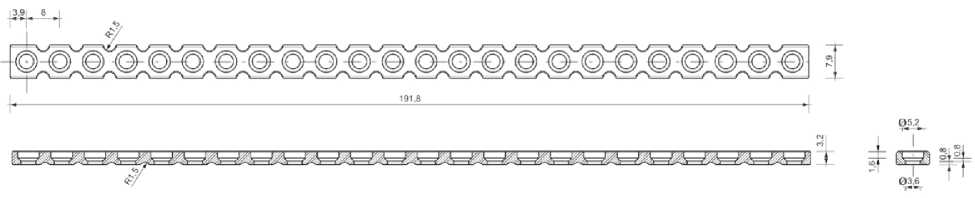
Трехмерная модель и схема перфорированной титановой пластины (заготовки) показана на рисунке 2. Использовалась объемная сетка конечных элементов, состоящая из тетраэдров.
Для описания свойств материала заготовки – титанового сплава ВТ6 – использовалась модель 003_PLASTIC_KINEMATIC (упругопластическая среда Прандтля – упрочнение отсутствует). Задаваемые параметры и их значения приведены в таблице 1. Матрица и пуансон моделировались как недеформируемые тела (модель 020_RIGID).
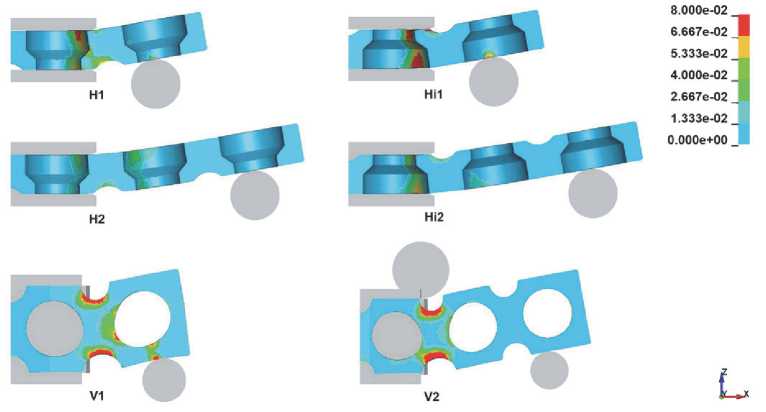
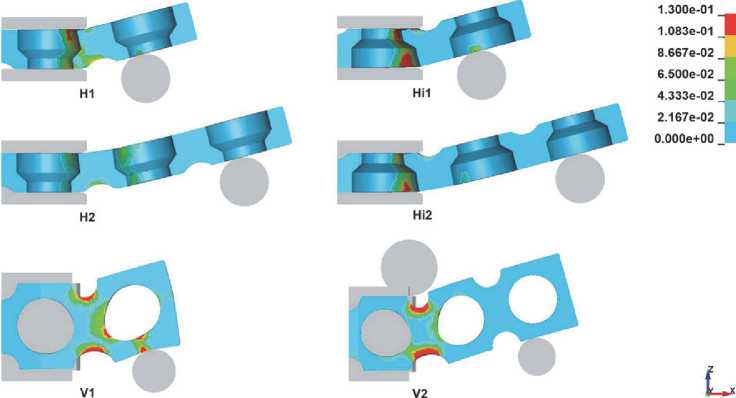
Рассматривали влияние на процесс гибки следующих параметров: направление изгиба и длина плеча изгиба. Возможны следующие варианты: линия гиба располагается вдоль ширины заготовки (горизонтальное расположение, H; горизонтальное перевернутое, Hi), линия гиба располагается вдоль толщины заготовки (вертикальное расположение, V). Для каждого из этих вариантов рассмотрено различное место приложения изгибающего усилия (длина плеча изгиба): усилие (пуансон) приложено или к первой перфорированной ячейке (индекс 1) от линии гиба (матрицы), или ко второй (индекс 2). Всего было смоделировано шесть схем гибки (рис. 3). На схеме V2 к матрице добавлен цилиндр для локализации деформации в области промежуточной ячейки.
Во всех случаях матрицу фиксировали в пространстве (ограничивалось ее перемещение и вращение по всем осям). Для пуансона также ограничивалось перемещение, за исключением перемещения по оси z.
Процесс разбивали на два этапа: нагружение и разгрузка. На первом этапе (от 0 до 0,8 с) происходит перемещение пуансона вдоль оси z (к заготовке), то есть происходит гибка заготовки. На втором этапе (с 0,8 до 1,0 с) пуансон меняет направление движения, возвращаясь в исходное положение, что позволяет оценить упругую разгрузку. Скорость перемещения пуансона рассчитывали таким образом, чтобы к концу пер-

a
б
Рис. 2. Трехмерная модель (а) и схема (б) перфорированной титановой пластины
Таблица 1. Свойства титанового сплава ВТ6
|
Параметр |
Значение |
|
Плотность, кг/м 3 |
4400 |
|
Модуль Юнга, ГПа |
105 |
|
Коэффициент Пуассона |
0,35 |
|
Предел текучести, МПа |
750 |
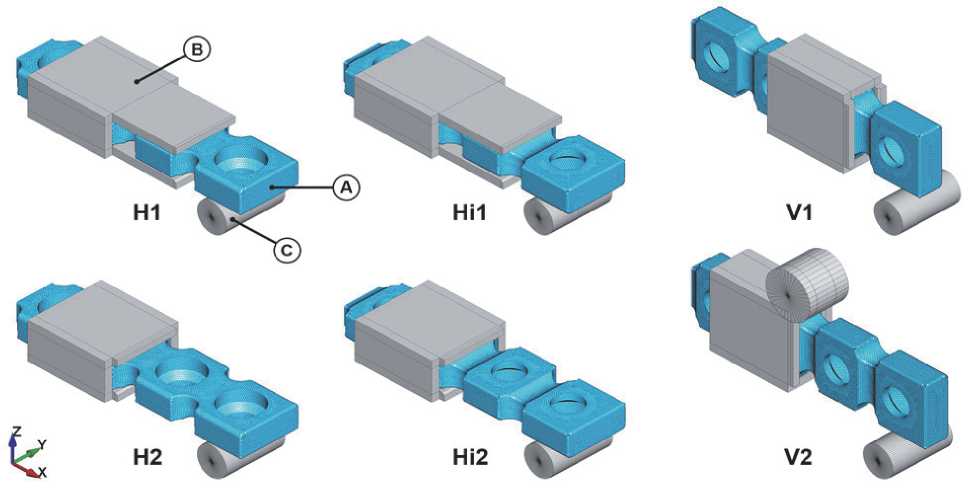
Рис. 3. Схемы гибки:
(H1) горизонтальная, пуансон в первой ячейке;
(H2) горизонтальная, пуансон во второй ячейке;
(Hi1) перевернутая горизонтальная, пуансон в первой ячейке;
(Hi2) перевернутая горизонтальная, пуансон во второй ячейке;
(V1) вертикальная, пуансон в первой ячейке;
(V2) вертикальная, пуансон во второй ячейке; заготовка (A), матрица (B) и пуансон (C)
вого этапа угол гибки был равен заданному. Для каждой схемы рассмотрен процесс гибки на угол 10°, 15° и 20°.
Трение между контактными парами задавалось по закону Кулона (коэффициент трения – 0,2).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
После расчетов методом конечных элементов были проанализированы два параметра процесса: остаточный угол изгиба детали (угол после разгрузки) и усилие изгиба (усилие по оси z).
Зависимость угла и усилия изгиба от времени процесса для схемы H1 (угол гибки 10°) приведена на рис. 4. Угол увеличивается почти прямолинейно на протяжении всего процесса нагружения (сразу после контакта пуансона и заготовки) и достигает максимума αмакс в конце первого этапа (0,8 с). Усилие также возрастает при нагружении и достигает максимума в конце первого этапа. При этом на кривой, описывающей зависимость усилия от времени, можно выделить два прямолинейных участка, отличающихся скоростью увеличения усилия. Первый участок соответствует упругой деформации, второй – пластической.
Во время упругой разгрузки усилие уменьшается до нуля, а угол – до некоторого постоянного значения α ост (остаточный угол). При этом угол упругой разгрузки ∆ α , разница между максимальным (фактическим) углом изгиба α макс и остаточным углом α ост, приблизительно равен углу α упр, полученному на этапе упругой деформации.
Для остальных схем гибки характер изменения угла и усилия аналогичен рассмотренному, изменяются только значения характерных точек, которые для каждого случая приведены в таблице 2.
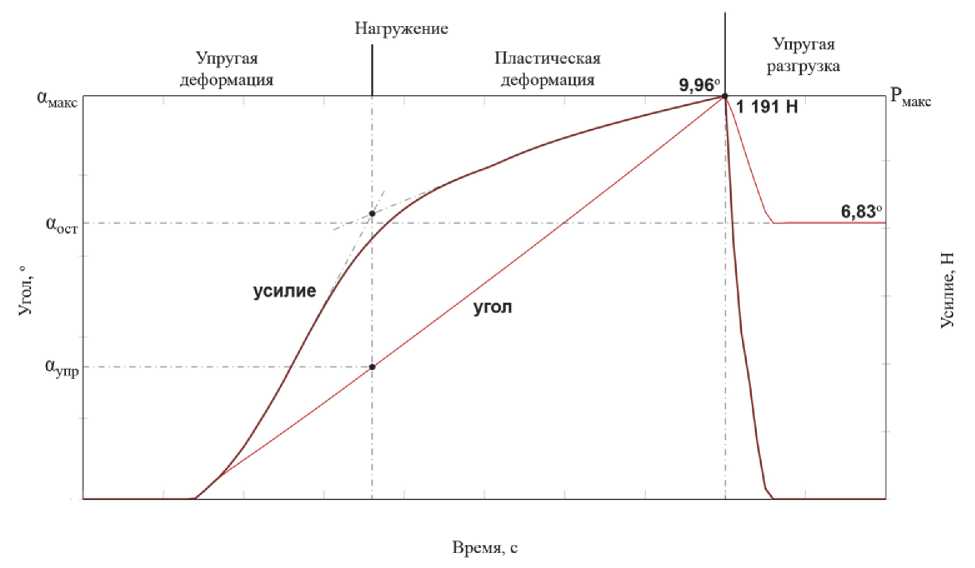
Рис. 4. Изменение угла изгиба заготовки и усилия на пуансоне от времени процесса (схема H1, угол гибки 10°)
Во всех случаях с увеличением угла изгиба увеличивается и потребное усилие процесса (в среднем на 8-24%). Увеличение длины плеча при гибке ожидаемо приводит к уменьшению усилия (от 2 до 4 раз). Максимальные усилия соответствуют схемам H1 и V1 с минимальным плечом изгиба. Схемы Hi1 и Hi2, когда из- гиб осуществляется поперечной проточкой во внутрь, характеризуются меньшими усилиями по сравнению с аналогичными схемами H1 и H2, когда изгиб происходит проточкой наружу. Это объясняется тем, что проточка увеличивает внутренний радиус гибки, а это приводит к изменению распределения напряжений по толщи-
Таблица 2. Остаточный угол, угол упругой разгрузки и максимальное усилие для каждой схемы гибки
|
Схема гибки |
Угол гибки |
Фактический угол гибки И макс |
Остаточный угол (Х ост |
Угол упругой разгрузки Да |
Максимальное усилие Р макс , Н |
|
H1 |
10° |
9,96° |
6,83° |
3,13° |
1191 |
|
15° |
14,94° |
11,81° |
3,13° |
1351 |
|
|
20° |
19,99° |
16,90° |
3,09° |
1477 |
|
|
Hi1 |
10° |
9,96° |
6,91° |
3,05° |
873 |
|
15° |
15,02° |
11,99° |
3,03° |
916 |
|
|
20° |
20,01° |
16,90° |
3,11° |
952 |
|
|
H2 |
10° |
9,35° |
4,39° |
4,96° |
309 |
|
15° |
14,96° |
9,16° |
5,80° |
330 |
|
|
20° |
19,99° |
14,10° |
5,89° |
343 |
|
|
Hi2 |
10° |
10,00° |
4,61° |
5,39° |
279 |
|
15° |
15,00° |
9,32° |
5,68° |
295 |
|
|
20° |
19,98° |
14,15° |
5,83° |
301 |
|
|
V1 |
10° |
9,05° |
6,26° |
2,79° |
1196 |
|
15° |
14,13° |
11,28° |
2,85° |
1279 |
|
|
20° |
19,25° |
16,34° |
2,91° |
1328 |
|
|
V2 |
10° |
9,84° |
6,33° |
3,51° |
614 |
|
15° |
14,96° |
11,30° |
3,66° |
647 |
|
|
20° |
19,92° |
16,04° |
3,88° |
666 |
Mean Ipt Effective Strain
a
Mean Ipt Effective Strain
в
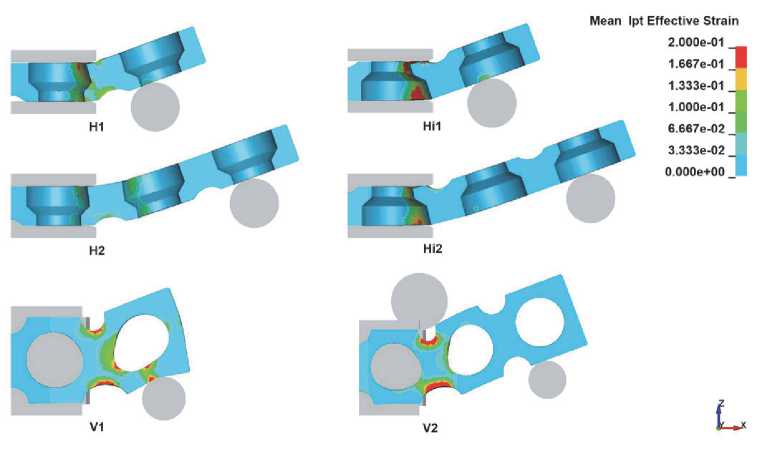
Рис. 5. Распределение интенсивности деформаций в центральном сечении заготовки для различных схем гибки и углов изгиба: 10° (а), 15° (б) и 20° (в)
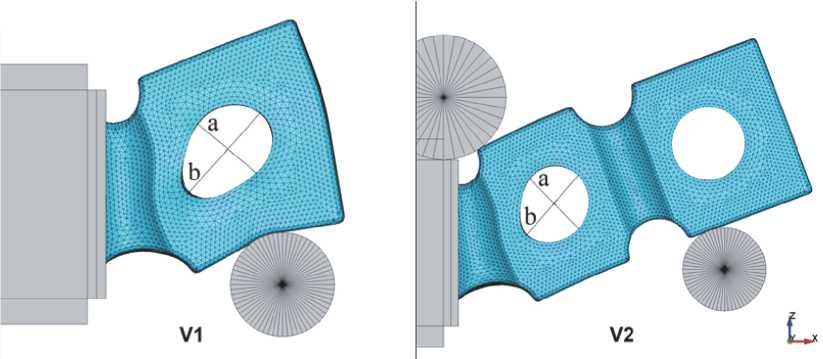
Рис. 6. Искажение формы отверстий при гибке по схемам V1 и V2 (угол гибки 20°)
не заготовки, а значит и к уменьшению усилия (в среднем в 1,1-1,5 раза).
Для каждой схемы угол упругой разгрузки практически не зависит от угла изгиба и определяется только упругими свойствами заготовки и размерами очага деформации. Так с увеличением длины плеча изгиба происходит и увеличение угла упругой разгрузки (в среднем на 1-3°). Для вертикальной и горизонтальной схемы гибки максимальный угол упругой разгрузки соответствует схемам с наибольшей длиной плеча изгиба (H2 и Hi2, V2). Расположение поперечной проточки (схемы H1 и Hi1, H2 и Hi2) практически не влияет на угол упругой разгрузки.
Распределение интенсивности деформации по сечению заготовки в конце первого этапа (0,8 с) приведено на рис. 5. Максимальные интенсивности деформаций соответствуют схемам H1, Hi1 и V1 с минимальным плечом изгиба. Схемы Hi1 и Hi2, когда изгиб осуществляется поперечной проточкой во внутрь, характеризуются меньшими деформациями по сравнению со схемами H1 и H2. С увеличением угла изгиба происходит рост значений интенсивности деформаций для всех рассматриваемых схем. Пластическая деформация начинается с наружных слоев заготовки и с увеличением угла изгиба глубже проникает внутрь заготовки.
В вертикальных схемах из-за характерной конструкции протеза наблюдаются максимальные интенсивности деформаций, что в свою очередь приводит к искажению формы отверстий в ячейках уже при малых углах изгиба (рис. 6). Важность сохранения круглой формы связана с тем, что через эти отверстия происходит крепление имплантата. Значительное изменение размеров отверстия может приводить к невозможности крепления. По результатам моделирования определен предельный угол изгиба, при котором диаметр отверстия искажается не более чем на 10%. Для схемы V1 предельный угол равен 12,6°, а для V2 – 25°.
ЗАКЛЮЧЕНИЕ
В статье проведено сравнение шести схем гибки, соответствующих различным направлениям изгиба, различным углу и плечу изгиба. Полученные результаты позволили изучить особенности процесса, оценить его силовые характеристики, упругое пружинение после гибки, которые необходимы для разработки оборудования для гибки персонифицированных имплантатов.
Результаты настоящего исследования показывают, что схемы H2 и Hi2 являются наиболее подходящими для гибки персонифицированных имплантатов и могут использоваться для разработки высокоточного и энергоэффективного оборудования. Использование схем V1 и V2 не рекомендуется и требует осторожного применения, поскольку данные схемы приводят к нарушению формы отверстий, предназначенных для крепления имплантата. В качестве альтернативы можно использовать другие L-образные модели перфорированных титановых пластин.
Исследование выполнено в рамках Губернского гранта в области науки и техники (Соглашение № 457 от 12.08.2021 г.).
Список литературы Моделирование процесса гибки персонифицированных имплантатов, используемых при реконструкции дефектов нижней челюсти
- Клинические рекомендации (протоколы лечения): "Перелом нижней челюсти") / ред. совет: Дробышев А.Ю., Малый А.Ю., [и др.]. - Москва: Московский Государственный медико-стоматологическим университет им. А. И. Евдокимова Минздрава РФ.
- Методика реконструкции челюстно-лицевой области с использованием индивидуальных имплантатов из биоактивной керамики / Д.Е. Кульбакин, Е.Л. Чойнзонов, С.Н. Кульков, С.П. Буякова, В.И. Чернов, М.Р. Мухамедов, А.С. Буяков // Опухоли головы и шеи. 2017. № 7(4). С. 29-34. DOI: 10.17650/2222-1468-2017-7-4-29-34
- Распространенность различных видов переломов нижней челюсти у взрослых / В.А. Шашков, И.В. Гайворонский, М.Г. Гайворонская [и др.] // Вятский медицинский вестник. - 2021. - № 1(69). - С. 41-47. - DOI: 10.24411/2220-7880-2021-10149
- Эндопротезирование нижней челюсти имплантатами из пористого никелида титана / В.К. Поленичкин, Ф.Т. Темерханов, А.В. Поленичкин, В.Э. Гюнтер // Медицина в Кузбассе. - 2004. - Т. 3. - № 1. - С. 27-31.
- Морфологическая оценка остеоинтеграции при замещении дефекта нижней челюсти имплантатами, изготовленными с применением аддитивных технологий. Экспериментальное исследование / А.А. Долгалев, Д.С. Святославов, В.А. Путь [и др.] // Медицинский алфавит. - 2019. - Т. 1. - № 5(380). - С. 63-68. - DOI: 10.33667/2078-5631-2019-1-5(380)-63-68
- Патент № 2523353 C1 Российская Федерация, МПК A61B 17/24. Способ костной пластики нижней челюсти: № 2013111277/14; заявл. 14.03.2013; опубл. 20.07.2014 / И.М. Байриков, А.Е. Щербовских.


