Модификация метода количественной оценки биопленкообразующей способности микроорганизмов с использованием сафранина
Автор: Антоневский И.В., Плешакова В.И., Лещёва Н.А.
Рубрика: Ветеринария
Статья в выпуске: 4 т.264, 2025 года.
Бесплатный доступ
Биопленки представляют собой организованные сообщества микроорганизмов. Существование в такой форме опосредует их повышенную устойчивость к антибиотикам, дезинфектантам, иммунной системе. Стандартный метод количественной оценки способности бактерий продуцировать биопленку, включающий определение оптической плотности биомассы в микротитровальном планшете, основан на окрашивании биопленки кристаллическим фиолетовым. Использование данного красителя имеет ряд ограничений, среди которых вариабельность экстракции и требования к технике безопасности. Цель исследования – модифицировать методику оценки биопленкообразующей способности микроорганизмов путем применения сафранина в качестве альтернативного индикаторного красителя и провести сравнительный анализ результатов с классическим методом. Исследование выполнено на клинических изолятах Escherichia coli (n=5) и Staphylococcus aureus (n=5), а также эталонных контрольных штаммах. Определение способности культур к биопленкообразованию проводили количественным методом определения этого показателя в микротитровальных планшетах. В рамках методики осуществляли параллельное сравнение получаемых показателей с использованием сафранина и классическим методом окрашивания кристаллическим фиолетовым, для этого каждый эксперимент выполняли в парных независимых планшетах. Окрашивание сафранином обеспечивало систематически более высокие значения оптической плотности (средний прирост составил 0,09; 10,2%), что было статистически значимо (t=5,16; p=0,00059). Между методами выявлена высокая положительная корреляция (r=0,96; p<0,001). В 90% случаев классификация степени адгезии оставалась согласованной, при этом сафранин продемонстрировал лучшую воспроизводимость для большинства штаммов. Полученные результаты подтверждают перспективность сафранина как альтернативного красителя для количественной оценки биопленок. Модифицированный метод может быть внедрен в рутинные лабораторные исследования после валидации и стандартизации, а также использоваться в скрининге антимикробных и антибиопленочных препаратов.
Биопленки, бактерии, микропланшетные анализы, красители, сафранин, кристаллический фиолетовый, спектрофотометрия
Короткий адрес: https://sciup.org/142246738
IDR: 142246738 | УДК: 619:579.61:57.086.83 | DOI: 10.31588/2413_4201_1883_4_264_6
Текст научной статьи Модификация метода количественной оценки биопленкообразующей способности микроорганизмов с использованием сафранина
Введение. Биопленки представляют собой сложные сообщества микроорганизмов, погруженных в внеклеточный матрикс, состоящий из полисахаридов, белков, липидов и внеклеточной ДНК [1]. Такая форма организации обеспечивает микроорганизмам не только физическую адгезию к поверхностям, но и существенное функциональное преимущество, обуславливая повышенную устойчивость к антимикробным агентам, иммунному ответу организма-хозяина и неблагоприятным физикохимическим условиям окружающей среды [2, 3, 4]. В ветеринарной медицине роль биопленок особенно значима, поскольку они формируются как на слизистых покровах и эпителии пищеварительного и дыхательного трактов животных, так и на поверхностях ветеринарных инструментов и технологических устройств (катетеров, имплантатов, доильного оборудования), в поильных и кормовых системах, а также на коже и шерсти животных [5, 6, 7]. С точки зрения эпизоотологии и клинической ветеринарной практики, способность микроорганизмов образовывать биопленки усложняет лечение больных животных и профилактику бактериальных инфекций, снижает эффективность санитарно-профилактических мероприятий и усложняет контроль качества продукции животного происхождения [8, 9].
Учитывая клиническую и прикладную значимость биопленок микроорганизмов, критически важно иметь валидные, чувствительные и воспроизводимые лабораторные методы их количественной оценки. Метод моделирования образования биопленок в микротитроваль-ных планшетах с окрашиванием биопленки кристаллическим фиолетовым, предложенный Christensen et al. (1985), остается широко используемым стандартом благодаря простоте и относительной низкой стоимости, однако на практике он демонстрирует ряд ограничений, которые снижают информативность и воспроизводимость метода [10]. Например, это связано с вариабельностью процесса экстракции красителя и связанные с этим колебания оптических показателей, трудности интерпретации результатов при наличии слабопродуцирую-щих штаммов, а также повышенные требования к технике безопасности при работе с реагентом. В таких условиях поиск альтернативных индикаторных красителей имеет как теоретическое, так и практическое оправдание, поскольку изменение химии взаимодействия красителя с компонентами внеклеточного матрикса может привести к повышению контрастности, устойчивости окрашивания и уменьшению вариабельности измерений.
Сафранин как катионный краситель демонстрирует основания для такой замены: его способность связываться с полисахаридами и белками матрикса потенциально обеспечивает более однородное и устойчивое окрашивание биопленок, что может повысить чувствительность метода при выявлении тонких и слабо-окрашенных слоев биопленки [11, 12]. Практическая значимость выражается в возможности внедрения модифицированного протокола в рутинные лабораторные и научные исследования: более воспроизводимый и чувствительный метод позволит точнее оценивать эффект антимикробных препаратов, тестировать био-пленкоразрушающие соединения и улучшить скрининг штаммов по биопленкообразующей способности.
Цель исследования - совершенствование метода количественного анализа биопленко-образующей способности микроорганизмов путем замены кристаллического фиолетового на сафранин в качестве красителя.
Условия, материалы и методы. Исследование выполняли на базах кафедры ветеринарной микробиологии, инфекционных и инвазионных болезней факультета ветеринарной медицины ИВМиБ Омского ГАУ, бактериологического отдела БУ «Омская областная ветеринарная лаборатория» с использованием клинических изолятов микроорганизмов, выделенных от животных. В качестве эталонных кон-тролей применяли культуры Staphylococcus aureus и Escherichia coli с заведомо известной биопленкообразующей способностью.
Для культивирования использовали стерильные полистироловые микротитровальные 96-луночные планшеты с плоским дном. В качестве питательной среды применяли мясопептонный бульон (МПБ). Для стафилококков в среду добавляли 1% глюкозы для стимулирования образования внеклеточного полисахаридного матрикса. Суточные культуры микроорганизмов готовили инокуляцией единичной петли культуры в 5 мл соответствующей среды с последующей инкубацией при 37 °C в течение 24 ч. Перед постановкой опыта плотность суспензии стандартизовали до 0,5 по шкале МакФарланда (1,5×108 КОЕ/мл) с последующим разведением 1:32 в свежей питательной среде. В рамках методики было предусмотрено не только применение сафранина в качестве альтернативного индикаторного красителя, но и параллельное сравнение получаемых показателей с классическим методом окрашивания кристаллическим фиолетовым для валидации предлагаемой модификации. Для этого каждый эксперимент выполняли в парных независимых планшетах. Из одной и той же культуры микроорганизмов готовили единый стандартный рабочий инокулят (после разведения 1:32), который равномерно распределяли по двум идентичным микропланшетам. Во всех параллельных сериях соблюдали идентичные условия инкубации, промывок и сушки.
В лунки микропланшета вносили 200 мкл подготовленной рабочей суспензии. Для каждого штамма использовали по три технических повторов в одном планшете, каждый эксперимент повторяли трижды в разные дни для получения независимых релевантных результатов. В качестве отрицательных контролей использовали лунки с чистой питательной средой (без бактериального инокулята), а в качестве внутреннего положительного контроля дополнительно инокулировали культуру с заведомо известной выраженной степенью биопленкообразования. Инкубацию планшетов проводили статически при 37 °C в течение 24 ч. По окончании инкубации содержимое лунок аккуратно удаляли, лунки промывали трижды по 200 мкл стерильным фосфатнобуферным раствором (pH 7,2), после чего планшеты высушивали при комнатной температуре в течение 40-60 мин. Для окрашивания использовали рабочий раствор красителя (сафранина/кристаллического фиолетового в концентрации 0,1%) и в каждую лунку вносили по 200 мкл раствора, выдерживали 15 мин при комнатной температуре. Затем краситель удаляли, лунки промывали трижды фосфатносолевым буфером и снова высушивали при комнатной температуре до полного высыхания. Для количественного считывания окрашенную биомассу экстрагировали растворителем: в каждую лунку вносили 200 мкл 95% этилового спирта и выдерживали 15 мин с периодическим встряхиванием для полного растворения связанного красителя. Затем 200 мкл экстракта переносили в чистый 96-луночный планшет для измерения оптической плотности (ОП) окрашенной биомассы (рис. 1).
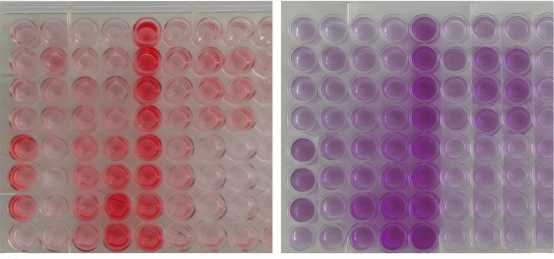
а) б)
Рисунок 1 – Определение биопленкообразующей способности микроорганизмов в парных планшетах: а) окраска сафранином; б) окраска кристаллическим фиолетовым
Оптическую плотность измеряли на планшетном фотометре ELx 808 («BioTek Instruments Inc.», США) при длине волны 490 нм. Дополнительно оценивали критические диагностические характеристики модифицированного метода: чувствительность и специфичность по отношению к эталонной классификации био-пленкообразования (на основе положительных контрольных штаммов), а также согласованность категориальной классификации исследуемых штаммов по степеням адгезии, предложенным S. Stepanović et al. (2000) [13]. Степень биопленкообразования определяли путем сравнения среднего значения оптической плотности тестовых лунок с контрольными значениями (отрицательный контроль и фон) и последующей классификации на категории. Пороговые значения были установлены отдельно для каждого красителя из-за систематического различия в абсолютных значениях ОП (табл. 1).
Таблица 1 – Критерии классификации степени адгезии исследуемых культур
|
Степень адгезии |
Кристаллический фиолетовый (ОП) |
Сафранин (ОП) |
|
Отсутствует |
≤0,07 |
≤0,09 |
|
Слабая |
0,07<ОП≤0,25 |
0,09<ОП≤0,30 |
|
Средняя |
0,25<ОП≤0,50 |
0,30<ОП≤0,60 |
|
Выраженная |
>0,50 |
>0,60 |
Примечание: «ОП» – оптическая плотность
Сравнение величин оптической плотности, полученных при окрашивании сафранином и кристаллическим фиолетовым, выполняли с использованием парного t-критерия Стьюдента, так как обе серии измерений относились к одним и тем же штаммам, исследованным в одинаковых условиях. Для каждой пары значений рассчитывали разницу ΔОП, после чего определяли среднее значение разницы и стандартное отклонение.
Статистическая обработка экспериментальных данных выполнялась в Microsoft Office Excel и STATISTICA v.12.
Результаты и обсуждение. В ходе исследования была проведена сравнительная оценка биопленкообразующей способности 10 клинических изолятов (5 культур Escherichia coli и 5 культур Staphylococcus aureus ) и контрольных штаммов с использованием двух красителей: кристаллического фиолетового и сафранина (табл. 2).
Таблица 2 – Сравнительная оценка оптической плотности и степени адгезии культур E. coli и S. aureus при окрашивании кристаллическим фиолетовым и сафранином
|
№ |
Культура |
Краситель, ОП±SD |
|||
|
Кристаллический фиолетовый |
Степень адгезии |
Сафранин |
Степень адгезии |
||
|
1 |
E. coli |
0,55±0,06 |
Выраженная |
0,62±0,07 |
Выраженная |
|
2 |
E. coli |
0,32±0,10 |
Средняя |
0,37±0,09 |
Средняя |
|
3 |
E. coli |
0,95±0,12 |
Выраженная |
1,05±0,10 |
Выраженная |
|
4 |
E. coli |
0,48±0,05 |
Средняя |
0,55±0,04 |
Средняя |
|
5 |
E. coli |
0,30±0,04 |
Средняя |
0,41±0,04 |
Средняя |
|
6 |
S. aureus |
0,18±0,03 |
Слабая |
0,26±0,02 |
Слабая |
|
7 |
S. aureus |
0,42±0,06 |
Средняя |
0,50±0,05 |
Средняя |
|
8 |
S. aureus |
0,12±0,02 |
Слабая |
0,18±0,02 |
Слабая |
|
9 |
S. aureus |
0,45±0,07 |
Средняя |
0,70±0,04 |
Выраженная |
|
10 |
S. aureus |
0,08±0,02 |
Слабая |
0,15±0,02 |
Слабая |
|
11 |
Контроль + ( S. aureus ) |
1,35±0,11 |
Выраженная |
1,40±0,09 |
Выраженная |
|
12 |
Контроль – ( S. aureus ) |
0,04±0,06 |
— |
0,06±0,03 |
— |
|
13 |
Контроль + ( E. coli ) |
0,78±0,11 |
Выраженная |
0,81±0,07 |
Выраженная |
|
14 |
Контроль – ( E. coli ) |
0,03±0,02 |
— |
0,04±0,01 |
— |
|
15 |
Фон |
0,02±0,01 |
— |
0,02±0,01 |
— |
Примечание: «ОП» – оптическая плотность; «SD» – стандартное отклонение; «Контроль +» – биопленкообразующий штамм; «Контроль –» – небиопленкообразующий штамм; «—» – не наблюдали.
В ходе проведенных измерений ОП выявили систематическое превышение значений при использовании сафранина по сравнению с кристаллическим фиолетовым, которое наблюдали для всех тестовых штаммов. Средняя разница ΔОП составила 0,08±0,03, с диапазоном от 0,02 до 0,25. Наибольшее различие зафиксировано для изолята S. aureus №9 (ЛОП=0,25).
Применение специфичных пороговых значений для каждого красителя обеспечило согласованную классификацию степени адгезии для 90% изолятов. Единственное расхождение отмечено для штамма S. aureus №9, который классифицировали по этому показателю как «средний» при окрашивании кристаллическим фиолетовым (ОП=0,45) и отметили степень биопленкообразования как «выраженную» при использовании сафранина (ОП=0,70).
Анализ воспроизводимости метода показал, что для 7 из 10 тестовых штаммов (70%)
стандартное отклонение (SD) при окрашивании сафранином было ниже или равно SD, полученному с кристаллическим фиолетовым.
Контрольные образцы продемонстрировали корректную работу метода. Положительные контроли (заведомо известные биоплен-кообразующие штаммы) показали высокие значения ОП и их степень адгезии была классифицирована как «выраженная», а отрицательные контроли (заведомо известные небио-пленкообразующие штаммы) показали значения ОП близкие к фоновым. Фоновые значения ОП для обоих красителей оставались стабильно низкими и составили 0,02±0,01 (рис. 2).
□ Кристаллический фиолетовый■ Сафранин
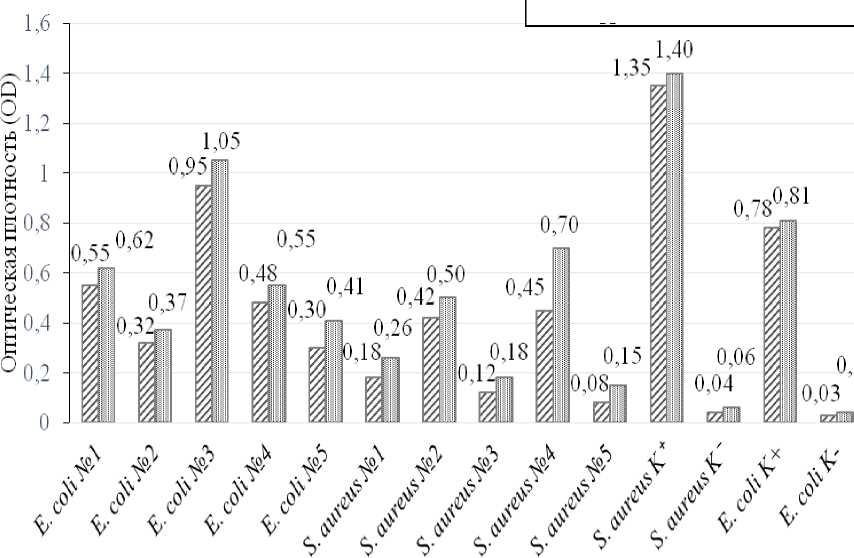
Рисунок 2 - Сравнительная оценка средней ОП культур E. coli и S. aureus , полученная с использованием кристаллического фиолетового и сафранина
Сравнительный парный анализ средних значений оптической плотности для тестовых культур показал статистически значимое превышение сигналов при использовании сафранина по сравнению с кристаллическим фиолетовым (t=5,16; p=0,00059). Средний прирост ОП составил 0,094±0,058 (10,2%). Этот эффект наблюдался для всех исследованных штаммов, причем наибольшая разница между методами отмечена для Staphylococcus aureus №9 (ЛОП=0,25). Полученные данные подтверждают, что модифицированный метод не только воспроизводит результаты классической вариации, но и в ряде случаев обеспечивает более высокий уровень детекции биопленкообразования.
Для оценки согласованности количественных данных, полученных с использованием сафранина и кристаллического фиолетового в качестве индикаторных красителей, была определена их корреляция. Анализ основывался на средних значениях ОП, рассчитанных для каждого исследуемого штамма по результатам трех независимых экспериментов.
На рисунке 3 представлена корреляция между значениями оптической плотности, полученными при использовании кристаллического фиолетового и сафранина. Статистический анализ выявил сильную положительную корреляцию между методами (коэффициент корреляции Пирсона r=0,96; p<0,001). Систематическое смещение точек выше линии тождества демонстрирует повышенную чувствительность метода с сафранином, особенно выраженную для образцов со слабой и средней биоплен-кообразующей способностью (значения ОП<0,5).
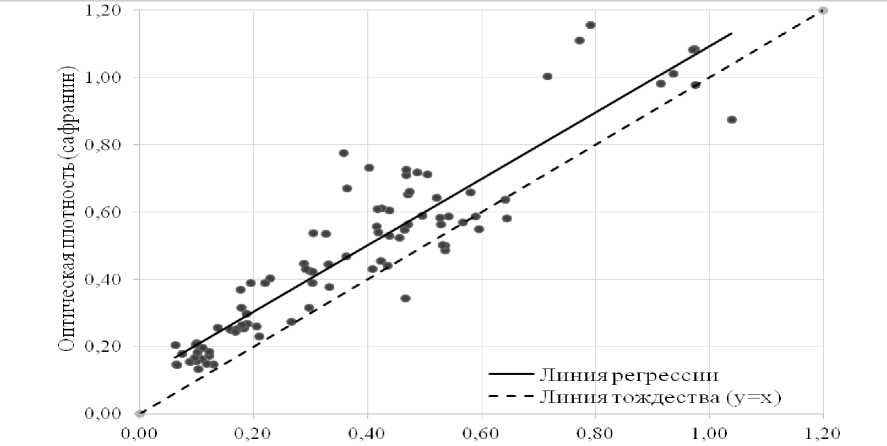
Оптическая плотность (кристаллический фиолетовый)
Рисунок 3 – Корреляция значений оптической плотности при окрашивании биопленок кристаллическим фиолетовым и сафранином
Важно отметить, что распределение точек демонстрирует большую вариабельность измерений для штаммов со средней биопленко-образующей способностью (значения ОП 0,20,5), что может быть связано с гетерогенностью структуры биопленки. При этом для штаммов с выраженной биопленкообразую-щей способностью (ОП>0,5) наблюдается более тесная группировка точек, что свидетельствует о лучшей воспроизводимости метода при оценке плотных биопленок.
В эксперименте продемонстрировано, что использование сафранина в модифицированном методе количественной оценки биоплен-кообразующей способности в микротитро-вальных планшетах дает систематически более высокие значения оптической плотности (ОП) по сравнению с классическим окрашиванием кристаллическим фиолетовым при длине волны 490 нм. Средний прирост ОП при переходе на сафранин составил 0,09 (10,2%) и был статистически значим (t=5,16; p=0,00059). При этом между значениями, полученными двумя методами, выявлена очень высокая положительная корреляция (коэффициент Пирсона r=0,96; p<0,001).
Полученные результаты позволяют выделить несколько ключевых наблюдений. Во-первых, повышение уровня сигнала при окрашивании сафранином носит систематический характер и отмечалось для всех изученных штаммов (диапазон ΔОП составил от 0,02 до 0,25), что указывает на отличия в физикохимическом взаимодействии красителя с компонентами внеклеточного матрикса биопленки. В качестве возможного объяснения можно предположить более выраженное сродство сафранина к полисахаридам и белковым компонентам матрикса, его лучшую проницаемость в тонкие слои биопленки. Во-вторых, применение отдельных пороговых значений для каждого красителя позволило достичь согласованной классификации степени адгезии для 90% изолятов; единственным расхождением стала культура S. aureus №9, уровень адгезии которой классифицирован как «средний» при окрашивании кристаллическом фиолетовом и как «выраженный» при использовании сафранина. Этот пример иллюстрирует, что сафранин может повысить чувствительность метода и способен выявлять слабые или близкие к пограничным биопленкообра-зующие штаммы, не входящие в пределы обнаружения при классическом методе окрашивания.
Анализ воспроизводимости показал преимущество сафранина у большинства штаммов, поскольку для 70% тестовых штаммов стандартное отклонение при окрашивании сафранином было ниже или равно таковому при сравнении двух красителей. Это указывает на потенциально лучшую стабильность сигнала при использовании сафранина, что важно при проведении сравнительных серийных измерений.
Полученные результаты сопоставимы с рядом работ, в которых сафранин рассматривается в качестве альтернативы кристаллическому фиолетовому в контексте изучения биопленок микроорганизмов. В работе P. Ommen et al. (2017) авторы показывают, что сафранин дает сопоставимые с кристаллическим фиолетовым результаты, при этом отмечается более высокая воспроизводимость измерений при его использовании [14].
Наше наблюдение о том, что сафранин дает более высокие значения ОП (определяя повышающую чувствительность для слабых продуцентов биопленки), также подтверждается в экспериментальных исследованиях других авторов. Например, в исследовании X. Wu et al., (2014) авторы также отмечают, что окрашивание сафранином в ряде условий оказывалось более чувствительным, чем использование кристаллического фиолетового [15].
Ряд обзорных публикаций подчеркивает, что использование кристаллического фиолетового остается «золотым стандартом» для количественного определения биопленки, но одновременно указывает на ограничения этого метода (токсичность, вариабельность экстракции, чувствительность к протоколу промывки и экстракции), что делает оправданным поиск альтернатив и сравнение методов [15, 16].
Систематическое получение более высоких показателей ОП при окрашивании биопленок сафранином может быть обусловлено несколькими причинами: более выраженным сродством сафранина к компонентам внеклеточного матрикса, отличиями в проницаемости красителей в тонкие слои биопленки или различиями в эффективности экстракции красителя 95% этанолом. Эти факторы обсуждаются в литературе как возможные источники различий изучаемых методик [16, 17].
Выводы. Модифицированный микротит-ровальный тест с использованием сафранина показал воспроизводимые результаты классического метода с кристаллическим фиолетовым и при этом стабильно более высокие значения оптической плотности (средний прирост составил 0,09; 10,2%), что явилось статистически значимо (t=5,16; p=0,00059). Между показателями двух методов выявлена высокая положительная корреляция (коэффициент Пирсона r=0,96; p<0,001), а для 90% исследованных изолятов категорическая оценка степени адгезии оставалась согласованной. Для 70% штаммов при окрашивании сафранином наблюдалась равная или меньшая вариабельность полученных значений, что указывает на потенциально лучшую воспроизводимость метода.
Для широкого практического внедрения предлагаемой модификации необходима дальнейшая валидация, включающая расширение исследуемых видов микроорганизмов, оптимизацию параметров протокола (концентрации сафранина, времени окрашивания, выбора растворителя для экстракции) и установление стандартизированных пороговых значений.
Использование сафранина показало себя как перспективная и практично применимая альтернатива для количественной оценки биопленкообразования. Его использование обеспечивает сопоставимую с кристаллическим фиолетовым классификацию штаммов, повышенную чувствительность в отдельных случаях и хорошую воспроизводимость, что делает его инструментом для скрининга биопленкообразующих штаммов и оценки эффективности антибиопленочных средств.


