Молекулярно-генетическое разнообразие коллекции 14 линий - доноров устойчивости подсолнечника к расе G заразихи на основе изоферментных и SSR-локусов
Автор: Гучетль Саида Заурбиевна, Антонова Татьяна Сергеевна, Арасланова Нина Михайловна, Челюстникова Татьяна Аркадьевна, Питинова Юлия Владимировна
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 1 (189), 2022 года.
Бесплатный доступ
Подсолнечник - основная масличная культура в Российской Федерации. Один из главных факторов, снижающих его урожайность, - поражение заразихой. Наиболее эффективным средством борьбы с паразитом является селекция устойчивых форм подсолнечника. Цель данной работы провести генотипирование и анализ молекулярно-генетического разнообразия на основе изоферментных и SSR-локусов коллекции линий - доноров устойчивости подсолнечника к расе G заразихи, выведенных в ФГБНУ ФНЦ ВНИИМК. Материалом для исследования служили 14 линий - доноров устойчивости к этой расе разного происхождения: 2RGB, 2RGNV, 2RGA, 2RGN, 2RGS, RGL1, RGL2, RGP1, RGP2, RGB, RGN, RGM, RGA, RG. Выделение ДНК осуществляли из семядольных листьев семидневных этиолированных проростков подсолнечника СТАВ-способом. Для генотипирования применили 15 микросателлитных локусов и 4 изоферментные системы. Показатели дискриминационного потенциала использованной системы из 15 микросателлитных локусов вычисляли по стандартным формулам. Кластерный анализ выполнен методом Ward в программе Statisticа 6.0. С помощью проведенного исследования идентифицировано 14 линий-доноров. Уникальность коллекции, выявленная при помощи анализа изоферментных систем, составила 64 %, а при помощи микросателлитных локусов - 100 %. Дискриминационный потенциал системы ДНК-маркеров оценен как средний. По результатам кластерного анализа все линии были разделены на две группы. Максимальная дистанция между линиями составила 7,4. Несмотря на то, что изученные линии объединены одним общим признаком - устойчивостью к расе G заразихи, молекулярные признаки у них отличаются. Благодаря разному генетическому фону данные линии могут быть использованы в качестве источников дополнительного разнообразия при вовлечении их в селекционные программы по созданию подсолнечника, устойчивого к расе G заразихи.
Подсолнечник, заразиха, раса g, доноры, устойчивость, молекулярные маркеры, днк, изоферменты, микросателлиты, генотипирование, разнообразие
Короткий адрес: https://sciup.org/142235145
IDR: 142235145 | УДК: 633.854.78:591.151:543.9 | DOI: 10.25230/2412-608X-2022-1-189-3-10
Текст научной статьи Молекулярно-генетическое разнообразие коллекции 14 линий - доноров устойчивости подсолнечника к расе G заразихи на основе изоферментных и SSR-локусов
Acknowledgements. The research was conducted under financial support of the RFFR and the Government of the Krasnodar region, grant project No 19-44230025 “Genetic control of the resistance to broomrape race G in sunflower lines of the different origin”.
Введение. Биотические факторы – одна из главных причин снижения урожайности ценной масличной культуры – подсолнечника. К ним относятся возбудители таких болезней, как ложная мучнистая роса, ржавчина, сухая гниль корзинки, фомоз, бактериоз и другие, а также заразиха. Сотрудники ФГБНУ ФНЦ ВНИИМК ежегодно проводят мониторинг болезней на гибридах и сортах подсолнечника и определяют их возбудителей [1; 2; 3]. Для снижения негативного последствия, вызываемого этими патоге- нами, применяются различные агротехнические приемы, а также обработка семян и посевов пестицидами [4; 5; 6]. Но наиболее эффективным средством остается селекция устойчивых форм подсолнечника. С помощью селекции получают гибриды подсолнечника, резистентные к основным патогенам [7; 8]. За последние десятилетия в южных регионах России появились новые вирулентные расы заразихи, которые поражают ранее устойчивые отечественные и зарубежные сорта и гибриды подсолнечника. Как ответная мера, создаются линии и гибриды подсолнечника, устойчивые к расе G заразихи. Так, сотрудниками ФГБНУ ФНЦ ВНИИМК получены линии-доноры разного происхождения, устойчивые к расе G заразихи [9]. Созданы также устойчивые к этой расе селекционные линии с разной продолжительностью периода от всходов до цветения, различающиеся по высоте и масличности [3]. Требования к исходному селекционному материалу для производства новых гибридов включают наличие максимального биологического разнообразия. Линии – доноры устойчивости подсолнечника к расе G заразихи могут служить источником этого разнообразия. Ранее были проведены испытания этих линий на отличимость, однородность и стабильность. Показано, что линии различались между собой по ряду морфологических и других признаков, таких как продолжительность периода от всходов до цветения растений, высота растений, форма и окраска листа и язычкового цветка и т. д. [10]. Дополнительную характеристику генетического разнообразия могут дать молекулярные маркеры, по которым данная коллекция линий еще не изучена. Молекулярные маркеры во всем мире признаны значимым инструментом изучения генетического разнообразия культурных растений. Например, с помощью основных типов молекулярных маркеров (RFLP, RAPD, SSR, ISSR, AFLP, SCAR, SSCP, ретро-транспозонные маркеры и т. д.) исследо- вано межвидовое и внутривидовое генетическое разнообразие Rubus L., RAРD- и SSR-маркеров – внутри- и межвидовой полиморфизм видов рода Aegilops L., SSR-маркеров – генетический пул фруктовых культур, выполнен анализ генетического сходства гибридных форм винограда [11; 12; 13; 14].
Целью данной работы является генотипирование и анализ молекулярногенетического разнообразия на основе изоферментных и SSR-локусов коллекции линий – доноров устойчивости подсолнечника к расе G заразихи, выведенных в ФГБНУ ФНЦ ВНИИМК.
Материалы и методы . Материал для исследования – 14 линий-доноров разного происхождения, устойчивых к расе G заразихи: 2RGB, 2RGNV, 2RGA, 2RGN, 2RGS, RGL1, RGL2, RGP1, RGP2, RGB, RGN, RGM, RGA, RG [9].
Изоферменты экстрагировали гомогенизацией части семядоли сухой семянки в 20 мкл 0,1 М трис-HCl буфера с добавлением 0,1%-ного поливинилпирролидона. Электрофорез выполняли в 12%-ном крахмальном геле с добавлением 2,04 % сахарозы. Для электрофоретического разделения изоферментов использовали гистидин-цитратный буфер pH 5,7. После электрофореза гелевая пластина разрезалась тонкой нихромовой нитью на три среза. Выявление зон энзиматической активности изоферментных систем эстеразы (EST), малатдегидрогеназы (MDH), глюкозофосфатдегидрогеназы (GPI) и 6-фосфоглюконатдегидрогеназы (PGD) проводилось окрашиванием по стандартным прописям у С. Vallejos [15].
Выделение ДНК осуществляли из семядольных листьев семидневных этиолированных проростков подсолнечника СТАВ-способом. Для проведения ПЦР использовали 25 мкл реакционной смеси следующего состава: 67 мМ трис-HCl, рН 8,8; 16,6 мM сульфата аммония; 1,5– 3 мM MgCl 2 ; 0,01%-ный Tween 20; по 0,2 мM дезоксирибонуклеозидфосфатов; по 10 пМ праймеров; 10 нг матричной ДНК и 1 ед. рекомбинантной термостабильной ДНК полимеразы (Сибэнзим,
Москва). Для амплификации применяли термоциклер S1000тм (BioRad, США). Условия амплификации: начальная денатурация при 96 °С в течение 2 мин; затем 30 циклов при соблюдении температурновременного режима: отжиг при 55–60 °С в течение 40 с, элонгация – 1 мин при 70 °С, денатурация при 94 °С – 30 с, финальная элонгация – 2 мин. Для генотипирования применили 15 известных микросателлитных локусов [16; 17].
Электрофорез продуктов амплификации проводили в 2%-ном агарозном (1 х SB-буфер) и 8%-ном полиакриламидном геле (1 х ТBЕ-буфер) с использованием камер для горизонтального (SE.2, ДНК-технология, Россия) и вертикального (VE.2, ДНК-технология, Россия) электрофореза. Последующее окрашивание осуществляли бромистым этидием. Визуализация результатов электрофореза в ультрафиолетовом свете и их документирование обеспечивались при помощи системы цифровой документации видеоизоб-ражения BIO-PRINT (Vilber Lourmat, Франция).
Индекс полиморфного содержании (PIC) и эффективное число аллелей (n e ) для всех линий в целом вычисляли по стандартным формулам:
PlCi =1-^]=iPij2, ne=1/ 2^=1 Pij2, где Р частота j паттерна для локуса i и суммирование распространяется на n паттернов.
Кластерный анализ выполнен методом Ward с использованием эвклидовых дистанций в программе Statisticа 6.0.
Результаты и обсуждение. Характеристика линий по биохимическим маркерам была осуществлена по четырем полиморфным изоферментным локусам: эстеразе (EST), малатдегидрогеназе (МDH), 6-фосфоглюконатдегидрогеназе (6PGD) и глюкозофосфатизомеразе (GPI). Выявлено по два аллеля на локус. По всем исследуемым инбредным линиям были составлены изоферментные паспорта (табл. 1). Анализ биохимических ха-5
рактеристик линий показал, что они делятся на девять групп, отличающихся друг от друга. Первая группа объединила линии 2RGA и RGN. Во вторую группу вошли линии RGL1, 2RGS. Третья включает RGA, RGP1, RGM. Четвертая – 2RGB и RGB. Линии RG, RGP2, 2RGN, RGL2 и 2RGNV отличались уникальным составом аллозимов. Уникальность анализируемой коллекции линий составила 64 %.
Таблица 1
Изоферментные фенотипы 14 линий – доноров устойчивости подсолнечника к расе G заразихи
|
Линия |
Изофермент |
|||
|
EST |
MDH |
GPI |
PGD |
|
|
2RGA |
FF* |
FF |
SS |
SS |
|
RGN |
FF |
FF |
SS |
SS |
|
RGL1 |
FF |
SS |
FF |
SS |
|
2RGS |
FF |
SS |
FF |
SS |
|
RGA |
SS |
SS |
FF |
SS |
|
RGP1 |
SS |
SS |
FF |
SS |
|
RGM |
SS |
SS |
FF |
SS |
|
2RGB |
SS |
FF |
FF |
SS |
|
RGB |
SS |
FF |
FF |
SS |
|
RGP2 |
SS |
SS |
FF |
FF |
|
RG |
SS |
FF |
FF |
FF |
|
2RGN |
SS |
FF |
SS |
SS |
|
RGL2 |
FF |
FF |
FF |
SS |
|
2RGNV |
FF |
FF |
SS |
FF |
* Примечание: SS – аллозим с медленной электрофоретической подвижностью, FF – аллозим с быстрой электрофоретической подвижностью
Поскольку для генотипирования по изоферментным системам используется небольшое число маркеров и количество аллозимных вариант не превышает двух, такая низкая уникальность коллекции вполне закономерна. Генотипирование коллекции по биохимическим признакам рассматривается нами как предварительное и дополнительное к анализу микроса-теллитных локусов ДНК. В результате анализа исследуемых линий по 15 микро-сателлитным локусам были получены специфичные фрагменты ДНК. Все использованные локусы были полиморфны в пределах изучаемой коллекции образцов, кроме локуса ORS553, у которого обнаружен лишь один аллель. При анализе электрофоретических спектров линий выявлена индивидуальность аллельного 6
состава каждой из них. Уникальность каждой линии в изученной группе составила 100 % (табл. 2).
Таблица 2
Аллельные состояния 15 микросателлитных локусов 14 линий – доноров устойчивости подсолнечника к расе G заразихи
|
Генотип |
SSR локусы |
||||||||||||||
|
ORS 5 |
ORS 1144 |
ORS 1287 |
HAR 432 |
ORS 509 |
ORS 553 |
HAR 1608 |
HAR 514 |
ORS 1043 |
ORS 1327 |
ORS 166 |
ORS 37 |
ORS 559 |
HAR 1796 |
ORS 815 |
|
|
2RGB |
307* |
141 |
192 |
164 |
210 |
135 |
235 |
180 |
183 |
192 |
358 |
185 |
122 |
232 |
212 |
|
2RGNV |
307 |
136 |
192 |
176 |
210 |
135 |
225 |
180 |
201 |
187 |
358 |
185 |
122 |
152 |
212 |
|
2RGA |
307 |
136 |
207 |
176 |
210 |
135 |
235 |
194 |
201 |
187 |
358 |
185 |
122 |
152 |
212 |
|
2RGN |
307 |
141 |
207 |
170 |
220 |
135 |
235 |
180 |
183 |
187 |
358 |
185 |
122 |
152 |
212 |
|
2RGS |
334 |
136 |
207 |
164 |
210 |
135 |
265 |
180 |
201 |
192 |
358 |
185 |
142 |
152 |
212 |
|
RGL1 |
334 |
136 |
192 |
164 |
220 |
135 |
265 |
194 |
183 |
187 |
358 |
185 |
142 |
152 |
212 |
|
RGL2 |
334 |
136 |
207 |
164 |
220 |
135 |
265 |
180 |
183 |
192 |
345 |
185 |
142 |
152 |
212 |
|
RGP1 |
334 |
136 |
207 |
176 |
220 |
135 |
265 |
180 |
183 |
187 |
345 |
185 |
142 |
232 |
240 |
|
RGP2 |
334 |
141 |
192 |
164 |
220 |
135 |
265 |
180 |
183 |
187 |
358 |
185 |
142 |
232 |
212 |
|
RGB |
334 |
141 |
192 |
164 |
220 |
135 |
265 |
170 |
183 |
187 |
345 |
185 |
142 |
152 |
212 |
|
RGN |
334 |
141 |
192 |
164 |
220 |
135 |
265 |
180 |
183 |
187 |
358 |
155 |
122 |
152 |
227 |
|
RGM |
334 |
136 |
192 |
176 |
210 |
135 |
235 |
180 |
201 |
187 |
358 |
185 |
142 |
232 |
212 |
|
RGA |
334 |
141 |
192 |
164 |
210 |
135 |
265 |
180 |
183 |
187 |
358 |
185 |
142 |
232 |
212 |
|
RG |
334 |
136 |
192 |
164 |
220 |
135 |
265 |
180 |
183 |
187 |
358 |
185 |
142 |
232 |
240 |
Для определения дискриминационного потенциала системы маркеров в пределах использованной коллекции линий вычисляли показатели: наблюдаемое число аллелей (n a ), эффективное число аллелей (n e ) индекс полиморфного содержания (PIC) (табл. 3).
Таблица 3
Дискриминационная сила системы
15 SSR-маркеров для 14 линий – доноров устойчивости к расе G заразихи
|
Локус |
Размер аллеля (п.н) |
n a |
n e |
PIC |
|
ORS5 |
307, 334 |
2 |
1,72 |
0,42 |
|
ORS1144 |
136, 141 |
2 |
1,96 |
0,49 |
|
ORS1287 |
192, 207 |
2 |
1,85 |
0,46 |
|
HAR432 |
164, 170, 176 |
3 |
2,01 |
0,50 |
|
ORS509 |
210, 220 |
2 |
1,96 |
0,49 |
|
ORS553 |
135 |
1 |
1 |
0 |
|
HAR1608 |
225, 235, 265 |
3 |
2,01 |
0,50 |
|
HAR514 |
170,180, 194 |
3 |
1,56 |
0,36 |
|
ORS1043 |
183, 201 |
2 |
1,72 |
0,42 |
|
ORS1327 |
187,192 |
2 |
1,51 |
0,33 |
|
ORS166 |
345, 358 |
2 |
1,51 |
0,33 |
|
ORS37 |
155, 185 |
2 |
1,07 |
0,07 |
|
ORS559 |
122, 142 |
2 |
1,85 |
0,46 |
|
HAR1796 |
152, 232 |
2 |
1,96 |
0,49 |
|
ORS815 |
212, 227, 240 |
3 |
1,56 |
0,36 |
|
Среднее |
2,2 |
1,68 |
0,38 |
Наибольший полиморфизм был выявлен у локусов HAR432 и HAR1608 (na 3, PIC 0,50 и ne 2,01). Наименьшим поли- морфизмом отличался ORS37 (na 2, PIC 0,07 и ne 1,07). Остальные локусы показали средний уровень полиморфизма (na равное 2–3, PIC от 0,36 до 0,50, ne от 1,56 до 2,00) (табл. 3).
Средние величины показателей информативности составили: n a 2,2, ne 1,68, PIC 0,38. Дискриминационная сила системы маркеров оценена как средняя. Эти результаты вполне согласуются с данными, полученными для коллекций культивируемого подсолнечника [18]. Рассчитанные нами величины характеризуют полиморфизм исследованных образцов коллекции как средний. Степень полиморфизма может существенно варьировать в зависимости от числа исследуемых генотипов и их генетического разнообразия. Образцы, использованные в нашей работе, имеют разное происхождение, но их количество невелико. Это может объяснять почему показатели информативности SSR-локусов невысокие.
Для выяснения генетических взаимоотношений внутри изучаемой группы линий применили технику кластеризации. Данные об аллельных состояниях микро-сателлитных локусов перевели в матрицу бинарных состояний. При выполнении иерархической кластеризации применили метод дисперсионного анализа для оценки расстояний между кластерами (метод Ward). Результаты кластерного анализа для 14 линий по 15 SSR-локусам приведены на рисунке 1.
Tree Diagram for 14 Cases Ward`s method
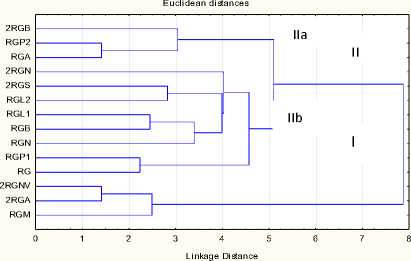
Рисунок 1 – Дендрограмма генетических дистанций между 14 линиями – донорами устойчивости подсолнечника к расе G заразихи на основе 15 SSR-локусов, построенная по методу Ward
Как видно из дендрограммы (рис. 1), все линии разделились в два кластера на уровне объединения 7,8. Кластер I объединил линии 2RGNV, 2RGA, RGM. Остальные 11 линий были сгруппированы в большой кластер II, который на уровне объединения 5,2 был подразделён на два меньших субкластера. В субкластер IIa были сгруппированы линии 2RGB, RGP2, RGA. Остальные восемь линий, вероятно, наиболее близки генетически, поскольку формируют один субкластер IIb. Для того чтобы выяснить, насколько на распределение по кластерам изучаемых образцов влияют дополнительные маркеры, матрицу бинарных состояний для SSR-локусов дополнили состояниями аллельных вариант изоферментов. Результаты кластерного анализа для 14 линий-доноров по 15 SSR- и четырем изоферментным локусам показаны на рисунке 2.
Tree Diagram for 14 Cases Ward`s method Euclidean distances
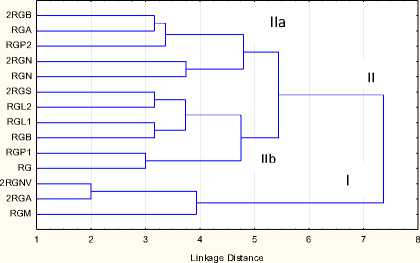
Рисунок 2 – Дендрограмма генетических дистанций между 14 линиями – донорами устойчивости подсолнечника к расе G заразихи на основе 15 SSR- и четырех изоферментных локусов, построенная по методу Ward
Сопоставление результатов кластеризации по 15 SSR-локусам (рис. 1) и 15 SSR-и четырем изоферментным локусам (рис. 2), показывает, что состав кластеров сохранен. Небольшие изменения были выявлены внутри кластеров. Так, в кластере II, где сгруппировано большее количество линий, распределение последних в субкластеры стало более равномерным. В субкластер IIa попало пять линий – 2RGB, RGP2, RGA, 2RGN, RGN. Линии 2RGS, RGL2, RGL1, RGB, RGP1, RG сформировали субкластер IIb. Вероятно, из-за низкой информативности изофер-ментных локусов уменьшился уровень объединения кластеров с 7,8 до 7,4. Вместе с этим увеличился уровень объединения субкластеров кластера II с 5,2 до 5,4. Таким образом, использование разных типов маркеров способствовало большей дифференциации изучаемых генотипов.
Все изученные линии объединены одним общим признаком – устойчивостью к расе G заразихи, а линии RG, RGL2, RGL1, RGB, RGP1, RGA, RGN, как было доказано, обладают идентичным геном устойчивости [19]. Однако ряд морфологических и селекционно ценных [10] так же, как и молекулярных признаков, у них отличается. Следовательно, благодаря разному генетическому фону данные линии представляют собой еще и источники дополнительного разнообразия для вовлечения в селекционные программы в качестве исходного материала и получения новых высокопродуктивных гибридов с устойчивостью к биотическим факторам окружающей среды.
Заключение. С помощью проведенного исследования установлена уникальность 14 линий подсолнечника – доноров устойчивости к расе G заразихи. Уникальность коллекции, выявленная при помощи анализа изоферментных систем, составила 64 %, а при помощи микроса-теллитных локусов – 100 %. Дискриминационный потенциал системы ДНК-маркеров оценен как средний, характерный для коллекций культивируемого подсолнечника. По результатам кластерного анализа все линии разделились на две группы.
Список литературы Молекулярно-генетическое разнообразие коллекции 14 линий - доноров устойчивости подсолнечника к расе G заразихи на основе изоферментных и SSR-локусов
- Децына А.А., Хатнянский В.И., Илларионова И.В. [и др.]. Мониторинг болезней на сортах подсолнечника селекции ВНИИМК // Масличные культуры. - 2021. - Вып. 1 (185). - С. 67-72. DOI: 10.25230/2412-608Х-2021-1-185-67-72.
- Самолюк А.Д., Ивебор М.В., Пикалова Н.А. Распространение облигатных и факультативных паразитов подсолнечника в агроценозах Краснодарского края // В сб.: Региональные географические исследования / Под общ. ред. А.В. Погорелова. -Краснодар, 2019. - С. 112-114.
- Рыженко Е.Н., Арасланова Н.М., Гончаров С.В. Селекция линий подсолнечника, устойчивых к расе G заразихи // Аграрная наука. - 2021. - № 6. - С. 42-45. DOI: 10.32634/0869-8155-2021-350-6-42-45.
- Лукомец В.М., Пивень В.Т., Семеренко С.А., Бушнева Н.А. Протравливание семян биологически активными композициями как основной элемент защиты подсолнечника от болезней и почвообитающих вредителей // Защита и карантин растений. -2020. - № 2. - С. 18-23. DOI: 10.47528/1026-8634-2020-2-18.
- Лукомец В.М., Семеренко С.А., Пивень B.Т., Бушнева Н.А. Влияние основных агротехнических приемов на развитие болезней и сорняков в посевах подсолнечника // Защита и карантин растений. - 2020. - № 10. - C. 30-33. DOI: 10.47528/1026-8634-2020-10-30.
- Бушнев А.С., Семеренко С.А., Гончаров С.В. Основы управления технологией возделывания подсолнечника. - Краснодар, 2019. - 216 с.
- Гончаров С.В., Голощапова Н.Н. Комбинационная способность линий подсолнечника, устойчивых к новым расам ложной мучнистой росы // Труды Кубанского государственного аграрного университета. - 2020. - № 84. - С. 126-129. DOI: 10.21515/1999-1703-84-126-129.
- Шугурова Н.А., Кутищева Н.Н. Создание гибридов подсолнечника на стационарном инфекционном фоне // Вестник Белорусской государственной сельскохозяйственной академии. - 2017. - № 4. - С. 52-56.
- Антонова Т.С., Стрельников Е.А., Арасланова Н.М. [и др.]. Отбор на устойчивость к расе G заразихи из расщепляющихся популяций подсолнечника в искусственных условиях выращивания // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2017. -Вып. 3 (171). - С. 18-22.
- Арасланова Н.М., Антонова Т.С., Гу-четль С.З. [и др.]. Морфологические признаки новых линий, устойчивых к расе G заразихи // Масличные культуры. - 2021. -Вып. 2 (186). - С. 18-23. DOI: 10.25230/2412-608X-2021-2-186-18-23.
- Камнев А.М., Антонова О.Ю., Дунаева С.Е. [и др.]. Молекулярные маркеры в исследованиях генетического разнообразия представителей рода Rubus L. и их перспективы в селекции // Вавиловский журнал генетики и селекции. - 2020. - № 24 (1). - С. 20-30. DOI: 10.18699/VJ20.591.
- Кавракова З.Б., Мамадюсуфова М., Косумбекова Ф.А., Насырова Ф.Ю. RARD- и SSR-анализ внутри- и межвидового полиморфизма видов рода Aegilops L., произрастающих в различных природно-климатических зонах Таджикистана // Кишоварз. - № 3. - 2015. - С. 16-19.
- Suprun I.I., Tokmakov S.V., Lobodina E.V. Microsatellite DNA-markers in the study of the gene pool of fruit crops // В сборнике: BIO Web of Conferences. Federal State Budgetary Scientific Institution North Caucasian Regional Research Institute of Horticulture and Viticulture. - 2020. - С. 0300.
- Котляр В.К., Ильницкая Е.Т., Макар-кина М.В., Степанов И.В. Анализ генетического сходства гибридных форм винограда, полученных с использованием Vitis amurensis Rupr. при помощи ДНК-маркеров, сцепленных с генами устойчивости // Научные труды Северо-Кавказского федерального научного центра садоводства, виноградарства, виноделия. - 2020. - Т. 29. - С. 145-149. DOI: 10.3 0679/2587-9847-2020-29-145-149.
- Vallejos C.E. Enzyme activity staining // Development in plant genetics and breeding. -1983. - Vol. 1. - Part A. - P. 469-516. DOI: 10.1016/B978-0-444-42226-2.50031-1.
- Filippi C., Aguirre N., Rivas J.G. [et al.]. Population structure and genetic diversity characterization of a sunflower association mapping population using SSR and SNP markers // BMC Plant Biol. - 2015. - V. 15. -P. 52.
- Tang S., Yu J-K., Slabaugh M.D. [et al.]. Simple sequence repeat мар of the sunflower genome // Theor. and Appl. Genet. -2002. - No 105. - P. 1124-1136.
- Саналатий А.В., Солоденко А.Е., Сиволап Ю.М. Идентификация генотипов подсолнечника украинской селекции при помощи SSRP-анализа // Цитология и генетика. - 2006. - Т. 40. - № 4. - С. 37-43.
- Гучетль С.З., Антонова Т.С., Арасланова Н.М. [и др.]. Идентичность генов устойчивости к расе G заразихи у линий подсолнечника разного происхождения // Масличные культуры. - 2021. - Вып. 3 (187). - С. 3-9. DOI: 10.25230/2412-608X-2021-3-187-3-9.


