Молекулярные и прогностические особенности глиобластом с отсутствием мутаций генов IDH/BRAF/H3F3A у молодых пациентов
Автор: Рыжова М.В., Абсалямова О.В., Голанов А.В., Пицхелаури Д.И., Снигирева Г.П., Воронина Е.И., Шишкина Л.В., Панина Т.Н., Шибаева И.В., Шугай С.В., Старовойтов Д.В., Баринов А.А., Сычева Р.В., Зубова И.В.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Молекулярная медицина
Статья в выпуске: 4 т.18, 2018 года.
Бесплатный доступ
Резюме Исследование посвящено изучению глиобластом у лиц молодого возраста в возрасте от 19 до 44лет. Цель исследования. Стратификация глиобластом у лиц молодого возраста с отсутствием мутаций (диким типом) генов IDH/BRAF/H3F3A. Материалы и методы. Исследование проведено с помощью изучения структуры метилирования ДНК на уровне генома и иерархического кластерирования на серии из 91 опухоли, в геноме которых отсутствуют мутации генов IDH/BRAF/H3F3A. Результаты. Выявлено два молекулярных кластера, что будет иметь важное значение для дальнейшей стратификации пациентов в последующих клинических испытаниях и для изучения оптимальных альтернативных терапевтических режимов. Заключение. Благодаря использованию сложных молекулярных методов и математического анализа, в работе показана гетерогенность глиобластом с отсутствием мутаций генов IDH/BRAF/H3F3A у молодых пациентов. Выявленные два молекулярных подтипа опухоли показали четкую взаимосвязь с биологическими параметрами и клиническим исходом и могут послужить предиктивным фактором ответа на стандартные протоколы лечения и возможной таргетной терапии. Однако, на сегодняшний день в условиях рутинной диагностики глиобластом по-прежнему целесообразным представляется исследование мутационного статуса генов IDH1/2, BRAF, H3F3A, TERT, TP53, ATRX и статуса метилирования гена MGMT.
Глиобластома, мутации генов, метилирование генов, иерархическое кластерирование
Короткий адрес: https://sciup.org/149132084
IDR: 149132084
Текст научной статьи Молекулярные и прогностические особенности глиобластом с отсутствием мутаций генов IDH/BRAF/H3F3A у молодых пациентов
Адрес: 125047, 4-ая Тверская-Ямская ул., д.16, г. Москва, Россия, e-mail: ORCID:
Глиобластома – наиболее часто встречающаяся первичная высокозлокачественная опухоль головного мозга [12]. К сожалению, несмотря на прилагаемые усилия по изучению биологии этой опухоли и ее лечению с использованием комплексного подхода, включающего максимально безопасное хирургическое удаление опухоли с последующими облучением и химиотерапией с темозоломидом, в большинстве случаев течение заболевания быстро приводит к летальному исходу: свыше 95 % пациентов умирают в течение первых двух лет после хирургического лечения [12, 25]. Наиболее часто глиобластомы диагностируются у людей среднего и пожилого возраста, небольшой процент (приблизительно 15 – 20 % от всех глиобластом) возникают у детей младше 18 лет или развиваются у молодых пациентов в возрасте от 18 до 45 лет [12]. На сегодняшний день хорошо известно, что глиобластомы у лиц молодого возраста имеют лучший прогноз, хотя научные данные об этом явлении достаточно скудно представлены в мировой литературе, в то время как крупные серии глиобластом у пожилых людей хорошо изучены с помощью молекулярных методов [2, 4, 18, 25]. Молекулярная классификация глиобластом, основанная на данных экспрессионного профилирования генов, наглядно продемонстрировала, что глиобластомы представляют собой гетерогенную группу опухолей с делением на пронейральную, нейральную, классическую и мезенхимальную подгруппы [4, 16, 21, 22]. Дополнительно, при использовании оценки статуса метилирования генов на уровне всего генома, была выявлена подгруппа взрослых глиобластом с так называемым «CIMP-позитивным фенотипом» – «glioma-CpG island phenotype (G-CIMP)» – «глиома с островками Цитозин-фосфат-Гуанин фенотипом». Установлено, что данная подгруппа глиобластом более всего соответствует пронейральной экспрессионной подгруппе и четко связана с мутацией гена IDH1, чувствительностью опухолевых клеток к лечению темозоломидом и более благоприятным прогнозом [18]. Молекулярная биология глиобластом у детей интенсивно исследовалась в последние пять лет, что позволило выявить присущие детским глиобластомам особенности: точковые мутации в гистоне 3.3 (H3F3A) кодонов 27 (K27) и 34 (G34) и в гистоне 3.1 (HIST1H3B/C) кодон 27 (K27), которые возникают приблизительно в половине глиобластом детского возраста [8, 9, 10, 11, 19].
На сегодняшний день исследования глиобластом по большей части сфокусированы на опухолях у детей и у взрослых старше 50 лет, в то время как данные об особенностях молекулярной биологии глиобластом у пациентов в возрасте от 18 до 45 лет в научной литературе представлены довольно скудно [25]. Известно, что глиобластомы у лиц молодого возраста ассоциируются с относительно благоприятным прогнозом по сравнению с опухолями у детей и пациентов пожилого возраста [2, 5, 18]. Однако группа глиобластом у лиц молодого возраста представляется тоже вполне гетерогенной: случаи глиобластом-долгожителей и пациентов с короткой общей выживаемостью регистрируются у лиц молодого возраста почти с равной частотой. Более того, исследования показывают, что значительная часть (приблизительно 40 – 50%) глиобластом у лиц молодого возраста часто связаны с взаимно исключающими мутациями генов IDH, BRAF и H3F3A, которые в свою очередь имеют важное прогностическое значение, и могут получать лечение с использованием таргетной терапии [8, 9, 10, 11,].
Целями нашей текущей работы были исследование и стратификация глиобластом у лиц молодого возраста с отсутствием мутаций (диким типом) генов IDH/BRAF/H3F3A ( IDH/BRAF/H3F3A wild type (wt)) с использованием молекулярных методов изучения структуры метилирования ДНК на уровне генома. Мы надеемся, что полученные нами в этой работе новые данные послужат очередной ступенью на пути к улучшению понимания молекулярной основы развития глиобластом у молодых пациентов, что, в свою очередь, позволит стратифицировать пациентов и обеспечить их более точным и подходящим лечением согласно биологической структуре этого гетерогенного заболевания.
Материалы и методы
Для включения пациентов в наше исследование мы использовали следующие критерии: впервые выявленная гистологически подтвержденная глиобластома без каких-либо указаний на предшествующую глиому, возраст пациентов от 19 до 44 лет, супратенториальная локализация опухоли именно в больших полушариях, тотальное или близко к тотальному удаление опухоли по данным послеоперационных КТ и МРТ и по данным протокола операции, наличие достаточного количества материала в парафиновом блоке для проведения молекулярного исследования опухоли и доказанное секвенированием по Сэнгеру (Sanger) отсутствие мутаций генов IDH/BRAF/H3F3A.
Образцы опухолевой ткани, полученные во время нейрохирургической операции, далее фиксировались в формалине и заливались в парафиновые блоки. Парафиновые блоки были доступны для исследования у 91 пациента в возрасте от 19 до 44 лет (средний возраст пациентов был 37 лет) с гистологическим диагнозом «глиобластома WHO grade IV». Все пациенты были первично оперированы в ФГАУ «НМИЦ нейрохирургии» Минздрава России в период с 2003 по 2005 годы. Информированное согласие было получено от всех пациентов или от их законных представителей. Ни у одного из этих пациентов не было никаких клинических или нейровизуализационных признаков предшествующей глиомы. Согласно данным нейровизуализации и согласно интраоперационной картине, все опухоли были супратенториальными и поражали исключительно большие полушария. Информация о полученном пациентами комплексном лечении по поводу глиобластом известна во всех случаях: первым этапом пациенты были оперированы, во всех случаях удалось добиться тотальной или близко к тотальной резекции опухоли, далее пациенты получили лучевую терапию в СОД 58 – 59.4 Грей на ложе удаленной опухоли и адъювантную химиотерапию с темозоломидом [1]. К моменту окончания этого исследования (декабрь 2017), было известно о 78 скончавшихся пациентах (86%).
Пациенты с частичным удалением опухоли или с проведенной биопсией (стереотаксической биопсией или открытой биопсией) в исследование не включались.
Гистологические препараты были повторно пересмотрены, гистологический диагноз «глиобластома WHO grade IV» основывался на текущей классификации ВОЗ опухолей ЦНС, которая определяет глиобластому как глиому высокой степени злокачественности преимущественно с астроцитарной дифференцировкой, ядерной атипией, клеточным полиморфизмом, митотической активностью, типично характеризующейся диффузным ростом, микроваскулярной пролиферацией и/или некрозами [12].
Для всех опухолей было выполнено прямое секвенирование по Сэнгеру (Sanger) и установлено, что все опухоли представляли собой глиобластомы дикого типа IDH/BRAF/H3F3A у лиц молодого возраста, так как не имели ни одной из мутаций генов IDH1/2, BRAF и генов, кодирующих гистон 3 ( H3F3A , HIST1H3A, HIST1H3B, HIST1H3C, HIST2H3C) . Кроме того, был проведен мутационный анализ гена TP53 и промоторной области гена TERT также методом прямого секвенирования по Сэнгеру (Sanger); мутантный протеин ATRX оценивался иммуногистохимически по потере экспрессии антитела.
Молекулярный анализ 91 глиобластомы у лиц молодого возраста с отсутствием мутаций (диким типом) генов IDH/BRAF/H3F3A проводился на платформе Illumina HumanMethylation450 BeadChip (450k). Для анализа полученных результатов метилирования ДНК применялся сложный математический и статистический анализ с помощью иерархического кластерирования. Статус метилирования области промотора гена MGMT оценивался с использованием модели логистической регрессии MGMT_STP27 [18]. Мутационный анализ, анализ метилирования ДНК на уровне генома, оценка метилирования гена MGMT и иерархическое кластерирование были выполнены на базе отделения нейропатологии Университета Хайдельберга, Германия при поддержке prof. Andrey Korshunov.
Статистический анализ
Общая выживаемость оценивалась по методу Kaplan-Meier. Под «общей выживаемостью» подразумевался временной период от даты операции до даты смерти пациента от прогрессии заболевания или до даты последнего контакта с пациентом. Безрецидивная выживаемость не оценивалась, так как подавляющее большинство больных с глиобластомами рецидивируют в течение первого года после операции.
Для мультивариантного анализа использовался метод регрессии пропорциональных рисков Кокса. Оценочные коэффициенты риска представлены 95% доверительными интервалами и значением p из теста Вальда. Тесты с p-значением ниже 0,05 считались значимыми.
Результаты
В исследование были включены пациенты с диким типом и отсутствием мутаций генов IDH/BRAF/H3F3A , поэтому первым этапом было проведено секвенирование по Сэнгеру (Sanger), не выявившее ни в одном случае мутаций вышеописанных генов. Кроме того, был проведен мутационный анализ гена TP53 и промоторной области гена TERT также методом прямого секвенирования по Сэнгеру (Sanger); мутации гена TP53 выявлены в 18 опухолях, мутации гена TERT p в 80 опухолях. Мутантный протеин ATRX оценивался иммуногистохимически по потере экспрессии антитела; потери экспрессии не было выявлено ни в одном случае, таким образом, мутаций гена ATRX среди 91 глиобластомы не выявлено.
Далее извлеченная из парафиновых блоков ДНК была анализирована на платформе Illumina HumanMethylation450 BeadChip (450k) для определения статуса метилирования структуры ДНК на уровне генома с последующим разделением на кластеры.
Иерархическая кластеризация выявила две подгруппы/два кластера (Рисунок 1). Кроме того, следует отметить наличие в каждом кластере двух подкластеров, что, безусловно, может послужить основой для продолжения изучения структуры метилирования ДНК на уровне генома. Данные о двух молекулярных кластерах были сопоставлены с уже имеющими данными об экспрессионном профилировании глиобластом [18] и по близости совпадения по молекулярным событиям и по аналогии, кластеры названы соответственно «MES» «мезенхимальный кластер» и «RTK» «Receptor Tyrosine Kinase кластер». Сравнительный анализ эпигенетических профилей не выявил разницы в общем уровне метилирования между двумя подгруппами.
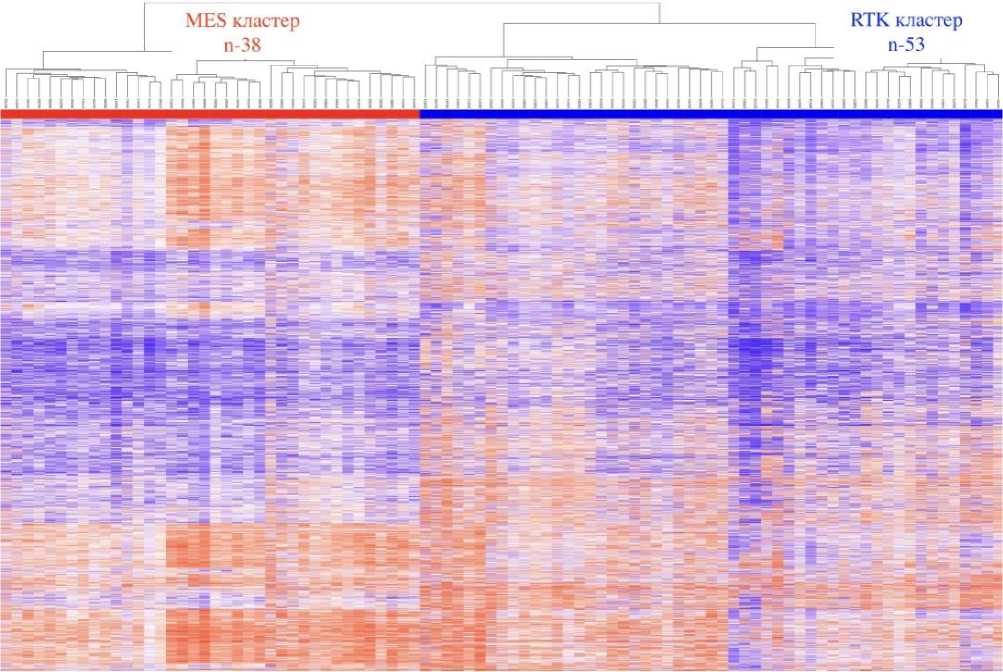
Рисунок 1. Кластерный анализ 91 глиобластомы у лиц молодого возраста с диким типом и отсутствием мутаций генов IDH/BRAF/H3F3A . Анализ выявил два кластера, кластеры названы «MES» «мезенхимальный кластер» и «RTK» «Receptor Tyrosine Kinase кластер».
При сложном математическом и статистическом анализе к кластеру «MES» отнесено 38 глиобластом, в кластер «RTK» попали, соответственно, 53 глиобластомы. Для удобства кластеры маркированы цветом: «MES» красным цветом и «RTK» синим цветом, соответственно. Цветовая шкала структуры метилирования ДНК: красный цвет – метилированный участок ДНК, синий цвет – неметилированный участок ДНК. Метилированный контроль – M.Sssl-DNA (M.SssI-treated DNA), неметилированный контроль – WGA-DNA (Whole-Genome Amplified DNA). Кластерирование выполнено на основе анализа 450 тысяч CpG-островков, расположенных на чипе Illumina Infinium Human-Methylation450 BeadChip.
При сопоставлении с клиническим данными, цитогенетическими аберрациями и мутационным статусом кластеры «MES» и «RTK» показывали совсем мало значимых различий, за исключением амплификации гена EGFR, добавки 19q, метилированного гена MGMT и более благоприятных показателей общей выживаемости в группе RTK (данные суммированы в Таблице 1).
Таблица 1. Клиническая и молекулярная характеристика 91 глиобластомы у лиц молодого возраста с диким типом и отсутствием мутаций генов IDH/BRAF/H3F3A
|
Характеристики |
Все глиобластомы (n = 91) |
Глиобластомы подгруппы MES (n = 38) |
Глиобластомы подгруппы RTK (n = 53) |
|
Средний возраст |
37 |
37 |
38 |
|
Возрастной ранг |
19 – 44 |
19 – 44 |
19 – 44 |
|
Пол мужской vs. женский |
54/37 59%/41% |
21/17 55%/45% |
27/26 51%/49% |
|
Средняя общая выживаемость |
17 месяцев |
12 месяцев* *p < 0.01 |
22 месяца |
|
Мутация гена TР 53 |
20% |
22% |
18% |
|
Амплификация гена EGFR |
57% |
34%* *p < 0.01 |
72% |
|
Гомозиготная делеция CDKN2A/В |
63% |
60% |
66% |
|
Добавка 7 |
93% |
91% |
94% |
|
Потеря 10q |
93% |
91% |
95% |
|
Добавка 19q |
37% |
24%* *p < 0.01 |
51% |
|
Мутация гена TERT p |
88% |
82% |
90% |
|
Метилированный MGMT |
45% |
36%* |
53% |
|
*p < 0.01 |
Некоторые характерные для глиобластом цитогенетические аберрации (потеря 10q и добавка хромосомы 7) были обнаружены нами со сходной частотой в обоих молекулярных вариантах глиобластом у лиц молодого возраста, но гомозиготные делеции генов CDKN2A/B и добавка 19q преобладали в молекулярном варианте RTK. Более того, в молекулярном варианте RTK значительно чаще выявлялась по сравнению с молекулярным вариантом MES амплификация гена EGFR (72% vs. 34; p < 0.01). Мутации гена TP53 встречались нечасто, были обнаружены только в 20% и не показывали различий по частоте распределения по подгруппам, в то время как мутации гена TERT p (преимущественно в варианте C228T) были обнаружены в 88% исследованных опухолей, с одинаковой частотой распределяясь среди молекулярных вариантов MES и RTK. Метилирование промотора MGMT было выявлено в 41 из 91 (45%) глиобластом у лиц молодого возраста с диким типом генов IDH/BRAF/H3F3A с небольшим преобладанием в молекулярном варианте RTK.
Катамнестические данные были получены для всех пациентов (91 пациент): подавляющее большинство пациентов имели локальный рецидив в течение первого года поле операции, случаев диссеминации или метастазирования опухолей не отмечалось. За период наблюдения, составивший 72 месяца, 78 пациентов скончались (средняя общая выживаемость составила 17 месяцев; интервал от 5 до 72 месяцев).
Наше исследование глиобластом у лиц молодого возраста с диким типом и отсутствием мутаций генов IDH/BRAF/H3F3A позволило выявить несколько интересных закономерностей: молекулярная подгруппа RTK имеет более высокие показатели общей выживаемости по сравнению с молекулярной подгруппой MES (Рисунок 2); одновариантный анализ общей выживаемости различных клинических и молекулярных параметров в 91 глиобластоме у лиц молодого возраста с диким типом и отсутствием мутаций генов IDH/BRAF/H3F3A выявил, что лишь метилирование MGMT было значительно связано с относительно благоприятным прогнозом (Рисунок 3), в то время как влияние других
параметров на общую выживаемость было недостоверно.
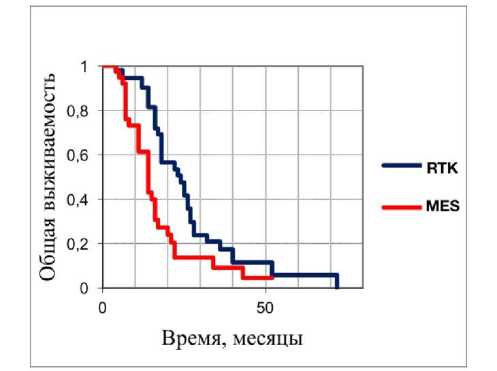
Рисунок 2. Анализ общей выживаемости у лиц молодого возраста с глиобластомами с диким типом и отсутствием мутаций генов IDH/BRAF/H3F3A в зависимости от подгруппы - MES глиобластомы показаны красным цветом и RTK глиобластомы показаны синим цветом соответственно (p < 0.01).
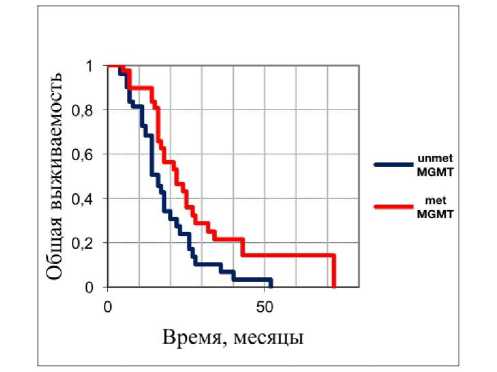
Рисунок 3. Анализ общей выживаемости у лиц молодого возраста с глиобластомами с диким типом и отсутствием мутаций генов IDH/BRAF/H3F3A в зависимости от статуса метилирования гена MGMT : красным цветом показаны глиобластомы с метилированным MGMT (metMGMT) и синим цветом показаны глиобластомы с неметилированным MGMT (unmetMGMT) соответственно (p < 0.01).
Мультивариантный анализ выявил, что статус метилирования гена MGMT и молекулярный вариант являются независимыми достоверно значимыми прогностическими маркерами относительно благоприятного клинического исхода при глиобластомах у лиц молодого возраста (p < 0.01; Таблица 2), подчеркивая прогностическое влияние предлагаемых нами молекулярных групп по сравнению с другими переменными.
Таблица 2. Результаты одновариантного и мультивариантного анализа выживаемости 91 глиобластомы у лиц молодого возраста с диким типом и отсутствием мутаций генов IDH/BRAF/H3F3A
|
Характеристики |
Одновариантный анализ Индекс рисков HR |
P |
Мультивариантный анализ Индекс рисков HR |
P |
|
Возраст: < 40 years vs. > 40 years |
0.45 |
0.51 |
1.24 |
0.42 |
|
Пол: мужской vs. женский |
0.42 |
0.51 |
0.93 |
0.81 |
|
EGFR амплификация: наличие vs. отсутствие |
1.92 |
0.12 |
0.91 |
0.76 |
|
Гомозиготная делеция CDKN2A: наличие vs. отсутствие |
1.18 |
0.27 |
0.93 |
0.81 |
|
Мутация гена TP53 : наличие vs. отсутствие |
2.05 |
0.09 |
1.64 |
0.19 |
|
Добавка 19q: наличие vs. отсутствие |
0.61 |
0.43 |
1.06 |
0.63 |
|
Мутация гена TERT p: наличие vs. отсутствие |
1.83 |
0.18 |
0.92 |
0.77 |
|
MGMT : метилирован vs. немитилирован |
0.21 |
< 0.01 |
0.34 |
< 0.01 |
|
Молекурный подтип: Глиобластома MES vs. Глиобластома RTK |
10.18 |
< 0.01 |
2.88 |
< 0.01 |
Некоторые переменные варианты также показывали свою прогностическую значимость для молекулярных подгрупп в глиобластомах у лиц молодого возраста: так, для молекулярного варианта MES только метилирование MGMT было независимым прогностическим маркером благоприятного прогноза MGMT (Рисунок 4 и Таблица 3).
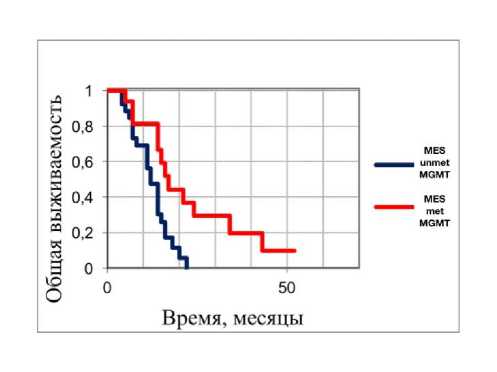
Рисунок 4. Анализ общей выживаемости у лиц молодого возраста с глиобластомами с диким типом и отсутствием мутаций генов IDH/BRAF/H3F3A подгруппы MES в зависимости от статуса метилирования гена MGMT: красным цветом показаны глиобластомы с метилированным MGMT (metMGMT) и синим цветом глиобластомы с неметилированным MGMT (unmetMGMT) соответственно (p < 0.01).
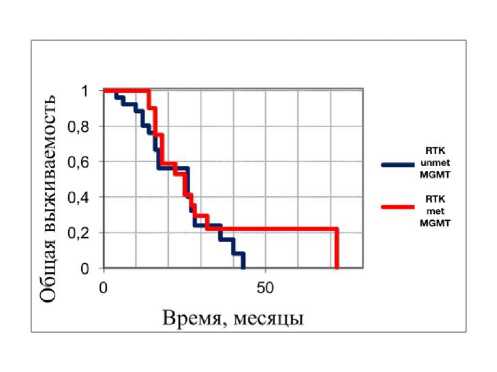
Рисунок 5. Анализ общей выживаемости у лиц молодого возраста с глиобластомами с диким типом и отсутствием мутаций генов IDH/BRAF/H3F3A подгруппы RTK в зависимости от статуса метилирования гена MGMT: красным цветом показаны глиобластомы с метилированным MGMT и синим цветом глиобластомы с неметилированным MGMT соответственно (p = 0.29).
Таблица 3. Результаты одновариантного и мультивариантного анализа выживаемости 38 глиобластом подгруппы MES у лиц молодого возраста с диким типом и отсутствием мутаций генов IDH/BRAF/H3F3A
|
Характеристики |
Одновариантный анализ Индекс рисков HR |
P |
Мультивариантный анализ Индекс рисков HR |
P |
|
Возраст: < 40 years vs. > 40 years |
1.07 |
0.67 |
1.19 |
0.66 |
|
Пол: мужской vs. женский |
1.01 |
0.96 |
1.05 |
0.91 |
|
EGFR амплификация: наличие vs. отсутствие |
0.57 |
0.44 |
0.61 |
0.36 |
|
Гомозиготная делеция CDKN2A: |
0.51 |
0.47 |
0.73 |
0.34 |
|
наличие vs. отсутствие |
||||
|
Мутация гена TP53 : наличие vs. отсутствие |
1.16 |
0.31 |
1.77 |
0.24 |
|
Добавка 19q: наличие vs. отсутствие |
0.98 |
0.94 |
0.91 |
0.85 |
|
Мутация гена TERT p: наличие vs. отсутствие |
1.92 |
0.13 |
0.77 |
0.55 |
|
MGMT : метилирован vs. немитилирован |
0.23 |
< 0.01 |
0.27 |
< 0.01 |
Удивительно, но ни статус метилирования гена MGMT, ни другие клинико-молекулярные параметры не были связаны с клиническим исходом в молекулярном варианте RTK в глиобластомах у лиц молодого возраста (Рисунок 5 и Таблица 4).
Таблица 4. Результаты одновариантного и мультивариантного анализа выживаемости 53 глиобластом подгруппы RTK у лиц молодого возраста с диким типом и отсутствием мутаций генов IDH/BRAF/H3F3A
|
Характеристики |
Одновариантный анализ Индекс рисков HR |
P |
Мультивариантный анализ Индекс рисков HR |
P |
|
Возраст: < 40 years vs. > 40 years |
1.31 |
0.61 |
1.89 |
0.22 |
|
Пол: мужской vs. женский |
1.01 |
0.98 |
0.65 |
0.29 |
|
EGFR амплификация: наличие vs. отсутствие |
0.88 |
0.18 |
1.28 |
0.59 |
|
Гомозиготная делеция CDKN2A: |
0.61 |
0.42 |
0.54 |
0.24 |
|
наличие vs. отсутствие |
||||
|
Мутация гена TP53 : наличие vs. отсутствие |
4.88 |
0.01 |
3.62 |
0.02 |
|
Добавка 19q: наличие vs. отсутствие |
0.81 |
0.64 |
1.07 |
0.84 |
|
Мутация гена TERT p: наличие vs. отсутствие |
1.84 |
0.18 |
1.83 |
0.24 |
|
MGMT : метилирован vs. неметилирован |
0.52 |
0.29 |
0.43 |
0.12 |
Список литературы Молекулярные и прогностические особенности глиобластом с отсутствием мутаций генов IDH/BRAF/H3F3A у молодых пациентов
- Абсалямова О.В., Кобяков Г.Л., Рыжова М.В. и др. Результаты применения современных режимов химиотерапии первой линии в комплексном лечении пациентов с глиобластомой. Вопросы нейрохирургии имени Н.Н. Бурденко. 2016. Т. 80. № 6. С. 5- 14.
- Рыжова М.В., Шишкина Л.В., Желудкова О.Г. и др. Сравнительная характеристика генетических аберраций в глиобластомах у детей и взрослых. Вопросы нейрохирургии имени Н.Н. Бурденко. 2014. Т. 78. № 2. P. 3-11.
- Abounader R. Interactions between PTEN and receptor tyrosine kinase pathways and their implications for glioma therapy. Expert Rev Anticancer Ther. 2009. V. 9. No. 2. P. 235-245.
- Brennan C.W., Verhaak R.G., McKenna A., et al. The somatic genomic landscape of glioblastoma. Cell. 2013. V. 155. No. 2. P. 462-477.
- Cantero D., Rodríguez de Lope Á., Moreno de la Presa R., et al. Molecular Study of Long- Term Survivors of Glioblastoma by Gene-Targeted Next-Generation Sequencing. J Neuropathol Exp Neurol. 2018. V. 77. No. 8. P. 710-716.
- Fan Q.W., Weiss W.A. Targeting the RTK-PI3K-mTOR axis in malignant glioma: overcoming resistance. Curr Top Microbiol Immunol. 2010. V. 347. P. 279-296.
- Hong E.K., Choi S.H., Shin D.J., et al. Radiogenomics correlation between MR imaging features and major genetic profiles in glioblastoma. Eur Radiol. 2018. V. 28. No. 10. P. 4350- 4361.
- Korshunov A., Ryzhova M., Hovestadt V., et al. Integrated analysis of pediatric glioblastoma reveals a subset of biologically favorable tumors with associated molecular prognostic markers. Acta Neuropathol. 2015. V. 129. No. 5. P. 669-678.
- Korshunov A., Capper D., Reuss D., et al. Histologically distinct neuroepithelial tumors with histone 3 G34 mutation are molecularly similar and comprise a single nosologic entity. Acta Neuropathol. 2016. V. 131. No. 1. P. 137-146.
- Korshunov A., Chavez L., Sharma T., et al. Epithelioid glioblastomas stratify into established diagnostic subsets upon integrated molecular analysis. Brain Pathol. 2018. V. 28. No. 5. P. 656-662.
- Korshunov A., Schrimpf D., Ryzhova M., et al. H3-/IDH-wild type pediatric glioblastoma is comprised of molecularly and prognostically distinct subtypes with associated oncogenic drivers. Acta Neuropathol. 2017. V. 134. No. 3. P. 507-516.
- Louis D.N., Ohgaki H., Wiestler O.D., Cavenee W.K. WHO Classification of Tumours of the Central Nervous System. Revised 4th edition. IARC: Lyon. 2016.
- Mathew L.K., Skuli N., Mucaj V., et al. miR-218 opposes a critical RTK-HIF pathway in mesenchymal glioblastoma. Proc Natl Acad Sci U S A. 2014. V. 111. No. 1. P. 291-296.
- McKay M.M., Morrison D.K. Integrating signals from RTKs to ERK/MAPK. Oncogene. 2007. V. 26. No. 22. P. 3113-3121.
- Mellinghoff I.K., Schultz N., Mischel P.S., Cloughesy T.F. Will kinase inhibitors make it as glioblastoma drugs? Curr Top Microbiol Immunol. 2012. V. 355. P. 135-169.
- Phillips H.S., Kharbanda S., Chen R., et al. Molecular subclasses of high-grade glioma predict prognosis, delineate a pattern of disease progression, and resemble stages in neurogenesis. Cancer Cell. 2006. V. 9. No. 3. P. 157-173.
- Qazi M.A., Vora P., Venugopal C., et al. Co-targeting ephrin receptor tyrosine kinases A2 and A3 in cancer stem cells reduces growth of recurrent glioblastoma. Cancer Res. 2018. V. 78. No. 17. P. 5023-5037.
- Sturm D., Witt H., Hovestadt V., et al. Hotspot mutations in H3F3A and IDH1 define distinct epigenetic and biological subgroups of glioblastoma. Cancer Cell. 2012. V. 22. No. 4. P. 425-
- Schwartzentruber J., Korshunov A., Liu X.Y., et al. Driver mutations in histone H3.3 and chromatin remodelling genes in paediatric glioblastoma. Nature. 2012. V. 482. No. 7384. P. 226-231.
- Shu C., Wang Q., Yan X., Wang J. The TERT promoter mutation status and MGMT promoter methylation status, combined with dichotomized MRI-derived and clinical features, predict adult primary glioblastoma survival. Cancer Med. 2018. V. 7. No. 8. P. 3704-3712.
- Shen.R., Mo Q., Schultz N., et al. Integrative subtype discovery in glioblastoma using iCluster. PLoS One. 2012. V. 7. No. 4. e35236.
- Verhaak R.G., Hoadley K.A., Purdom E., et al. Integrated genomic analysis identifies clinically relevant subtypes of glioblastoma characterized by abnormalities in PDGFRA, IDH1, EGFR, and NF1. Cancer Cell. 2010. V. 17. No. 1. P. 98-110.
- Wang Z., Sun Y. Targeting p53 for Novel Anticancer Therapy. Transl Oncol. 2010.V. 3. No.1.P. 1-12.
- Xu X., Bao Z., Liu Y., et al. PBX3/MEK/ERK1/2/LIN28/let-7b positive feedback loop enhances mesenchymal phenotype to promote glioblastoma migration and invasion. J Exp Clin Cancer Res. 2018. V. 37. No. 1. P. 158.
- Zhao Y.H., Wang Z.F., Cao C.J., et al. The Clinical Significance of O6-Methylguanine-DNA Methyltransferase Promoter Methylation Status in Adult Patients With Glioblastoma: A Meta- analysis. Front Neurol. 2018. V. 9. P. 127.


