Морфо-функциональные механизмы гемостаза и ранних восстановительных процессов в тканях после травматических повреждений в спорте
Автор: Вирник В.Л., Алексанянц Г.Д.
Журнал: Физическая культура, спорт - наука и практика @fizicheskaya-kultura-sport
Рубрика: Из портфеля редакции
Статья в выпуске: 4, 2022 года.
Бесплатный доступ
Актуальность. Высокий уровень конкуренции в современном профессиональном спорте побуждает искать новые эффективные методы ускорения восстановления спортсменов после получения неизбежных в состязательной деятельности тяжелых травматических повреждений, нередко сопровождающихся кровопотерей. Актуальность проблемы обусловлена широким набором потенциальных осложнений тяжелых геморрагических травм, значительной продолжительностью их лечения и реабилитации. В этих условиях спортсмен вынужденно выходит из тренировочного и состязательного процессов, длительное время не получает эффективные физические нагрузки и в итоге детренируется. Для решения этой проблемы со- временная спортивная медицина развивается в направлении поиска новых высокоэффективных технологий радикального сокращения сроков лечения и реабилитации геморрагических травм у действующих спортсменов. В последние годы внимание ученых всего мира привлек феномен функциональной полимодальности тромбоцитов, безъядерных форменных элементов крови, принимающих непосредственное активное участие в запуске каскадного процесса образования кровяного сгустка (гемостатического тромба) в месте альтерации (повреждения) сосудистой стенки с последующей инициацией эксудативной и пролиферативной стадий реактивного воспаления. В результате в области травмы при участии тромбоцитов происходит не только остановка кровотечения (гемостаз), но и полноценное восстановление структурно-функциональной целостности поврежденных клеток и тканей (репаративная регенерация). Целью настоящего обзора является освещение некоторых тонких аспектов реализации механизма функциональной полимодальности тромбоцитов в обеспечении гемостаза в области геморрагической травмы и связанного с ним механизма репаративной регенерации поврежденных клеток и тканей при участии сравнительно недавно открытых тромбоцитарных факторов роста. В обзоре рассматриваются отдельные вопросы происхождения, ультраструктурной анатомии и функции тромбоцитов в обеспечении как системы гемостаза, так и на последовательных стадий посттравматического восстановления.
Тромбоциты крови, гистогенез, ультраструктурная анатомия, функциональная полимодальность, тонкие механизмы гемостаза, тромбоцитарные факторы роста, репаративная регенерация, ускорение восстановления тканей после травматических повреждений в спорте
Короткий адрес: https://sciup.org/142236968
IDR: 142236968 | УДК: 796.01:61 | DOI: 10.53742/1999-6799/3_2022_44_50
Текст научной статьи Морфо-функциональные механизмы гемостаза и ранних восстановительных процессов в тканях после травматических повреждений в спорте
Тромбоциты, открытые и изученные Giulio Bizzozero в 1882 году [9, 11], принимают непосредственное участие в инициации локального свертывания крови в форме тромба в месте трансмурального повреждения и разгерметизации стенки сосудистой трубки. В случае тяжелой травмы это предупреждает острую кровопотерю с развитием геморрагического шока, который уже сам по себе может представлять непосредственную угрозу жизни спортсмена. Т ромбоциты – это безъядерные, дисковидной формы клетки размером 2-3 мкм. По объему они примерно в 10 раз меньше эритроцитов. Содержание тромбоцитов в крови в норме от 150 до 350 в мкм 3 , а их средний объем 9-12 мкм 3 . Тромбоциты живут не более 10 дней. Тонкая структура зрелого тромбоцита представлена на рисунке 1 [10, с. 288].
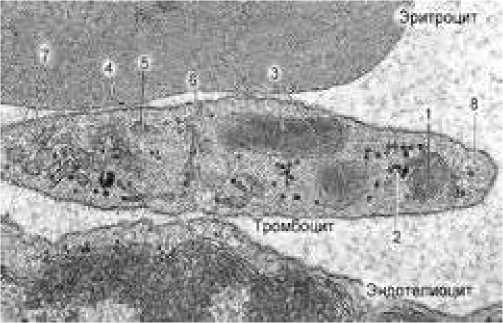
Рисунок 1. Электронограмма (×30,000) зрелого тромбоцита (в центре) между эритроцитом (сверху) и эндотелиоцитом сосудистой стенки (снизу); органоиды: 1 – митохондрии, 2 – глыбки гликогена, 3 – крупные гранулы «α-альфа», 4 – плотные гранулы «δ-сигма», 5 – гранулы «γ-гамма» (лизосомы), 6 – открытая канальцевая система, 7 – плотная трубчатая система, 8 – микротрубочки [10, с. 288].
В зрелом тромбоците выделяют четыре морфологически зоны: 1 – периферическая зона, 2 – структурная зона, 3 – зона органелл и 4 –зона мембранных каналь-циевых систем (рисунок 2) [10, с. 288].
Периферическая зона состоит из плазмолеммы, покрытой с внешней стороны развитым гликокаликсом из гликопротеинов, гликозаминогликанов и адсорбированными из плазмы протромбином и фибриногеном. Интегральные гликопротеины плазмолеммы обеспечивают в присутствии фактора Виллебранда рецептор-но адгезию и рецепторное связывание тромбоцитов к коллагену сосудистой стенки в месте дефекта [8, 9].
Структурная зона тромбоцита непосредственно примыкает к периферической зоне и представлена пучками микротрубочек вдоль экватора клетки, придавая ей характерную дисковидную форму в состоя- нии функционального мониторинга эндотелия. Между структурной и периферической зоной находятся контрактильные белки актина, миозина и тромбостенина. Актин и миозин оперативно изменяют дисковидную форму неактивного тромбоцита в многоотросчатую при экстренной активации в точке обнаружения сосудистого дефекта. Тромбостенин сжимает тела тромбоцитов в стадии ретракции (уплотнения) сгустка [10].
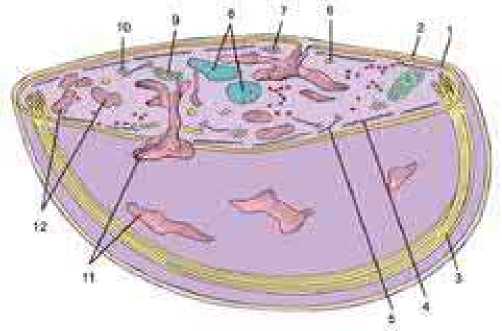
Рисунок 2. Трехмерная реконструкция неактивного тромбоцита; периферическая зона: 1 – плазматическая мембрана, 2 – гликокаликс; структурная зона: 3 – пучки микротрубочек (от 18 до 24) по экватору дисковидного тромбоцита, 4 – актин, 5 – миозин II; зона органелл: 6 – γ-гамма гранулы (лизосомы), 7 – гликоген, 8 – α-альфа гранулы, 9 – митохондрии, 10 – δ-сигма гранулы; зона мембранных канальцевых систем: 11 – открытая канальцевая система, 12 – плотная трубчатая система. [10, с. 288].
Зона органелл занимает центральную область тромбоцита. В ней находятся митохондрии, пероксисомы, глыбки гликогена и три основных типа специфических тромбоцитарных гранул. Наиболее многочисленны гранулы «α-альфа» типа. Их размеры достигают 300-500 нм. Они содержат фибриноген, тромбокиназу, плазминоген и его активатор, уникальную группу регуляторных молекул – тромбоцитарных факторов роста (Platelet-derived growth factor, PDGF), которые синтезируются в созревающих мегакариоцитах. Гранулы «α-альфа» играют важную роль в гемостазе, а именно в инициации массированной агрегации активированных тромбоцитов в зоне трансмурального дефекта в стадии незрелого «белого тромба» с последующей коагуляцией плазменных белков образованием и ретракцией сгустка в стадии зрелого «красного тромба» и, наконец, в развитии экссудативной и пролиферативной фаз реактивного воспаления в области посттравматического заживления. Гранулы «δ-сигма» типа более плотные. Они меньше по количеству, размерам, содержат макроэрги АДФ, АТФ и серотонин, который действует на гладкомышечные клетки сосудов регуляторного звена системы микроциркуляции, суживает их, замедляет кровоток и экстравазацию. Гранулы «δ-сигма» содержат также гистамин – медиатор реактивного воспаления в области альтерации. Гранулы «γ-гамма» типа – это лизосомы, гидролитические ферменты которых резорбируют старый тромб [10, 13].
Зона мембранных канальцевых систем тромбоцита состоит из открытой канальцевой системы (OCS) и плотной трубчатой системы (DTS) каналов. Открытая канальцевая система (OCS) является по существу фрагментом периферического участка цитоплазмы родительского мегакариоцита. Открытый канал представляет собою инвагинацию плазмолеммы в цитоплазму тромбоцита. Плотная трубчатая система каналов (DTS) – это гранулярный эндоплазматический ретикулум родительского мегакариоцита, содержащий значительные объемы ионов кальция. Плотная трубчатая система (DTS) не связана с внешней плазмолеммой, но образует коммуникации с открытой канальцевой системой (OCS) тромбоцита, что позволяет перемещать ионизированный кальций в качестве фактора свертывающей системы крови из тромбоцита на поверхность гликокаликса во внеклеточную среду [10].
Происхождение тромбоцитов. В соответствии с действующей классификацией, кровь является уникальной разновидностью соединительной ткани внутренней среды, клеточный состав которой у взрослого человека формируется красным костным мозгом в плоских и трубчатых костях. Три основные функции крови, транспортная, защитная и регуляторная, обеспечиваются сложным биохимическим составом плазмы, полиморфизмом и полифункциональностью ее форменных элементов, а также многовекторностью межклеточных взаимодействий [6]. Общепризнанная и действующая в настоящее время схема кроветворения А.И. Воробьева и И.Л. Черткова [4, 5] подразделяет все клетки крови на 3 основных класса: 1 – родоначальные или стволовые клетки (1-2%), 2 – созревающие или дифференцирующиеся клетки (25-40%) и, наконец, 3 – зрелые или дифференцированные клетки (60-75%). Родоначальные (стволовые) клетки 1 класса обладают потенциалом пролиферации до 100 митозов в течение жизни. Они способны дифференцироваться в направлении всех ветвей кроветворения как белой, так и красной крови. Созревающие клетки (полустволовые) 2 класса в каждой ветви кроветворения способны образовывать групповые колонии дифференцирующихся клеток с относительно небольшим пролиферативным потенциалом. Одной из разновидностей стволовых клеток являются колониеобразующие клетки 3 класса, КОЕ-Ме-гЭ. Они дают начало колониям будущих эритроцитов и мегакариоцитов. Каждая из этих колоний образует дифферон – последовательность дифференцирующихся клеток. В диффероне КОЕ-МегЭ это приводит к образованию зрелых тромбоцитов (рисунок 3).
Зрелый мегакариоцит III стадии зрелости (рисунок 4) [24, с. 287] является материнской клеткой молодых тромбоцитов, которые отделяются от нее по демаркационным линиям краевых цитомембран. Созревшие молодые тромбоциты покидают красный костный мозг
Рисунок 3. Дифферон КОЕ-МегЭ, формирующий популяцию зрелых тромбоцитов в последовательности: 1– мегакариобласт, 2 – промегакариоцит, 3 – мегакариоцит I, II и III стадии зрелости, 4 – молодые формы зрелых тромбоцитов [8, стр. 24].
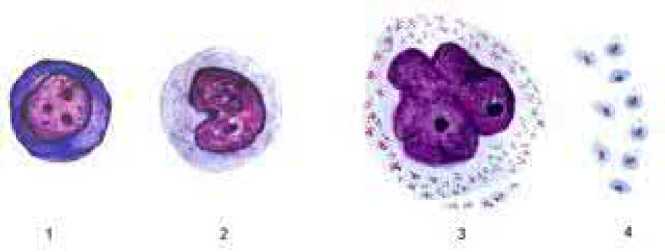
Рисунок 4. Электронная (×13,000) и световая (×1,000) микрофотографии зрелого мегакариоцита: 1 – двудольное ядро, 2 – линия пограничных точек по краю тромбоцита, 3 –плотная трубчатая система – DTS, 4 – открытая канальцевая система – OCS, 5–просвет между мегакариоцитом и отрывающимся тромбоцитом, 6 – α-альфа гранулы, 7 – δ-сигма гранулы, 8 –γ-гамма гранулы, 9 – гликоген, 10 – митохондрии, 11, 12 – молодой отделившийся тромбоцит, 13, 14 – цитоплазма зрелого мегакариоцита и ее вспененный край в области формирования тромбоцитов [10, с. 287].
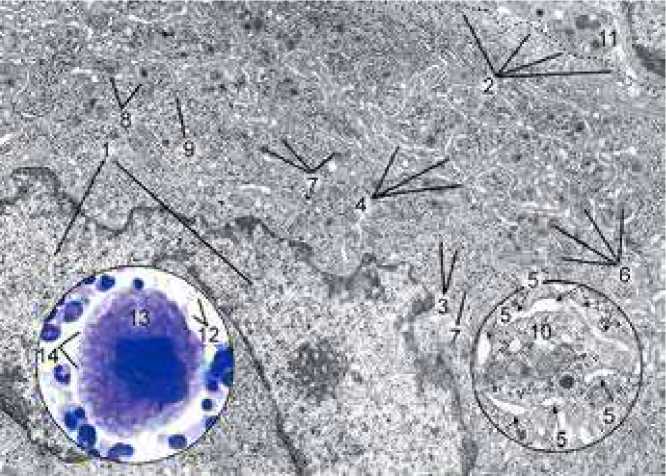
и выходят в общий кровоток как самостоятельный форменный элемент крови. Один мегакариоцит может быть источником образования около 800 зрелых тромбоцитов.
Функциональная полимодальность тромбоцитов достаточно хорошо изучена. Доказано, что тромбоциты непосредственно участвуют в:
-
- тромбоцитарной и коагуляционной стадиях гемостаза [6];
-
- активации и регуляции сложных процессов регенерации [1, 2];
-
- взаимодействии свертывающей и антисвертывающей систем крови [5];
-
- иммунологических реакциях [1, 6];
-
- реализации последовательных стадий реакции воспаления [10].
Основная функция тромбоцитов – участие в последовательных стадиях свертывания крови с образованием прочного герметизирующего тромба. Выделяют тромбоцитарную и коагуляционную стадии гемостаза.
Стадии тромбоцитарного гемостаза реализуются как внутренний каскадный процесс. Тромбоциты в кровотоке непрерывно наблюдают за состоянием эндотелиальной выстилки стенки кровеносных сосудов. Люминарная (обращенная к просвету сосуда) плаз-молемма эндотелиоцитов не контактирует с тромбоцитами, так как обладает тромборезистентностью за счет одноименного заряда отрицательной полярности. Плазмолемма тромбоцитов со стороны гликокаликса содержит специфические рецепторы к субэндотелиальному коллагену, который обнажается и становится доступен рецепторам в результате травматического отторжения эндотелиоцитов. Отторгающиеся эндо-телиоциты разрушаются, а содержащиеся в них тельца Вейбеля-Паладе выделяют в точке повреждения мультимерный белок – Фактор Виллебранда. Положительный заряд субэндотелиального коллагена электростатически притягивает тромбоциты к базальной пластинке и обеспечивает контакт между ними. Фактор Виллебранда усиливает электростатическое соединение между коллагеном базальной пластинки и рецепторами тромбоцитов за счет ковалентных химических связей. Это приводит к прочной адгезии тромбоцитов к поверхности сосудистого дефекта. Таким образом, контролируемая адгезия тромбоцита к обнаженному коллагену сосудистой стенки является первой стадией тромбоцитарного гемостаза. Активация тромбоцита на поверхности сосудистого дефекта указывает на развитие второй стадии тромбоцитарного гемостаза. Имеются основания считать, что активация тромбоцитов после адгезии происходит за счет пространственной реорганизации микротрубочек цитоскелета структурной зоны в миллисекундном диапазоне [5, 6]. Сигналы от тромбоцитарных рецепторов в точке повреждения сосудистой стенки достигают каналов плотной трубчатой системы (DTS) тромбоцита, из которых в цитоплазму высвобождаются ионы кальция. Они запускают пространственную реорганизацию цитоскелета дис- ковидного тромбоцита за счет контрактильных белков актина и миозина, ассоциированных с микротрубочками в структурной зоне тромбоцита. В результате наблюдающие дисковидные тромбоциты превращаются в высокоактивные многоотростчатые клетки, которые в кооперации с другими тромбоцитами закрывают дефект эндотелиальной выстилки. Метаморфоз активированных тромбоцитов не только увеличивает поверхность и силу контактного взаимодействия между субстратом и тромбоцитарной пробкой, но усиливает внутриклеточную компрессию цитоплазматических структур, что приводит их к взаимному сближению. В результате содержимое «α-альфа» и «δ-сигма» гранул заполняют просвет каналов OCS, откуда они выводятся на поверхность тромбоцитарного гликокаликса, а сами тромбоциты дегранулируются. В третьей стадии тромбоцитарного гемостаза адгезивность гликокалик-са после дегрануляции тромбоцитов быстро нарастает, а агрегация тромбоцитов существенно ускоряется. Образовавшаяся «белая» тромбоцитарная пробка блокирует экстравазацию.
Поверхность такой тромбоцитарной пробки формирует реакционную зону, где инициируется завершающая стадия гемостаза – коагуляционная .

Рисунок 5. «Белый» тромбоцитарный тромб: 1 – эндотелиоциты сосудистой интимы, 2 – активированные тромбоциты, 3 – адгезия тромбоцитов к субстрату, 4 – единичные захваченные эритроциты [12].
Стадии коагуляционного гемостаза – это последующие процессы каскадных ферментативных реакций, переводящих растворимый фибриноген плазмы крови в нерастворимый белок фибрин. На стадии тромбоцитарного гемостаза «белая» тромбоцитарная пробка не содержит нерастворимого фибрина и она недостаточно надежна, что объясняет рецидивы кровотечений после короткого периода гемостаза [7]. Главные плазменные факторы свертывания крови, протромбин и фибриноген, синтезируются в печени и попадают в кровоток по системе печеночных вен. Схема каскадных реакций а стадии коагуляционного гемостаза описана Моравицем в 1905 году [4]. Протромбин постоянно присутствует в крови в концентрации 3,36-4,0мг/100 мл плазмы. Тромбоцитарная цитокиназа в присутствии ионов кальция конвертирует протромбин в тромбин. В свою очередь, тромбин переводит растворимы белок фибриноген плазмы крови (2-4 г/л) в нерастворимый фибрин, который в виде нитей окончательно выпадает на тромбоцитарный сгусток и окутывает его. При участии тромбостенина фибриновый тромб подвергается окончательной ретракции, что делает его прочными и надежно фиксированным на субстрате.
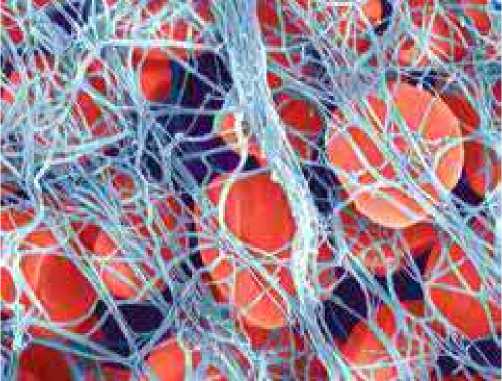
Рисунок 6. Фибриновые нити «красного тромба» [10, c. 289].
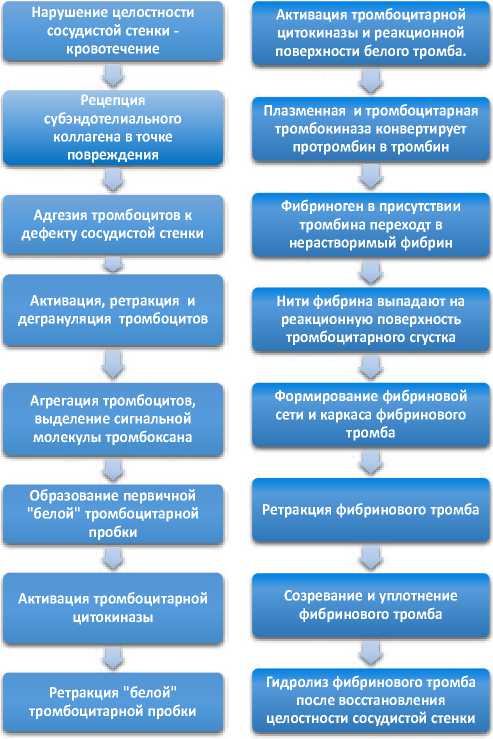
Рисунок 8. Стадии гемостаза коагуляционного
Рисунок 7. Стадии гемостаза тромбоцитарного
i/55PEzgZQYmROcA
NA66XmMfCWUmlw
Список литературы Морфо-функциональные механизмы гемостаза и ранних восстановительных процессов в тканях после травматических повреждений в спорте
- Анитуа Э. Плазма, богатая факторами роста: предварительные результаты использования при подготовке будущих мест для имплантатов. Оральные челюстно-лицевые имплантаты Int J. – 1999; 14: – С. 529-535.
- Вирник В.Л. «Пути переноса ионизированного лантана через десцеметов эндотелий роговицы кролика при экспериментальной аноксии», Москва, «Архив анатомии, гистологии и эмбриологии». – 1986. – №8. – С. 36-38., илл. 4.
- Вирник В.Л. «Ультраструктурная морфология заднего эпителия роговицы новорожденного ребенка», Алма-Ата, Сборник докладов Второго съезда офтальмологов Казахстана, Алма-Ата. – 1983. – 156 с., 1 с.
- Воробьев А.И. Схема кроветворения / А.И. Воробьев, Н.И. Дризе, И.Л. Чертков // Проблемы гематологии. – 1995. – Т. 1, №1. – 14 с.
- Куприянов В.В. Ангиогенез. Образование, рост и развитие кровеносных сосудов / В.В. Куприянов, В.А. Миронов. – М., Медицина, 1993. – 286 с.
- Липунова Е.А. Система красной крови: Сравнительная физиология: монография / Е.А. Липунова, М.Ю. Скоркина. – Белгород: Изд-во БелГУ, 2004. – 216 с.
- Макарова Г.А. Спортивная медицина: учебник. – М.: Советский спорт, 2003. – 480 с: ил.
- Ральченко И.В. Влияние аминогликозидов на тромбоцитарный и коагуляционный гемостаз / И.В. Ральченко, Е.А. Тетерина, Т.Х. Тимохина // Успехи современного естествознания. – 2003. – № 11. – С. 85-86.
- Юшканцева С.И. Гистология, цитология и эмбриология. Краткий атлас: учебное пособие / С.И. Юшканцева, В.Л. Быков. – 2-е изд., перераб. и доп. – СПб.: Издательство «П-2», 2007. – 120 с.: 279 илл.
- Chen X., Jones I.A., Park C. // The Efficacy of Platelet-Rich Plasma on Tendon and Ligament Healing: A Systematic Review and Meta-analysis With Bias Assessment. / Am. Journ. Sports. Med. 2018 Jul; 46: 2020-2032.
- Ross M.H, Pawlina W., Histology Text and Atlas With Correlated Cell and Molecular Biology. 2011, 6th ed., p.996.
- Vigliani,R. Giulio Bizzozero: Remenbrance 100 years after his death // Pathologica : journal. 2002. August (vol. 94, no. 4). P. 206-215.
- Интернет источник: https://disk.yandex.ru/i/55PEzgZQYmROcA
- Интернет источник: https://disk.yandex.ru/i/NA66XmMfCWUmlw
- Barman A., Mukherjee S., Sinha K., Sahoo J., Wiswanath A. // The benefit of platelet-rich plasma injection over institution-based physical therapy program in adhesive capsulitis patients with diabetes mellitus: prospective observational cohort study. / National Library of Medicine. 2021 Dec; 24(4):215-223.
- Grambart S. // Sports medicine and platelet-rich plasma: nonsurgical therapy / Clin. Podiatr. Med Surgery. 2015 Jan; 32(1):99-107.


