Морфофункциональная характеристика моноцитов периферической крови и их предшественников у потомства самок крыс с аутоиммунным поражением печени
Автор: Брюхин Геннадий Васильевич, Комарова Татьяна Михайловна
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Клиническая и экспериментальная медицина
Статья в выпуске: 1 т.16, 2016 года.
Бесплатный доступ
Цель. Исследование влияния экспериментального поражения печени матери аутоиммунного генеза на морфофункциональные особенности становления моноцитов в костном мозге потомства. Материалы и методы. Объектом исследования явились белые лабораторные половозрелые самки крыс «Вистар» с экспериментальным поражением печени и их потомство на 30-е и 60-е сутки постнатального развития, разделенные на две группы: контрольную и опытную. Хроническое аутоиммунное поражение печени моделировалось с помощью вакцины БЦЖ путем подкожной иммунизации с чередованием внутрибрюшинного введения печеночного антигена с интервалом в три дня. Результаты. Выявлено снижение абсолютного количества клеток на всех стадиях развития в экспериментальной группе животных по сравнению с контролем. Кроме этого, обнаружено уменьшение числа ШИК-позитивных клеток, активности кислой фосфатазы и содержания альфа-глицерофосфатдегидрогеназы в клетках моноцитарного ростка костного мозга и моноцитах периферической крови опытных групп исследуемых животных. Заключение. При экспериментальном поражении гепатобилиарной системы аутоиммунного генеза матери рождается потомство с нарушением моноцитопоэза, проявляющееся функциональной незрелостью моноцитов.
Эксперимент, патология печени, потомство, костный мозг, моноциты
Короткий адрес: https://sciup.org/147153300
IDR: 147153300 | УДК: 612.112.95 | DOI: 10.14529/hsm160107
Текст научной статьи Морфофункциональная характеристика моноцитов периферической крови и их предшественников у потомства самок крыс с аутоиммунным поражением печени
Актуальность настоящего исследования определяется необходимостью воспроизводства полноценного поколения. В последние годы отмечен рост числа бесплодных браков и рождение детей с различными патологиями. Наряду со многими причинами нарушения внутриутробного развития плода ведущая роль принадлежит экстрагенитальной патологии со стороны материнского организма, приводящая к ухудшению условий антенатального развития и, как следствие, перинатальной патологии плода. Заболевания гепатобилиарной системы как проявление экстрагенитальной патологии матери во время беременности осложняют течение самой беременности и увеличивают вероятность прогностически неблагоприятного исхода для потомства. Многочисленные экспериментальные и клинические исследования, проведенные сотрудника ми нашей кафедры, указывают на нарушения становления систем жизнеобеспечения у потомства матерей с хронической патологией гепатобилиарной системы, в том числе репродуктивной [6, 14, 16], иммунной [19], макрофагальной [1], эндокринной [116 17], пищеварительной [15] и др. Большинство фундаментальных процессов, находящихся в основе индивидуального развития, в настоящее время изучены недостаточно. В частности, под пристальным вниманием российских и зарубежных ученых находятся вопросы становления одной из важнейших систем человеческого организма - системы крови. Ранее сотрудниками кафедры гистологии, эмбриологии и цитологии ЮУГМУ в условиях эксперимента было установлено, что у самок крыс с хроническим поражением гепатобилиарной системы рождается потомство с нарушениями морфофункционального состояния моноцитов костного мозга и периферической крови [4, 5]. Неоспоримым фактом является положение о том, что резистентность любого живого организма во многом определяется состоянием ряда систем жизнеобеспечения, в том числе системы неспецифической защиты, основными агентами которой являются макрофаги [10]. Кроме того, данные клетки во многом определяют характер и интенсивность иммунологической реактивности организма [10]. Нарушение дифференцировки клеток моноцитарного ростка ведет к снижению и потере неспецифической резистентности организма.
Исходя из вышеизложенного, целью настоящего исследования явился анализ роли хронического поражения печени в нарушении морфофункционального становления клеток моноцитарного ростка костного мозга и моноцитов периферической крови у потомства.
Материалы и методы. Экспериментальное исследование было проведено на белых лабораторных крысах «Вистар» и их потомстве в различные периоды постнатального онтогенеза - на 30-й и 60-й день. Сроки проведения эксперимента были выбраны с учетом общепринятого подразделения возрастных периодов у крыс [13]. Работа с экспериментальными животными проводилась в соответствии с «Правилами проведения работ с использованием животных», утвержденными приказом М3 СССР № 755 от 12.08.77. Исследования проводились с учетом суточных колебаний. Животные исследуемых групп содержались в виварии в одинаковых условиях. Все животные были разделены на 2 группы. В первую группу выделено потомство от интактных крыс (контрольная группа - К) -42 животных из 12 пометов, во вторую группу (опытная группа О) включены были крысята от самок крыс с экспериментальным поражением печени -38 животных из 10 пометов. Для достижения поставленной цели исследования у подопытных животных моделировалось аутоиммунное поражение печени с помощью вакцины БЦЖ, путем подкожной иммунизации, с чередованием внутрибрюшинного введения печеночного антигена с интервалом в три дня.
В качестве объекта исследования изучались клетки моноцитарного ростка: монобласты, промоноциты, моноциты костного мозга и моноциты периферической крови. Выделение клеток костного мозга проводили по об- щепринятой методике [11]. Красный костный мозг получали из отпрепарированной от мышц бедренной кости забитого животного с отсеченными эпифизами путем выдавливания. Из полученного костного мозга изготавливали мазки. Моноциты периферической крови выделяли с помощью метода, основанного на седиментации их в одноступенчатом градиенте плотности фиколл-урографина (плотностью 1,077 г/см3) [20]. Метод получения монослоя клеток основан на способности мононуклеаров адгезироваться на чистой стеклянной поверхности [22]. Исследования проводили в мазках и в монослое клеток [9].
Количественный состав клеток производили в камере Горяева. Функциональное состояние клеток оценивали с помощью цитохимических методов исследования.
В мазках изучалась способность клеток к накоплению гликогена. С этой целью проводилась ШИК-реакция по Мак-Манусу, основанная на способности йодной кислоты окислять спиртовые группы, что при взаимодействии с реактивом Шиффа (фуксин - сернистая кислота) приводит к образованию кислотностойкого красителя красно-фиолетового цвета. ШИК-положительные вещества окрашиваются в красный цвет различных оттенков. Нейтральные мукополисахариды, содержащие гексозу - пурпурно-красные, гликоген - темнокрасный [3].
Количество накопленного клетками гликогена визуально оценивали полуколичест-венным методом с вычислением среднего цитохимического коэффициента по формуле Астальди и Верга (1957).
Активность кислой фосфатазы изучали с помощью реакции азосочетания. Альфа-глицерофосфатдегидрогеназу определяли по методу [8]. В результате реакции места размещения фермента выявляются по восстановлению тетразолия до формазанов, окрашенных в фиолетовый цвет.
Полученные цифровые данные обрабатывали на компьютере с использованием программы SPSS Statistics 17,0 (StatSoft, Inc.) Учитывая небольшую выборку животных, достоверность полученных результатов определяли при помощи непараметрического метода -критерия Манна-Уитни.
Результаты собственных исследований.
Проводилось определение содержания клеток моноцитарного ростка костного мозга и моноцитов периферической крови. Полученные результаты отражены в табл. 1.
Таблица 1
Table 1
Содержание клеток моноцитарного ростка костного мозга и моноцитов периферической крови у потомства самок крыс с аутоиммунным поражением печени в различные сроки постнатального онтогенеза (х 105в1 мл)
Count of bone marrow monocyte lineage and peripheral blood monocytes in progeny of female rats with autoimmune liver injury at different stages of postnatal ontogenesis (x 10° per 1 ml)
|
Группа Group |
Монобласты Monoblasts |
Промоноциты Promonocytes |
Моноциты КМ Bone marrow monocyte |
Моноциты ПК Peripheral blood monocytes |
||||
|
30-й день Day 30 |
60-й день Day 60 |
30-й день Day 30 |
60-й день Day 60 |
30-й день Day 30 |
60-й день Day 60 |
30-й день Day 30 |
60-й день Day 60 |
|
|
Контроль Control |
0,72 (0,5-1,0) |
1,02 (0.25-1,2) |
1,5 (1,25-1,75) |
1,74 (1,5-2,0) |
3,28 (2,5-4,0) |
3,27 (2,75-3,75) |
3,4 (2,25-4,0) |
3,32 (2,75-4,0) |
|
Опыт Experimental |
0,47 (0,25-0,75) |
0,27 (0,25-0,5) |
1,02 (0,75-1,25) |
0,65* (0,5-0,75) |
2 3 (2,0-2,5) |
1,75* (1,5-2,0) |
2,22 (2,0-2,5) |
1,6* (1,5-1,75) |
Примечание: * - 95 % ДИ.
Note: * - 95 % confidence interval.
В результате проведенного исследования у подопытных крысят на 30-й день постнатального развития было выявлена тенденция к уменьшению содержания в 1 мл взвеси клеток как незрелых клеток моноцитарного ростка -монобластов и промоноцитов, так и зрелых форм - моноцитов, что может указывать на возможное нарушение процессов дифференцировки моноцитов в костном мозге.
Подобная динамика наблюдается и в отношении моноцитов периферической крови -изменение содержания в 1 мл моноцитов периферической крови в опытной группе на 30-й день постнатального развития по сравнению с контролем. На 60-й день развития у крысят матерей опытной группы наблюдалось достоверное изменение количества всех клеток моноцитарного ростка - монобластов и промоноцитов по сравнению с контролем соответственно. В отношении зрелых форм наблюдается снижение количества моноцитов опытной группы по сравнению с контрольными животными. В то же время можно отметить уменьшение количества клеток моноцитарного ростка - монобластов и промоноцитов у 60-дневных крысят по сравнению с 30дневными в опытной группе животных, соответственно. В группе контрольных животных на 60-й день постнатального развития происходит закономерное увеличение содержания в 1 мл и клеток моноцитарного ростка, и зрелых форм моноцитов костного мозга и периферической крови, в сравнении с 30-дневным сроком. Обращает на себя внимание факт существенного различия количества моноцитов в костном мозге и моноцитов периферической крови. Наблюдается заметное уменьшение содержания в 1 мл моноцитов периферической крови в опытных группах 30-дневных и 60-дневных крысят, тогда как в контрольных группах мы видим закономерное увеличение количества моноцитов периферической крови 30-дневных и 60-дневных крысят, в сравнении с количеством в 1 мл моноцитов костного мозга тех же сроков соответственно.
Снижение количества моноцитов периферической крови опытных групп может быть вызвано либо нарушением процессов моноци-топоэза в костном мозге, либо массовой миграцией моноцитов в очаг воспаления в тканях.
В ходе изучения количественного соотношения клеток моноцитарного ростка костного мозга мы выявили тенденцию к снижению абсолютного количества клеток на всех стадиях развития в экспериментальной группе животных по сравнению с контролем, что связано с нарушением процесса моноцитопо-эза в красном костном мозге вследствие негативного влияния хронического поражения печени матери на гемопоэз потомства.
В следующей серии исследований была проведена оценка способности моноцитов различных стадий дифференцировки к накоплению гранул гликогена. Результаты исследования монобластов, промоноцитов моноцитов костного мозга представлены в табл. 2.
Из таблицы видно, что количество ТТТИК-позитивных незрелых клеток моноцитарного ростка костного мозга - монобластов и промоноцитов снижено в опытной группе по сравнению с контролем, соответственно на ЗО-й день постнатального развития.
Подобная закономерность наблюдается и в группе опыта и контроля на 60-й день развития. Такая же картина выявлена в отношении зрелых форм моноцитов периферической крови экспериментальных животных в сравнении с контрольной группой.
Обращает на себя внимание факт незначительного увеличения количества ТТТИК-позитивных клеток незрелых форм моноцитарного ростка - монобластов и промоноцитов на 60-й день постнатального развития в опытной группе по сравнению с 30-дневным сроком соответственно. Тогда как в контрольной группе животных, на этих же сроках, отмечается более интенсивное увеличение количества (ПИК-позитивных незрелых клеток моноцитарного ростка костного мозга. В отношении зрелых форм моноцитов костного мозга и периферической крови картина будет выглядеть иначе. Здесь мы четко прослеживаем тенденцию увеличения количества ТТТИК - позитивных клеток моноцитов костного мозга и периферической крови на сроке 60 суток по сравнению с 30-дневным сроком как в опытной, так и в контрольной группах животных. Можно отметить, что разница между контролем и опытом по мере повышения степени дифференцировки клеток увеличивается, что можно объяснить тем обстоятельством, что чем более зрелым становится моноцит, тем сильнее у него способность к запасанию питательных веществ, в частности, гликогена [2]. Что является необходимым ус- ловием для выполнения основных функций моноцита, в том числе фагоцитарной и кил-линговой [18].
Реализация защитных воспалительных функций полиморфноядерных лейкоцитов обусловлена мобилизацией внутриклеточных гранул. Экзоцитоз гранул крайне важен, так как именно он ответственен за появление лейкоцитов в очаге воспаления с развитием последующих защитных реакций. Одним из маркеров первичных (азурофильных) гранул служит кислая фосфатаза. Этот фермент вовлечен в регуляцию биологических процессов на разных уровнях. С его действием связано начало и осуществление многих биохимических процессов.
Учитывая, что кислая фосфатаза является маркером лизосомального аппарата, следующим этапом работы было изучение влияния патологии матери на активность кислой фосфатазы в моноцитарных клетках потомства. Исследование показало угнетение данного показателя в опытной группе по сравнению с контролем.
Обращает на себя внимание наименьшая активность кислой фосфатазы в незрелых клетках моноцитарного ростка - монобластах, во всех исследуемых группах животных. По мере созревания моноцитов этот показатель увеличивается, достигая наибольших значений в зрелых формах исследуемых клеток периферической крови. Причем, на сроке 60 суток активность кислой фосфатазы выше, чем у 30-дневного потомства во всех рассматриваемых группах животных.
Таблица 2
Table 2
Содержание ШИК-позитивных клеток моноцитарного ростка костного мозга и моноцитов периферической крови у потомства самок крыс с аутоиммунным поражением печени в различные сроки постнатального онтогенеза, %
Count of PAS positive cells of bone marrow monocyte lineage and peripheral blood monocytes in progeny of female rats with autoimmune liver injury at different stages of postnatal ontogenesis, %
|
Группа Group |
Монобласты Monoblasts |
Промоноциты Promonocytes |
Моноциты КМ Bone marrow monocyte |
Моноциты ПК Peripheral blood monocytes |
||||
|
30-й день Day 30 |
60-й день Day 60 |
30-й день Day 30 |
60-й день Day 60 |
30-й день Day 30 |
60-й день Day 60 |
30-й день Day 30 |
60-й день Day 60 |
|
|
Контроль Control |
2,23 (2,19-2,27) |
2,28 (2,24-2,32) |
2,35 (2,33-2,37) |
2,45 (2,41-2,49) |
2,44 (2,42-2,46) |
2,56 (2,52-2,6) |
2,48 (2,44-2,52) |
2,58 (2,54-2,62) |
|
Опыт Experimental |
1,99* (1,91-2,07) |
2,01* (1,97-2,05) |
2,1* (2.04-2,16) |
2,19* (2,13-2,25) |
2,24* (2,18-2,3) |
2,45* (2,39-2,51) |
2,27* (2,25-2,29) |
2,49* (2,39-2,59) |
Примечание: * - 95 % ДИ.
Note: * - 95 % confidence interval.
В результате проведенных исследований получены результаты, свидетельствующие о снижении активности кислой фосфатазы в незрелых клетках моноцитарного ростка костного мозга и моноцитах периферической крови потомства матерей с патологией гепатобилиарной системы.
доказанно имеет место при высокой сенсибилизации организма [12].
В последние годы широкое применение получил метод выявления митохондриальных дисфункций по активности митохондриальных ферментов в лейкоцитах крови, отражающие полисистемные изменения всего
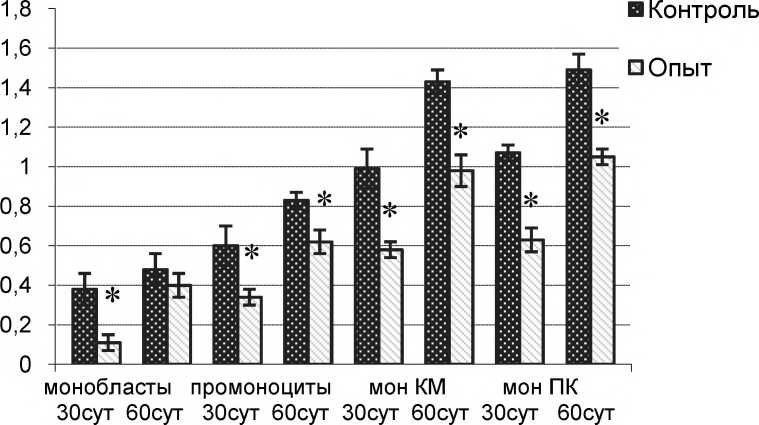
Интенсивность цитохимической реакции на кислую фосфатазу в клетках моноцитарного ростка костного мозга и моноцитов периферической крови у потомства самок крыс с аутоиммунным поражением печени в различные сроки постнатального онтогенеза, %
Intensity of acid phosphatase cytochemical reaction in cells of bone marrow monocyte lineage and peripheral blood monocytes in progeny of female rats with autoimmune liver injury at different stages of postnatal ontogenesis, %
Полученные нами данные находят подтверждение в ряде научных работ. При моделированных патологиях печени: токсической, аутоиммунной и холестатическом гепатите [3] происходит снижение киллинговой активности макрофагов, вероятно всего, обусловленное снижением активности кислой фосфатазы.
Кислая фосфатаза, в качестве маркера лизосом, отражает уровень дифференцировки и функциональной активности клетки [21]. Поэтому по снижению активности лизосомального гидролитического фермента в исследуемых нами клетках опытных групп можно судить об их функциональной неполноценности. Кроме того, секреция лизосомальных ферментов напрямую связана с состоянием стабильности клеточной мембраны: при лаби-лизации лизосомальных мембран происходит повышение выхода ферментов, при стабилизации - снижение [23]. Таким образом, повышенная активность, в данном случае, кислой фосфатазы в цитоплазме клеток подопытных животных наводит на мысль о нестабильности клеточных и лизосомальных мембран, что организма. В рамках этого проводится оценка активности, в том числе и митохондриального окислительно-восстановительного фермента -альфа-глицерофосфатдегидрогеназы, принимающего участие в гликолитическом пути расщепления углеводов. Уровень активности данного фермента напрямую зависит от эффективности митохондриального аппарата, а значит отражает степень обеспеченности клеток энергоемкими соединениями [12].
В ходе исследования нами было выявлено увеличение содержания а-ГФДГ в процессе постнатального развития в моноцитах периферической крови на рассматриваемых сроках экспериментальных групп. При анализе проводимого исследования обнаружена следующая закономерность - цитохимический коэффициент а-ГФДГ в опытной группе животных выше по сравнению с контролем.
Полученные нами результаты нашли подтверждение в работах ряда авторов, показавших аналогичную закономерность при моделировании хронического холестатического, аутоиммунного и токсического поражения гепатобилиарной системы [3].
Таблица 3
Table 3
Содержание а - ГФДГ в моноцитах периферической крови у потомства самок крыс с аутоиммунным поражением печени в различные сроки постнатального онтогенеза, %
Content ofa-GPDH in peripheral blood monocytes in progeny of female rats with autoimmune liver injury at different stages of postnatal ontogenesis, %
|
Группа Group |
Сроки Stages |
|
|
30 день Day 30 |
60 день Day 60 |
|
|
Контроль Control |
0,89(0,79-0,99) |
1,1(1,02 1,18) |
|
Опыт Experimental |
1,15(1,09-1,21)* |
1,29(1,23 1,35)* |
Примечание: * - 95 % ДИ.
Note: * - 95 % confidence interval.
Обнаруженные изменения могут быть объяснены нарушением гликолитического пути расщепления углеводов в моноцитарных клетках у потомства матерей с хронической патологией печени, что, неизбежно ведет к нарушению углеводного обмена [7, 21].
Заключение. Таким образом, результаты проведенных исследований наглядно демонстрируют, что при моделировании хронического аутоиммунного гепатита у потомства самок крыс происходит системное нарушение процессов жизнеобеспечения [3], сопровождающееся, в том числе, угнетением костномозгового кроветворения. Это проявляется в нарушении дифференцировки и созревания клеток моноцитарного ростка костного мозга, уменьшением числа моноцитарных клеток на различных стадиях костномозгового развития, что обуславливает снижение числа моноцитов в периферической крови. Изменение численного состава моноцитов протекает на фоне снижения их функционального состояния, на что указывает снижение содержания гликогена, а также уменьшение интенсивности гистохимической реакции на кислую фосфатазу и а-ГФДГ. В целом полученные результаты позволяют считать, что у самок крыс с хроническим экспериментальным аутоиммунным поражением печени рождается потомство со сниженной резистентностью.
Список литературы Морфофункциональная характеристика моноцитов периферической крови и их предшественников у потомства самок крыс с аутоиммунным поражением печени
- Барышева, С.В. Характеристика фагоцитарной активности перитонеальных и альвеолярных макрофагов при экспериментальном D-галактозаминовом поражении печени/С.В. Барышева, Г.В. Брюхин, А.А. Федосов//Морфология. -2008. -Т. 133, № 2. -С. 17.
- Бернет, Ф.М. Клеточная иммунология/Ф.М. Бернет. -М.: Мир, 1971. -720 с.
- Брюхин, Г.В. Влияние иммолизационного стресса на бактерицидную активность мононуклеарных фагоцитов у потомства животных с хроническим холестатическим поражением печени различной этиологии/Г.В. Брюхин, А.Ю. Грачев//Рос. вестник перинатологии и педиатрии. -1994. -Т. 39, № 2. -С. 35.
- Брюхин, Г.В. Сравнительный анализ субпопуляционного состава тимоцитов и Т-лимфоцитов периферической крови потомства самок крыс с хроническим экспериментальным поражением печени различного генеза/Г.В. Брюхин//Иммунология. -2004. -№ 2. -С. 83-86.
- Брюхин, Г.В. Роль экспериментального поражения печени матери в развитии физиологической незрелости потомства/Г.В. Брюхин, М.Л. Сизоненко//Бюл. экперим. биол. и мед. -2012. -Т. 154, № 11. -С. 544-547.
- Вторушина, Е.В. Характеристика инкреторной функции яичников потомства самок крыс с хроническим экспериментальным поражением печени различной этиологии/Е.В. Вторушина, Г.В. Брюхин//Проблемы репродукции. -2008. -№ 1. -С. 6-9.
- Коржевский, Д.Э. Основы гистологической техники/Д.Э. Коржевский, А.В. Гиляров. -М.: Спецлит, 2010. -94 с.
- Лабораторные животные. Разведение, содержание, использование в эксперименте/И.П. Западнюк, В.И. Западнюк, Е.А. Захария, Б.В. Западнюк. -3-е изд. перераб., доп. -Киев: Вища шк., 1983. -383 с.
- Луговская, С.А. Структура и функции моноцитов и макрофагов (обзор литературы)/С.А. Луговская//Клинич. лаборатор. диагностика. -1997. -№ 9. -С. 10-16.
- Мазуров, Д.В. Оценка внутриклеточного киллинга стафилококка фагоцитами периферической крови с помощью проточной цитометрии/Д.В. Мазуров, С.В. Дамбаева, Б.В. Пинегин//Иммунология. -2000. -№ 2. -С. 57-59.
- Маянский, А.Н. Очерки о нейтрофиле и макрофаге/А.Н. Маянский, Д.Н. Маянский. -Новосибирск: Наука: Сибир. отд-ние, 1989. -341 с.
- Николина, О.В. Морфофункциональное становление щитовидной железы самок крыс с хроническим поражением печени в раннем постнатальном периоде/О.В. Николина Г.В. Брюхин//К 100-летию со дня рождения профессора В.Г. Елисеева: сб. -М., 1999. -С. 134-135.
- От здоровой клетки к здоровому организму (Современные подходы к оценке и коррекции состояния ряда энергообеспечивающих систем организма в норме и патологии)/Т.Д. Измайлова, С.В. Петричук, В.М. Шищенко, И.В. Писарева//Лечащий врач. -2005. -№ 4. -С. 66-69.
- Романов, Б.К. Лекарственная регуляция активности лизосомальных ферментов/Б.К. Романов//Рос. мед.-биол. вестник им. акад. И.П. Павлова. -2003. -№ 1-2. -С. 75-82.
- Серышева, О.Ю. Морфофункциональная характеристика эпителия крипт двенадцатиперстной кишки у потомства самок крыс с экспериментальным поражением печени/О.Ю. Серышева, Г.В. Брюхин//Морфология. -2013. -Т. 144, № 4. -С. 36-40.
- Сизоненко, М.Л. Влияние хронической патологии печени матери на эндокринную функцию мужских половых желез потомства/М.Л. Сизоненко, Г.В. Брюхин//Проблемы репродукции. -2008. -№ 2. -С. 45-47.
- Солянникова, Д.Р. Характеристика парафолликулярных клеток щитовидной железы потомства самок крыс с хроническим экспериментальным поражением печени в различные сроки постнатального онтогенеза/Д.Р. Солянникова, Г.В. Брюхин//Морфология. -2013. -Т. 143, № 2. -С. 47-50.
- Строение и функции лейкоцитов. Гранулоциты: рук. по гематологии/О.Э. Виноградова, О.К. Гаврилов, Г.И. Козинец, Н.Б. Черняк. -М.: Медицина, 1985. -288 с.
- Федосов, А.А. Характер популяционных изменений лимфоцитов периферической крови при экспериментальном поражении гепатобилиарной системы различной этиологии/А.А. Федосов, С.В. Барышева//Актуальные проблемы патофизиологии: сб. -СПб., 2001. -С. 55-57.
- Фримель, Г. Иммунологические методы: пер. с нем./Г. Фримель. -М.: Медицина, 1987. -472 с.
- Фролова, О.Е. Морфофункциональная характеристика моноцитов. Значение исследования нуклеолярного аппарата (обзор литературы)/О.Е. Фролова//Клинич. лаборатор. диагностика. -1998. -№ 10. -С. 3-8.
- Хейфец, Л.Б. Разделение форменных элементов крови человека градиенте плотности верографин-фиколл/Л.Б. Хейфец, В.А. Абалакина//Лаборатор. дело. -1973. -№ 10. -С. 579-581.
- Чередеев, А.Н. Количественная и функциональная оценка Т-и В-систем иммунитета у человека/А.Н. Чередеев//Общие вопросы патологии. Итоги науки и техники. -М.: ВИНИТИ, 1976. -Т. 4. -С. 124-160.
- Шехтман, М.М. Руководство по экстрагенитальной патологии у беременных/М.М. Шехтман. -5-е изд. -М.: Триада-Х, 2011. -896 с.


