Морфометрический анализ полового диморфизма Asellus aquaticus (Сrustacea) на микропопуляционном уровне
Автор: Водунон Наиля Робертовна, Токинова Римма Петровна
Журнал: Принципы экологии @ecopri
Рубрика: Оригинальные исследования
Статья в выпуске: 1 (39), 2021 года.
Бесплатный доступ
Проведен сравнительный анализ морфометрической структуры и степени выраженности полового диморфизма у пресноводных ракообразных Asellus aquatics из небольшого родникового озера в природном заказнике «Голубые озера». На примере микропопуляций с различной средней сезонной плотностью из двух биоценозов, харовой водоросли Chara contraria (4.63 тыс. экз./м2) и листостебельного мха Fontinalis antipyretica (2.27 тыс. экз./м2), рассмотрены размерные характеристики тела и конечностей половозрелых и пререпродуктивных особей. Различия морфометрических параметров между полами проанализированы с помощью дискриминантного анализа и ANOVA. Выявлено, что самки и самцы достоверно различаются между собой по длине тела, ложноклешни (проподит L1), карпоподита L5 и по ширине плеотельсона. Наибольшей дисперсии из перечисленных признаков подвержен размер тела. При сравнении на микропопуляционном уровне у самок наибольшая нагрузка падает на длину тела. У самцов аспектирующими признаками в дискриминации являются длина ложноклешни и карпоподита L5. Различия в коэффициенте полового диморфизма в наибольшей степени выражены по длине ложноклешни и карпоподиту L5. Среди исследуемых фенотипических признаков длина головы демонстрирует наименьшие различия между полами и между особями сравниваемых микропопуляций. Предполагается, что пространственная неоднородность морфометрической структуры ракообразных обусловлена различной плотностью микропопуляций и связанными с ней регуляторными механизмами рождаемости и поведения. Изменение размеров самок является возможным проявлением механизма регуляции плодовитости; у самцов плотность влияет на поведенческие реакции, способствующие успеху в поиске и удержании партнера на стадии прекопулы.
Половой диморфизм, asellus aquaticus, микропопуляция, родниковое озеро, морфометрическая структура, статистический анализ
Короткий адрес: https://sciup.org/147231317
IDR: 147231317 | УДК: 57.087.1:591.4::565.373
Текст научной статьи Морфометрический анализ полового диморфизма Asellus aquaticus (Сrustacea) на микропопуляционном уровне
^ПРИНЦИПЫ ЭКОЛОГИИ
Одним из эффективных подходов в исследовании реакции популяции на изменение условий среды является анализ изменчивости морфологических признаков, отражающих размеры и форму организмов (Ермаков, Русановская, 2015). К числу таких признаков относятся размеры тела, которые непосредственно связаны со многими физиологическими и поведенческими реакциями, обеспечивающими приспособленность организма к условиям окружающей среды (Chown, 2010; Chown, Gaston, 2010; Silva et al., 2014). Многочисленные исследования размерных характеристик в биологии и экологии обусловлены существованием тесной взаимосвязи между размерами тела и компонентами физической формы. Известно, что более крупные самки являются более плодовитыми (Honěk, 1993; Pincheira-Donoso, Hunt, 2017). Увеличение размеров тела самок может происходить, если они имеют больший репродуктивный успех в связи с более высокой плодовитостью (Andersson, 1994) и если самцы предпочитают более крупных самок (Jormalainen, Tuomi, 1994; Sandercock, 1998; Bertin, Cezilly, 2005). Среди самок морфологические различия обнаруживаются, если они проявляют реакции сопротивления или терпимости к поведению самцов (Svensson et al., 2009). Кроме того, конкуренция между самками за пищевые ресурсы также может генерировать диморфизм между ними (Svensson et al., 2009). Конкуренция между самцами, соперничающими за самку, может способствовать увеличению размеров их тела (Lindenfors et al., 2003; Raihani et al., 2006), более крупные самцы часто более успешны при спаривании (Arriaga-Osnaya, 2017; Avila et al., 2017). Больший размер тела повышает боеспособность самцов в условиях высокой плотности населения (Bertin et al., 2002). Кроме того, организмы большего размера часто способны лучше справляться со стрессовой средой. Например, более крупные насекомые могут быть более устойчивыми к ограничению пищи и воды и могут выживать при более низких температурах во время зимовки (Kingsolver, Huey, 2008; Stillwell et al., 2010). Если ресурсов недостаточно и возникает конкуренция между полами, то могут последовать изменения в морфологии и размерах тела (Sandercock, 2001). Различные стратегии спаривания (охрана, территориальность) могут способствовать изменению степени и направле- ния полового диморфизма (ПД) (Andersson, 1994; Bertin, Cezilly, 2005). У разных таксонов эффект влияния полового отбора на половой диморфизм может варьировать (Teder, Tammaru, 2005). Механизмы, ведущие к внутривидовым изменениям, обсуждаются; высказывается необходимость рассмотрения внутривидовых вариаций ПД в сравнительных исследованиях на широко распространенных видах (Teder, Tammaru, 2005).
В качестве объекта исследования нами выбраны равноногие рачки Asellus aquaticus (Linnaeus, 1758). Этот вид широко распространен в пресных водоемах Европы и довольно хорошо изучен. В литературе имеются подробные данные по генеративному росту и развитию, плодовитости, культивированию водяного ослика (Желтенкова, 1952; Шпак, 1976; Жемаева, 1988; Хмелева, 1988; Младенова, 1991), особенностям экологии и жизненного цикла (Murphy, Learner, 1982), популяционной структуре (Панов, 1986), влиянию антропогенных факторов на жизненный цикл и плодовитость (Maltby, 1991). Несмотря на множественные аспекты изученности этого вида, работ по анализу морфометрических признаков Asellus aquaticus немного. Среди них следует отметить исследования по изменчивости морфометрических параметров самцов из нескольких европейских стран, на основе которых у водяных осликов выявлен высокий уровень полиморфизма и существование многочисленных географических рас (Prevorcnik et al., 2004); по взаимосвязи роста и размеров тела с продолжительностью жизни и наличием репродуктивной диапаузы в условиях водоемов северной и южной части Европы (Vitagliano et al., 1991); по количественной оценке различий в морфологии полов и их связи с сексуальным поведением A. aquaticus , о потенциальной роли полового отбора в ПД в условиях низкой и высокой плотности особей (Bertin et al., 2002; Bertin, Cezilly, 2005).
В отражении морфологических признаков у этого вида наблюдается приспособленность к условиям обитания, т. к. взаимосвязь морфологии и функции универсальна (Hendry et al., 2008). Данный факт делает A. aquaticus интересным объектом для изучения направлений и механизма ПД (Bertin et al., 2002; Bertin, Cezilly, 2005; Konec et al., 2015).
Цель работы – охарактеризовать морфометрические параметры полового диморфизма A. aquaticus и степень их изменчи- вости на примере двух микропопуляций из одного родникового озера.
Материалы
Район исследования. Озеро Большое Голубое (рис. 1) расположено в лесной зоне Вятско-Камской возвышенности на правобережной надпойменной террасе р. Казанки (Среднее Поволжье, Татарстан, Российская
Федерация). Озеро (площадь 2.73 га) родниковое, температура воды в зоне выхода подземных вод постоянна на протяжении всего года и составляет 6–7.4 °С (Токинова и др., 2017); относится к редкому для Среднего Поволжья типу солоноватых карстовых водоемов. Озеро безрыбное, доминирующим видом в донных сообществах является A. aquaticus .
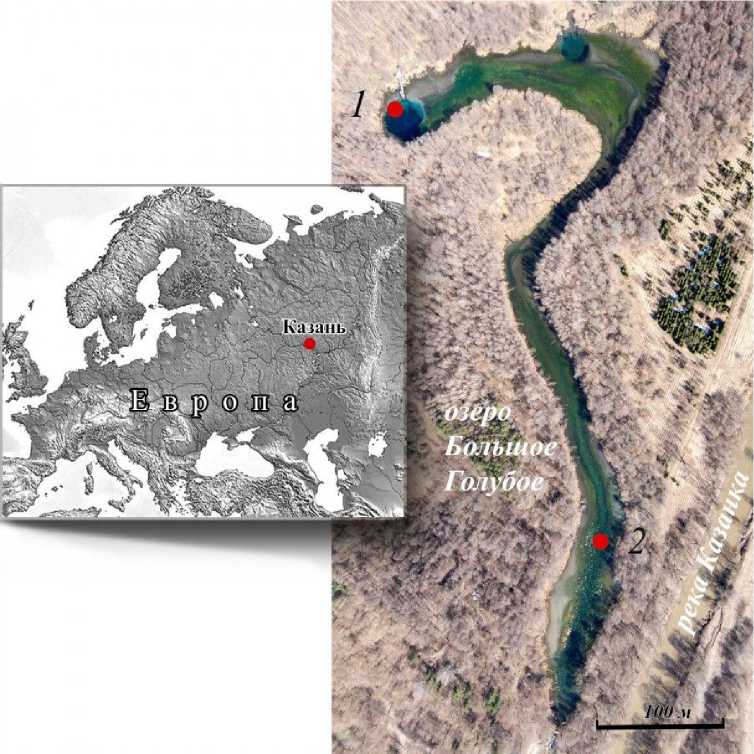
Рис. 1. Карта оз. Большое Голубое с местом расположения станций (1, 2) для отбора материала Fig. 1. Map of Lake Bol'shoye Goluboye with the location of sampling stations (1, 2)
Методы
Сбор материала. Для исследований использован материал, отбиравшийся ежемесячно с апреля по октябрь 2016 г. на двух станциях оз. Бол. Голубое (см. рис. 1). Станция 1 (ст. 1, глубина 4–5 м) представляет собой биоценоз листостебельных мхов Fontinalis antipyretica Hedw., расположенных в северной части озера, на склоне глубокой карстовой воронки, со дна которой идет выход напорных подземных вод. Станция 2 (ст. 2, глубина 1.5–2 м) – биоценоз харовых водорослей Chara contraria (A. Braun ex Kutzing 1845), расположенный в 600 м ниже по те- чению от ст. 1, в южной мелководной части озера. Сбор проб осуществлен с помощью дночерпателя Петерсона (0.025 м2) в трех повторностях. Из извлеченных и промытых проб макробентоса выбраны неповрежденные особи A. aquaticus всех возрастов. Материал зафиксирован раствором 70%-ого этилового спирта. В общей сложности отобрано и измерено 929 (ст. 1) и 1640 (ст. 2) рачков. Для измерений выбраны следующие признаки (Bertin et al., 2002; Prevorcnik et al., 2004): длина тела (Lb), головы (Lh), длина (Lp) и ширина (Wp) плеотельсона; для члеников переопод (грудных ног): длина пропо- дита первой пары (L1), карпоподита четвертой и пятой пар (L4 и L5) (рис. 2). Размеры учтены как линейные расстояния на прижатых покровным стеклом особях, помещенных в каплю глицерина. Измерения проведены с помощью окулярмикрометра, под бинокулярным микроскопом при увеличении ×16.
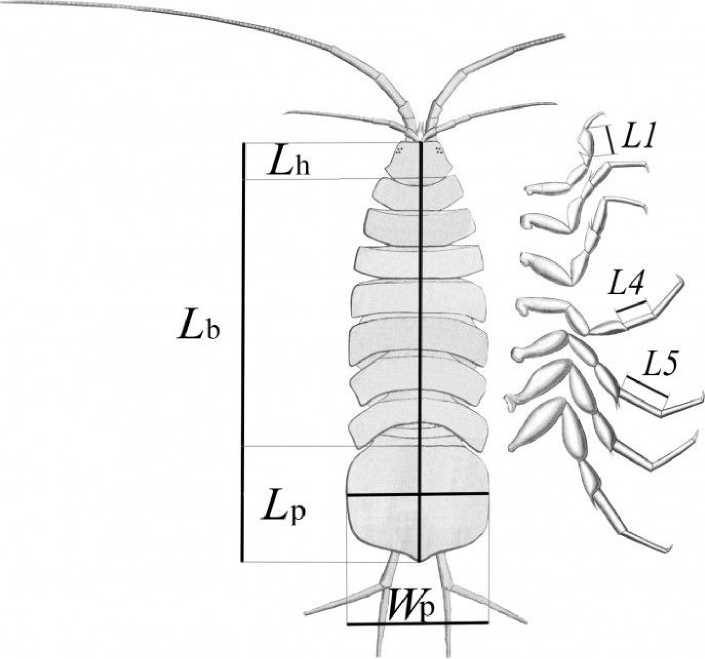
Рис. 2. Схема измерения размеров тела и конечностей у A. aquaticus , вид со спины Fig. 2. Body and limb size measurement scheme of A. aquaticus , dorsal view
Наступление половозрелости у самок определялось следующим образом: наименьший размер тела самок с марсупиумом (яйценосной сумкой) составлял 5.5 мм. Самок такого размера и крупнее относили к половозрелым, более мелких особей – к пре-репродуктивному возрасту. К половозрелым самцам относили особей с длиной тела от 6 мм и выше. Зрелость самцов определяли по плеоподам – видоизмененным брюшным конечностям, участвующим в размножении, и ложноклешням, используемым для удержания самок. При достижении половой зрелости структуры, участвующие в размножении, у ракообразных резко увеличиваются, что используется для дифференциации популяции по половозрелости (Pinheiro, Fransozo, 1998; Mariappan, Balasundaram, 2004). Плодовитость самок оценивали подсчетом количества яиц в марсупиуме. Показатель плодовитости A. aquaticus оценивался как число яиц, вынашиваемых самками в марсупиуме.
Коэффициент полового диморфизма рассчитан по формуле: КПД = (Xm – Xf) / Xf, где Xm и Xf – средние величины признаков для самцов и самок.
Cтатистическая обработка материала осуществлена в программах Excel 07, Statistica 9.0 и Past 3.
Дискриминантный анализ – комплекс методов многомерного статистического анализа, дающих возможность изучать межгрупповые различия по нескольким переменным одновременно. Переменные, применяемые для разделения объектов на группы, называются группирующей переменной, в нашем случае – это исследуемые факторы, такие как пол, биоценоз, месяц исследования. Переменные, которыми оперируют для поиска различий между группами, называют дискриминантными переменными (Боровиков, 2003; Бессокирная, 2003). Дискриминантными переменными в данном исследовании являются анализируемые нами фенотипические показатели, такие как длина тела, головы, длина и ширина плеотельсона, длина проподита перейопода первой пары, длина карпоподита перейопода четвертой и пятой пар. Таким образом, результаты дискриминантного анализа демонстрируют различия в морфометрической структуре исследуемых популяций в зависимости от пола, сезона и биоценоза.
Квадрат расстояния Махаланобиса отражает корреляции между переменными в модели. Большее расстояние квадрата расстояния Махаланобиса свидетельствует о большем различии между центроидами групп зависимых переменных.
Значение Wilks’ λ (лямбды Уилкса) принадлежат интервалу от 0 до 1; значения, стремящиеся к нулю, свидетельствуют о высокой когезивности признака в рамках анализируемого фактора, т. е. о большей дискриминации.
F -критерий Фишера – отношение межгрупповой дисперсии к объединенной внутригрупповой дисперсии. Если межгрупповая дисперсия оказывается существенно больше, тогда это должно означать различие между средними. Таким образом, F -критерий дает ответ на вопрос, имеются ли значимые различия между группами (с точки зрения всех переменных).
Статистически значимые различия между группами при р < 0.05 помечены одной звездочкой *, при р < 0.01 – двумя ** и при р <
0.001 – тремя ***
.
Объединенные внутригрупповые корреляции переменных (структурные функции) отображают связь каждой переменной с дискриминантной функцией. При стремлении значений канонических корней к единице увеличивается корреляция с соответствующей дискриминантной функцией (Ха-лафян, 2008).
Результаты
В ходе исследований установлено, что количественное развитие микропопуляций A. aquaticus и их сезонная динамика в ма-крофитных биоценозах на разных участках озера значительно отличаются. Так, средневегетационная плотность особей в биоценозе Chara (ст. 2) достигает 4.63 тыс. экз. и 34.82 гр. на м2, что в 2 раза превышает таковые в биоценозе Fontinalis (ст. 1: 2.27 тыс. экз. и 19.10 гр. на м2). В ходе вегетационного сезона плотность ослика в карстовой воронке имеет сглаженную сезонную динамику (1.21–3.34 тыс. экз./м2) с тенденцией на постепенное снижение от весны к осени. На ст.
2 этот показатель демонстрирует значительный рост в летние месяцы с максимумом значений в июле (до 12.12 тыс. экз./м2).
Рассмотрим размерные характеристики зрелых самок и самцов, сравнив выборки из двух биоценозов. Как показано на рис. 3, в исследуемых выборках отмечается достоверное различие полов по фенотипу. Длина тела, длина проподита ложноклешни L 1 и карпоподита L 5 у самцов существенно выше, чем у самок. Размеры этих параметров у самцов, населяющих склон карстовой воронки (ст. 1), достоверно выше, чем у самцов из мелководной части озера (ст. 2). Половые различия в длине плеотельсона L p и карпоподита L 4 значимо выражены лишь на ст. 2.
По результатам анализа ANOVA (табл. 1) следует, что измеренные морфометрические параметры существенно различаются между полами, за исключением длины головы и карпоподита L 4. Наибольшие различия между полами приходятся на такие признаки, как длина тела L b и длина проподита L 1. Условия обитания оказывают влияние на морфометрическую структуру, но в меньшей степени, чем половая принадлежность. Влияние биоценоза на морфометрию водяного ослика в наибольшей степени выражено по длине карпоподита L 5 и проподита L 1.
Дискриминантный анализ показывает статистически значимые различия между полами репродуктивной и пререпродуктив-ной групп (рис. 4; Wilks’ λ = 0.3; p < 0.00001). По значениям р -level и квадрата расстояния Махаланобиса сравниваемые группы статистически значимо различаются (табл. 2). Значения F опровергают нулевую гипотезу о равенстве выборок. Следовательно, самки и самцы репродуктивной группы различаются между собой по морфометрическим показателям тела так же, как и особи пререпродук-тивной группы.
Анализ дискриминантных функций по полу показывает, что проанализированные признаки варьируют в пределах групп примерно с равной Wilks’ λ, которая между полами колеблется от 0.29 до 0.34 единиц, наибольшая лямбда Уилкса и, соответственно, варьирование размеров внутри выборок отмечено для длины тела - 0.34 ед. (табл. 3). Между самками сравниваемых выборок значимые отличия наблюдаются по длине тела и карпоподита L 5, между самцами – по длине тела, карпоподита L 5, проподита L 1, ширине плеотельсона. По показателям F-статистики в наибольшей степени разли-
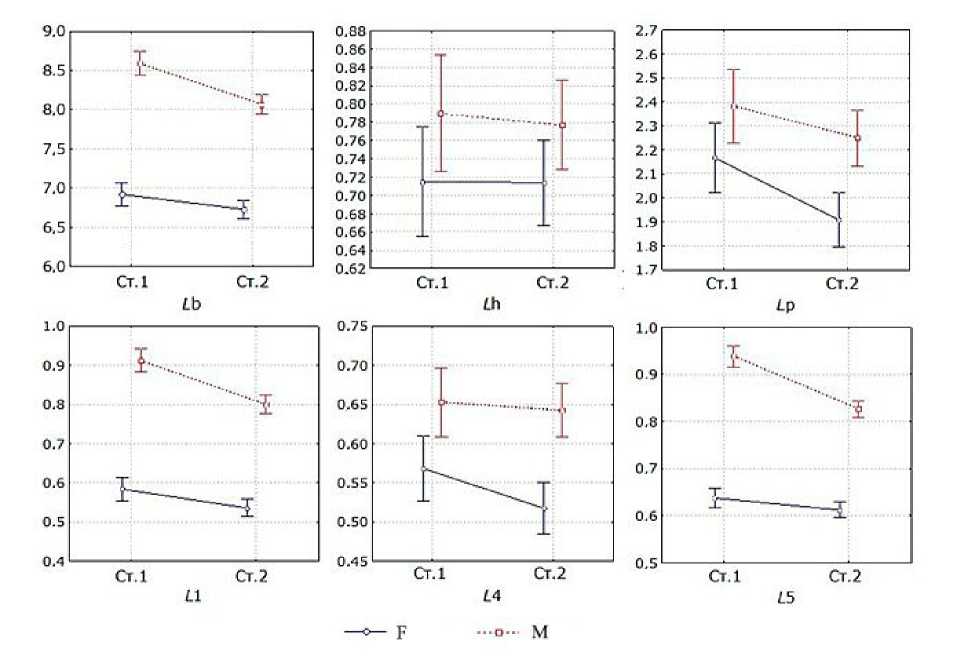
Рис. 3. Средние значения морфометрических параметров самцов (M) и самок (F) A. aquaticus на ст. 1 и ст. 2, оз. Большое Голубое
Fig. 3. Average values of morphometric parameters of males (M) and females (F) of A. aquaticus from stat. 1 and stat. 2, Lake Bol'shoye Goluboye
Таблица 1. Результаты анализа ANOVA по определению морфометрических различий
|
Параметр |
L b |
L h |
L 1 |
L 4 |
L 5 |
L p |
W p |
|
Пол |
304*** |
0.58 |
165.2*** |
1.19 |
95.81*** |
31.65*** |
46.94*** |
|
Биоценоз |
15.24*** |
0.05 |
21.64*** |
2.38 |
23.35*** |
8.2** |
10.1** |
Примечание. ** – р < 0.001; *** – p < 0.0001.
Таблица 2. Значения квадрата расстояния Махаланобиса и F фактора между группами
По результатам объединенных внутригрупповых корреляций матрицы, содержащей в качестве группирующей переменной пол, выяснилось, что аспектирующими признаками при дискриминации являются длина тела, карпоподита L5, ширина и длина плеотельсона (табл. 4). Между самками сравниваемых выборок наибольшая нагрузка падает на длину тела, между самцами – на проподит L1 и карпоподит L5.
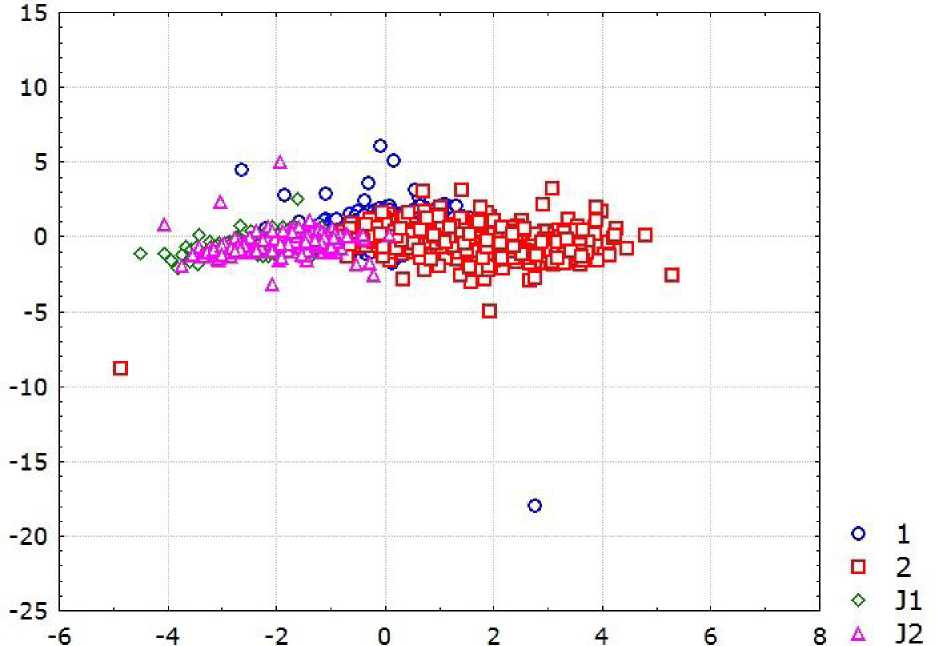
Рис. 4. Распределение между группами A. aquaticus в плоскости дискриминантых осей с группирующими переменными по половой принадлежности (λ Wilks' = 0.3; approx. F (21.37) = 92.36, p < 0.00001): 1 – самки, 2 – самцы, J1 – пререпродуктивные самки, J2 – пререпродуктивные самцы
Fig. 4. Distribution between groups of A. aquaticus in the plane of discriminant axes with grouping variables by sex [(λ Wilks' = 0.3; approx. F (21.37) = 92.36, p < 0.00001); 1– females, 2 – males, J1 – prereproductive females, J2 – prereproductive males
Таблица 3. Сводка анализа дискриминантных функций
|
Пол |
Самки двух сообществ |
Самцы двух сообществ |
||||
|
λ Wilks' |
F-remove |
λ Wilks' |
F-remove |
λ Wilks' |
F-remove |
|
|
L b |
0.34* |
62.43* |
0.45* |
128.27* |
0.39* |
14.59* |
|
L h |
0.29 |
0.93 |
0.29 |
0.71 |
0.36 |
0.21 |
|
L 4 |
0.29 |
1.29 |
0.29 |
1.65 |
0.37 |
1.24 |
|
L 5 |
0.32* |
32.09* |
0.30* |
6.32* |
0.37* |
4.38* |
|
L p |
0.29 |
0.43 |
0.29 |
1.23 |
0.36 |
1.18 |
|
W p |
0.30* |
7.51* |
0.29 |
2.40 |
0.37* |
4.07* |
|
L 1 |
0.32* |
28.27* |
0.29 |
1.34 |
0.37* |
5.88* |
Примечание. * – р < 0.01.
Таблица 4. Объединенные внутригрупповые корреляции группирующих переменных внутри групп
|
Пол |
Самки двух сообществ Самцы двух сообществ |
||
|
root 1 |
root 1 |
root 1 |
|
|
L b |
0.97 |
0.64 |
-0.53 |
|
L h |
0.16 |
0.01 |
-0.06 |
|
L 4 |
0.30 |
0.60 |
-0.04 |
|
L 5 |
0.88 |
0.62 |
-0.77 |
|
L Р |
0.29 |
0.49 |
-0.47 |
|
W p |
0.73 |
0.57 |
-0.36 |
|
L 1 |
0.67 |
0.56 |
-0.80 |
|
Показатель плодовитости A. aquaticus , выраженный числом яиц в марсупиуме самки, находится в пределах 2–57 яиц (в среднем 25.11 ± 1.62) на ст. 1. В мелководной части озера, на ст. 2, он находится в более узком диапазоне – от 2 до 47 яиц (в среднем 17.33 ± |
0.75). По результатам корреляционного анализа (табл. 5) наблюдается умеренная связь плодовитости с размером тела ( R = 0.5) и с местом расположения участка ( R = 0.28). Зависимость количества яиц с размером тела выражена сильнее, чем с местом обитания. |
||
Таблица 5. Результаты корреляционного анализа плодовитости с анализируемыми факторами
|
Станция |
L b |
L h |
L 4 |
L 5 |
L p |
W p |
L 1 |
|
|
Число яиц |
0.28* |
0.50* |
0.03 |
0.11 |
0.10 |
0.09 |
0.09 |
0.07 |
Примечание. * – p < 0.05.
КПД О
-0.05
-0.15
-0.2
-0.25
Lh Lp Иф 14 Lb L5 L1
8 ° ■
о о ° R
-0 3
-0.35
-0.4

о-1 o-2
Рис. 5. Коэффициент полового диморфизма (КПД) A. aquaticus и его изменения в сравниваемых выборках: 1 – ст. 1, 2 – ст. 2
Fig. 5. The coefficient of sexual dimorphism (КПД) of A. aquaticus and its changes in the compared samples: 1 – stat. 1, 2 – stat. 2
Карпоподит L 5 статистически значимо крупнее у самцов из биоценоза Fontinalis . Длинные конечности пятой пары ног способствуют быстрому передвижению (Bertin et al., 2002). Самцы ведут активный поиск партнерши, и увеличение конечностей способствует повышению скорости бега, с одной стороны (Бирштейн, 1951; Панов, 1986), и снижают скорость погружения, увеличивая риск стать жертвой хищника, с другой стороны. В биоценозе Chara с более высокой плотностью осликов, среди которых доля самок преобладает, увеличение скорости бега для самцов не является основным условием для успешного поиска и спаривания; возможно, это одна из причин, почему у них развиваются сравнительно более короткие карпоподиты L 5. У самок этот признак существенно не отличается.
Значения КПД по длине плеотельсона указывают на его незначительные отличия у полов, наиболее выраженные на ст. 2. Размер плеотельсона аллометрически связан с общим размером тела. В озерах с круглогодичным размножением водяные ослики для компенсации постоянного роста численности популяции снижают размеры тела, т. к. от них зависит то количество яиц, которое сможет выносить самка (Vitagliano et al., 1991). Сравнительно более высокий коэффициент ПД по
L p на ст. 2 сопряжен со снижением размера тела и, соответственно, длины плеотельсона у самок. Наблюдаемая при этом зависимость в снижении числа яиц в марсупиуме самок, по-видимому, является проявлением механизма регуляции плодовитости у A. aquaticus в условиях возрастающей плотности микропопуляции.
Среди исследуемых морфометрических признаков длина головы демонстрирует наименьшие различия между полами. КПД по L h также не показывает значимых различий на микропопуляционном уровне.
Заключение
На примере локальной популяции A. aquaticus из небольшого родникового озера изучены различия в морфометрических параметрах тела и конечностей самцов и самок. Дискриминантный анализ подтверждает существование значимых различий между полами у особей как репродуктивной, так и пререпродуктивной групп по всем исследованным признакам. Между самцами и самками в большей степени различаются такие признаки, как длина тела, длина проподита L 1, карпоподита L 5 и ширина плеотельсона. Наибольшей дисперсии из перечисленных признаков подвержен размер тела. При сравнении на микропопуляционном уровне у самок наибольшая нагрузка падает на длину
тела, что, возможно, обусловлено проявлением механизма регуляции плодовитости в условиях возрастающей плотности. У самцов аспектирующими признаками в дискриминации являются длина проподита L 1 и карпо-подита L 5, что обуславливает успех в поиске и удержании партнера в период прекопулы.
Таким образом, пространственная неоднородность морфометрической структуры ракообразных, как предполагается, обусловлена различной плотностью микропопуляций на различных участках озера и связанными с ней регуляторными механизмами рождаемости и поведенческими реакциями.
Список литературы Морфометрический анализ полового диморфизма Asellus aquaticus (Сrustacea) на микропопуляционном уровне
- Бессокирная Г. П. Дискриминантный анализ для отбора информативных переменных // Социология:4М. 2003. № 16. С. 25–35.
- Бирштейн Я. А. Пресноводные ослики (Asellota) . М.; Л.: АН СССР, 1951. 142 с.
- Боровиков В. П. STATISTICA. Искусство анализа данных на компьютере . СПб.: Питер, 2003. 687 с.
- Ермаков Е. Л., Русановская О. О. Сезонная динамика фенотипической структуры природной популяции Epischura baicalensis Sars по количественным морфологическим признакам // Сибирский экологический журнал. 2015. № 2. С. 238–247.
- Жемаева Н. П. Asellus aquaticus L. и Gammarus pulex (L.) как объекты интродукции в рыбоводные пруды : Автореф. дис. ... канд. биол. наук. М., 1988. 23 с.
- Желтенкова М. В. Размножение и рост водяного ослика (Asellus aquaticus L.) // Труды Всесоюзного гидробиологического общества. 1952. Т. 4. С. 132–150.
- Младенова А. Г. Зависимость роста водяного ослика от температуры // Гидробиологический журнал. 1991. Т. 27, № 2. C. 100–105.
- Панов В. Е. Рост и продукция Asellus aquaticus (L.) в прибрежных зарослях Невской губы Финского залива // Исследования пресноводных и морских беспозвоночных животных (Труды Зоологического института). Л.: АН СССР, 1986. Т. 152. С. 142–161.
- Токинова Р. П., Бердник С. В., Буторова Л. Е., Любарский Д. С., Андреева М. Г., Абрамова К. И., Любин П. А. Биоразнообразие голубых озер Приказанья // Российский журнал прикладной экологии. 2017. № 4. С. 16–20.
- Халафян А. А. Statistica 6. Статистический анализ данных . М.: ООО Бином-Пресс, 2008. 512 с.
- Хмелева Н. Н. Закономерности размножения ракообразных . Минск: Наука и техника, 1988. 204 с.
- Шварц С. С. Эволюционная экология животных: Экологические механизмы эволюционного процесса . Свердловск: РИСО УФ АН СССР, 1969. 199 с.
- Шпак А. Д. Размножение и продукция водяного ослика (Asellus aquaticus L.) в оз. Шогоярви // Гидробиологический журнал. 1976. Т. 12, № 1. C. 104–105.
- Andersson M. Sexual Selection. Princeton: Princeton Uniersity Press, 1994. 599 p.
- Arriaga‐Osnaya B. J. Are body size and volatile blends honest signals in orchid bees? // Ecology and Evolution. 2017. Vol. 7. Issue 9. P. 3037–3045. DOI: 10.1002/ece3.29
- Avila G. A., Withers T. M., Holwell G. I. Courtship and mating behaviour in the parasitoid wasp Cotesia urabae (Hymenoptera: Braconidae): mate location and the influence of competition and body size on male mating success // Bull. of Entomol. Res. 2017. Vol. 107. Р. 439–447. DOI: 10.1017/S0007485316001127
- Balesdent M. L. Recherches sur la sexualité et le déterminisme des caractères sexuels d’Asellus aquaticus Linné (Crustacé Isopode). Unpubl. DPhil Thes. Univ. de Nancy, 1964. 231 р.
- Bertin A., Cezilly F. Density-dependent influence of male characters on mate-locating efficiency and pairing success in the waterlouse Asellus aquaticus: An experimental study // The Zoological Soc. of London J. of zoology. 2005. Vol. 265. Issue 4. P. 333–338. DOI: 10.1017/S0952836905006400
- Bertin A., David B., Cezilly P. Quantification of sexual dimorphism in Asellus aquaticus (Crustacea: Isopoda) using outline approaches // J. of the Linnean Soc. 2002. Vol. 77. P. 523–533. DOI: 10.1046/j.1095-8312.2002.00125.x
- Chown S. L. Temporal biodiversity change in transformed landscapes: a southern African percpective // Philosoph. Trans. of the Royal Soc. Biol. Scien. 2010. Nov. P. 3729–3742. DOI: 10.1098/rstb.2010.0274
- Chown S. L., Gaston K. J. Body size variation in insects: a macroecological perspective // Biological Reviews. 2010. Vol. 85. Issue 1. P. 139–169. DOI: 10.1111/j.1469-185X.2009.00097.x
- Hendry A. P., Farrugia T. J., Kinnison M. T. Human influences on rates of phenotypic change in wild animal populations // Molecular Ecology. 2008. Vol. 17. Issue 1. P. 20–29.
- Honěk A. Intraspecific Variation in Body Size and Fecundity in Insects. A General Realationship // Oikos. 1993. Vol. 66, No 3. P. 483–492. DOI: 10.2307/3544943
- Jormalainen M. S., Tuomi J. Male Choice and Male‐male Competition in Idotea baitica (Crustacea, Isopoda) // Ethology. 1994. Vol. 96. Issue 1. P. 46–57.
- Kingsolver J. G., Huey R. B. Size, temperature and fitness: three rules // Evol. Ecology Res. 2008. Vol. 10. P. 251–268.
- Konec M., Prevorcnic S., Sarbu M., Verovnik R., Trontelj P. Parallels between two geographically and ecologically disparate cave invasions by the same species Asellus aquaticus (Isopoda, Crustacea) // J. of Evol. Biology. 2015. Vol. 28. P. 864–875.
- Lindenfors P., Székely T., Reynolds J. D. Directional changes in sexual size dimorphism in shorebirds, gulls and alcids // J. of Evol. Biology. 2003. Vol. 16. Issue 5. P. 930–938. DOI: 10.1046/j.1420-9101.2003.00595.x
- Maltby L. Pollution as a probe of life-history adaptation in Asellus aquaticus (Isopoda) // Oikos. 1991. Vol. 61. № 1. P. 11–18.
- Mariappan P., Balasundaram Ch. Studies on the morphometry of Macrobrachium nobilii (Decapoda, Palaemonidae) // Brazilian Arch. of Biol. and Technol. 2004. Vol. 47 (3). P. 441–449.
- Murphy P. M., Learner M. A. The life history and production of Asellus aquaticus (Crustacea: Isopoda) in the River Ely, South Wales // Freshw. Biol. 1982. Vol. 12 (5). P. 435–444. DOI: 10.1111/j.1365-2427.1982.tb00638.x
- Pincheira-Donoso D., Hunt J. Fecundity selection theory: concept and evidence // Biological Reviews. 2015. Vol. 92. Issue 1. P. 341–356. DOI: 10.1111/brv.12232
- Pinheiro M. A., Fransozo A. Sexual maturity of the speakled swimming crab Araneus cribrius (Lamarc 1818) (Crustacea, Brachyura, Portunidae) in Ubatuda Litoral, Sao Paulo State, Brazil // Crustaceana. 1998. Vol. 71. P. 434–452.
- Prevorcnik S., Blejec A., Sket B. Racial differentiation in Asellus aquaticus (L.) (Crustacea: Isopoda: Asellidae) // Hydrobiologya. 2004. Vol. 160. № 2. P. 193–214.
- Raihani G., Székely T., Serrano-Meneses M. A., Pitra C., Goriup P. The influence of sexual selection and male agility on sexual size dimorphism in bustards (Otididae) // Animal behavior. 2006. Vol. 71. P. 833–838. DOI: 10.1016/j.anbehav.2005.06.013
- Sanderock B. K. Assortative mating and sexual size dimorfism in westernand semipalmated sandpipers // Auk. 1998. Vol. 115. P. 786–791.
- Sandercock B. K. What is the relative importance of sexual selection and ecological processes in the evolution of sexual size dimorphism in monogamous shorebirds? // Wader Study Group Bull. 2001. Vol. 96. P. 64–70.
- Silva F. R. J., Battirola L. D., Lhano M. G., Sousa W. O., Marques M. I. Morphometry of Cornops aquati¬cum (Orthoptera: Acrididae: Leptysminae) in the Pantanal of Mato Grosso, Brazil // Brazilian Journ. of Biology. 2014. Vol. 74. № 3. P. 730–738. DOI: 10.1590/bjb.2014.0068
- Stillwell R. C., Blanckenhorn W. U., Teder T., Davidowitz G., Fox Ch. W. Sex differences in phenotypic plasticity affect variation in sexual size dimorphism in insects // Annu Rev Entomol. 2010. Vol. 55. P. 227–245. DOI: 10.1146/annurev-ento-112408-085500
- Svensson E. I., Abbot J. K., Gosden T. P., Coreau A. Female polymorphism, sexual conflict and limits to speciation processes in animals // Evolutional Ecology. 2009. Vol. 23. P. 93–108.
- Teder T., Tammaru T. Sexual size dimorphism within species increases with body size in insects // Oikos. 2005. Vol. 108 (2). P. 321–334.
- Vitagliano G., Fano E. A., Marchetti E., Colangelo M. A., Vitagliano E. Importance of longevity, growth, and diapause in the evolution of Asellus aquaticus // Bolletino di zoologia. 1991. Vol. 3. P. 125–131.


