Мультиплексная ПЦР для индикации и дифференциации возбудителей респираторных вирусных инфекций крупного рогатого скота
Автор: Осянин К.А., Лартон Р.Р., Алимов А.М., Фаизов Т.Х.
Статья в выпуске: 4 т.244, 2020 года.
Бесплатный доступ
В результате проведенной полимеразной цепной реакции установлено, что смесь оли-гонкулеотидных затравок при взаимодействии с одним из ДНК-маркеров не препятствует накоплению специфических продуктов амплификации. Каждому биологическому патогену соответствует индивидуальная флуоресцентная метка. Так, для вирусной диареи крупного рогатого скота это канал R6G, для парагриппа-3 - канал Fam, а для инфекционного ринотра-хеита - Cy5.
Вирусная диарея, геномика, инфекционный ринотрахеит, парагрипп-3, пцр
Короткий адрес: https://sciup.org/142226047
IDR: 142226047 | УДК: 577.113 | DOI: 10.31588/2413-4201-1883-244-4-111-116
Текст научной статьи Мультиплексная ПЦР для индикации и дифференциации возбудителей респираторных вирусных инфекций крупного рогатого скота
Ведущее место среди заболеваний телят занимает патология респираторного тракта. Инфекции респираторного тракта ведут к формированию хронической бронхолегочной патологии у крупного рогатого скота (КРС). Поиск причин рецидивирова-ния существенно затрудняет широкий этиологический спектр острых респираторных вирусных инфекций крупного рогатого скота (ОРВИ КРС). В числе вирусов, вызывающих острые респираторные заболевания, отмечают респираторносинцитиальный вирус, вирусы парагриппа, инфекционного ринотрахеита, вирусной диареи-болезни слизистых, бактериальные инфекции [1].
Болезни легких инфекционной этиологии наиболее распространены и являются одной из ведущих причин гибели животных. Они остаются единственным видом патологии, гибель от которого не только не снижается, но и продолжает расти. По прогнозам ветеринарных специалистов, к 2020 году болезни органов дыхания войдут в тройку лидеров по показателям гибели животных [6].
Наиболее значимыми из группы респираторных болезней являются инфекционный ринотрахеит (ИРТ), парагрипп-3 (ПГ-3) и вирусная диарея (ВД). В современном промышленном скотоводстве наиболее эффективным способом профилактики респираторных инфекций крупного рогатого скота считается вакцинация
Ведущую роль в возникновении респираторных болезней играют вирусы инфекционного ринотрахеита крупного рогатого скота (ИРТ КРС), вирусной диареи – болезни слизистых оболочек крупного рогатого скота (ВД-БС КРС). По данным большинства исследователей, респираторные болезни регистрируют в основном у молодняка КРС в возрасте 1-6 месяцев. [7].
Респираторные болезни являются важной причиной экономического ущерба в молочном скотоводстве. Они приводят к падежу животных или снижению скорости их роста, увеличению затрат на лечение, диагностические и профилактические мероприятия [2].
Тяжесть их проявления варьирует от острых клинических форм, приводящих к летальному исходу, до субклинических или бессимптомных, сопровождающихся снижением показателей продуктивности у переболевших животных [8].
Для подтверждения диагноза на эти инфекции используются специфические лабораторно-инструментальные методы исследования: выделение вирусов и токсинов (цитопатическое действие на культуру клеток); серологическая диагностика и полимеразная цепная реакция (ПЦР) или специфическая амплификация.
Недостаток при выделении вирусов на культуре клеток (низкая чувствительность, не всегда можно по цитопатическо- му действию (ЦПД) точно определить вид вируса, ЦПД может и не быть, большие трудности связаны с контаминацией культуры клеток другими биопатогенами и сапрофитными организмами) [5].
Недостаток серологической диагностики (низкая чувствительность (РА, ПР, РСК), низкая специфичность (ИФА с цельным вирусным антигеном), не всегда есть возможность дифференциации вакцинного иммунитета от патологического процесса) [3].
Индикация респираторных заболеваний крупного рогатого скота - долгий и трудоемкий процесс, а на практике зачастую требуется быстрое и точное определение биопатогена циркулирующего в хозяйстве, чтобы своевременно предпринять меры по профилактике и лечению возникшей болезни. Наиболее точным и быстрым методом диагностики является ПЦР, особенно при одновременной амплификации нескольких маркерных областей.
С учетом изложенного целью настоящей работы являлось изыскание олигонуклеотидных праймеров для одновременной индикации и дифференциации геномов возбудителей, наиболее часто регистрируемых респираторных вирусных инфекций мультиплексной полимеразноцепной реакцией.
Материал и методы исследований. Подбор праймеров и зондов для ге-ноиндикации пользовались ресурсами национального центра биологической информатизации (NCBI), BLAST и программой VectorNTI 9.1.0. (Invitrogen Corporation). Выделение ДНК для положительного контроля не требуется, перед ПЦР положительный контроль разбавяли в 100000 раз. С целью применения в мультиплексной ПЦР сконструировали уникальный положительный контроль, содержащую комплиментарную нуклеотидную последовательность ко всем олигонуклиотидным затравкам искомых вирусов.
Результаты исследований. Для оценки генетического полиморфизма и выявления консервативных участков геномов возбудителей инфекционного рино- трахеита, парагриппа-3 и вирусной диареи крупного рогатого скота был создан собственный банк геномов, включающий от 7 до 14 изолятов каждого вида вируса. Путем выравнивания олигонуклеотидных последовательностей геномов каждого из исследуемых вирусов установлены консервативные участки соответствующих геномов. У вируса возбудителя инфекционного ри-нотрахеита в геноме HV тип 1 штамм Cooper консервативный локус находится на участке 4716 - 4846 bp. У вируса парагриппа-3, изолят Egypt2014 консервативный локус находится в зоне 2820-2910 bp. У возбудителя вирусной диареи, изолят Carlito консервативный локус выявлялся на участке 84-204 bp. Установление последовательностей локусов актуальна для варианта «Consensus» при выравнивании нуклеотидных последовательностей. Нуклеотидные последовательности наиболее перспективных в плане специфичности локусов геномов приведены в таблице 1.
С учетом выявленных данных созданы праймеры и зонды для амплификации последовательностей в рамках вышеуказанных консервативных локусов, которые представлены в таблице 2. Одновременно с подбором праймеров был создан и зонд для возможного использования в качестве внутреннего контроля амплификации последовательности гена каппа-казеина.
Опытным путем была установлена оптимальная температура отжига для всех праймеров которая составляла 56 °С, что позволяет реализовывать возможность сочетания тест-систем в мультиплексном формате. Для контроля амплификации (в качестве положительного контроля) был произведен дизайн и синтез кольцевых молекул ДНК (плазмид), включающих в себя амплифицируемые последовательности ДНК. На основе экспериментальных данных разработана реакционная смесь и условия проведения реакции, обеспечивающие эффективное накопление продуктов амплификации для всех исследуемых видов вирусов приведены в таблице 3 и 4 соответственно
Таблица 1 – Маркерные участки геномов вирусов
|
Вирус |
Консервативный локус |
|
Парагрипп-3 |
acaaguaagaaaaacuuaggauuaacgggaauuauccaauccggagac-ggagggacaaauccagaauccacccacgaccaaccaaaccaaagauucaug-gaaaacaaugcuaaagacaaucaaaucauggauucuugggaagagggaucaggaga-caagucaucugacaucucaucggcccucgacauc |
|
Вирусная диарея |
agcgaaggccgaaaagaggcuagccaugcccuuaguaggacuag- caaaacaaggaggguagcaacaguggugaguucguuggauggcugaagcccugagua-caggguagucgucagugguucgacgcuuugugcgacaagccucgagaugccacgug-gacgagggcaugcccacagcacaucuua |
|
Инфекционный ринотрахеит |
ctgtgcccgtgcgtgtagacaggcaagtagcggctcatggcctcggcgacgatgccctt-gagcgtgggg |
Таблица 2 – Нуклеотидная последовательность разработанных праймеров и зондов для генетической идентификации возбудителей вирусных респираторных заболеваний КРС (ИРТ, ПГ-3, ВД-БС).
|
Название |
Последовательность 5` -› 3` |
|
BPG1F |
ttcccaagaatccatgatttgatagt |
|
BPG1R |
aacaaataagaaaaacttaggattaacgga |
|
BPG1P |
Fam-atgtcgagggccgatgagatgtcagatg-BHQ1 |
|
BPG2F |
cagaaagggcgattacattattacaga |
|
BPG2R |
tcttcgatgcagtatccgcatt |
|
BPG2P |
Fam-cattcgccacacacacaactctcttgtcttg-BHQ1 |
|
BVD1F |
cgaaggccgaaaagaggcta |
|
BVD1R |
cgaaccactgacgactaccctg |
|
BVD1P |
R6G-agtggtgagttcgttggatggctgaag-BHQ2 |
|
BVD2F |
agcggcggagcatgtggat |
|
BVD2R |
cacacaggccacaagggaacg |
|
BVD2P |
CY5-cgatgcaacgcgaagaaccttacctggg- BHQ3 |
|
BHV1F |
ctgtgcccgtgcgtgtagac |
|
BHV1R |
cccacgctcaagggcatc |
|
BHV1P |
CY5-tagcggctcatggcctcggcg-BHQ3 |
|
BHV2F |
aggctgtcggcaggacga |
|
BHV2R |
tgcggctgcccgtagc |
|
BHV2P |
CY5-ccaaacacgtagggcgcggcag-BHQ3 |
|
BkapF |
cttggcaggcacagtatttgaca |
|
BkapR |
attactaccaacagaaaccagttgcac |
|
BkapP |
CY5-ttgaagaatttgggcaggtgacctaactg-BHQ3 |
Таблица 3 – Реакционная смесь, в расчёте на одну пробирку
|
Компонент |
Количество, мкл |
|
dNTP |
1,5 |
|
10 Х ПЦР буфер Б |
1,5 |
|
Syn Taq ДНК-полимераза |
0,5 |
|
MgCl 2 |
1,5 |
|
dd H2O |
3,5 |
|
флуоресцентный зонд (типа Taq Man), 10 пкмоль/мкл |
0,5 |
|
смесь праймеров, 10 пкмоль/мкл |
Каждого по 0,5 |
|
MMLV ревертаза |
0,2 |
|
Образец ДНК |
5 |
Таблица 4 – Условия проведения ПЦР состояли из следующих этапов
|
1. |
37°С |
30 мин |
|
2. |
95°С |
5 мин |
|
3. |
95°С |
5 сек |
|
4. |
56°С |
30 сек, детекция, переход на шаг №3 (40 повторов) |
Опытным путем определяли режим и пропорциональный состав ПЦР тест-систем, для индикации каждого из выявляемых биопатогенов методом одиночной ПЦР и в режиме реального времени с одновременной обратной транскрипцией вирусной РНК, в той же реакционной смеси были одинаковы.
Чувствительность тест-систем определялась путем десятикратных разведений препарата плазмидной ДНК для индикации возбудителей вирусной диареи КРС, инфекционного ринотрахеита и парагриппа-3. Стабильная амплификация наблюдалась при разведении 1:10-10, что составило 1 геном-эквивалент на 0,1 мкл плазмидной ДНК.
Основываясь на результате созданных испытаний моно-тест-систем для индикации вирусов ИРТ, ВД, ПГ-3 было выявлено, что максимальной эффективностью амплификации ДНК мишени обеспечивают следующие комплексы олигонук- леотидных затравок: BPG32; BVDV1 и BHV11.
Установленное экспериментом наиболее эффективное соотношение оли-гонуклеотидных затравок для выявления каждого из искомых вирусов, приведено в таблице 6.
В установленную реакционную смесь вводится 5 мкл препарата искомых нуклеиновых кислот. Условия проведения ПЦР были те же, что и для одиночной ПЦР.
В результате проведенных опытов установлена специфическая амплификация целевых праймеров на ДНК-матрице положительного контрольного образца в мультипраймерной реакционной смеси (в качестве ДНК-матрицы выступают нуклеиновые кислоты на каждый из искомых возбудителей).
Результаты амплификации представлены на рисунке 1.
Таблица 6 – Соотношение количества олигонуклеотидных затравок для амплификации
ДНК-матриц респираторных вирусов крупного рогатого скота в мультиплексном варианте
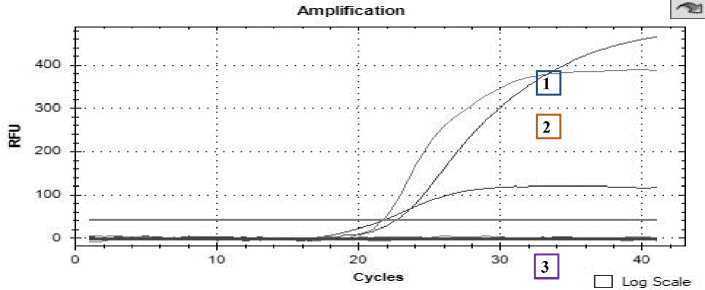
Рисунок 1 – Амплификация ДНК-маркеров легочных вирусов респираторных инфекций крупного рогатого скота в режиме реального времени. Обозначения: 1 –мультиплексная реакционная смесь, содержащая ДНК-матрицы плазмидной ДНК со вставкой специфичного для вируса локуса парагриппа-3; 2- мультиплексная реакционная смесь, в качестве ДНК-
Каждому биологическому патогену соответствовала индивидуальная флуоресцентная метка. В частности, для возбудителя вирусной диареи крупного рогатого скота – канал R6G, для вируса парагриппа-3- канал Fam, и для вируса инфекционного ринотрахеита Cy5. Таким образом разработана технология и режим ПЦР в реальном времени, позволяющие обнаруживать одновременно все 3 генома возбудителя.
Полимеразно-цепная реакция показала, что смесь отобранных олигонуклео-тидных затравок при взаимодействии с одними ДНК-маркерами не препятствует накоплению продуктов амплификации специфических локусов.
Заключение. В результате проведенных исследований определены маркерные локусы генотипов возбудителей ПГ-3, ВД, ИРТ. Изысканы праймеры и зонды, оптимизированы условия и режим мультиплексной ПЦР локусов их геномов. При амплификации исследуемых образцов нуклеиновых кислот в мультиплексной ПЦР в реальном времени доказана возможность одновременной индикации и дифференциации геномов возбудителей ПГ3, ВД, ИРТ.
Список литературы Мультиплексная ПЦР для индикации и дифференциации возбудителей респираторных вирусных инфекций крупного рогатого скота
- Алексеев, А.Д. Петрова О.Г. Дроздова Л.И. Респираторно - синцитиальная инфекция и ее роль в патогенезе острых респираторных заболеваний КРС / А.Д. Алексеев, О.Г. Петрова Л.И. Дроздова // Medicus. - 2016. - № 3. - С. 31-33.
- Котенева С.В., Войтова К.В., Глотова Т.И., Строганова И.Я., Глотов А.Г. Частота выявления генома респираторно-синцитиального вируса у крупного рогатого скота при вспышках бронхопневмоний на молочных комплексах. Российский ветеринарный журнал. Сельскохозяйственные животные. 2016. - № 3. - С. 18
- Кудряшов, А.А. Диагностика инфекционного ринотрахеита и пастереллёза телят в агрохозяйствах / А.А. Кудряшов, B. И. Балабанова, Е.В. Беляева // Международный вестник ветеринарии. - 2017. - № 1. - С. 7-12.
- Магдеева, Э.А. Биологические свойства инактивированной липосомальной вакцины против инфекционного ринотрахеита и парагриппа-3 крупного рогатого скота / Э.А. Магдеева. - Казань. - 2016. - С. 39.
- Нефедченко, А.В. Комплексный подход к определению этиологической структуры респираторных болезней крупного рогатого скота в молочных хозяйствах / А.В. Нефедченко, Т.И. Глотова, А.Г. Глотов // Вестник Красноярского государственного аграрного университета. -2017. - № 1 (124). - С. 65-71.
- Петрова, О.Г. Респираторные заболевания животных и птиц с учетом экологических особенностей территории / О.Г. Петрова, Н.А. Кольберг, С.А. Марковская [и др.]. - Екатеринбург. - 2012. - C. 228.
- Ellis, J.A. Update on viral pathogenesis in BRD / J.A. Ellis // Animal Health Research Reviews. - 2009. - Vol. 10. - P. 151-152.
- Hilton, W.M. BRD in 2014: where have we been, where are we now, and where do we want to go? / W.M. Hilton // Animal Health Research Reviews. - 2014. - Vol. 15 (2). - P. 120.


