Нейроморфометрические характеристики (результаты ПЭТ-диагностики с 18F-ФДГ) у больных шизофренией с хроническим слуховым галлюцинозом
Автор: Иванов Михаил Владимирович, Тумова Марианна Анатольевна, Костерин Дмитрий Николаевич, Станжевский Андрей Алексеевич, Лукин Владислав Олегович, Илющенко Юрий Ренальдович
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Биологические исследования
Статья в выпуске: 1 (98), 2018 года.
Бесплатный доступ
Преодоление терапевтической резистентности у больных шизофренией является одной из актуальных задач современной психиатрии. В статье приведены данные, показывающие не только различия в клинике одной из форм шизофрении, но и неоднородность функционального и морфологического субстрата при нейроинстументальной диагностике. Использование современных методов (ПЭТ с 18F-ФДГ) показало морфологические различия при галлюцинаторном и бредовом вариантах параноидной шизофрении. При галлюцинаторном варианте были выявлены гипометаболизм глюкозы в ассоциативной коре правой лобной доли, височной коре обеих долей, гиперметаболизм в затылочной коре обоих полушарий и средних отделах теменной доли справа. После проведенного лечения у пациентки с галлюцинаторным вариантом параноидной шизофрении наблюдалась полная редукция галлюцинаторной симптоматики, что на ПЭТ отражалось частичным восстановлением уровня метаболизма глюкозы в лобных и височных долях головного мозга. При преобладании бредовых построений наблюдалось снижение метаболизма глюкозы в ассоциативной коре обеих затылочных долей. Обнаруженные изменения позволяют говорить о неоднородности нейрофизиологических механизмов, приводящих к резистентности, даже при однотипной нозографии психических расстройств, что доказывает необходимость индивидуального подхода к терапии.
Пэт, терапевтическая резистентность, галлюцинаторный и бредовой варианты параноидной шизофрении
Короткий адрес: https://sciup.org/142212909
IDR: 142212909 | УДК: 616.855.8:616.89-008.428.5:577.25 | DOI: 10.26617/1810-3111-2018-1(98)-11-17
Текст научной статьи Нейроморфометрические характеристики (результаты ПЭТ-диагностики с 18F-ФДГ) у больных шизофренией с хроническим слуховым галлюцинозом
Несмотря на появление новых антипсихотических препаратов и разработку методов преодоления терапевтической резистентности, количество психически больных, не реагирующих адекватно на медикаментозное лечение, остается постоянным и составляет около 30% [1]. Больные с лекарственной резистентностью обречены на частые длительные госпитализации. Наличие резидуальной симптоматики в ремиссии ухудшает качество жизни этих больных, приводит к неблагоприятным социальным условиям [2]. Этими причинами обусловлен интерес к возможности оптимизации диагностики и терапии данной категории пациентов.
Как известно из соответствующей литературы, терапевтическую резистентность подразделяют на первичную (истинную), вторичную, отрицательную резистентность и псевдорезистентность. Случаи с неблагоприятным течением заболевания, такие как ядерные формы шизофрении, шизофрения на «патологически измененной почве» и другие, относятся к истинной резистентности (прогнозируемой плохой курабельности) [3]. При вторичной резистентности наблюдается снижение эффективности терапии с формированием хронических симптомокомплек-сов на фоне длительного приема антипсихотических препаратов. Такая адаптация пациентов к психофармакотерапии более характерна при умереннопрогредиентном течении процесса [4].
У части пациентов неэффективность лечения связана с развитием нейролептической интолерант-ности (отрицательной резистентности), невозможностью применения адекватных доз лекарственных препаратов. Отсутствие эффекта в связи с неправильным ведением пациента, его низкой комплаент-ностью, неадекватным подбором терапии и недостаточными сроками лечения называют псевдорезистентностью [1].
Анализ причин терапевтической резистентности при применении конвенциональных нейролептиков у больных шизофренией артикулировал ряд факторов, связанных с механизмом действия препаратов, которые обусловливают трудности в терапии. Это недостаточное влияние на негативную симптоматику, широкий спектр побочных эффектов, индукция «фармакогенной депрессии». Однако даже применение атипичных антипсихотиков, включая назначение клозапина – «золотого стандарта» при терапевтической резистентности, по данным разных авторов, эффективно только у трети резистентных больных шизофренией [5, 6]. В связи с этим проблема поиска эффективных способов преодоления терапевтической устойчивости к лечению остается актуальной.
Использование инструментальных методов расширяет наши возможности в изучении механизмов формирования терапевтической резистентности. Ранее проведенные исследования свидетельствуют о различии морфологической картины при разных формах течения процессуального заболевания. Например, при обследовании пациентов на компьютерном томографе было выявлено, что локализация КТ-изменений на подкорковом уровне отражала присутствие гидроцефальных изменений преимущественно в диэнцефальной и заднестволовой областях при периодическом или приступообразном течении и в лобно-базальных областях – при непрерывном течении [7]. A. Carlo Altamuraa et al. (2017) установлена статистически значимая зависимость эффективности психофармакотерапии от объема серого вещества пациентов.
У пациентов с большим объемом серого вещества по данным МР-морфометрии отмечалось более значительное улучшение по шкале BPRS [8].
Для исследования не только анатомических, но и функциональных изменений наиболее эффективным методом неинвазивного лучевого исследования важнейших биохимических процессов и физиологических функций центральной нервной системы является позитронная эмиссионная томография. Причем из числа изотопов 18F_фтордезоксиглюкоза (18F_ФДГ) является оптимальным РФП для оценки функционального состояния коры головного мозга при различных патологических процессах, так как она отражает уровень потребления глюкозы клетками головного мозга (прежде всего нейронами). Локальное снижение метаболизма глюкозы указывает на нарушение нейрональной активности, что может свидетельствовать об активной нейродегенерации [9].
Цель исследования – выявление вероятных связей между нейроморфологическими и клиническими особенностями у пациентов с вербальным галлюцинозом в рамках параноидной шизофрении при наличии проявлений, резистентных к антипсихотической терапии.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование было включено 6 стационарных больных параноидной шизофренией с наличием в статусе вербального истинного и пседогаллюцино-за, резистентного к курсам антипсихотической психофармакотерапии на стадии становления ремиссии. Средний возраст больных составил 39,0±15,8 года, из них 4 пациента относились к младшей возрастной группе (22–33 года) и 2 пациента – к старшей возрастной группе (52–68 лет). Соотношение мужчин и женщин 1:1. Средняя длительность болезни 15,5±12,0 года. Тип течения заболевания у 3 пациентов был непрерывным, ещё у 3 – приступообразнопрогредиентным с остаточной симптоматикой согласно МКБ-10.
Все пациенты до включения в исследование подписали информированное согласие. Перед этим они были ознакомлены с целями, методами исследования и рисками, связанными с диагностическими мероприятиями. Оценка клинических симптомов проводилась с использованием шкалы PANSS во время психиатрического интервью в первый день.
В соответствии с предложенными А.В. Снежнев-ским клиническими критериями для диагностики вариантов параноидной шизофрении [10] обследованные больные были разделены на две группы: с бредовым (I группа) и галлюцинаторным (II группа) вариантами.
В I группу вошли 4 пациента (средний возраст 39,0±17,33 года) со средним баллом по шкале PANSS 59,25±4,82. У 3 пациентов этой группы течение заболевания носило непрерывный характер, у одной – приступообразно-прогредиентный. На этапе становления ремиссии у этих больных отмечалась частичная редукция продуктивной симптоматики с сохранением высокосистематизированной бредовой фабулы, слуховых псевдогаллюцинаций с недостаточной критической оценкой к перенесенному психотическому состоянию.
Практически все пациенты этой группы в момент обследования получали монотерапию атипичными антипсихотиками (палиперидоном, сероквелем в средних терпевтических дозах), один больной получал комбинированную терапию антипсихотиками первой и второй генерации (азалептин, клопиксол).
Во II группу вошли 2 пациента (средний возраст 40,0±12,0 года), у которых клиническая картина в момент включения в исследование в основном определялась резидуальной галлюцинаторной симптоматикой. Отмечалась критика к болезненным переживаниям. Оба пациента из II группы были социально адаптированы. Средний балл по шкале PANSS в этой группе был равен 49,00±2,00.
Пациенты II группы получали терапию антипсихотиками первой генерации (клопиксол, трифтазин).
Всем пациентам была проведена ПЭТ с использованием 18F-ФДГ. Одной пациентке с галлюцинаторным вариантом была выполнена повторная ПЭТ с 18F-ФДГ (69 баллов по шкале PANSS) и через 4,5 месяца после проведенного курса ЭСТ на фоне редукции галлюцинаторной симптоматики (47 баллов по шкале PANSS). Позитронную эмиссионную томографию головного мозга выполняли на совмещённом позитронном эмиссионном/рентгеновском компьютерном томографе (ПЭТ-КТ) «Dyscovery PET/CT 690» General Electric (США).
Радиофармпрепарат – 18F-ФДГ – вводили внутривенно за 30 минут до начала сканирования из расчёта 100 МБк/м2 площади поверхности тела пациента.
После укладки пациента в томограф проводили короткое недиагностическое КТ-сканирование, необходимое для коррекции неравномерности поглощения излучения тканями и улучшения качества ПЭТ-изображения. Затем проводили непосредственно эмиссионное сканирование длительностью 15 минут.
Обработку полученных изображений осуществляли на рабочей станции Adwantage 4.5 GE (США) с использованием программ Volume Viewer и Cortex ID version 1.04-5.
В программе Volume Viewer оценивали изображение методом расчёта индекса асимметрии, используя программу ROI. Значение показателя Standart Uptake Value максимальный (SUVmax) вычитали из SUVmax в контралатеральной зоне (SUVmax к/л) и получившееся число делили на SUVmax к/л и умножали на 100%, при этом диагностически значимой считали асимметрию накопления больше 7%.
В программе Cortex ID оценивали метаболизм головного мозга с использованием метода Three Dimensional Stereotactic Surface Proection – 3D-SSP (Department of Internal Medicine, University of Michigan, Ann Arbor, MI, USA), усовершенствованный профессором S. Minoshima (University of Washington, Seattle, WA, USA).
Суть метода заключается в сравнении данных ПЭТ-исследования головного мозга у пациента с данными группы контроля, предоставленной профессором S. Minoshima. Сравнение осуществляется повоксельно, с использованием специальных алгоритмов и математических преобразований [11].
Оценивались: ассоциативная кора лобных, теменных, височных, затылочных долей, поясные из-
Таблица 1
Распределение РФП 18F-ФДГ в структурах головного мозга по показателю Z-счёт в I и II группах пациентов
|
Область мозга |
I группа (бредовой вариант) |
II г |
руппа (галлюцинаторный вариант) |
|
|
1. Ассоциативная кора теменной доли |
П |
0,84±0,51 |
П |
-0,17±0,72 |
|
Л |
1,06±0,47 |
Л |
0,39 ±0,84 |
|
|
2. Ассоциативная кора височной доли |
П |
0,97±0,54 |
П |
1,2±0,29 |
|
Л |
0,91±0,60 |
Л |
1,34±0,08 |
|
|
3. Ассоциативная кора лобной доли |
П |
0,85±0,76 |
П |
1,1±0,41 |
|
Л |
1,00±0,63 |
Л |
1,52±0,28 |
|
|
4. Ассоциативная кора затылочной доли |
П |
0,29±0,79 |
П |
-1,02 ±0,63 |
|
Л |
0,70±0,84 |
Л |
-1,28 ±0,09 |
|
|
5. Задние отделы поясной извилины |
П |
-0,60±0,33 |
П |
-0,22±0,25 |
|
Л |
-0,32±0,27 |
Л |
-0,05±0,66 |
|
|
6. Передние отделы поясной извилины |
П |
-0,60±0,67 |
П |
0,65±1,12 |
|
Л |
-0,72±0,63 |
Л |
0,57±1,29 |
|
|
7. Средние отделы лобной доли |
П |
-0,26±0,86 |
П |
0,48±0,91 |
|
Л |
-0,04±0,71 |
Л |
0,56±0,37 |
|
|
8. Средние отделы теменной доли |
П |
0,28±0,35 |
П |
-1,04±0,65 |
|
Л |
0,66±0,43 |
Л |
-0,96±0,92 |
|
|
9. Сенсомоторная кора |
П |
0,55±0,41 |
П |
0,35±0,01 |
|
Л |
0,60±0,41 |
Л |
0,23±0,29 |
|
|
10. Зрительная кора |
П |
-1,48±1,79 |
П |
-3,135±0,29 |
|
Л |
-0,77±1,37 |
Л |
-3,47±0,61 |
|
|
11. Хвостатое ядро |
П |
0,12±0,96 |
П |
-0,55±0,58 |
|
Л |
-0,27±0,52 |
Л |
-0,92±0,59 |
|
|
12. Мост |
-1,33±0,84 |
-1,33±0,84 |
||
Как видно по приведенным в таблице данным, у пациентов с галлюцинаторным вариантом также были выявлены гипометаболизм глюкозы в ассоциативной коре правой лобной доли (1,1±0,41), височной коре обеих долей (1,2±0,29 справа и 1,34±0,08 слева), гиперметаболизм в затылочной коре обоих полушарий (-1,02±0,63 справа и -1,28±0,09 слева) и средних отделах теменной доли справа (-1,04±0,65).
На повторных томограммах у пациентки из II группы на фоне редукции галлюцинаторной симптоматики наблюдалось частичное восстановление уровня метаболизма глюкозы в лобных и височных долях головного мозга (рис. 1).
вилины (передние и задние их отделы отдельно), срединные отделы лобных и теменных долей, сенсомоторная кора, зрительная кора, хвостатые ядра, мост. Уровень метаболизма оценивался по показателю Z-счёт, положительные значения которого указывают на снижение метаболизма, отрицательные значения – на гиперметаболизм. Нормализация проводилась по показателю Global. Сравнение проводилось с соответствующей пациенту возрастной контрольной группой.
Нормальные значения показателя Z-счёт варьируют в диапазоне от -0,9 до 0,9 для всех областей, за исключением зрительной коры. Нормальные значения показателя Z-счёт для зрительной коры составляют от -1,5 до -4,5.
Статистическую обработку осуществляли с помощью программы MedCalc 11.4.2.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Значимые изменения метаболизма глюкозы (1,0±0,63 у пациентов с бредовым вариантом и 1,52±0,28 у пациентов с галлюцинаторным вариантом) в ассоциативной коре левой лобной доли были выявлены у всех пациентов обеих групп (табл.1).
Это не только говорит о наличии структурных расстройств, лежащих в основе шизофрении, но и свидетельствует об обратимых функциональных нарушениях, определяющих клиническую картину.
В связи с малым объемом выборки достоверность различий не определялась. Тем не менее полученные данные соответствуют описанным ранее в исследованиях. Так, M.S. Bushbaum (1982) и T. Farkas (1984) впервые обнаружены изменения в лобных долях головного мозга в виде снижения метаболизма глюкозы и показателей кровотока [12, 13]. В ряде последующих исследований также отмечались подобные находки [14, 15, 16, 17, 18, 19].
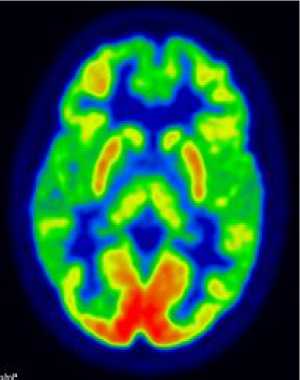
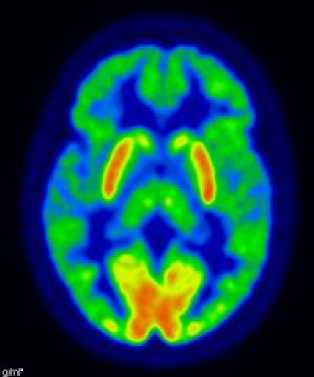
Рисунок 1. Данные ПЭТ-исследования пациентки до (а) и после (б) терапии
Гипометаболизм глюкозы в ассоциативной лобной коре, обнаруживаемый в обеих группах, подтверждает концепцию гипофронтальности у пациентов с шизофренией. Согласно данным D. Canon (2015), снижение функции лобной коры, особенно медиальной префронтальной коры, связано с гипофункцией NMDA-рецепторов, что может приводить к дисбалансу возбуждения и торможения. Считается, что этот дисбаланс активирует апоптоз нейронов, избыточную синаптическую обрезку с последующим разрастанием нейроглии (ростом объема белого вещества) [20]. Эти изменения приводят к когнитивному дефициту, который проявляется в нарушении способности к планированию, инициированию и поддержанию целенаправленных стратегий [21].
Ch. Gaser et al. (2004) при исследовании пациентов с параноидной шизофренией и слуховыми галлюцинациям с помощью МР-морфометрии выделил зоны значительного снижения объема коры головного мозга: правая префронтальная кора, левая поперечная височная извилина (извилина Гешля), левая нижняя надкраевая извилина – эти области частично соответствуют зонам гипометаболизма, обнаруженным у наших пациентов [22].
Гиперметаболизм в затылочной коре обеих полушарий и средних отделах теменной доли справа, определяющийся у пациентов из II группы, может быть признаком наличия актуальных галлюцинаций у пациента в момент исследования.
Таким образом, более выраженные изменения метаболизма глюкозы у пациентов II группы могут указывать на наличие органически измененной «почвы». По данным А.И. Нисса, шизофренический процесс на органически неполноценной «почве» протекает более благоприятно. Для этих пациентов характерно формирование синдрома хронического вербального галлюциноза, определяющего клиническую ремиссию в межприступном периоде («галлюцинаторная ремиссия») [23]. По мнению С.Г. Жислина и О.П. Ветроградовой, таких больных следует относить к так называемым артефактным формам шизофрении, так как дискретность аффективно-параноидных (реже – аффективных) приступов, отсутствие стержневой бредовой системы, критика к «голосам» в ремиссии, а в части случаев и в приступе, личностная сохранность, мягкость, а доступность и даже сенситивность больных противоречат клинике параноидной шизофрении [24, 25].
ВЫВОДЫ
По данным исследования выявлено наличие нейроморфологических различий в метаболической картине пациентов в зависимости от клинического варианта параноидной шизофрении. Так, у пациентов с галлюцинаторным вариантом, в отличие от больных с бредовым вариантом параноидной шизофрении, обнаружены гипометаболизм глюкозы в ассоциативной коре правой лобной доли, височной коре обеих долей и гиперметаболизм в затылочной коре обеих полушарий и средних отделах теменной доли справа. Положительный ответ на терапию, сопровождавшийся изменениями в метаболической картине в виде частичного восстановления уровня метаболизма глюкозы в лобных и височных долях головного мозга, позволяет предположить, что использование инструментальных методов наряду с клиническими улучшит подходы к терапии, поможет определить прогноз лечения.
Обнаруженные изменения метаболической картины доказывают различия нейрофизиологических механизмов, приводящих к резистентности даже в клинически однородной группе. Это говорит о необходимости индивидуального подхода для определения тактики ведения резистентных пациентов. К настоящему времени не проводилось полномасштабных исследований, сравнивающих изменения метаболизма глюкозы в головном мозге при приеме различных антипсихотиков. Дальнейшие исследования в этом направлении смогут помочь в оценке эффективности проводимой терапии, позволят выделить нейробиомаркеры различных форм резистентности и, возможно, даже осуществлять оптимизацию терапии на основе параметрических картин.
Список литературы Нейроморфометрические характеристики (результаты ПЭТ-диагностики с 18F-ФДГ) у больных шизофренией с хроническим слуховым галлюцинозом
- Мосолов С.Н. Резистентность к психофармакотерапии и методы ее преодоления. Психиатрия и психофармакотерапия. 2002; 4 (4): 132-136.
- Рахмазова Л.Д., Агарков А.А., Васильева Н.А., Петрачков И.В., Погорелова Т.В. Клинико-социальная адаптация пациентов с психозами и состояниями слабоумия. Сибирский вестник психиатрии и наркологии. 2014; 2 (83): 9-13.
- Авруцкий Г.Я., Недува А.А. Лечение психически больных: Руководство для врачей. 2-е изд., перераб. и доп. М.: Медицина, 1988: 528.
- Вовин Р.Я., Аксенова И.О. и др. Проблема хронизации психозов и преодоление терапевтической резистентности (на модели депрессивных состояний). Фармакотерапевтические основы реабилитации психически больных/Под ред. Р.Я. Вовина, Г. Е. Кюне. М.: Медицина, 1981: 151-181.
- Breier A., Buchanan R.W., Kirkpatrick B. et al. Effects of clozapine on positive and negative symptoms in outpatients with schizophrenia. Am J Psychiatry. 1994; 151: 20.
- Kane J., Honigfeld G., Singer J. et al. Clozapine for the treatment-refractory schizophrenic: a double-blind comparison with chlorpromazine. Arch Gen Psychiatry. 1988; 45: 789.
- Иванов М.В., Акименко М.А. Диагностика изменений нейроморфологического субстрата при эндогенных психозах методом компьютерной томографии. Современные достижения в диагностике и лечении эндогенных психических расстройств/Под ред. М.В. Иванова. СПб., 2008.
- Altamura C., Delvecchio G., Paletta S., Di Pace Ch., Reggiori A., Fiorentini A., Mirabile M.D., Paoli R.A., Cinnante C., Triulzi F., Mauri M.C., Brambilla P. Gray matter volumes may predict the clinical response to paliperidone palmitate long-acting in acute psychosis: A pilot longitudinal neuroimaging study. Psychiatry Research Neuroimaging. 2017; 261: 80-84.
- Лобзин В.Ю., Одинак М.М., Лупанов И.А., Бойков И.В., Емелин А.Ю. Оценка церебрального метаболизма 18-фтордезоксиглюкозы в ранней диагностике когнитивных нарушений. Биомедицинский журнал. 2013; 14: 1057-1070.
- Тиганов А.С., Снежневский А.В., Орловская Д.Д. и др. Руководство по психиатрии в 2-х т./Под ред. А.С. Тиганова. М.: Медицина, 1999; 1: 425-428.
- Станжевский А.А., Тютин Л.А., Костеников Н.А. Позитронная эмиссионная томография головного мозга: принципы и методы обработки изображений (обзор литературы). Лучевая диагностика и терапия. 2010; 2 (1): 12-20.
- Buchsbaum M.S., Ingvar D.H., Kessler R., Waters R.N., Cappelletti J., van Kammen D.R, King A.C., Johnson J.J., Manning R.G., Flynn R.M., Mann L.S., Bunney W.E.Jr., Sokoloff L. Cerebral glucography with positron tomography in normals and in patients with schizophrenia. Archives of General Psychiatr. 1982;39:251-259.
- Farkas T., Wolf A.P., Jaeger J., Brodie J.D., Christman D.R., Fowler J.S. Regional brain glucose metabolism in chronic schizophrenia: A positron emission transaxial tomographic study. Archives of General Psychiatry. 1984; 41: 293-300.
- Andreasen N.C., O'Leary D.S., Flaum M., Nopoulos P., Watkins G.L., Boles Ponto L.L., Hichwa R.D. Hypofrontality in schizophrenia: Distributed dysfunctional circuits in neuroleptic-naïve patients. Lancet. 1997; 349: 1730-1734.
- Andreasen N.C., Rezai K., Alliger R., Swayze V.W., Flaum M., Kirchner P., Cohen G., O'Leary D.S. Hypofrontality in neuroleptic-naïve patients and in patients with chronic schizophrenia. Archives of General Psychiatry. 1992; 49: 943-958.
- Buchsbaum M.S., Hazlett E.A. Update on PET glucose methodology. International Review of Psychiatry. 1997; 9: 339-354.
- Buchsbaum M.S. The frontal lobes, basal ganglia, and temporal lobes as sites for schizophrenia. Schizophrenia Bulletin. 1990; 16 (3): 379-389.
- Chua S.E., McKenna P.J. Schizophrenia -A brain disease? A critical review of structural and functional cerebral abnormality in the disorder. British Journal of Psychiatry. 1995; 166::563-582.
- Williamson P. Hypofrontality in schizophrenia: A reviewof the evidence. Canadian Journal of Psychiatry. 1987; 32: 399-404.
- Cannon T.D. Review. How Schizophrenia Develops: Cognitiveand Brain Mechanisms Underlying Onset of Psychosis. Trends in Cognitive Sciences. 2015; 1502: 13.
- Янушко М.Г., Иванов М.В., Сорокина А.В. Когнитивные нарушения при эндогенных психозах: современные представления в свете дименсионального подхода. Социальная и клиническая психиатрия. 2014; 24 (1): 90-95.
- Gaser Ch., Nenadic I., Volz H.-P., Buchel Ch., Sauer H. Neuroanatomy of ‘Hearing Voices': A Frontotemporal Brain structural Abnormality Associated with Auditory Hallucinations in schizophrenia. Cerebral Cortex January. 2004; 14: 91-96.
- Нисс А.И. Клиника и терапия шизофрении у больных с церебрально-органической недостаточностью: автореф. дис. д.м.н. Л., 1990: 48.
- Ветроградова О.П. К вопросу о шизофрении с синдромом вербального галлюциноза. Проблемы шизофрении. М., 1962; 1.
- Жислин С.Г. Роль возрастного и соматогенного фактора в возникновении и течении некоторых форм психозов. М., 1956.


