Немелкоклеточный рак легкого в практике радиотерапевта (лекция). Часть 1. Классификации и исходное стадирование
Автор: Сотников В.М., Паньшин Г.А.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Обзоры
Статья в выпуске: 3 т.18, 2018 года.
Бесплатный доступ
Резюме Технологическая революция в радиотерапии, ознаменовавшаяся широким внедрением в клиническую практику компьютеризированных технологий прецизионного объемного планирования и реализации терапевтического облучения, существенно ужесточила требования к исходному обследованию больного, стандартизации морфологического диагноза и стадии заболевания на основе международных классификаций. Решающую роль в планировании радиотерапии играет выявление степени исходной распространенности опухоли (стадирование заболевания) с использованием современных методов медицинской визуализации и морфологической верификации предполагаемых очагов поражения. 97 Встатье изложены действующие и перспективные классификации рака легкого, а также наборы современных неинвазивных и инвазивных диагностических методов, рекомендуемых для первичной диагностики и стадирования немелкоклеточного рака легкого, с учетом потребностей последующего планирования конформной радиотерапии в любом варианте ее применения: как в самостоятельном плане, так и в рамках программ комбинированного и комплексного лечения.
Короткий адрес: https://sciup.org/149132074
IDR: 149132074
Текст научной статьи Немелкоклеточный рак легкого в практике радиотерапевта (лекция). Часть 1. Классификации и исходное стадирование
Общепринятое название заболевания и синонимы: рак легкого, карцинома легкого, немелкоклеточный рак легкого (НМРЛ), non-small cell lung cancer (NSCLC). Код по МКБ – 10 C34 (C34.0 – опухоль главного бронха, C34.1 – опухоль верхней доли легкого, C34.2 – опухоль средней доли легкого, C34.3 – опухоль нижней доли легкого, C34.8 – опухоль, распространяющаяся на несколько долей, C34.0 – опухоль неуточненной локализации).
Еще в начале ХХ века, вплоть до массового распространения курения, единичные случаи рака легкого описывались в научных журналах как редчайшие заболевания (Рис.1). Под сомнение ставилась сама возможность возникновения рака в этом органе. Но уже к середине XX века с распространением курения и увеличением продолжительности жизни рак легкого стал одним из наиболее распространенных онкологических заболеваний. Ежегодно в мире диагностируется более 1820000 новых случаев рака легкого, что составляет около 13% от всех опухолевых заболеваний. Из них примерно 80% приходится на немелкоклеточный рак. Рак легкого занимает также ведущие позиции в структуре смертности от онкологических заболеваний в мире, составляя 19,4% (около 1600000
случаев смерти от рака легкого в год) от общего количества смертей от злокачественных новообразований.
Перепечатай о кчъ газеты , Мел ининя®, 1S9C г.
Доэволеио пенаурою. С.-Петербурга, 23 Яч^вря ЮТ гола, Слб. Губернская Типография, у л ни» Глинки. 6
Къ казуистика злокачественныхъ новообразован!! зъ грудной полости.
(,-рл А. А Крупецкаго.
(Ilm Юрхчии» леракеипиегкоп китом лроф. <’■ М. кк-илкоя?.
Развита илокачегтвенных'ь ниииобразовян!# вь п>удпой полости продел авляетси довольно plyuuiMi лвленюжь. большею частью ои1; и, ubjhioti я мгтастатнчсеки. самостоятельное же забол'Бва Hie грхшысь органопь неоплазмами есть tiMcuLe исключительно'. пастельно ш ключительное. что некоторые авторы соиериичпю отрицаюсь вадможность самостоательпаго рззвит!я саркомы in. лепииъ п плевр!:.
Болтаиг-ю частью г.т. uaoaitaaiiinxi иодобиаго рода поход нымь пуиг.томь < тужать йроих1альиы:! железы, нлн-аз' железы подмыш1.-1>г.ыя. или. накопись, органы, ле.напйя йиТзч-лалсппо.
Д-р-ь Э1жерт-. ') сообши.гь случай саркомы логкаго, который ему пр:ии.:>сь паблюдать вь Обуховской больниц^ въ Петербург!;; больная была пожилая (но л.), крестьянка, которая чрезъ u l; иедКт поелУ. постуг тент вь больницу умерла, па ihiqibirin оказались, что почти вся нижняя и сродниц доли ирлпаго легкаго сильно иямГ.нены и состоять нгь бЬлыхт. масел., пропитаппыхъ гноемь. ноторын выделятся какь-бы изъ н-'.1''гтп. на границ^ с-ь здоровыми частями; замечается разращение <6Ь1ой мягкой опухолевой ткани», прорастающей Д" Кориа легкаги и выдающейся пч> просиять
’) Гюлшкчпа» и,е1Л Ьошхина, N* 30, 1S93 г.
Рис.1. Репринт публикации 1890 г.
В 2015 году в России было выявлен 60351 новый случай рака легкого: 48139 – у мужчин и 12212 – у женщин, что составило примерно 13% от всех впервые зарегистрированных случаев злокачественных новообразований [3]. Рак легкого – болезнь пожилого возраста: 90% случаев рака легкого приходится на возраст свыше 50 лет, 47% -на возраст старше 70 лет и 14% – на возраст старше 80 лет. Средний возраст больных составляет 65 лет (мужчины – 64,5, женщины 67,7).
В структуре заболеваемости мужского населения России злокачественными опухолями рак легкого занимает первое место и составляет 17,8%. У женщин рак легкого находится на десятом месте, составляя 3,8% от всех онкологических заболеваний. За последние 11 лет (2005 – 2015 гг.) заболеваемость мужского населения снизилась на 5,3%, а женского – увеличилась на 17,8%. Рак легкого, по-прежнему, лидирует в структуре смертности от злокачественных опухолей – 17,3%. В структуре смертности мужского населения от онкологических заболеваний в России рак легкого находится на первом месте, составляя 26,5%, у женщин – на четвертом месте (6,8%).
Радиотерапия является одним из основных методов лечения немелкоклеточного рака легких (НМРЛ). Доля пациентов с НМРЛ, имеющих доказательные показания к лучевой терапии по современным оценкам, варьируют в диапазоне 46% – 68% для первичных больных и 64% –75% для всей когорты больных НМРЛ. Фактическое использование радиотерапии во всем мире ниже, в диапазоне от 28% до 53%, с наибольшими различиями между фактическим и расчетным использованием радиотерапии при III стадии НМРЛ [14]. В России доля больных НМРЛ, получающих радиотерапию, существенно ниже приведенных выше цифр [2], что совершенно не оправдано с клинических позиций, учитывая весьма ограниченную эффективность повсеместно используемых дуплетных платиносодержащих режимов химиотерапии НМРЛ. Тем не менее, в клинических рекомендациях по диагностике и лечению больных раком легкого, утвержденных Ассоциацией онкологов России в 2014 г. [1], показания к радиотерапии НМРЛ ограничены рамками химиолучевой программы лечения IIIA/N2 и IIIB стадий.
Классификации рака легкого
Действующая морфологическая классификация рака легкого (Табл.1) принята в 2015 г. и является частью морфологической классификации всех опухолей легкого, включающей также аденомы, папилломы, мезенхимальные опухоли, лимфомы и гистиоцитарные опухоли, эктопические и метастатические опухоли [12].
Табл.1. Морфологическая классификация рака легкого
|
Эпителиальные опухоли |
Нейроэндокринные опухоли |
|
Аденокарцинома |
Мелкоклеточный рак |
|
Стелющаяся (ранее БАР) |
Комбинированный мелкоклеточный рак |
|
Ацинарная |
Крупноклеточный нейроэндокринный рак |
|
Папиллярная |
Комбинированный нейроэндо-кринный |
|
Микропапиллярная |
крупноклеточный рак |
|
Солидная |
Карциноидные опухоли |
|
Инвазивная муцинозная |
Типичные |
|
Смешанная инвазивная муцинозная и |
Атипичные |
|
немуцинозная |
Преинвазивные |
|
Коллоидная |
Диффузная идиопатическая гиперплазия |
|
Фетальная |
нейроэндокринных клеток легких |
|
Кишечного типа |
Крупноклеточный рак |
|
Минимально инвазивная |
Аденосквамозный рак |
|
Немуцинозная |
Саркоматоидный рак |
|
Муцинозная |
Плеоморфный рак |
|
Преинвазививные опухоли |
Веретеноклеточный рак |
|
Атипичная аденоматозная гиперплазия |
Гигантоклеточный рак |
|
Аденокарцинома in situ |
Карциносаркома |
|
Немуцинозная |
Пульмональная бластома |
|
Муцинозная |
Прочие и неклассифицированные раки |
|
Плоскоклеточный рак |
Лимфоэпителиоподобный рак |
|
Ороговевающий Неороговевающий Базалоидный Преинвазививные Плоскоклеточный рак in situ |
NUT карцинома Опухоли типа слюнных желез |
|
Мукоэпидермоидный рак Аденокистозный рак Эпителиальный-миоэпителиальный рак |
Представленные многочисленные морфологические варианты рака легкого на практике объединены в две основных группы: немелкоклеточный и мелкоклеточный рак легкого, различающиеся по тактике лечения.
Действующая классификация рака легкого по системе TNM 7-го пересмотра принята в 2009 г. и включает мелкоклеточный и немелкоклеточный раки легкого. Карциноидные опухоли, cаркомы и другие редкие опухоли не включены.
Т – первичная опухоль
Тx – недостаточно данных для оценки первичной опухоли или опухоль доказана только наличием опухолевых клеток в мокроте или промывных водах бронхов, но не выявляется методами визуализации или при бронхоскопии.
ТО – первичная опухоль не определяется.
Tis – преинвазивная карцинома (сarcinoma in situ).
T1 – опухоль ≤ 3 см в наибольшем измерении, окруженная легочной тканью или висцеральной плеврой, без видимой инвазии проксимальнее долевого бронха при бронхоскопии (без поражения главного бронха).
Т1а – опухоль ≤ 2 см в наибольшем измерении.
Т1б – опухоль > 2см, но ≤ 3 см в наибольшем измерении.
Примечание. В практическом здравоохранении опухоли диаметром 3 см ошибочно классифицируются, как Т2.
Т2 – опухоль > 3 см, но ≤ 7 см в наибольшем измерении или опухоль со следующими признаками (Т2 опухоли с этими признаками классифицируются как Т2а, если они размером 5 см и менее): распространяется на главный бронх на 2 см или далее от карины, или врастает в висцеральную плевру, или сопровождается ателектазом (обструктивной пневмонией), распространяющимся на область корня легкого, но не на легкое.
Т2а – опухоль > 3 см, но ≤ 5 см.
Т2б – опухоль > 5 см, но ≤ 7 см в наибольшем измерении.
Т3 – опухоль > 7 см или опухоль любого размера с одним из следующих признаков: врастает в париетальную плевру, грудную стенку (включая опухоли верхней борозды), диафрагму, диафрагмальный нерв, медиастинальную плевру, приетальный перикард, или опухоль в главном бронхе, доходящая до карины менее чем на 2 см, но без вовлечения карины*, или опухоль с сопутствующим ателектазом или обструктивной пневмонией всего легкого, или наличие отдельных опухолевых узлов (узла) в первично пораженной доле легкого.
*Редкая опухоль, распространяющаяся поверхностно по слизистой бронха, не выходящая за пределы стенки бронха, которая может распространяться проксимально на главный бронх, классифицируется как Т1а.
Т4 – опухоль любого размера, непосредственно переходящая на одну из следующих структур: средостение, сердце, крупные сосуды, трахею, возвратный нерв, пищевод, тела позвонков, карину; или наличие отдельных опухолевых узлов (узла) в другой доле первично пораженного легкого.
N – регионарные лимфатические узлы
Nх – недостаточно данных для оценки регионарных лимфатических узлов.
N0 – нет признаков метастатического поражения регионарных лимфатических узлов.
N1 – поражение ипсилатеральных перибронхиальных и / или лимфатических узлов корня легкого и внутрилегочных лимфатических узлов, включая прямое прорастание опухолью лимфатических узлов.
N2 – поражение ипсилатеральных лимфатических узлов средостения и / или бифуркационных лимфатических узлов.
N3 – поражение контралатеральных лимфатических узлов средостения или контралатерального корня легкого, прескаленных или надключичных лимфатических узлов (ипси- или контралатеральных).
М – отдаленные метастазы
МО – нет отдаленных метастазов.
М1 – наличие отдаленных метастазов.
M1а – наличие отдельных опухолевых узлов (узла) в контралатеральном легком; опухоль с диссеминацией по плевре, или злокачественным плевральным или перикардиальным выпотом.**
М1б – отдаленные метастазы (в экстраторакальных органах).
** Хотя большинство экссудативных плевритов и перикардитов при раке легкого опухолевые, у отдельных пациентов они негативны при исследовании на опухолевые клетки, плевральная жидкость не геморрагическая и не экссудативная. Эти данные в совокупности с клиническим заключением, что выпот не связан с опухолью, позволяют исключить плевральный выпот, как элемент стадирования, и пациент должна быть классифицирован как М0.
Группировка по стадиям
Оккультный рак TX N0 M0
|
Стадия 0 |
Tis N0 M0 |
|
Стадия IA |
T1a,b N0 M0 |
|
Стадия IB |
T2a N0 M0 |
|
Стадия IIA |
T2b N0 M0, T1a,b N1 M0, T2a N1 M0 |
|
Стадия IIB |
T2b N1 M0, T3 N0 M0 |
|
Стадия IIIA |
T1a,b,T2a,b N2 M0, T3 N1-2 M0, T4 N0-1 M0 |
|
Стадия IIIB |
T4 N2 M0, T любое N3 M0 |
|
Стадия IV |
T любое N любое M1 |
В связи с ожидаемым в ближайшее время принятием новой международной классификации TNM рака легкого VIII пересмотра, мы сочли необходимым привести ниже ее опубликованный проект [6].
Классификация рака легкого по системе TNM VIII пересмотра включает мелкоклеточный и немелкоклеточный раки легкого, карциноидные опухоли. Саркомы и другие редкие опухоли не включены.
Основными отличиями новой классификации являются более подробная детализация критерия Т по размеру опухоли, анатомического распространения ее, и появление новой группы в критерии М (M1b для одиночного экстраторакального метастаза). Первое нововведение связано с предполагаемым большим прогностическим значением размера первичной опухоли, чем это считалось ранее, а последнее нововведение аргументируется появлением в научной литературе термина «олигометастатическая опухоль», обозначающего опухоли различной локализации с единичными отдаленными метастазами, для которых предполагается особый механизм отдаленного метастазирования и предпринимаются попытки разработки программ радикального лечения [7].
Т – Первичная опухоль
Тx – недостаточно данных для оценки первичной опухоли или опухоль доказана только наличием опухолевых клеток в мокроте или промывных водах бронхов, но не выявляется методами визуализации или при бронхоскопии/
Т0 – первичная опухоль не определяется.
Tis – преинвазивная карцинома (сarcinoma in situ).
T1 – опухоль ≤ 3 см в наибольшем измерении, окруженная легочной тканью или висцеральной плеврой, без видимой инвазии проксимальнее долевого бронха при бронхоскопии (без поражения главного бронха).
Т1а (mi) – минимально инвазивная аденокарцинома.
Т1а – опухоль 1см и менее в наибольшем измерении.*
Т1б – опухоль > 1 см, но ≤ 2 см в наибольшем измерении.
Т1с – опухоль > 2 см, но ≤ 3 см в наибольшем измерении.
Т2 – опухоль > 3 см, но ≤ 5 см в наибольшем измерении или опухоль с одним из следующих признаков:
– распространяется на главный бронх, независимо от расстояния до карины, но не на карину;
– врастает в висцеральную плевру;
– сопровождается ателектазом (обструктивной пневмонией), распространяющимся на область корня легкого, часть или все легкое.
Т2а – опухоль > 3 см, но ≤ 4 см в наибольшем измерении.
Т2б – опухоль > 4 см, но ≤ 5 см в наибольшем измерении.
Т3 – опухоль > 5 см, но ≤ 7 см в наибольшем измерении или опухоль с одним из следующих признаков:
– наличие отдельных опухолевых узлов (узла) в первично пораженной доле легкого;
– врастает в париетальную плевру, грудную стенку (включая опухоли верхней борозды), диафрагмальный нерв, париетальный перикард.
Т4 – опухоль > 7 см в наибольшем измерении или опухоль с одним из следующих признаков:
– наличие отдельных опухолевых узлов (узла) в другой доле первично пораженного легкого;
– опухоль, непосредственно переходящая на одну из следующих структур: диафрагму, средостение, сердце, крупные сосуды, трахею, возвратный нерв, пищевод, тела позвонков, карину.
*Редкая опухоль, распространяющаяся поверхностно по слизистой бронха, не выходящая за пределы стенки бронха, которая может распространяться проксимально на главный бронх, классифицируется как Т1а.
-
**Солитарная аденокарцинома ≤ 3 см в наибольшем измерении с преимущественно стелющимся типом роста (lepidic pattern) и ≤ 5 мм инвазии в любом фокусе.
-
***Т2 опухоли с этими признаками классифицируются как T2a, если они ≤ 4 см в наибольшем измерении, или их размер невозможно определить, или как T2b, если опухоль > 4 см, но ≤ 5 см в наибольшем измерении.
N – Регионарные лимфатические узлы
Nх – недостаточно данных для оценки регионарных лимфатических узлов.
N0 – нет признаков метастатического поражения регионарных лимфатических узлов.
N1 – поражение ипсилатеральных перибронхиальных и/ или) лимфатических узлов корня легкого и внутрилегочных лимфатических узлов, включая прямое прорастание опухолью лимфатических узлов.
N2 – поражение ипсилатеральных лимфатических узлов средостения и/ или бифуркационных лимфатических узлов.
N3 – поражение контралатеральных лимфатических узлов средостения или контралатерального корня легкого, прескаленных или надключичных лимфатических узлов (ипси- или контралатеральных).
М – отдаленные метастазы
МО – нет отдаленных метастазов.
М1 – наличие отдаленных метастазов:
M1а – наличие отдельных опухолевых узлов (узла) в контралатеральном легком; опухоль с диссеминацией по плевре, или злокачественным плевральным или перикардиальным выпотом.**
М1б – единичный метастаз в экстраторакальных органах, включая единичный нерегионарный лимфатический узел.
М1с – множественные метастазы в одном или нескольких экстраторакальных органах.
Группировка по стадиям
|
Оккультный рак |
TX N0 M0 |
|
Стадия 0 |
Tis N0 M0 |
|
Стадия IA1 |
T1a(mi) – T1a N0 M0 |
|
CтадияIA2 |
T1b N0 M0 |
|
Стадия IA3 |
T1c N0 M0 |
|
Стадия IB |
T2a N0 M0 |
|
Стадия IIA |
T2b N0 M0 |
|
Стадия IIB |
T1a-c, T2a,2b,3 N1 M0 |
|
Стадия IIIA |
T1a-c,T2a-b, N2 M0, T3N1, T4N0-1 |
|
Стадия IIIB |
T1a-c,T2a-b, N3 M0, T3-4 N2 M0 |
|
Стадия IIIC |
T3-4 N3 M0 |
|
Стадия IVA |
T любая Nлюбая M1a-1b |
|
Стадия IVB |
T любая Nлюбая M1c |
Единая классификация лимфатических узлов средостения (Рис.2) необходима для международной унификации диагностической и клинической информации о каждом случае рака легкого и важна не только в научном, но и в практическом плане, особенно для планирования и проведения лучевого и хирургического лечения.
Стадирование рака легкого
Первичное обследование с морфологическим подтверждением диагноза, как правило, осуществляется до направления пациента к радиотерапевту, однако планирование программы лечения рака легкого в целом, и радиотерапии в частности, требует достоверного и топографически точного описания всех очагов заболевания, формализованного в TNM стадии, поэтому диагностический этап стадирования должен проводиться с активным участием радиотерапевта.
Стадирование первичной опухоли (Т-стадирование)
Задачи: определение локализации, размеров опухоли, распространения ее по бронхам, вовлечение анатомических структур грудной клетки, наличие метастазов в пораженном и контралатеральном легком.
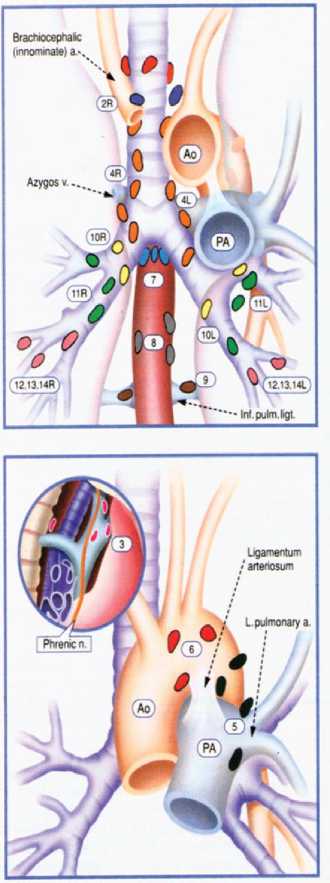
ЛимфоузлыВерхние медиастинальные
-
1 – высокие медиастинальные
-
2 - верхние паратрахеальные
-
3 - преваскулярные и ретротрахеальные
-
4 – нижние паратрахеальные (включая узлы v. Azygos)
Аортальные
-
5 – субаортальные
-
6 - парааортальные
Нижние медиастинальные
-
7 – бифуркационные
-
8 – параэзофагеальные
-
9 – легочной связки
N1 Лимфатические узлы
-
10 – корня легкого
-
11 – интерлобарные
-
12 – лобарные
-
13 – сегментарные
-
14 – субсегментарные
Рис.2. Классификация лимфатических узлов средостения Международной ассоциации по изучению рака легкого (IASLC, 2009) [10].
Стадирование регионарное (N – стадирование)
При раке легкого наличие регионарных метастазов (критерий N) превосходит критерий Т по прогностической значимости и имеет решающее значение в определении программы лечения не только при отсутствии отдаленных метастазов [13], но и при M1А стадии [5]. Однако до настоящего времени диагностика регионарного метастазирования при раке легкого вызывает наибольшие трудности в связи с ограниченной диагностической ценностью всех существующих методов, как инвазивных, так и неинвазивных. Неинвазивные методы (РКТ, ПЭТ, ПЭТ-КТ) позволяют оценить все группы лимфатических узлов средостения (Табл.2), но они недостаточно специфичны при диаметре лимфатического узла менее 1 см.
Табл.2. Диагностическая ценность неинвазивных методов N-стадирования при раке легкого [11]
|
Операционные характеристики диагностических методов |
РКТ – наименьший диаметр лимфатического узла ≥ 1см |
ПЭТ-КТ |
|
Чувствительность |
55% |
62% |
|
Специфичность |
81% |
90% |
|
Позитивная предсказательная величина |
58% |
63% |
|
Негативная предсказательная величина |
83% |
90% |
Инвазивные методы (минимально инвазивные: трансбронхиальная и транспищеводная пункция лимфатических узлов под контролем УЗИ); хирургические (видеомедиастиноскопия, парстернальная медиастинотомия) отличаются высокой чувствительностью и специфичностью, как при центральных, так и при периферических раках, но позволяют исследовать лишь некоторые группы лимфатических узлов. В табл.3 представлены данные по критериям диагностической ценности каждого из этих методов, позволяющие оценить их значение для планирования лучевого лечения рака легкого.
Табл.3. Диагностическая ценность инвазивных методов N-стадирования при раке легкого [4, 8, 11, 9]
|
Метод |
Исследуемые группы лимфоузлоы |
Чувствительность |
Специфичность |
Точно сть |
|
Медиастиноскопия |
2R, 4R, 2L, 4L, 7 |
76-81% |
100% |
92% |
|
Расширенная |
2R, 4R, 2L, 4L, 7, 5, 6 |
94% |
|
медиастиноскопия |
||||
|
Медиастиноплевроскопия |
2R, 4R, 2L, 4L, 7, 5, 6 |
81% |
100% |
92% |
|
Видеомедиастиноскопи- ческая лимфаденэктомия |
2R, 4R, 2L, 4L, 7 |
94% |
100% |
97% |
|
Чрезшейная медиасти нальная лимфаденэктомия |
2R, 4R, 2L, 4L, 7, 5, 6, 7, 8 |
94% |
100% |
97% |
|
Чрезбронхиальная биопсия медиастинальных лимфатических узлов под контролем УЗИ (EBUS-NA) |
2R, 4R, 2L, 4L, 7, 5, 6, 10, 11 |
89% |
100% |
94% |
|
Чрезпищеводная биопсия медиастинальных лимфатических узлов под контролем УЗИ (EUS-NA) |
4L, 7, 8L, 8R, 9L, 9R |
89% |
100% |
94% |
|
EBUS -NA+ EUS-NA |
2-4R, 2-4L, 7, 5, 6, 8L-R, 9L-R |
89% |
100% |
97% |
Наиболее обширный доступ к лимфатическим узлам средостения обеспечивает трансцервикальная расширенная медиастинальная лимфаденэктомия (TEMLA) [16]. Она позволяет полностью удалить 1, 2R, 4R, 3a,3p, 2L, 4L, 5, 6, 7, и частично - 8 группу лимфатических узлов, однако, по сути, является полноценным хирургическим вмешательством, средней длительностью 107 мин., с более чем 21% осложнений и 0,6– 1,2% смертности. Предложены и другие инвазивные методы стадирования рака легкого (парастернальная медиастиноплевроскопия, передняя медиастинотомия, видеоторакоскопия), однако широкого практического применения они не получили. На практике чаще всего применяются эндоскопические методы, ввиду их минимальной инвазивности, возможности биопсии большинства групп лимфатических узлов средостения при сочетанном их применении, и высокой чувствительности (до 90%), которая, однако, снижается до 58 – 60% при размерах медиастинальных лимфатических узлов менее 1 см. По последним данным, при сочетании ПЭТ-КТ и EBUS-NA, чувствительность для N-стадирования составляет 91 – 95%, точность – 92 – 97%.
Показания к инвазивным методам стадирования медиастинальных лимфатических узлов (N2-3)
-
1. сN1 по данным КТ и ПЭТ или центральный рак или периферическая
-
2. сN2 по данным КТ и ПЭТ – EBUS – NA/EUS-NA, при отрицательном
опухоль > 3 см (аденокарцинома с высоким уровнем накопления ФДГ) – EBUS – NA/EUS-NA или видеоассистированная медиастиноскопия).
результате – видеоассистированная медиастиноскопия.
Инвазивные методы не показаны при периферической опухоли ≤ 3с м и сN0 по данным КТ и ПЭТ.
Алгоритм диагностики поражения медиастинальных лимфатических узлов при раке легкого представлен на Рис.3.
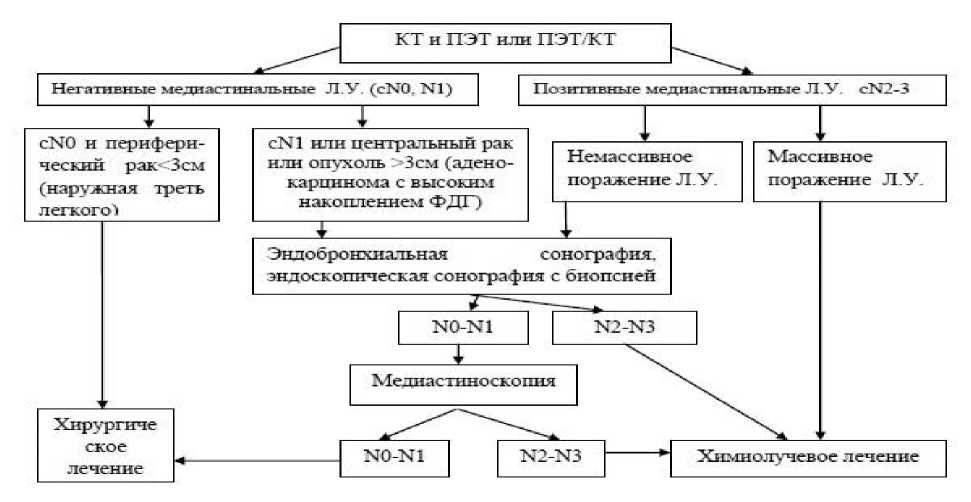
Рис.3. Алгоритм диагностики поражения медиастинальных лимфатических узлов при раке легкого.
При невозможности выполнить полноценное стадирование, для планирования лучевого лечения рака легкого полезно использовать данные о частоте поражения различных групп лимфатических узлов средостения, в зависимости от локализации и размеров первичной опухоли (Табл. 4).
Табл. 4. Частота метастазирования НМРЛ в различные группы лимфатических узлов средостения [4, 15].
|
Правое легкое |
Левое легкое |
||||
|
Группы лимфоузлов |
Верхняя и средняя доли |
Нижняя доля |
Группы лимфоузлов |
Верхняя доля |
Нижняя доля |
|
2R |
19% |
8% |
2L |
10% |
3% |
|
4R |
23% |
12% |
4L |
16% |
18% |
|
5,6 |
1 – 3% |
1% |
5/6 |
17% – 25% |
11 – 14% |
|
7 |
14% |
17% |
7 |
12% |
16% |
|
8R |
1 – 2% |
11% |
8L |
2% |
7% |
|
9R |
1 – 2% |
3% |
9L |
2%0 |
12% |
|
10,11 |
50% |
51% |
10,11 |
51% |
56% |
Наиболее точно N cтадирование проводится по результатам двухсторонней лимфаденэктомии во время хирургического вмешательства. Европейское общество терапевтической радиоционной онкологии (ESTRO) рекомендует при послеоперационном стадировании морфологическое исследование не менее 6 групп лимфатических узлов: 3 группы из зоны N1 (10, 11, 12) и 3 группы из зоны N2 (2R, 4R,7 – для правого легкого, 5, 6, 7 – для левого легкого). При опухоли нижней доли – дополнительно 9 группа (Рис.2). Дополнительный критерий достаточности хирургической лимфаденэктомии – негативность наиболее удаленной от опухоли группы лимфатических узлов.
М-стадирование
Немелкоклеточный рак легкого наиболее часто метастазирует в кости (до 34%), в легкие и плевру (до 30%), головной мозг (до 22%), печень (19%), надпочечники (8%). Для выявления всех локализаций отдаленных метастазов за исключением головного мозга, наиболее информативна позитронная эмиссионная томография с 18-фтордезоксиглюкозой. Она позволяет выявить дополнительно субклинические отдаленные метастазы у 6 - 37% больных и превосходит по точности КТ брюшной полости в сочетании со сцинтиграфией костей (Табл.5).
Табл. 5. Операционные характеристики различных методов выявления отдаленных метастазов рака легкого
|
Локализация |
Метод |
Чувствительность |
Специфичность |
Точность |
|
Легкие |
КТ |
78% |
98% |
93% |
|
ПЭТ |
95% |
98% |
96% |
|
|
Кости |
Сцинтиграфия |
78% |
98% |
88% |
|
ПЭТ-КТ |
93% |
99% |
96% |
|
|
Печень |
КТ |
62% |
99% |
81% |
|
ПЭТ |
100% |
100% |
100% |
|
|
Надпочечники |
КТ |
72% |
98% |
85% |
|
ПЭТ-КТ |
97% |
94% |
95% |
|
|
Головной мозг |
МРТ |
95-97% |
88 – 90% |
93% |
При невозможности выполнить ПЭТ, стандарт обследования больных раком легкого с целью выявления отдаленных метастазов включает МРТ головного мозга, КТ грудной клетки и брюшной полости, сцинтиграфию костей.
Пример формулировки диагноза: C34.2 Центральный рак верхней доли правого легкого (умеренно дифференцированный плоскоклеточный рак), Т3N2M0, IIIA стадия с поражением главного бронха 0,8 см от карины, метастазами в 2R, 4R, 7, 10R, 11R группы лимфатических узлов. Ателектаз верхней доли правого легкого.
Заключение
Изложенные в данной статье требования к исходному стадированию немелкоклеточного рака легкого отражают современные потребности планирования персонифицированной радиотерапии этого заболевания, учитывающие возможности современной конформной радиотерапии, радиобиологические характеристики жизненно важных органов грудной клетки, и являются необходимым условием достижения максимального терапевтического эффекта облучения при приемлемом для качества жизни больного уровне ранних и поздних лучевых повреждений.
Список литературы Немелкоклеточный рак легкого в практике радиотерапевта (лекция). Часть 1. Классификации и исходное стадирование
- Бычков М.Б., Горбунова В.А. Клинические рекомендации по диагностике и лечению больных раком легкого. Москва. 2014 г.
- Каприн А.Д., Старинский Д.Д., Петрова Г.В. (ред.). Состояние онкологической помощи населению России в 2016 году. М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИРЦ» Минздрава России, 2017. 236 с.
- Каприн А.Д., Старинский Д.Д., Петрова Г.В. (ред.). Злокачественные новообразования в России в 2015 году (заболеваемость и смертность). М. МНИОИ им. П.А. Герцена филиал ФГБУ «НМИРЦ» Минздрава России. 2017.
- Яблонский П.К., Петров А.С. Видеомедиастиноскопия и другие методы Nстадирования в хирургии рака легкого. М. ГЭОТАР-Медиа. 2015. 158 с.
- Dai C., Ren Y., Xie D., et al. Does Lymph Node Metastasis Have a Negative Prognostic Impact in Patients with NSCLC and M1a Disease? J Thorac Oncol. 2016. V. 11. No. 10. P. 1745-1754.
- Goldstraw P., Chansky K., Crowley J., et al. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer. J Thorac Oncol. 2016. V. 11. No. 1. P. 39-51.
- Henke L., Kashani R., Yang D., et al. Simulated Online Adaptive Magnetic Resonance- Guided Stereotactic Body Radiation Therapy for the Treatment of Oligometastatic Disease of the Abdomen and Central Thorax: Characterization of Potential Advantages. Int J Radiat. Oncol Biol Phys. 2016. V. 96. No. 5. P. 1078-1086.
- Kuzdzal J., Zielinski M., Papla B., et al. Tranccervical extended mediastinal lymphadenectomy - the new operative technique and early results in lung cancer stading. Eur J Cardiothor Surg. 2005. V. 27. No. 3. P. 384-390.
- Micames C.G., McCrory D.C., Pavey D.A., et al. Endoscopic ultrasound-guided fine- needle aspiration for non-small cell lung cancer staging: A systematic review and metaanalysis. Chest. 2007. V. 131. P. 539-547.
- Rusch V.W., Asamura H., Watanabe H., et al. The IASLC Lung Cancer Staging Project: A Proposal for a New International Lymph Node Map in the Forthcoming Seventh Edition of the TNM Classification for Lung Cancer. J Thorac Oncol. 2009. V. 4. No. 5. P. 568-577.
- Silvestri G.A, Tanoue L., Margolis M. The noninvasive staging of non-small cell lung cancer: the guidelines. Chest. 2003. V. 123. No. 1. P. 147-156.
- Travis W. D., E. Brambilla, A.G. Nicholson A.G., et al. The 2015 World Health Organization Classification of Lung Tumors: Impact of Genetic, Clinical and Radiologic Advances Since the 2004 Classification. J of Thorac Oncol. 2015. V. 10. No. 9. P. 1243-1260.
- Varlotto J.M., Yao A.N., De Camp M.M., et al. Nodal stage of surgically resected non- small cell lung cancer and its effect on recurrence patterns and overall survival. Int J Radiat Oncol Biol Phys. 2015. V.91. No. 4. P. 765-773.
- Vinod S.K. International Patterns of Radiotherapy Practice for Non-Small Cell Lung Cancer. Semin Radiant Oncol. 2015. V. 25. No. 2. P. 143-150.
- Wang Y.X., Li B.S., Huang W., et al. Pattern of lymph node metastases and its implication in radiotherapeutic clinical target volume in patients with non-small-cell lung cancer: a study of 2062 cases. Br J Radiol. 2015. V. 88. No. 1056.
- Zielinski M., Szlubovski A., Kolodziej M., et al. Commparison of endobronhial ultrasound and/or endoesophageal ultrasound with transcervical extended mediastinal lymphadenectomy for staging and restaging of non-small cell lung cancer. J Torac Oncol. 2013. V. 8. No. 5. P.630-636.


