Необычное n-алкилирование хиназолин-4(3Н)-она 2- бензоилхлорацетанилидом
Автор: Озеров А.А., Новиков М.С., Ходес Е.А.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Фармакология, токсикология
Статья в выпуске: 3 (59), 2018 года.
Бесплатный доступ
Алкилирование хиназолин-4(3Н)-она 2-бензоилхлорацетанилидом в среде безводного ДМФА при температуре 80-90 °С в присутствии карбоната калия сопровождается циклизацией и приводит к производному хиназолина, содержащему хинолоновый цикл в качестве заместителя, с выходом 78 %.
Хиназолин-4(3н)-он, 2-бензоилхлорацетанилид, n-алкилирование, циклизация, 2-хинолон
Короткий адрес: https://sciup.org/142216692
IDR: 142216692 | УДК: 547.856.1
Текст научной статьи Необычное n-алкилирование хиназолин-4(3Н)-она 2- бензоилхлорацетанилидом
N-Алкилирование хиназолин-4(3Н)-она анилидами альфа-галогенкарбоновых кислот, содержащими разнообразные заместители, позволяет получать соединения (1) с выражен- ной фармакологической активностью, спектр которой в наибольшей степени зависит от характера замещения в ароматическом ядре.
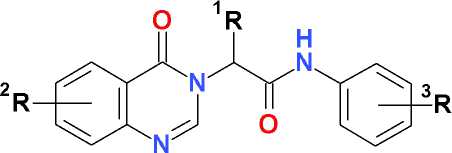
где R1 = H, CH 3 , C 2 H 5 ; R2 = H, 6(8)-CH 3 , Br, NO 2 ;
R3 = H, o -, m -, p -CH 3 , C 2 H 5 , C 6 H 5 , OCH 3 , N(CH 3 ) 2 , Cl, Br, NO 2
Среди соединений этого ряда ранее были выявлены вещества с отчетливыми иммуно-тропными [2, 3, 7], антидепрессантными [4, 5] и ноотропными [7] свойствами. С другой стороны, известны многие производные бензофенона, также демонстрирующие высокий уровень фармакологической, в частности, противовирусной активности [1, 8]. С целью синтеза новых фармакологически активных веществ, сочетающих в своей структуре основные элементы базового скелета соединений (1) и ядро бензофенона, нами была исследована реакция N-алкилирования хиназо-лин-4(3Н)-она 2-бензоилхлорацетанилидом.
ЦЕЛЬ РАБОТЫ
Исследование реакции N-алкилирования хи-назолин-4(3 Н )-она 2-бензоилхлорацетанилидом с целью получения новых фармакологически активных соединений хиназолинового ряда.
МЕТОДИКА ИССЛЕДОВАНИЯ
Спектры ЯМР 1Н и 13С регистрировали на спектрометре «Bruker Avance 600» (600 МГц для 1H и 150 МГц для 13С) в ДМСО-D 6 , внутренний стандарт тетраметилсилан. Интерпретацию спектров осуществляли с помощью лицензионной программы ACD/HNMR Predictor Pro 3.0 (Advanced Chemistry Development, Канада). Температуры плавления измерены в стеклянных капиллярах на приборе Mel-Temp 3.0 (Laboratory Devices Inc., США).
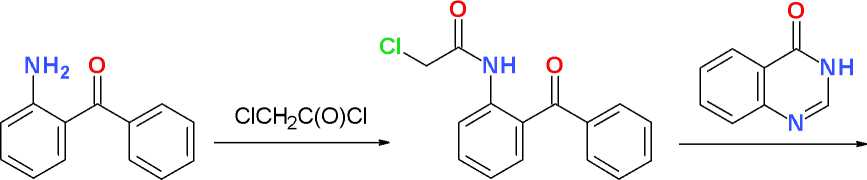
2-Бензоилхлорацетанилид (3). К перемешиваемому раствору 25,0 г (0,127 моль) 2-бензо-иланилина (2) и 11,0 мл (0,136 моль) пиридина в 200 мл хлороформа добавляют при температуре 0–10 оС в течение 10 мин 11,0 мл (0,138 моль) хлорацетилхлорида, перемешивают при той же температуре в течение 1 ч и выдерживают в течение ночи в холодильной камере при температуре 0–5 оС. Реакционную массу последовательно промывают 100 мл воды, 100 мл 2%-го раствора хлористоводородной кислоты, 100 мл 5%-го раствора натрия хлорида, сушат безводным натрия сульфатом, фильтруют и упаривают в вакууме. Остаток растирают с 50 мл диэтилового эфира, закристаллизовавшийся продукт отфильтровывают, промывают петролейным эфиром, сушат на воздухе при комнатной температуре, перекристаллизовывают из 150 мл изопропилового спирта и получают 29,2 г (84 %) светложелтого игольчатого кристаллического вещества, Т. пл. 108–109,5 оС.
Спектр ЯМР 1Н, δ, м. д.: 4,15 с (2Н, СН 2 ); 7,26– 7,86 м (9Н, ароматические Н); 10,68 с (1Н, NH).
Спектр ЯМР 13С, δ, м. д.: 43,26; 123,55; 124,74; 128,64; 129,77; 130,00; 131,09; 132,67; 133,11; 136,62; 137,51; 165,19; 196,17.
3-(2-Оксо-4-фенил-1,2-дигидрохинолин-3-ил) хиназолин-4(3 Н )-он (6). Смесь 2,00 г (13,7 ммоль) хиназолин-4(3 Н )-она (4) и 4,00 г (28,9 ммоль) тонко измельченного карбоната калия перемешивают при температуре 80–90 оС в течение 1 ч в 50 мл безводного ДМФА, добавляют в один прием 3,75 г (13,7 ммоль) 2-бензоил-хлорацета-нилида (3) и перемешивают при той же температуре в течение 2 ч.
Реакционную массу охлаждают, фильтруют, фильтрат упаривают в вакууме, растирают с 50 мл воды и выдерживают в течение ночи в холодильной камере при температуре 0–5 оС.
Образовавшийся осадок отфильтровывают, промывают водой, сушат на воздухе при комнатной температуре, перекристаллизовывают из 40 мл ледяной уксусной кислоты и получают 3,90 г (78 %) светло-желтого кристаллического вещества, Т. пл. 341–343 оС.
Спектр ЯМР 1Н, δ, м. д.: 7,06-7,64 м (11 Н, ароматические Н, Н6, Н8); 7,76 т (1Н, 8 Гц, Н7); 8,08 д (1Н, 8 Гц, Н5); 8,22 с (Н2); 11,93 с (1Н, NH).
Спектр ЯМР 13С, δ, м. д.: 115,78; 118,95; 121,45; 122,52; 126,18; 126,51; 127,23; 127,30; 127,41; 128,43; 128,60; 128,86; 131,66; 132,69; 134,70; 138,61; 147,50; 147,80; 149,84; 158,30; 159,74.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Ацилирование 2-бензоиланилина (2) хло-рацетилхлоридом легко протекает, как и в случае других замещенных производных анилина, в среде безводного хлороформа в присутствии пиридина при пониженной (0–10 оС) температуре и с высоким выходом (84% после очистки) приводит к производному бензофенона (3), содержащему хлорацетамидный фрагмент в альфа-положении. При этом наличие объемного бензоильного заместителя в орто положении исходного анилина не препятствует эффективному N-ацилированию (схема).
Однако использование полученного 2-бензоилхлорацетанилида (3) в реакции N-алкилирования хиназолин-4(3 Н )-она (4) не приводит к ожидаемому ацетанилидному производному (5). Выделенное с достаточно высоким выходом (78% после очистки) в качестве единственного продукта реакции соединение (6) обладает значительно более высокой температурой плавления (свыше 340 оС) по сравнению с полученными ранее аналогами – ацетанилидными производными хиназолин-4(3 Н )-она (220-270 оС в зависимости от характера замещения в ароматическом ядре [5]) и более низкой растворимостью в кислотах, щелочах и органических растворителях. В спектре ЯМР 1Н продукта реакции наблюдается не 17 протонов (как в случае соединения 5), а только 15 (как в случае соединения 6). Сигнал метиленовой группы СН 2 ацетильного фрагмента, который должен проявляться в области 4,80– 5,05 м.д. [5], в спектре отсутствует. Кроме того, в спектре ЯМР 13С, при наличии всех 21 сигналов магнитно не эквивалентных ядер углерода, отсутствует сигнал указанной выше метиленовой группы (область 40–50 м.д.), а также сигнал карбонильного углерода бензофенонового фрагмента (область 190–200 м.д.). При этом в спектре ЯМР 13С наблюдается два близких сигнала карбонильных групп как 4-хиназолинонового (159,74 м.д.), так и 2-хинолонового (158,30 м.д.) ядра.
2 34
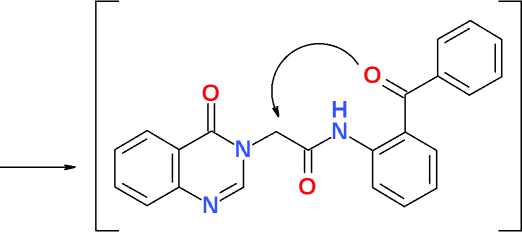
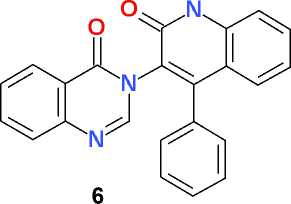
Схема. N-Алкилирование хиназолин-4(3 Н )-она 2-бензоилхлор-ацетанилидом
Таким образом, полученные спектральные данные позволяют предположить, что в условиях реакции N-алкилирования в полярной среде в присутствии основания при повышенной температуре в промежуточном соединении (5) происходит нуклеофильная атака ионизированной (как СН-кислоты) экзоциклической метиленовой группы по карбонилу бензофенонового фрагмента с последующей дегидратацией и формированием 1,2-дигидро-2-хинолоновой гетероциклической системы. Синтезированное соединение – 2-хинолоновое производное 4-хиназолинона (6) может представлять интерес в плане синтеза на его основе новых фармакологически активных веществ.
ЗАКЛЮЧЕНИЕ
N-Алкилирование хиназолин-4(3 Н )-она 2-бензоилхлорацетанилидом в полярной среде в присутствии основания сопровождается циклизацией боковой цепи и образованием 1,2-дигидро-2-хинолоновой системы.
Список литературы Необычное n-алкилирование хиназолин-4(3Н)-она 2- бензоилхлорацетанилидом
- Озеров А. А., Новиков М. С., Луганченко А. И. //ВНМЖ. -2012. -Вып. 4. -С. 15-18.
- Самотруева М. А., Цибизова А. А., Озеров А.А. //Хим.-фарм. журн. -2016. -Т. 50, № 6. -С. 12-14.
- Самотруева М. А., Цибизова А. А., Ясенявская А. Л. //Астрах. мед. журн. -2015. -№ 1. -С. 12-29.
- Тюренков И. Н., Озеров А. А., Солодунова Е. А. //Вестник ВолгГМУ. -2012. -Вып. 2. -С. 66-68.
- Тюренков И. Н., Озеров А. А., Солодунова Е. А. и др.//Хим.-фарм. журн. -2013. -Т. 47, Вып. 5. -С. 7-10.
- Тюренков И. Н., Озеров А. А., Шматова Е. Н. //Хим.-фарм. журн. -2015. -Т. 49, № 2. -С. 18-20.
- Цибизова А. А., Тюренков И. Н., Самотруева М. А. //Междунар. журн. прикл. и фундамент. исслед. -2013. -№ 11. -С. 71-72.
- Ren J.//J. Med. Chem. -2008. -Vol. 5, № 16. -P. 5000-5008.


