Новые подходы к коррекции цитопенического синдрома у пациентов с депрессией кроветворения
Автор: Романенко Н.А., Алборов А.Э.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Обзорные статьи
Статья в выпуске: 2 т.16, 2020 года.
Бесплатный доступ
Цитопенический синдром является следствием несостоятельности костного мозга и воздействия на него целого ряда неблагоприятных факторов и включает анемию, лейкопению, тромбоцитопению, которые могут приводить к осложнениям, угрожающим жизни. Причинами развития цитопений могут быть онкологические, инфекционные, некоторые врожденные, иммунные заболевания и дефицитные состояния. В этиологии цитопений важную роль могут играть хронический стресс, токсическое воздействие фармакологических препаратов, лучевое поражение клеток костного мозга. Для эффективной коррекции цитопении имеет большое значение выяснение причины и, по возможности, ее устранение и назначение адекватной терапии. Основными методами коррекции цитопенических состояний являются назначение заместительной терапии компонентами и препаратами крови, дающими быстрый терапевтический эффект, и гемостимулирующих средств. В статье продемонстрирован собственный опыт по использованию трансфузий эритроцитов, назначению эритропоэзстимулирующей терапии при анемическом синдроме; детально изложен вопрос посттрансфузионной перегрузки железом. Также представлены данные литературы по применению агонистов рецепторов тромбопоэтина в комплексной терапии у больных апластической анемией, миелодиспластическим синдромом.
Цитопенический синдром, анемия, тромбоцитопения, хелаторы железа, эритропоэтин, перегрузка железом, ферритин, лимфопролиферативные заболевания, миелодиспластический синдром, апластическая анемия, костный мозг, депрессия кроветворения, трансфузии эритроцитов
Короткий адрес: https://sciup.org/170172543
IDR: 170172543
Текст обзорной статьи Новые подходы к коррекции цитопенического синдрома у пациентов с депрессией кроветворения
диспластический синдром, апластическая анемия, костный мозг, трансфузии эритроцитов, депрессия кроветворения.
Цитопенические состояния, включающие анемию, лейкопению и тромбоцитопению, а также их сочетания, являются закономерным следствием несостоятельности костного мозга (КМ) и воздействия на него целого ряда неблагоприятных факторов. Цитопении могут проявляться в виде анемического,геморраги-ческого синдрома, синдрома иммунодефицита и могут приводить к различным, в том числе угрожающим жизни, осложнениям. Например, анемия приводит к гипоксии с последующим развитием сердечной недостаточности — как острой, так и хронической, к церебральной
Классификация цитопений по степеням тяжести (Шкала гематологической токсичности)
недостаточности, вплоть до комы; лейкопения — к инфекционным (бактериальным, вирусным, грибковым) осложнениям, вплоть до бактериально-септического шока; тромбоцитопения — к геморрагическому синдрому с кровоизлиянием в вещество мозга. Двухростковая цитопения и панцитопения еще более опасные состояния для больного, которые можгут угрожать его жизни и нередко требуют срочных мероприятий.
В таблице 1 приведена классификация ци-топений,которую используют для градации нежелательных явлений [1].
Таблица 1.
|
Степень |
Анемия (Гемоглобин г/л) |
Тромбоцитопения (Тромбоциты х 109/л) |
Лейкопения (Лейкоциты х 109/л) |
Нейтропения (Нейтрофилы х 109/л) |
|
1 (легкая) |
95 – 110 |
75 – 100 |
≥ 3,0 – < 4,0 |
≥ 1,5 – < 2,0 |
|
2 (умеренная) |
80 – 94 |
50 – 74 |
≥ 2,0 – < 2,9 |
≥ 1,0 – < 1,5 |
|
3 (средняя) |
65 – 79 |
25 – 49 |
≥ 1,0 – < 1,9 |
≥ 0,5 – < 1,0 |
|
4 (тяжелая/ угрожающая жизни) |
< 65 |
< 25 |
< 1,0 |
< 0,5 |
Причинные факторы развития цитопе-нического синдрома
Причинами цитопений могут быть различные факторы,среди которых особое значение имеют следующие.
-
1. Онкологические заболевания, прежде всего с поражением костного мозга и сопровождающиеся нарушением образования кроветворных клеток: острые и хронические лейкозы, миелодисплазия, множественная миелома, неходжкинские лимфомы, метастазы солидных опухолей в КМ, первичный, вторичный миелофиброз.
-
2. Инфекционные заболевания: группа вируса герпес (цитомегаловирусная инфекция, Эпштейна-Барр / инфекционный мононуклеоз, поражение костного мозга 6 типом вируса герпес и др.), коревая инфекция, коклюш, паракоклюш, туберкулез, ВИЧ, вирусные гепатиты В, С и др.
-
3. Дефицитные состояния: железодефицитная анемия, авитаминоз В12; B9; белковый дефицит и др.
-
4. Наследственная патология: врожденная нейропения, врожденные гипо- и апластические
-
5. Иммунного характера: иммунная тромбоцитопения, тромбоцитопения при аутоиммунных заболеваниях (например,при системной красной волчанке), аутоиммунная гемолитическая анемия (например,при не-ходжкинских лимфомах), апластическая анемия, аутоиммунная нейтропения (например, при ревматоилогических заболеваниях) и др. Этиологическими факторами цитопений могут быть хронический стресс, токсическое воздействие некоторых препаратов,прежде всего, цитостатиков (например, алкилирующие препараты, блокаторы топоизомеразы), иммуномодуляторов (леналидомид), некоторых таргетных препаратов (ингибиторы тирозинкиназы) [2, 3]. Эти лекарственные средства угнетают работу клеток костного мозга. Кроме того, может иметь большое значение в развитии цитопений и лучевое поражение кроветворных клеток костного мозга (радиоактивное поражение, облучение рентгеновскими лучами, воздействие СВЧ).
анемии (анемия Фанкони, Эстрена-Дамеше-ка, Джозефса-Блекфена-Даймонда).
Важно подчеркнуть, что в связи с совершенствованием медицинских технологий, разработкой таргетных препаратов, которые обладают миелосупрессивным эффектом, нередко применяемых на протяжении многих лет или пожизненно для лечения онкологических и аутоиммунных заболеваний, увеличивается и частота цитопенических состояний, в том числе, угрожающих жизни больного. Это диктует необходимость совершенствования программы коррекции цитопенического синдрома, с учётом патогенетических особенностей повреждения костномозгового кроветворения и с наиболее целесообразными комбинациями современных средств терапии,включая как компоненты, препараты крови, так и ростовые факторы.
Особенности цитопении при онкологической и гематологической патологии.
Цитопении — это состояния, которые часто встречаются в онкологической и гематологической практике, они могут служить моделью для изучения повреждения костного мозга различными цитотоксическими агентами и патологическими иммунными процессами. Апластическая анемия может рассматриваться в качестве варианта длительной цитопении с уменьшением гемопоэтического плацдарма в костном мозге и возможными вирусными, химическими и физическими (включая ионизирующее облучение) этиологическими факторами. Индуцирующее действие миелотоксических факторов при данной патологии объясняется повреждающим эффектом на митохондриальный аппарат клеток,ингибированием клеток-предшественниц гемопоэза, иммуноопос-редованной миелосупрессией с вовлечением Т-клеточного звена иммунитета. В то же время имеются косвенные данные о наследственной предрасположенности к развитию аплазии кроветворной ткани при неблагоприятных экзогенных воздействиях, свидетельством чего может служить повышенная частота встречаемости отдельных антигенов гистосовместимости у больных апластической анемией.
В качестве модели длительно текущей цитопении с неэффективным кроветворением и клональными нарушениями гемопоэза могут рассматриваться гипопластические варианты миелодиспластического синдрома (МДС). Напротив, постцитостатическая цитопения, индуцированная химиотерапией с развитием миелодепрессии, является моделью краткосрочной цитопении. При данном варианте глубина и длительность цитопении зависят как от миелотоксического агента и его дли- тельности, так и от величины костномозгового резерва.
Трансфузии донорских эритроцитов
В лечении всех типов цитопений широко используется заместительная терапия в виде трансфузий эритроцитных компонентов крови для коррекции анемии,концентрата тромбоцитов — для предупреждения и купирования геморрагического синдрома. Однако необходимо учитывать тот факт, что назначение гемокомпонентной терапии может приводить и к ряду осложнений. Например, несмотря на применение современных методов тестирования на различные вирусные инфекции, все же сохраняется риск передачи трансмиссивных инфекций (ВИЧ, вирусных гепатитов В и С, цитомегаловирусной инфекции, парвовируса В19, Т-клеточной лимфомы взрослого человека и др.). Кроме того, существует риск иммунных осложнений (аллоиммунизация, иммуносупрессия, особенно у пациентов, получающих химиотерапию, острая легочная недостаточность, посттрансфузионная пурпура, реакция «трансплантат против хозяина», острые и отсроченные трансфузионные реакции), а при многократных трансфузиях эритроцитов (ТЭ) — гемосидероза.
Для снижения частоты посттрансфузионных осложнений предложена рестриктивная тактика (жесткое ограничение показаний для ТЭ, т. е. переливания при снижении уровня гемоглобина менее 70 г/л), что позволяет уменьшить частоту тромботических осложнений (острого инфаркта миокарда, отека легких и др.). Однако данная тактика может оказаться не приемлемой в категории пациентов с заболеваниями системы крови или с онкологической патологией, так как имеется ряд особенностей течения болезни: нестабильность течения основного заболевания,отрицательное влияния на кроветворение лучевой и химиотерапии,инток-сикация за счет распада клеток или инфекций, иммуносупрессия, сердечная недостаточность, особенно у пожилых пациентов. Поэтому таким пациентам с анемией переливания донорских эритроцитов проводят и при более высоком уровне гемоглобина.
Важно подчеркнуть, что в качестве переносчиков газов крови в последние десятилетия все больше применяются компоненты, содержащие эритроциты со значительной редукцией примеси лейкоцитов,тромбоцитов и плазмы. Их применение значительно сокращает частоту посттрансфузионных пирогенных и иммун- ных, в том числе аллергических, реакций. Так, нами исследована частота применения эритро-цитсодержащих компонентов крови, включая фильтрованную эритроцитную массу (ФЭМ), отмытую эритроцитную массу (ОЭ), разморо- женные и отмытые эритроциты (РЭМ), а также эритроцитную массу (ЭМ) в гематологической клинике ФГБУ РосНИИГТ ФМБА России за периоды с 2005 по 2014 и с 2015 по 2019 годы (Рисунок 1).
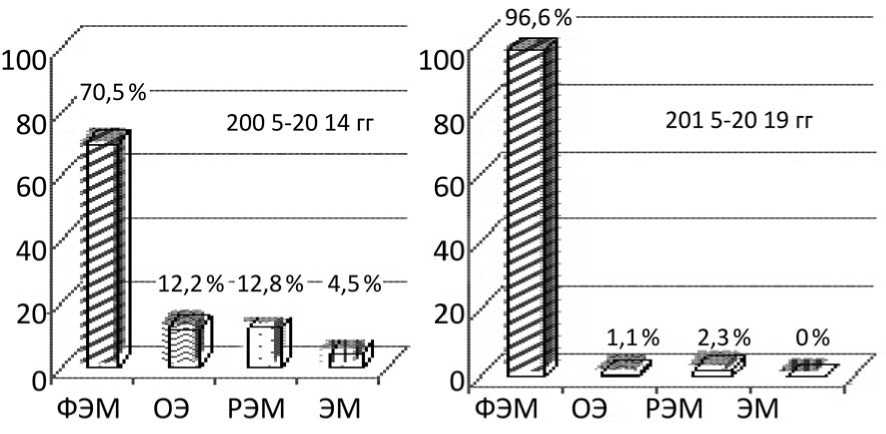
Рисунок 1. Частота применения эритроцитсодержащих компонентов крови у больных гемобластозами в различные периоды в ФГБУ РосНИИГТ ФМБА России.
Установлено, что в последние годы наиболее востребованным эритроцитсодержа-щим компонентом крови была фильтрованная эритроцитная масса,реже — отмытые эритроциты, размороженная эритроцитная масса. Важно отметить,что эритроцитная масса без редукции лейкоцитарного и тромбоцитарного слоя не применялась,что привело к следующему:
-
1. редукции посттрансфузионных пирогенных реакций;
-
2. уменьшению риска передачи вирусных агентов, например, цитомегаловируса благодаря удалению лейкоцитов и тромбоцитов в компоненте;
-
3. не было ни одного случая развития реакции «трансплантат против хозяина» (благодаря применению облученной фильтрованной эритроцитной массы);
-
4. снижению риска аллоиммунизации, что важно при планировании аллогенных трансплантаций;
-
5. стандартизации дозы эритроцитной массы (например, в 2005–2007 гг. объем эритро-цитной массы колебался от 90 до 300 мл, в последние годы — в пределах 300–370 мл), что позволяет точно знать объем перелитого компонента одному больному, следователь-
- но, и оценить эффективность терапии и риск перегрузки организма железом.
Актуальные аспекты перегрузки организма железом и ее профилактики
Широкое использование эритроцитных компонентов крови с заместительной целью для быстрой коррекции анемии,несмотря на применение эффективных эритроцитсодержащих сред, может приводить к перегрузке организма железом. Избирая ограничительную тактику, назначая больше инфузионных сред, препаратов патогенетической направленности для лечения анемии, все же не всегда удается избежать трансфузий эритроцитов у некоторой категории больных, что может стать причиной гемосидероза внутренних органов из-за избыточного содержания в организме железа, полученного при переливаниях донорских эритроцитов. Так, ежемесячные переливания даже 1–2 доз эритроцитной взвеси уже через 1,5–2 года могут привести к переизбытку железа в организме.
Важно отметить,что в организме человека общий пул железа составляет приблизительно 3–5 г, из которых 1,8–2 1 г находится в гемоглобине эритроцитов и миоглобине мышц, до 1 г — в печени, до 0,6 г — в макрофагах, до
0,4–0,6 г — в различных ферментах организма. При этом 1 мл нормохромных эритроцитов содержит железа в среднем 1,16 мг, а в 1 единице эритроцитной массы (300–360 мл) содержится около 200–250 мг железа. Следовательно, с учетом того, что объем циркулирующей крови (ОЦК) взрослого человека, имеющего гематокрит 40–45 %, составляет около 6 л (или 2000–2700 мл эритроцитов), что соответствует 10–12 единицам эритроцитной массы, становится очевидным, что переливание 20 доз эритроцитов эквивалентно переливанию двух ОЦК, или полному содержанию пула железа человека в организме. Иначе говоря, после трансфузий 20 доз донорских эритроцитов удваиваются запасы железа в организме: с 5 до 10 г. Однако, если на начальных этапах избыток железа «утилизируется» благодаря эффективному функционированию транспортных белков организма, транспортирующих железо в органы-депо,то со временем наступает их перегрузка, с последующим повреждением тканей отдельных органов, что приводит к такому грозному осложнению как гемосидероз внутренних органов [4, 5].
Опасность избыточного содержания агрессивных форм железа заключается в том, что оно инициирует процесс свободно-радикального окисления,приводя к повреждению фосфолипидов клеточных мембран с последующим нарушением функции внутренних органов, эндокринных желез. Так, избыток железа в организме может приводить к таким последствиям, как: 1) задержка роста (при действии токсических концентраций железа на гипофиз, что характерно для талассемии); 2) сахарный диабет (высокое содержание железа оказывает свое отрицательное влияние на поджелудочную железу); 3) цитопении (развитие костномозговой недостаточности); 4) фиброз, цирроз печени с последующей ее недостаточностью (токсический эффект на гепатоциты); 5) кардиомиопатия с развитием сердечной недостаточности [4, 6, 7].
Поэтому крайне важно учитывать число всех (в течение жизни)перелитых доз эритроцит-ной массы каждому больному, получающих многократные ТЭ,чтобы в дальнейшем своевременно мониторировать и диагностировать риск или уже развившуюся перегрузку организма железом. С этой целью необходимо оценить ферростатус больного. Для этого определяют, прежде всего, уровень ферритина в крови, изучают мазки пунктата костного мозга с помощью специфической окраски по Перлсу, при которой детально оценивают макрофаги и синцитий, анализируют накопление железа в тканях печени и миокарда с помощью Т2* взвешенной МРТ, а также исследуют функции эндокринных желез. Одним из наиболее доступных методов оценки перегрузки организма железом, применяемых в рутинной практике, является определение уровня ферритина. Обычно для больных, получающих многократные трансфузии, на перегрузку железа может указывать наличие в анамнезе более 20 переливаний эритроцит-содержащих компонентов крови и увеличение ферритина свыше 1000 нг/ мл (или мкг/л). Однако не стоит забывать и о том, что уровень ферритина является «суррогатным» маркером, так как он является не только транспортным протеином (депо), но и белком острой фазы воспаления. Следовательно, уровень ферритина увеличивается не только вследствие повышения содержания железа в организме, но и при воспалительных реакциях или при высокой активности иммунной системы как ответ на злокачественную опухоль, а также в период химиотерапевтического лечения. Поэтому при диагностике избытка железа необходимо учитывать и такие факторы,как «воспаление», «активность злокачественной опухоли», что особенно часто наблюдается, например, в активной фазе острого лейкоза.
В регуляции обмена железа в организме человека ключевую роль играет гормон гепси-дин, синтез которого индуцируется избытком железа и липополисахаридами мембран разрушенных микробных частиц,что наблюдается при воспалительном процессе. Гепсидин приводит к торможению абсорбции железа клетками крипты в энтероцитах, с одной сто-роны,и снижению высвобождения железа из макрофагов (из депо) и зрелых энтероцитов за счет снижения концентрации ферропортина — с другой. Следовательно,уровень гепсидина и ферритина увеличивается при инфекциях и злокачественных новообразованиях, что ведет к функциональному дефициту железа и развитию анемии. Однако при мутации гена, кодирующего гепсидин, когда гормон в крови практически отсутствует, наблюдается тяжелый переизбыток железа в организме с развитием гемохроматоза с поражением сердечной, эндокринной и других систем организма с развитием их недостаточности [8, 9].
Характерным для перегрузки железом является стойкое повышение уровня сывороточно- го ферритина (свыше 1000 мкг/л), снижение уровня сывороточного трансферрина и повышение коэффициента насыщения трансферрина железом ( > 60 %). Среди морфологических и биохимических критериев следует обратить внимание на повышенное количество сидеробластов в костном мозге, отложения гемосидерина в тканях (окраска по Перлсу) и высокую концентрацию железа в ткани печени [10].
Таблица 2.
Степени тяжести перегрузки железом
|
Степень тяжести |
Уровень ферритина мкг/ л |
LIC* (мг Fe на 1 г сухого вещества печени) |
МРТ — Т2* сердца (мс) |
|
Лёгкая |
1000 – 1999 |
1, 2 – 6,9 |
14 – 20 |
|
Умеренная |
2000 – 3999 |
7 – 14,9 |
8 – 13,9 |
|
Тяжелая |
≥ 4000 |
≥ 15 |
< 8 |
Если у больного выявлена легкая степень тяжести перегрузки организма железом, то за ним необходимо тщательно наблюдать, проводить мониторинг ферростатуса и рассматривать такого пациента в качестве кандидата на хелаторную терапию. В то же время,при средней степени тяжести и тяжелой перегрузке организма железом показана терапия хелаторами железа для того,чтобы не допустить последующего ухудшения состояния и развития гемосидероза с недостаточностью печени,или кардиомиопатии с сердечной недостаточностью [4, 5, 11].
Нами изучался риск перегрузки организма железом при целом ряде заболеваний системы
Количество трансфузий эритроцитов у различных категорий гематологических пациентов (Ме)
Таблица 3.
|
Заболевание |
Количество перелитых единиц ЭМ (Ме) |
Уровень ферритина в крови нг/мл (Ме) |
|
Талассемия |
80 |
1846 |
|
Первичный миелофиброз |
37 |
1476 |
|
МДС |
35 |
1406 |
|
Апластическая анемия |
32 |
1238 |
|
Неходжкинские лимфомы |
22 |
1195 |
|
Острые лейкозы |
20 |
1060 |
|
Хронический лимфолейкоз |
19 |
797 |
|
Аутоиммунная гемолитическая анемия |
17 |
227 |
|
Множественная миелома |
14 |
102 |
Более того, перегрузка организма железом средней и тяжелой степени с риском развития гемосидероза внутренних органов, значительно чаще обнаружена у пациентов с талассе-
По тяжести избыток железа в организме на практике принято делить на степени в зависимости от уровня ферритина в сыворотке крови (исследование содержания ферритина в крови), содержание железа в ткани печени (LIC* — концентрация железа в печени из расчета на сухое вещество) и миокарде (МРТ — Т2*), как показано в таблице 2 .
крови в зависимости от количества трансфузий эритроцитов. В ходе исследования выявлены группы больных, наиболее подверженных посттрансфузионной перегрузке организма железом — это пациенты с талассемией, первичным миелофиброзом (ПМФ), МДС, и АА (таблица 3) . В то же время, у больных неходжкинскими лимфомами (НХЛ), острыми лейкозами (ОЛ), хроническим лимфолейкозом (ХЛЛ), множественной миеломой (ММ) и аутоиммунной гемолитической анемией (АГА), даже, несмотря на то, что у них выявлялась анемия, нередко тяжелой степени, число трансфузий в сумме было значительно меньше [4].
мией, ПМФ, МДС, АА, а также НХЛ (рисунок 2). При этом уровень ферритина ≥ 2000 нг/мл наблюдался более чем у 30 % таких больных. Следовательно, этим пациентам показана терапия хелаторами железа. Однако следует не забывать,что ориентироваться лишь на биохимический маркер — ферритин — при констатации перегрузки организма железом нельзя, так как он отражает не только запасы железа, но и активность общего воспаления или опухолевого процесса в организме, являясь белком острой фазы воспаления. Поэтому при существенном увеличении уровня ферритина необходимо оценить данные анамнеза (количество перелитых доз эритроцитов), концентрацию растворимых трансферриновых рецепторов в сыворотке крови, по возможности, МРТ Т2* сердца, содержание железа в ткани печени (LIC*), а также исследовать пунктат костного мозга с окраской по Перлсу.
□ Ферритин 52000 нг/мл
□ Ферритин <2000 нг/мл
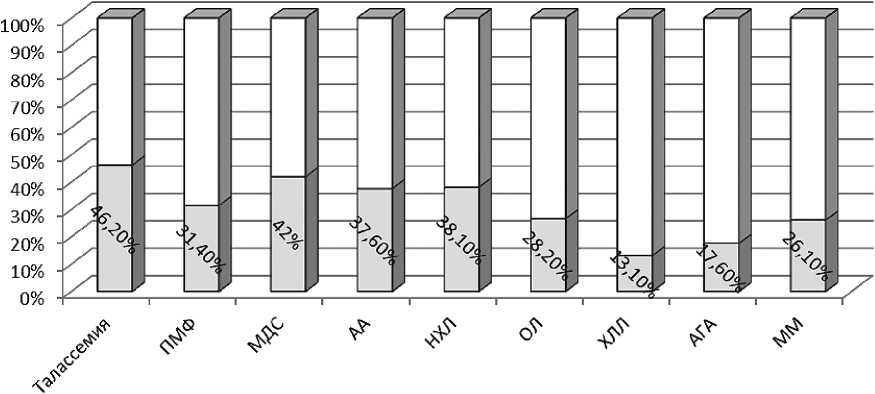
Рисунок 2. Частота выявления перегрузки железом средней и тяжелой степени у пациентов с различными заболеваниями системы крови.
Важно отметить,что при выявлении перегрузки организма железом и своевременном назначении адекватной терапии такому пациенту у него может существенно уменьшиться содержание железа, что не приведет к развитию гемосидероза внутренних органов.
Для наглядности представляется случай из практики течения заболевания с изменениями уровня ферритина у больной 39 лет с диагнозом врожденная гемолитическая анемия (бета талассемия, гетерозиготная форма), которой в течение жизни постоянно проводилась заместительная терапия эритроцитными компонентами крови в дозе 260 единиц (с возраста 5 лет по настоящее время).
Больная ШМХ, 39 лет, наблюдается в клиническом отделе гематологии ФГБУ РосНИИГТ ФМБА России с сентября 2008 года с диагнозом: (основной) гемолитическая наследственная анемия β-талассемия, гетерозиготная форма. Осложнения основного заболевания: гипохромная анемия IV ст. Сопутствующий диагноз: хронический вирусный гепатит В, персистирующая форма.
Из анамнеза болезни известно,что диагноз врожденной гемолитической анемии — малая β-талассемия — установлен на 1-м году жизни. В 5 летнем возрасте выполнена операция — спленэктомия. С 5 до 12 лет получала переливания эритроцитной массы по 3–5 доз каждые 3 месяца (за 7 лет перелито 130 единиц эри-троцитной массы). В 12 лет в связи с гемолитической реакцией прекращены ТЭ. Уровень гемоглобина сохранялся в пределах 60–70 г/л. В 24летнем возрасте у пациентки диагностируют трофическую язву левой голени, что потребовало возобновить переливания донорских эритроцитов. К моменту госпитализации пациентка получала постоянно по 2–4 единицы донорских эритроцитов каждые 3 месяца.
Объективно: состояние средней тяжести. Кожные покровы бледно-медного цвета. Пульс 102 удара в минуту. При аускультации на верхушке и в точке Боткина выслушивался систолический шум. Печень увеличена до +11 см из-под края реберной дуги.
Гемограмма (28.09.2009): Эритроциты — 3,05 × 1012/л, гемоглобин — 60 г/л, гемато- крит — 22,8 %, ретикулоциты — 37‰. Лейкоциты — 21, 4 × 109/л; лейкоцитарная формула: миелоциты — 2 %, метамиелоциты — 0 %, палочкоядерные — 8 %, сегментоядерные — 27 %; эозинофилы — 5 %, базофилы — 2 %, лимфоциты — 41 %, моноциты — 15 %. СОЭ — 37 мм/ч. Тромбоциты — 868 × 109/л. Анизоциты, мишеневидные эритроциты, полихромазия.
Биохимические показатели. Общий билирубин — 28,7 мкмоль/л (непрямой — 25 мкмоль/л). АлАТ — 3,1 ммоль/л, АсАТ-2,6, Электролиты — ионизированный кальций — 1, 37 ммоль/л. Данные обмена железа: сывороточное железо — 80,2 мкмоль/л, ферритин — 8657 нг/мл (в норме от 20 до 291 нг/мл), Трансферрин — 1,74 г/л, процент насыщения трансферрина — 106,2 % (в норме от 15 до 50 %).
По данным ЭХО-кардиографического обследования выявлены признаки сердечной недостаточности: концентрическая гипертрофия левого желудочка (толщина межжелудочковой перегородки — 1,5 см, задней стенки — 1,4 см).
Индекс массы миокарда 145 г/м2 с умеренным снижением глобальной сократимости левого желудочка (фракция выброса 45 %) за счет диффузной гипокинезии стенок миокарда. Дилатация левого предсердия (переднезадний размер 5 см).
В связи с анемией, наличием признаков перегрузки организма железом (включая сердечную недостаточность, снижение функции печени), проводилась терапия: деферозамин (Десферал) по 40 мг/кг (суточное введение) 7 дней, дефе-разирокс (Эксиджад) ежедневно по 20 мг/кг (в течение 1 года и 5 месяцев); трансфузии эритроцитов (5 доз каждые 6 месяцев); 6 циклов плазмафереза (удалено 3, 860 л плазмы).
В ходе лечения анемия была компенсирована, в гемограмме уровень гемоглобина повысился до 93 г/л (таблица 4) , уровень ферритина снизился за первый месяц до 5674 нг/мл.
В течение 3-х лет пациентка получала Экс-иджад (до 40 мг/кг) с параллельными трансфузиями донорских эритроцитов (3–5 доз каждые 3 месяца).
Таблица 4.
Динамика показателей красной крови и уровня ферритина у пациентки ШМХ в процессе лечения
|
Периоды терапии |
До начала хелаторной терапии |
Показатели в процессе терапии (хелаторами железа и трансфузиями эритроцитной массы) |
||||||
|
Терапия |
i i CM X ’*— ■ ' CD m ^ I- |
c; CD CL Ф "§" m
+ ^ гм =C 5 S о s m |
m h + -С Я CD ^ s m |
m i- + OJ о m m \ си s m |
m i- + (D о m го ? 4 LT) m |
m i- + —^. 5 m о CD Ji m |
m i- + —^. 5 m о CD Ji m |
m + -—^ 5 m о ^ m m =1 CD Ji m |
|
Дата период исследов. |
28.09.09 1 |
21.10.09 (1 мес.) 2 |
02.03.11 (+17 мес.) 3 |
02.07.11 (+4 мес.) 4 |
04.10.11 (+3 мес.) 5 |
16.03.12 (+6 мес.) 6 |
19.02.13 (+11 мес.) 7 |
10.10.13 (+8 мес.) 8 |
|
Эритроц. × 1012/л |
3,05 |
4,03 |
3,99 |
3,92 |
4,01 |
3,99 |
4,21 |
4, 21 |
|
Hb (г/л) |
60 |
93 |
99 |
97 |
95 |
94 |
103 |
103 |
|
Htc ( %) |
22,8 |
30,3 |
30,4 |
30,8 |
29,9 |
30,1 |
32,7 |
32, 7 |
|
Ферритин (нг/мл) |
8657 |
5674 |
5101 |
5080 |
4940 |
2664 |
1160 |
1160 |
В процессе такого лечения уровень ферритина удалось снизить до 1160 нг/мл (рисунок 3).
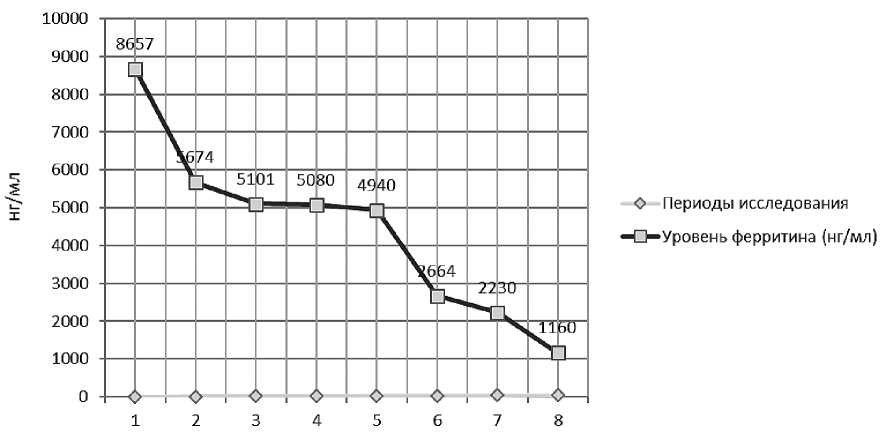
Рисунок 3. Динамика уровня ферритина у пациентки ШМХ на фоне хелаторной терапии.
Несмотря на то, что у больной не удалось получить значительного улучшения общего состояния, прогрессирование перегрузки организма железом остановлено. Более того, у пациентки уменьшились размеры печени — до +0, 5–1 см из-под края реберной дуги (ранее были размеры до +11 см). При исследовании содержания железа в 2016 г. (через 6 лет с момента начала терапии) в ткани печени (LIC*) — концентрация железа из расчета на сухое вещество составила 15,1 мг/г (соответствует средней степени тяжести) и миокарде (МРТ — Т2*) — 21,5 мс (соответствует норме, см. табл. 2). В настоящее время у больной уровень ферритина не превышает 1000 нг/ мл, несмотря на то, что она продолжает получать заместительную терапию — трансфузии эритроцитов (2–4 единицы каждые 3 мес.) и Экс-иджад по 20–30 мг/кг массы тела.
Представленным клиническим случаем показана эффективность хелаторной терапии в виде существенного снижения концентрации ферритина у больной врожденной гемолитической анемией — β-талассемией,имеющей исходно тяжелую перегрузку организма железом. При этом заболевании данный вид лечения применяется наиболее часто, так как эта категория пациентов требует многократных переливаний эритроцитов.
Таким образом, углубленное исследование эффективности хелаторной терапии у больных МДС, апластической анемией и некоторыми другими гематологическими заболеваниями, у которых развилась перегрузка железом, обусловленная длительной трансфузионной 52
зависимостью от донорских эритроцитов, представляется также актуальным направлением.
Эритропоэзстимулирующая терапия
Одним из путей решения проблемы эффективной коррекции анемии является назначение эритропоэзстимулирующих препаратов (ЭПСП). Однако данный вид лечения назначается не всем категориям больных. Эритропоэзстимулирующую терапию назначают онкологическим пациентам с солидными опухолями, лимфопролиферативными заболеваниями (ЛПЗ), а также МДС с благоприятным или промежуточным I прогнозом [12]. Важно при этом подчеркнуть, что при солидных опухолях, ЛПЗ показанием для назначения эритропоэтинов является анемия,в основе генеза которой лежит мие-лосупрессивный эффект химиотерапии, т. е. анемия, индуцированная противоопухолевой терапией (включая и таргетные препараты).
Для оценки эффекта терапии рекомбинантным эритропоэтином учитываются прибавка гемоглобина и достижение целевого уровня гемоглобина. Поэтому эффективной терапией считается, если у больного достигнут целевой уровень гемоглобина 120 г/л. Также положительным ответом считается и повышение гемоглобина на ≥ 20 г/л или ежемесячная прибавка его уровня на ≥ 10 г/л [13].
В гематологической клинике ФГБУ РНИИГТ ФМБА России нами проведено изучение эффективности рекомбинантного эритропоэтина у больных лимфопролиферативными заболеваниями. В целом,положительный ответ от корригирующей терапии ЭПСП при различных ЛПЗ был достигнут у 64, 5 % пациентов. Однако незначительно отличалась частота ответа на эритропоэтин в зависимости от группы больных, как показано на рисунке 4. Так, при индолентных НХЛ положительный результат констатирован у 77, 3 %, при множественной миеломе — у 61, 8 %, при хроническом лимфолейкозе — у 60, 9 %.
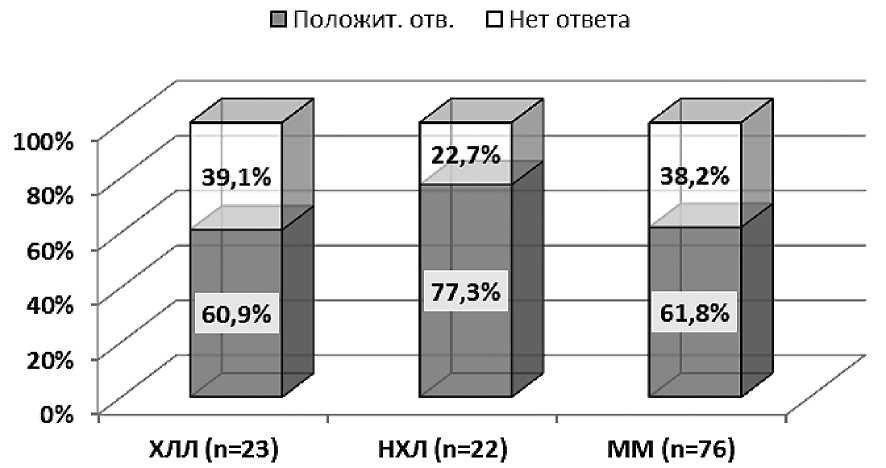
Рисунок 4. Эффективность препаратов эритропоэтина у больных лимфопролиферативными заболеваниями.
Как ранее было сказано,коррекцию анемии с помощью эритропоэзстимулирующих агентов проводят не только пациентам с ЛПЗ, но и с МДС, а в некоторых случаях и больным ПМФ, с той целью, чтобы отдалить период назначения трансфузий эритроцитов. Кроме того, ЭПСП назначаются и больным хроническим миелолейкозом,причиной анемии у которых был миелотоксический эффект блокатора тирозинкиназы. Так, по результатам наших собственных исследований, при миелодиспла-стическом синдроме эритроцитарный ответ достигался у 35,7 % больных, при первичном миелофиброзе — у 50 %, при хроническом миелолейкозе — у 72,2 % [2, 14].
Важно при оценке достижения ответа на терапию рекомбинантным эритропоэтином не только увеличить уровень гемоглобина на 20 г/л,но и достичь снижения зависимости от трансфузий эритроцитов. Под понятием
«зависимость от трансфузий эритроцитов» принято считать переливание ≥ 2 единиц в течение последних 8 недель. И обратное понятие «трансфузионная независимость» — отсутствие потребности в переливаниях эритроцитной массы в течение трех последовательных месяцев при минимальном и стабильном уровне гемоглобина ≥ 90 г/л [15].
Так, по результатам собственного исследования у пациентов с лимфопролиферативными заболеваниями, назначение терапии рекомбинантным эритропоэтином этой категории больных,зависимых от переливаний эритроцитов, позволило снизить трансфузионную зависимость в 2 раза по сравнению с контрольной группой больных (рисунок 5) , в которой пациентам проводилась лишь заместительная терапия с помощью переливаний,но без назначения ЭПСП [2].
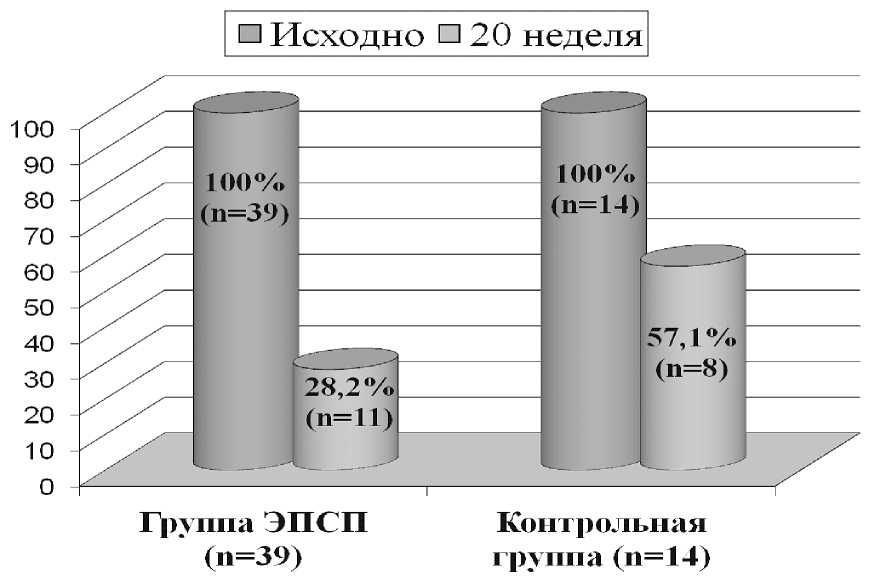
Рисунок 5. Снижение трансфузионной зависимости при назначении препаратов рекомбинантного эритропоэтина.
Агонисты тромбопоэтиновых рецепторов (АТР) в терапии онкогематологических больных
Препараты — агонисты тромбопоэтиновых рецепторов обладают высокой эффективностью и в последние годы широко применяются в лечении иммунной тромбоцитопении в основном в качестве второй или третей линии терапии, когда у больных констатирована неэффективность кортикостероидной терапии. Кроме этого у АТР, в частности у элтромбопага, выявлен и положительный эффект не только на тромбоцитарный росток,но и на ранние стволовые предшественники гемопоэза, поэтому у больных апластической анемией,гипопла-стическим вариантом миелодиспластического синдрома назначение препарата позволяет получить гематологический ответ, а у части пациентов и ремиссию заболевания.
Например, использование АТР у пациентов с апластической анемией позволяет получить ответ даже в режиме монотерапии. Однако применение АТР в комплексе с иммуносупрессивными препаратами повышает эффективность терапии в 1,5–2 раза. В исследовании Ecsedi M. и соавторов в ходе лечения 134больных апластической анемией с помощью элтром-бопага в дозе по 50–150 мг в день (длительность терапии составляла (Ме) 15,3 недель)
в комплексной терапии с АТГАМом и циклоспорином А общий ответ наблюдался у 62 % [16]. Похожие результаты показали и в своем ретроспективном анализе Konishi A. и соавторы, изучая результаты лечения 11 больных АА. В ходе терапии элтромбопагом общий ответ был констатирован у 55 % [17]. Winkler T. и соавторы, проводя свое исследование, в которое были включены пациенты с апластической анемией, рефрактерные к иммуносупрессивной терапии, заключили, что назначение элтром-бопага должно быть длительным, т. е. не менее 24 месяцев, с использованием максимальной дозы — по 150 мг ежедневно, так как на терапию в течение 12 месяцев отвечает лишь четверть больных АА [18]. По результатам их исследования общий ответ у больных АА рефрактерных к иммуносупрессивным средствам достигался в 50 % случаев.
Hong Y. и соавторы, проведя метаанализ исследований, посвященных изучению эффективности элтромбопага у пациентов с АА, выявили, что в режиме монотерапии на АТР общий ответ был достигнут у 47 % больных. В то же время, назначая элтромбопаг в комплексной терапии с иммуносупрессивными препаратами (АТГАМ, циклоспорин А), они отметили, что частота положительного ответа была выше, достигая 88 %, но при условии, что ранее антитимоци- тарный иммуноглобулин этим больным не применялся. В то же время,если ранее отмечалась рефрактерность к АТГАМу, общий ответ не превысил 17 % [19].
Важно отметить, что, несмотря на удовлетворительные результаты терапии АА с помощью АТР, в литературе появляются и негативные данные о возникновении клональной эволюции в МДС на фоне приема элтромбопага [16, 18, 19]. Однако необходимо заметить, что вероятность трансформации АА в МДС является давно известным фактом и наблюдается у больных АА, получающих иммуносупрессивную терапию и компоненты крови. Поэтому эти данные, в целом, требуют дальнейшего детального изучения на большей когорте пациентов.
Еще перспективным направлением применения АТМ является использование их для коррекции тромбоцитопении у пациентов с АА после аллогенной трансплантации,у которых в течение длительного периода нет тромбоцитарного ответа. У этой категории пациентов эффект достигается, как показали в своем исследовании Yuan C. и соавторы, в 62 % случаев при использовании элтромбопага начиная с 25–50 мг/ день [20]
В последние годы АТР стали применять и для лечения МДС. Так, известно, что миелодиспла-стический синдром характеризуется неэффективным гемопоэзом и часто — цитопеническим синдромом, для коррекции которого уже десятилетия применяются препараты рекомбинантного эритропоэтина и колониестимулирующий фактор гранулоцитопоэза (Г-КСФ) с положительным эффектом у 25–45 % пациентов. Аналогично эритропоэтинам и Г-КСФ, с недавнего времени в этой категории пациентов стали назначать агонисты рецепторов тромбопоэти-на,так как частым проявлением заболевания у них бывает тромбоцитопения,нередко проявляющаяся выраженным геморрагическим синдромом. Назначение же больным МДС препаратов АТР как в монорежиме, так и в комплексной терапии, например, с леналидомидом или с гипометилирующими агентами,позво-ляет повысить тромбоциты в периферической крови, уменьшить геморрагический синдром. Тем не менее, в настоящее время недостаточно изучен вопрос безопасности назначения агонистов тромбопоэтина при МДС: имеются клинические исследования, в которых показан опыт безопасного использования АТР, но есть и данные,показывающие увеличение риска трансформации в острый лейкоз [21, 22, 23].
Более того, с учетом высокой эффективности в отношении корригирующего эффекта,от-сутствия доказательной базы достоверности увеличения серьезных нежелательных явлений, в настоящее время элтромбопаг может быть использован для лечения тромбоцитопении при МДС, остром миелоидном лейкозе, в том числе тем больным,которым нет возможности провести соответствующее противоопухолевое лечение [24].
Таким образом,элтромбопаг не только эффективен в терапии иммунной тромбоцитопении, но и для лечения больных АА, МДС, а в некоторых случаях и для коррекции стойкой тромбоцитопении у пациентов с острым миелоидным лейкозом. При этом по имеющимся в настоящее время в литературе данным доказанного увеличения нежелательных явлений не выявлено. Следовательно, с учетом высокой его эффективности у пациентов с апластической анемией,МДС назначение данного агониста рецепторов тромбопоэтина оправдано. Однако важно помнить об адекватной терапевтической дозе препарата и длительности его назначения у этой категории пациентов.
Заключение. Цитопенический синдром при гемобластозах, являясь следствием несостоятельности КМ и/или результата воздействия на него химиотерапевтических,таргет-ных и иммуносупрессивных средств, а также ионизирующего действия лучевой терапии, является вариантом различных механизмов повреждения гемопоэтической ткани агрессивными факторами и некоторым образом может служить моделью для изучения эффективности коррекции с помощью заместительной (гемокомпонентной) и гемостимулирующей терапии. Исследование патогенетических особенностей развития цитопений у пациентов с депрессией кроветворения позволят разработать эффективный алгоритм их коррекции с учетом особенностей клинико-лабораторных данных. Проведенные ранее исследования по изучению результативности использования донорских компонентов крови, применения эритропоэзстимулирующих агентов, назначения препаратов хелирующих избыток железа у конкретного пациента,позволит разработать эффективную программу профилактики и терапии перегрузки организма железом у больных, получающих многократные переливания эритроцитсодержащих компонентов крови. Исследования эффективности применения агонистов рецепторов тромбопоэтина у боль- ных некоторыми онкогематологическими заболеваниями позволит улучшить результаты лечения пациентов с апластической анемией, миелодиспластическим синдромом, в том числе и после аллогенной трансплантации,а в некоторых случаях и острым миелоидным лейкозом.
Список литературы Новые подходы к коррекции цитопенического синдрома у пациентов с депрессией кроветворения
- Provan D., Baglin T., Dokal I., de Vos J. Oxford Handbook of Clinical Haematology // Oxford University Press, Third edition (2015), 2015: 824 p.
- Бессмельцев С. С., Романенко Н. А. Анемия при опухолевых заболеваниях системы крови: рук. для врачей / С. С. Бессмельцев, Н. А. Романенко. — М.: СИМК, 2017: 228 с.
- Романенко Н. А., Абдулкадыров К. М., Бессмельцев С. С. Эффективность коррекции анемии у боль- ных хроническим миелолейкозом, развившейся на фоне терапии иматинибом // Биомедицинский журнал Medline.ru. 2010; 11: 376–389.
- Грицаев С. В., Даваасамбуу Б., Романенко Н. А., Абдулкадыров К. М. Отбор больных для терапии хе- латорами железа // Клин. Онкогематология. 2013; 6(2); 204–209.
- Романенко Н. А. Терапия и профилактика анемии и перегрузки железом у больных миелодиспла- стическим синдромом // Биомедицинский журнал Medline.ru. 2012; 13: 967–986.
- Cazzola, M., Della Porta M. G., Malcovati L. Clinical relevance of anemia and transfusion iron overload in myelodysplastic syndromes // Hematology Am. Soc. Hematol. Educ. Program. 2008(1): 166–175.
- Gattermann N. Pathophysiological and clinical aspects of iron chelation therapy in MDS. Curr Pharm Des. 2012; 18(22): 3222–3234.
- Цветаева Н. В., Левина А. А., Мамукова Ю. И. Основы регуляции обмена железа // Клиническая онко- гематология. 2010.3(3): 278–283.
- Pigeon C., Ilyin G., Courselaud B. et al. A new mouse liver-specific gene, encoding a protein homologous to human antimicrobial peptide hepcidin, is overexpressed during iron overload // J. Biol. Chem. 2001; 276(11): 7811–7819.
- Лукина Е. А., Деженкова А. В. Метаболизм железа в норме и при патологии // Клин. онкогематол. 2015; 8(4): 355–361.
- Taher A., El Rassi F., Isma‘eel H. et al. Correlation of liver iron concentration determined by R2 magnetic resonance imaging with serum ferritin in patients with thalassemia intermedia // Haematologica. 2008; 93(10): 1584–1586.
- Протоколы клинических рекомендаций поддерживающей терапии в онкологии под ред. Академика РАН М. И. Давыдова, 2-е издание дополненное. М., 2018, 228 с. [rassc. org. Электронный ресурс; по- следнее обращение 17.04.2020].
- Романенко Н. А., Бессмельцев С. С., Беркос М. В., Розанова О. Е., Абдулкадыров К. М. Прогностическая значимость ряда лабораторных показателей крови при использовании препаратов, стимулирующих эритропоэз у больных лимфопролиферативными заболеваниями с анемией // Тер. Архив. 2013; 85(8): 81–86.
- Романенко Н. А., Грицаев С. В., Бессмельцев С. С., Абдулкадыров К. М. Эффективность эритропоэзсти- мулирующих препаратов при анемии у больных миелодиспластическим синдромом / Гематология и трансфузиология. 2013; 58(4): 18–21.
- Cheson B. D., Greenberg P. L., Bennett J. M. et al. Clinical application and proposal for modification of the International Working Group (IWG) response criteria in myelodysplasia. Blood 2006; 108(2): 419–25.
- Ecsedi M., Lengline E., Knol-Bout C. et al. Use of eltrombopag in aplastic anemia in Europe. Ann Hematol. 2019; 98(6): 1341–1350.
- Konishi A., Nakaya A., Fujita S. et al. Evaluation of eltrombopag in patients with aplastic anemia in real-world experience // Leuk. Res. Rep.2019; 5(11): 11–13.
- Winkler T., Fan X., Cooper J. et al. Treatment optimization and genomic outcomes in refractory severe aplastic anemia treated with eltrombopag. Blood. 2019; 133(24):2575–2585.
- Hong Y., Li X., Wan B. et al. Efficacy and Safety of Eltrombopag for Aplastic Anemia: A Systematic Review and Meta-analysis. Clin Drug Investigating. 2019; 39(2): 141–156.
- Yuan C., Boyd A. M., Nelson J. et al. Eltrombopag for Treating Thrombocytopenia after Allogeneic Stem Cell Transplantation. Biol Blood Marrow Transplant. 201925(7): 1320–1324.
- Basood M., Oster H. S., Mittelman M. Thrombocytopenia in Patients with Myelodysplastic Syndromes: Still an Unsolved Problem Mediterr J Hematol Infect Dis. 2018; 10(1): e2018046. doi: 10.4084/MJHID.2018.046. [Электронный ресурс; последнее обращение 23.04.2020]
- Oliva E. N., Alati C., Santini V. et al. Eltrombopag versus placebo for low-risk myelodysplastic syndromes with thrombocytopenia (EQoL–MDS): phase 1 results of a single-blind, randomised, controlled, phase 2 superiority trial. Lancet Haematol. 2017; 4(3): 127–136.
- Swaminathan M., Borthakur G., Kadia T. M. et al. A phase 2 clinical trial of eltrombopag for treatment of patients with myelodysplastic syndromes after hypomethylating-agent failure. Leuk Lymphoma. 2019; 60(9): 2207–2213.
- Mittelman M., Platzbecker U., Afanasyev B. et al. Eltrombopag for advanced myelodysplastic syndromes or acute myeloid leukaemia and severe thrombocytopenia (ASPIRE): a randomised, placebo-controlled, phase 2 trial // Lancet Haematol. 2018; 5(1): 34–43.


