О дозазависимом влиянии экзогенного 20-гидроксиэкдизона на глоточную железу и поведение взрослых пчел Apis mellifera L.
Автор: Авдеев Н.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Физиология адаптаций
Статья в выпуске: 6 т.59, 2024 года.
Бесплатный доступ
20-Гидроксиэкдизон (20Е) - биологически активное вещество, оказывающее множественной действие как на позвоночных, так и на беспозвоночных. У членистоногих стероидный гормон 20Е в первую очередь известен как гормон линьки доимагинальных стадий, относительно недавние исследования свидетельствуют об активности 20Е у взрослых насекомых. Однако результаты исследований его эффектов противоречивы, а попытка коммерческого использования препаратов 20Е в пчеловодстве не имела успеха, вероятно, из-за толерантности Apis mellifera L. к экзогенному 20Е вследствие усиления его метаболизма или активации гематоэнцефалического барьера. В настоящей работе в модельном опыте мы показали, что биологическое действие 20Е на молодых пчел проявляется в дозозависимом влиянии на запасание корма в ячейках сот, на развитие глоточной железы и накопление в меде секретируемого ею пролина. Целью исследования было выявление дозы экзогенного 20Е, активирующей компенсаторную реакцию на его поступление в организм, и особенностей этой реакции. В лабораторном эксперименте по 50 недавно вылупившихся рабочих особей помещали в клетки размером 120×105×40 мм с пустым сотом в трех-четырехкратной повторности на вариант корма. Кормом служил 50 % сахарный сироп с добавками 20Е в концентрации от 4×10-10 до 1×10-5 моль/л (суточная доза от 0,01 до 250 пмоль на пчелу), в контроле в сироп 20Е не добавляли. В течение 7 сут клетки находились в гигротермостате при температуре 35,0±0,5 °С и относительной влажности воздуха 50±5 %. Наименьшая исследованная суточная доза 20Е (0,01 пмоль на пчелу) не оказала достоверного влияния на размеры фолликулов глоточной железы. Максимальное уменьшение диаметра фолликулов глоточной железы (на 1/4, p 1/5, p -10 до 2×10-9 моль/л (или дозы с 0,01 до 0,05 пмоль на пчелу в сутки). Таким образом, в зависимости от дозы 20Е его биологическое действие меняется вплоть до смены эффекта на противоположный. Сделано предположение, что при поступлении с кормом 20Е в суточной дозе 0,05 пмоль на пчелу происходит активация ферментного окисления 20Е, обусловливающая защитный эффект за счет снижения концентрации 20Е в гемолимфе.
Медоносная пчела, 20-гидроксиэкдизон, гормон линьки, доза-эффект, глоточная железа, пролин, запасание нектара
Короткий адрес: https://sciup.org/142244128
IDR: 142244128 | УДК: 638.1:591.1:577.171.7 | DOI: 10.15389/agrobiology.2024.6.1160rus
Текст научной статьи О дозазависимом влиянии экзогенного 20-гидроксиэкдизона на глоточную железу и поведение взрослых пчел Apis mellifera L.
Один из механизмов регуляции размера пчелиной семьи — каннибализм, когда рабочие особи поедают часть развивающихся личинок. Активность каннибализма подвержена сезонной изменчивости: весной со стадии яйца до имаго доживает 75-80 % пчел, летом — 80-90 %, осенью — 50-75 % (22). Содержание 20Е у куколок рабочих пчел и трутней достигает максимальных значений на стадии розовых глаз — 1441,04±407,17 пмоль/мл (23) или 800 пг/мкл гемолимфы (24) (примерно 1,5½10-6 моль/л). Можно предполагать, что устойчивость к высокому уровню экзогенного 20Е эволюционно возникла у предков пчелиных — хищных и паразитических видов перепончатокрылых.
Известны несколько путей инактивации экдистероидов у насекомых: 3-эпимеризация, 22-фосфорилирование, 22-этерификация и 26-гидроксилирование (25, 26). Последний вариант с образованием (20-гидрокси)-экдизоновый кислоты является основным (26). Ген Cyp18a1 , кодирующий цитохром P450-зависимую монооксигеназу, которая катализирует эту реакцию, сохранился у медоносной пчелы, несмотря на значительное сокращение генов детоксикации в ходе эволюции (27, 28). Активность фермента, окисляющего 20Е, регулируется концентрацией 20Е. Введение 20Е табачному рогатому червю Manduca sexta Linnaeus, 1763 приводит к индукции активности экдистероидной 26-гидроксилазы в митохондриях и микросомах средней кишки (29).
Между мозгом и гомолимфой медоносной пчелы существует гематоэнцефалический барьер, перенос стероидных гормонов через него осуществляется с участием полипептида EcI. Экспрессия транспортного EcI происходит в поверхностных глиальных клетках, которые образуют гематоэнцефалический барьер, и при недостатке EcI в гематоэнцефалическом барьере блокируется передача опосредованных 20Е сигналов в мозг (30).
Анализ публикаций по влиянию экзогенного 20Е на взрослых особей медоносной пчелы (5-11) показывает широкий разброс используемых концентраций, чаще очень высоких. При этом в одном исследовании, как правило, испытывается единственная концентрация, что делает полученные результаты несопоставимыми. Существующие работы с разными концентрациями 20Е, различающимися на один-два порядка, не выявили существенной разницы в действии 20Е (11). Публикаций с широким диапазоном исследованных концентраций экзогенного 20Е и оценкой действия одновременно на разные органы-мишени, в том числе головной мозг, отвечающий за поведенческие реакции, в доступной научной литературе мы не обнаружили.
В настоящей работе в модельном опыте, сопоставив биологическое действие разных концентраций 20Е, мы показали его дозозависимое влияние на поведение, развитие глоточной железы и ее функцию у молодых пчел.
Целью исследования было выявление дозы экзогенного 20Е, активирующей компенсаторную реакцию на его поступление в организм, и особенностей влияния 20Е на глоточную железу, секрецию ею пролина и поведенческие реакции пчел (запасание корма в ячейки сот).
Методика . В работе использовали медоносных пчел местной популяции Apis mellifera mellifera , для чистоты опыта пчел брали из одной семьи. Исследования выполнены в июне 2020 года.
Готовили пять вариантов углеводного корма: с концентрацией 20Е 4х10 ’ 10, 2x10 — 9 , 2x10 — 8 , 1x10 — 5 моль/л и контрольный (без 20Е). Использовали стандартный образец 20Е (ООО «Геофарма», Россия). Все варианты корма, в том числе контрольный, содержали 50 % сахарозы и 0,2 % этанола, используемого для растворения 20Е.
В эксперименте моделировали работу пчел-приемщиц. По 50 рабочих пчел в возрасте до 24 ч заселяли в клетки размером 120½105½40 мм с кормушкой с раствором сахарозы (контроль — без 20Е, 3 клетки, опыт — с 20Е от 4½10-10 до 1½10-5 моль/л, по 3-4 клетки) и пустым сотом, помещали в гигротермостат при температуре 35,0±0,5 ° С и относительной 1162
влажности воздуха 50±5 %. Условия опыта, конструкция клетки и кормушки приведены в соответствие с рекомендациями и описаниями в аналогичных сообщениях (31, 32). Через 7 сут учитывали смертность, количество взятого сиропа и запасенного корма, определяли содержание пролина в запасенном корме, исследовали анатомическое состояние глоточных желез.
Гибель пчел в 1-е сут, связанную с травмами от манипуляций при заселении в клетки, из результатов смертности исключали.
Для оценки состояний глоточных желез отбирали по три-четыре пчелы из каждой клетки, фиксировали и хранили материал в жидкости Буэна. Пчелу переносили в 70 % спирт, препарировали глоточную железу, с помощью бинокулярного микроскопа МБС-10 (ОАО ЛЗОС, Россия), цифровой камеры HAYEAR 5MP (Китай) и программы HiView 1.0 измеряли размеры 10-24 случайно выбранных фолликулов, лежащих в экваториальной проекции (всего по 160-215 фолликулов на вариант опыта).
Содержание пролина в меде определяли по ГОСТ Р 54947-2012 («Мед. Метод определения пролина». М., 2013). Общее количество секретируемого пролина рассчитывали, как произведение количества запасенного продукта на содержания в нем пролина.
Вычисляли средние значения ( M) и стандартные ошибки средних (±SEM), а также коэффициент вариации ( Cv , %) и корреляции ( r ). Достоверность различий оценивали, используя t -критерий Стьюдента. Статистическую обработку данных проводили в программе Microsoft Excel.
Результаты . Количество потребленного сиропа (разница между взятым из кормушки и отложенным в ячейках сотов) во всех вариантах опыта практически не различалось и в среднем в сутки на пчелу составило 27,7±1,4 мг, или 22,0±1,1 мкл. Суточные дозы 20Е по вариантам опыта составили: минимальная — 0,01; низкая — 0,05; промежуточная — 0,5; максимальная — 250 пмоль на пчелу при концентрациях 20Е в сахарном сиропе соответственно 4½10 - 10, 2½10 - 9, 2½10 - 8 и 1½10 - 5 моль/л.
Смертность пчел при потреблении чистого сахарного сиропа к концу опыта составила 4,7±3,7 %. Добавление в сироп 20Е достоверно не повлияло на смертность, что соответствует результатам аналогичных работ (5). Однако при максимальной исследованной дозе показатель смертности повышался до 17,1±4,5 % (p = 0,10).
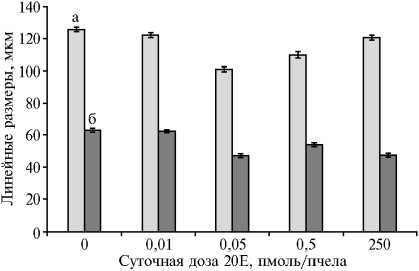
Рис. 1. Размеры фолликулов глоточной железы у пчел Apis mellifera mellifera в зависимости от суточной дозы 20Е: а — длина, б — диаметр ( n = 160215, M ±SEM, модельный опыт; Пермский край, 2020 год).
происходит частичное восстановление
Минимальная доза 20Е не оказывала достоверного влияния на линейные размеры фолликулов глоточной железы (рис. 1). Однако имело место небольшое (р < 0,05) снижение соотношение длины фолликула и его диаметра, что характерно для возрастных изменений глоточной железы, связанных с повышением ее секреторной активности (33). При увеличении количества полученного 20Е резко уменьшался как диаметр (на 1/4), так и длина фолликулов (на 1/5). Однако при дальнейшем повышении дозы размеров фолликулов глоточной железы. Максимальная доза привела к уменьшению диаметра фолликулов. Все различия линейных размеров по сравнению с контролем или вариантом с минимальной дозой, а также с предыдущим вариантом опыта были статистически значимы (р < 0,001), длина фолликула в варианте с максимальной дозой почти достигла контроля (р < 0,05).
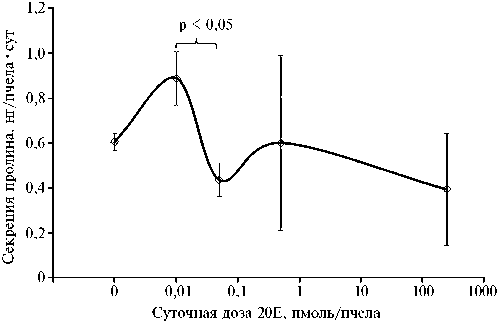
Рис. 2. Секреция пролина у пчел Apis mellifera mellifera в зависимости от суточной дозы 20Е ( n = 3-4, M ±SEM, модельный опыт; Пермский край, 2020 год).
Максимальную секрецию пролина (рис. 2) отмечали при минимальной дозе 20Е, минимальную — при низкой и максимальной. Низкая доза вызвала 2-кратное снижение (p < 0,05) секреции пролина по сравнению с минимальной. Секреторная активность имела высокую корреляцию (r = 0,83) с шириной фолликулов глоточной железы.
Результаты, полученные нами для максимальной концентрации 20Е, подтверждают данные о негативном влиянии высоких доз 20Е (инъекции 3, 30 и 300 пмоль на пчелу) на размеры фолликулов глоточной железы и экспрессию генов ее секреторных белков (11). Однако нами обна- ружено существенное снижение размеров глоточной железы и секреции ею пролина при низкой дозе 20Е и ослабление эффекта при промежуточной дозе. При этом характер деформации фолликулов различен: низкая доза вызывала уменьшение размера фолликулов с сохранением пропорций, высокая — приводила к деструкции с уменьшением диаметра фолликулов и некоторым смещением максимального диаметра к верхушке фол- ликула.
Максимальная активность пчел по запасанию корма отмечалась при минимальной концентрации 20Е (4½10 - 10 моль/л) (рис. 3). В работе Н.П. Тимофеева (8) стимулирующий эффект при сборе нектара в естественных условиях обнаружен в еще меньшей концентрации — 2½10 - 11 моль/л.
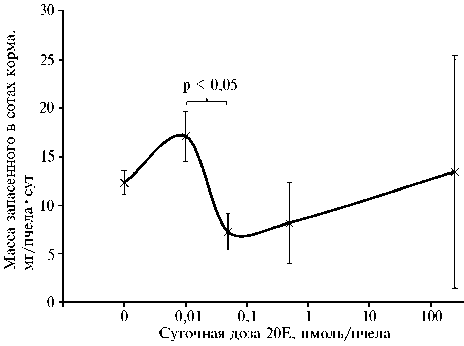
Рис. 3. Перенос сахарного сиропа в соты пчелами Apis mel-lifera mellifera в зависимости от суточной дозы 20Е ( n = 34, M ±SEM, модельный опыт; Пермский край, 2020 год).
Однако последовавшее 5-кратное увеличение дозы привело 2-кратному снижению этого показателя (p < 0,05).
Далее рост дози-woo ровки 20Е сопровождался повышением вариабельности количества за пасенного корма в сотах (Cv от 16,8 % в контроле до 125,4 % при макси- мальной дозе 20Е). Перенос корма в ячейки сотов — социальное поведение, характерное для группы пчел. Однако, вероятно, на этот процесс влияют пчелы-лидеры или переносом корма в соты занимаются не все пчелы из группы. Отмечено (12), что у некоторых молодых пчел содержание 20Е чрезвычайно высокое — до 10-6 моль/л.
Наибольший интерес представляет обнаруженное скачкообразное уменьшение размера фолликулов, а также запасания корма и секреции пролина при повышении дозы с минимальной до низкой. Принимая, что концентрация 20Е в гемолимфе молодых рабочих пчел (возраст 1-5 сут) находится в пределах 0,01-0,025 пмоль/мкл (34, 35) при количестве гемолимфы у пчелы 15 мкл (36), фоновое количество эндогенного 20Е составляет в среднем 0,25 пмоль на одну пчелу. Таким образом, полученная в сутки минимальная доза 0,01 пмоль экзогенного 20Е равняется примерно 1/ 25 части эндогенного. Можно предположить, что такое количество экзогенного 20Е беспрепятственно проникает через пищеварительный тракт и гематоэнцефалический барьер, оказывая значительное стимулирующее влияние на глоточную железу и головной мозг пчел, а при пятикратном увеличение суточной дозы, соответствующей примерно 1/ 5 от эндогенного 20Е, происходит активация 20Е-оксидазы, снижающей общий титр 20Е.
При суточной дозе 0,5 пмоль на пчелу некоторое восстановление размеров фолликулов глоточной железы и вариабельности биологического действия, вероятно, обусловлено слишком высокой нагрузкой на ферменты, метаболизирующие 20Е. Поскольку характер изменения параметров глоточной железы и поведения совпадают, можно предположить отсутствие влияния гематоэнцефалического барьера, по крайней мере, в минимальной и низкой дозе 20Е.
В целом следует отметить, что, несмотря на кажущуюся толерантность взрослых пчел, 20Е, получаемый при посещении некоторых медоносных растений (17, 21) и имеющем место каннибализме (22), значительно влияет на поведение, состояние и работу глоточных желез медоносной пчелы. Предложенная ранее V. Corby-Harris с соавт. (11) опосредованная 20Е модель регуляции активности глоточной железы требует пересмотра, поскольку характер влияния 20Е на ее развитие и функционирование более сложный. Так, мы выявили два максимума концентрации 20Е, оказывающие негативное действие на размеры и секреторную активность глоточной железы, скачкообразное уменьшение как ее размеров и секреторной активности, так и поведения по запасанию углеводного корма в соты, сопровождаемые изменением эффекта на противоположный. Можно предполагать активацию ферментов, окисляющих 20Е при его поступлении с кормом в дозе от 0,01 до 0,05 пмоль на пчелу в сутки (соответствующие концентрации 20Е в сахарном сиропе — от 4½10 - 10 до 2½10 - 9 моль/л). Тогда низкая эффективность выпускаемого ранее препарата ВЭСП объясняется слишком высокой концентрацией активного вещества в рабочем растворе (2½10 - 8 моль/л), оказывающей негативное действие на глоточную железу и проявление кормового инстинкта. Отмеченное ранее повышение кормособирающей активности пчел при очень малом количестве экзогенного 20Е (2½10 - 11 моль/л) (8) обусловлено стимулированием деятельности пчел — приемщиц нектара. Следовательно, использования препаратов 20Е в пчеловодстве с целью повышения интенсивности сбора меда представляет интерес.
Также отметим, что наши исследования проведены на небольших группах пчел при клеточном содержании в лабораторных условиях и представляют собой первый этап в изучении 20Е как биологического стимуля-1165
тора на полноценных пчелиных семьях в условиях пасек. Предполагаемый механизм смены знака эффекта требует подтверждения в экспериментах по анализу содержания 20Е в гемолимфе и генной экспрессии.
Итак, показано, что наименьшая исследованная суточная доза 20-гидроксиэкдизона (20Е) (0,01 пмоль на пчелу) не оказала достоверного влияния на размеры фолликулов глоточной железы. Диаметр фолликулов глоточной железы максимально уменьшался (на 1/ 4 , p < 0,001) при максимальной и низкой дозе 20Е (соответственно 250 и 0,05 пмоль на пчелу в сутки). Минимальную длину фолликулов (уменьшение на 1/ 5 , p < 0,001) отмечали только при низкой дозе 20Е (0,05 пмоль на пчелу в сутки), при дозе 250 пмоль на пчелу в сутки фолликулы вытягивались и почти достигали контрольной длины (p < 0,05). Размеры фолликулов при промежуточной суточной дозе (0,5 пмоль на пчелу) имели промежуточные показатели между таковыми для 0,05 пмоль на пчелу в сутки и контролем при достоверных отличиях от этих значений (p < 0,001). Также выявлено скачкообразное снижение (в 2 раза, p < 0,05) секреции пролина и активности пчел по запасанию корма при повышении дозы 20Е с 0,01 до 0,05 пмоль на пчелу в сутки.


