О химии стабильных свободных радикалов в курсе органической химии
Автор: Танасейчук Борис Сергеевич, Буртасов Алексей Анатольевич, Пряничникова Маргарита Константиновна
Журнал: Интеграция образования @edumag-mrsu
Рубрика: Общая педагогика, история педагогики и образования
Статья в выпуске: 2 (79), 2015 года.
Бесплатный доступ
Важность изучения раздела химии стабильных свободных радикалов в курсе органической химии объясняется значительно возросшим в последнее время интересом к химии свободных радикалов, в том числе и стабильных. Стабильные свободные радикалы находят применение в качестве ингибиторов процесса старения полимеров, используются в качестве строительных блоков при создании магнитоактивных полимеров, в качестве катализаторов в реакциях окисления-восстановления и других реакциях, а также и для моделирования химических процессов, протекающих в живом организме с целью внедрения в химическое производство экологически приемлемых процессов. Исходя из этого, познание закономерностей, связывающих строение и реакционную способность стабильных радикалов, является необходимым и весьма актуальным и в статье рассматривается в качестве предмета данного обсуждения материала по химии стабильных свободных радикалов. В работе дается характеристика стабильных свободных радикалов и предлагается единый подход изучения химии стабильных свободных радикалов в курсе органической химии, позволяющий объяснить и предсказать возможные особенности реакционной способности различных типов радикалов («электронодонор», «электроноакцептор», «амфотерный радикал»), основанный на классификации радикалов по энергетической характеристике уровня верхней однократно занятой орбитали. Обосновывается необходимость рассмотрения реакций свободнорадикального инициирования и ингибирования применительно к конкретным классам органических соединений. Подробно рассматривается реакция стабильных радикалов с минеральными кислотами; предлагается механизм реакции для каждого типа радикала. Также дается объяснение существованию в ряде случаев двух типов димеров радикалов - симметричного (образование связи по центрам с наибольшей спиновой плотностью) и несимметричного (образование связи между центрами с разноименными зарядами, т. е. так называемая донорно-акцепторная димеризация).
Стабильный свободный радикал, классификация, химические свойства, электронодо-нор, электроноакцептор, амфотерный стабильный радикал, реакция с кислотами, димеризация, димер, структура димера, "электронодонор", "электроноакцептор", "амфотерный радикал"
Короткий адрес: https://sciup.org/147137113
IDR: 147137113 | УДК: 378.147:547 | DOI: 10.15507/Inted.079.019.201502.092
Текст научной статьи О химии стабильных свободных радикалов в курсе органической химии
Основные положения классификации стабильных свободных радикалов
Несмотря на то, что подавляющее большинство химических реакций, протекающих как в природе, так и в живых организмах, происходит с участием свободных радикалов, в учебниках органической химии этим реакциям уделяется, на наш взгляд, недостаточное внимание. Подробно рассматриваются лишь реакции свободнорадикального галогенирования алканов и присоединения бромистого водорода к алкенам (эффект Хараша). Еще меньше времени уделяется химии стабильных* свободных радикалов. Как правило, приводятся сведения только о трифенилметильном радикале [1; 4; 16]. Более детально химия свободных радикалов рассмотрена только в учебниках О. А. Реутова «Органическая химия» и Ф. Кери «Углубленный курс органической химии» [3; 10], и лишь только в одном из них [10] рассмотрены достаточно подробно химические свойства нескольких наиболее известных типов стабильных свободных радикалов. Однако подробное рассмотрение химических свойств радикалов и в этом случае не объединено единой концепцией, позволяющей объяснить связь наблюдаемых химических свойств радикалов с их структурой.
Изучение химии стабильных свободных радикалов представляется весьма важным и в связи с тем, что стабильные радикалы позволяют изучать и моделировать химические процессы, протекающие в живом организме. Это в свою очередь позволяет внедрить в химическое производство экологически приемлемые процессы.
С точки зрения авторов статьи, представляется значимым и необходимым более глубокое изучение химии свободных радикалов и в особенности стабильных, а именно, рассмотрение взаимосвязи химических свойств радикалов с их структурой, что и является предметом данного обобщения материала по химии стабильных свободных радикалов.
В принципе радикал можно рассматривать как промежуточное состояние между катионом и анионом 1 , и, естественно, в зависимости от структуры радикала он может либо принимать, либо отдавать электрон, переходя в состояние иона.
(+) +e _ +e _
R +e R +e R (1).
_ _ -e -e
Так как наиболее устойчивыми системами являются системы с полностью заполненными молекулярными орбиталями, то в связи с этим можно классифицировать свободно-радикальные системы по энергетической характеристике уровня занимаемого неспаренным электроном (в рамках π -электронного приближения Хюккеля метода МОЛКАО) [14]. В этом случае возможны три варианта (рис. 1):
α
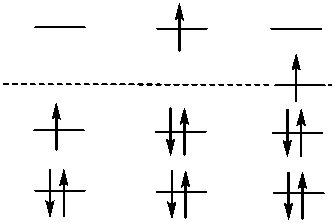
Р и с. 1. Классификация свободных радикалов по энергетической характеристике уровня занимаемого неспаренным электроном : 1) электронодифецитные радикалы (εвзмо < α);
-
2) электроноизбыточные радикалы (εвзмо > α); 3) электроноамфотерные радикалы (εвзмо ~ α)
F i g. 1. Classification of free radicals in terms of energetic characteristics of the level occupied by unpaired electron: 1) electron-deficient radicals (εвзмо < α); 2) electron-excess radicals (εвзмо > α);
-
3) еlectronamphoterous radicals (εвзмо ~ α).

Наиболее устойчивыми являются системы с полностью заполненными связывающими молекулярными орбиталями. В этой связи становится понятным, что радикалы первых двух групп будут стремиться к переходу в более энергетически выгодные ионные состояния, получаемые либо путем переноса электрона к радикалу («электронодефицитные радикалы», окислители), либо путем отдачи электрона («электроноакцепторные радикалы, восстановители). Радикалы третьей группы способны образовывать как анионы, так и катионы, т. е. проявлять в зависимости от реагента как окислительные, так и восстановительные свойства (например, трифенилметильный радикал). Из них только трифенилметильный радикал имеет не- спаренный электрон на несвязывающей орбитали. Введение электронодонорных заместителей в любое из ароматических колец трифенилметильного радикала сдвигает εвзмо на разрыхляющую орбиталь, а электроноакцепторных заместителей – на связывающую орбиталь. В этом случае более приемлемым отнесением радикалов к этому классу является возможность существования двух относительно стабильных ионов (аниона и катиона), полученных при восстановлении или окислении данного радикала* (табл. 1).
Позднее аналогичное деление стабильных свободных радикалов на электронодонорные, электроноакцепторные и электроноамфотерные (амбидентные) было предложено и другими авторами [21].
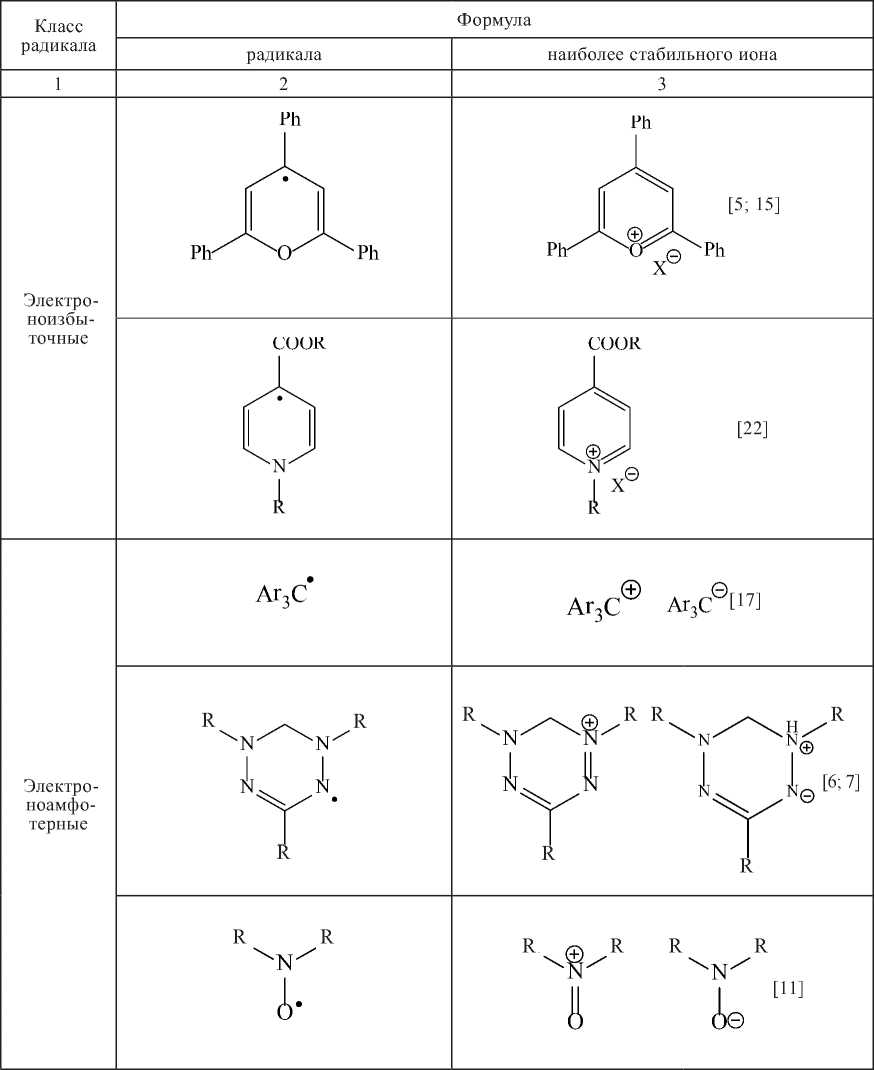
Т а б л и ц а 1. Классификация свободных радикалов
T a b l e 1. Classification of stable free radicals
|
Класс радикала |
Формула |
|
|
радикала |
наиболее стабильного иона |
|
|
1 |
2 |
3 |
|
Электро-нодефи-цитные |
Ar O |
Ar O ° [9] |
|
Ar N Ar |
о Ar N Ar [19] |
|
|
Ar NN R Ar |
Ar \ 0 NN R [18] Ar |
|
|
Ar N --- Ar Ar N |
Ar N Н V- Ar [20] Ar N |
|
|
Ph Ph Ph Ph N |
Ph Ph J к [12] Ph N Ph |
|
*Об окислительно-восстановительных свойствах стабильных радикалов см. [8]
Окончание табл. 1
End of table 1
При рассмотрении химии алканов, алкенов и свободнорадикальных реакций уместно более подробно ознакомиться и с понятием инициаторов радикальных процессов (перекиси алкилов, перекиси ацилов, гидроперикиси и т. д.), образующих при распаде активные короткоживущие радикалы.
Вопрос об ингибиторах свободнорадикальных реакций наиболее целесообразно
рассматривать после изучения химии фенолов, так как наиболее известным ингибитором радикальных процессов (стабилизатором каучуков, полимеров и т. п.) является 2,6-ди трет .бутил-4-ме-тилфенол – «ионол»). К тому же при окислении фенолов образуются достаточно хорошо изученные феноксильные радикалы. Стабильные радикалы, образующиеся при окислении ингибиторов (фенолов и аминов), ингибируют свободнорадикальные процессы, вступая в реакции с короткоживущими радикалами, и тем самым, предотвращая дальнейшую цепную реакцию.
Применимость предложенной классификации радикалов к объяснению ранее непонятых реакций можно проиллюстрировать на примере реакций радикалов с минеральными кислотами.
Реакции стабильных радикалов с минеральными кислотами
Одной из реакций, не имеющей достаточно ясного объяснения, является реакция стабильных радикалов с минеральными кислотами, протекающая по уравнению:
2 R +HX —RH + RX .
Эта реакция описывается в ряде случаев уравнением первого порядка по радикалу, в других же случаях – уравнением второго порядка по радикалу. Исходя из предложенной классификации радикалов, данную реакцию можно объяснить достаточно просто.
Так, первой стадией реакции радикала (независимо от класса радикала) является образование катион-радикала (реакция 2)
R + H© M RH + (2).
Дальнейшие превращения катион-ра-дикалов будут определяться характеристиками (классом) радикала. При протонировании радикала (реакция 2) донорно-акцепторные характеристики радикалов будут изменяться – электронодонорные свойства уменьшаться, а электроноакцепторные – увеличиваться. Поэтому на следующей стадии (стадии переноса электрона) радикалы, относящиеся к типу электроноизбыточных или электроноамфотерных будут реагировать по схеме (реакции 3, 4) [6]:
RH'++ R M RH + Ri (3),
R©+ X Б RХ (4).
Эта реакция подробно изучена в случае реакции нитроксильных радикалов с кислотами. Скорость данной реакции описывается уравнением второго порядка по радикалу [2; 11].
Для радикалов, относящихся к группе электронодефицитных, протонирование только усиливает его электроноакцепторные свойства, а стадией, определяющей скорость реакции, будет являться взамо-действие образовавшегося катион-ради-кала с нуклеофилом (анионом кислоты) (реакции 2, 5, 6):
H
RH + Y —>- R (5),
H •
R + R —RY + RH (6).
Y
Скорость реакции (6) будет описываться уравнением первого порядка по радикалу, что соотетствует литературным данным для реакции электронодефицитного N,N-дифенилпикрилгидразила с кислотами [23].
Димеризация радикалов [13]
Ряд стабильных свободных радикалов существует в равновесии со своими димерами (реакция 7):
2R‘^* R R (7).
Однако если короткоживущие радикалы димеризуются всегда по атомам, имеющим наибольшую спиновую плотность (плотность неспаренного электрона), образуя симметричный димер, то в случае стабильных радикалов возможно образование в ряде случаев димеров как симметричного, так и несимметричного строения. Так, для стабильного 2,4,6-трифе-нилимидазолильного радикала наблюдалось образование двух димеров:
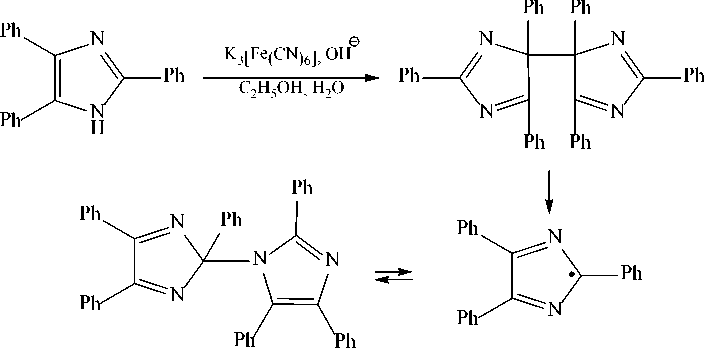
Это связано с тем, что у стабильных радикалов, имеющих достаточно обширную цепь сопряжения, наряду с центрами, имеющими наибольшую плотность неспаренного электрона, имеет место и частичное разделение заряда, т. е. существуют центры с наибольшей и наименьшей электронной плотностью (донорные и акцепторные центры).
В случае, если димеризация радикала идет по атомам с наибольшей спиновой плотностью, образуется симметричный димер, а если идет димеризация донорно-акцепторного типа, образуется несимметричный димер.
Если синтез радикала осуществляется окислением или восстановлением иона в высокополярных средах (кислотной или щелочной, спиртовой или водно-спиртовой), то радикал, не сольватирующийся в этих условиях, димеризуется по центрам с наибольшей спиновой плотностью, образуя симметричный димер. Когда среда (растворитель) способна сольватировать радикал, то он димеризуется по центрам с наибольшими разноименными зарядами, т. е. димеризация осуществляется по донорно-акцепторному типу, образуя термодинамически более выгодный несимметричный димир.
Таким образом, рассматриваемая в данной работе классификация стабильных свободных радикалов, основанная на их стремлении к переходу в более выгодное стабильное состояние иона, позволяет объяснить механизмы большинства реакций органических соединений, протекающих с участием свободных радикалов, в том числе и реакций, протекающих в живом организме. Это дает возможность целенаправленно синтезировать органические соединения со специально заданными свойствами.
СПИСОК
ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
-
1. Гауптман, З. Органическая химия / З. Гауптман, Ю. Грефе, Х. Ремане. – Москва : Химия, 1994. – С. 273–274.
-
2. Голубев, В. А. Механизм кислотного диспропорционирования дитреталкилнитроксильных радикалов / В. А. Голубев, В. Д. Сень, А. А. Александров // Известия АН СССР. Сер. «Химия». – 1975. – С. 2235–2243.
-
3. Кери, Ф. Углубленный курс органической химии / Ф. Керри, Р. Сандберг. – Москва : Химия, 1981. -Т. 1. – С. 4473–4498.
-
4. Моррисон, Р. Органическая химия / Р. Моррисон, Р. Бойд. – Москва : Мир, 1974. – С. 381–384.
-
5. Палчков, В. А. Синтез стабильного радикала из 2,4,6-трифенилпирилиевых солей / В. А. Палчков, Ю. В. Жданов, Г. Н. Дорофеенко // Журнал органической химии. – 1975. – Т. 1. – С. 1171.
-
6. Полумбрик, О. М. Реакции замещенных трифенилвердазилов с монохлоруксусной кислотой / О. М. Полумбрик [и др.] // Журнал органической химии. – 1972. – Т. 8. – С. 1925–1929.
-
7. Полумбрик, О. М. Химия вердазильных радикалов / О. М. Полумбрик. – Киев : Наукова думка, 1984. – 250 с.
-
8. Походенко, В. Д. Окислительно-восстановительные реакции свободных радикалов / В. Д. Походенко, А. А. Белодед, В. Г. Кошечко. – Киев : Наукова думка, 1977. – 274 с.
-
9. Походенко, В. Д. Феноксильные радикалы / В. Д. Походенко. – Киев : Наукова думка, 1969. – 194 с.
-
10. Реутов, О. А. Органическая химия : в 4 т. / О. А. Реутов, А. Л. Курц, К. П. Бутин. – Москва : Бином, 2004. - Т. 2. – 496 с.
-
11. Розанцев, Э. Г. Свободные иминоксильные радикалы. – Москва : Химия, 1970. – 216 с.
-
12. Танасейчук, Б. С. Исследования в области азотсодержащих гетероциклических свободных радикалов. XVI. Синтез 2-арил-3,4—дифенил-5-бифенилилпирролов и исследование свободных радикалов на их основе / Б. С. Тана-сейчук, С. Л. Власова, Е. Н. Морозов // Химия гетероциклических соединений. – 1972. – Т. 12. – С. 1681–1683.
-
13. Танасейчук, Б. С. К вопросу об общих закономерностях образования димеров свободных радикалов / Б. С. Танасейчук // Журнал органической химии. – 2004. – Т. 40, № 4. – С. 629–632.
-
14. Танасейчук, Б. С. О влиянии заместителей на относительную стабильность свободных радикалов / Б. С. Танасейчук, О. Б. Томилин, К. П. Бутин // Журнал органической химии. – 1982. – Т. 18, № 2. – С. 241–246.
-
15. Танасейчук, Б. С. Свободные радикалы. XXVIII. Реакция 2,4,6-трифенилпиранила с (диацетокси-λ3-иоданил) бензолом / Б. С. Танасейчук [и др.] // Журнал органической химии. – 2011. – Т. 47, № 3. – С. 447–450.
-
16. Шабаров, Ю. С. Органическая химия / Ю. С. Шабаров. – Москва : Химия, 1979. – Т 2. - С. 700–702.
-
17. Шолле, В. Д. Успехи химии стабильных углеводородных радикалов / В. Д. Шолле, Э. Г. Розанцев // Успехи химии. – 1973. – Т. 42. – С. 2176–2193.
-
18. Balaban, A. T. Stability and Equilibrina of Free Radicals. III. Preparation of stable stercally snielded, diarylnitrogen in the same molecules / A. T. Balaban, P. T. Frangopol, N. Negoita // Tetrahedron. – 1967. – Vol. 23. – P. 4661–4676.
-
19. Danen, W. C. Aminyl Free Padicals / W. C. Danen, F. A. Neugebauer // Angew. Chem. Inter. Ed. – 1975. – Vol. 14, № 12. – P. 783–789.
-
20. Dessauer, R. Photochemistry, History and Cjmmercial Applications of Hexaarylbiimidazoles. All about HABIS Elsevier, 2006. – 236 p.
-
21. Fabian, J. MO-KCAO-Calculation on Polymethines. XXI. Electro-dabive, Electro-captive and Electrono-amdident Polymethine Radicals / J. Fabian, H. Hartmann // J. Pract. Chem. – 1984. – Vol. 326, № 3. – P. 443–456.
-
22. Mohammed M. The reaction between 1-ethyl-4-carbonetheoxy-ryridinyl radical and 4-nitrobenzyl halides / M. Mohammed, E. M. Kosower // Journal American Chemical Society. – 1971. – Vol. 93. – P. 2713–2719.
-
23. Proll, P. J. Kinetics of the decomposition of DFPH in some non-aqueous solvents / P. J. Proll, R. H. Sutclifte // Trans. Faradoy Soc. – 1963. – Vol. 59. – P. 2090–2098.
Поступила 19.03.15.
Об авторах :
Список литературы О химии стабильных свободных радикалов в курсе органической химии
- Гауптман, З. Органическая химия/З. Гауптман, Ю. Грефе, X. Ремане. -Москва: Химия, 1994. -С. 273-274.
- Голубев, В. А. Механизм кислотного диспропорционирования дитреталкилнитроксильных радикалов/В. А. Голубев, В. Д. Сень, А. А. Александров//Известия АН СССР. Сер. «Химия». -1975. -С. 2235-2243.
- Кери, Ф. Углубленный курс органической химии/Ф. Керри, Р. Сандберг. -Москва: Химия, 1981. -Т. 1. -С. 4473-4498.
- Моррисон, Р. Органическая химия/Р. Моррисон, Р. Бойд. -Москва: Мир, 1974. -С. 381-384.
- Палчков, В. А. Синтез стабильного радикала из 2,4,6-трифенилпирилиевых солей/В. А. Палчков, Ю. В. Жданов, Г. Н. Дорофеенко//Журнал органической химии. -1975. -Т. 1. -С. 1171.
- Полумбрик, О. М. Реакции замещенных трифенилвердазилов с монохлоруксусной кислотой/О. М. Полумбрик //Журнал органической химии. -1972. -Т. 8. -С. 1925-1929.
- Полумбрик, О. М. Химия вердазильньгх радикалов/О. М. Полумбрик. -Киев: Наукова думка, 1984. -250 с.
- Походенко, В. Д. Окислительно-восстановительные реакции свободных радикалов/В. Д. Походенко, А. А. Белодед, В. Г. Кошечко. -Киев: Наукова думка, 1977. -274 с.
- Походенко, В. Д. Феноксильные радикалы/В. Д. Походенко. -Киев: Наукова думка, 1969. -194 с.
- Реутов, О. А. Органическая химия: в 4 т./О. А. Реутов, А. Л. Курц, К. П. Бутин. -Москва: Бином,2004. -Т. 2. -496 с.
- Розанцев, Э. Г. Свободные иминоксильные радикалы. -Москва: Химия, 1970. -216 с.
- Танасейчук, Б. С. Исследования в области азотсодержащих гетероциклических свободных радикалов. XVI. Синтез 2-арил-3,4-дифенил-5-бифенилилпирролов и исследование свободных радикалов на их основе/Б. С. Танасейчук, С. Л. Власова, Е. Н. Морозов//Химия гетероциклических соединений. -1972. -Т. 12. -С. 1681-1683.
- Танасейчук, Б. С. К вопросу об общих закономерностях образования димеров свободных радикалов/Б. С. Танасейчук//Журнал органической химии. -2004. -Т. 40, № 4. -С. 629-632.
- Танасейчук, Б. С. О влиянии заместителей на относительную стабильность свободных радикалов/Б. С. Танасейчук, О. Б. Томилин, К. П. Бутин//Журнал органической химии. -1982. -Т. 18, № 2. -С. 241-246.
- Танасейчук, Б. С. Свободные радикалы. XXVIII. Реакция 2,4,6-трифенилпиранила с (диацетокси-Х3-иоданил) бензолом/Б. С. Танасейчук //Журнал органической химии. -2011. -Т. 47, № 3. -С. 447-150.
- Шабаров, Ю. С. Органическая химия/Ю. С. Шабаров. -Москва: Химия, 1979. -Т 2. -С. 700-702.
- Шолле, В. Д. Успехи химии стабильных углеводородных радикалов/В. Д. Шолле, Э. Г. Розанцев//Успехи химии. -1973. -Т. 42. -С. 2176-2193.
- Balaban, A. T. Stability and Equilibrina of Free Radicals. III. Preparation of stable stercally snielded, diarylnitrogen in the same molecules/A. T. Balaban, P. T. Frangopol, N. Negoita//Tetrahedron. -1967. -Vol. 23. -P. 4661-1676.
- Danen, W. C. Aminyl Free Padicals/W. C. Danen, F. A. Neugebauer//Angew. Chem. Inter. Ed. -1975. -Vol. 14, № 12. -P. 783-789.
- Dessauer, R. Photochemistry, History and Cjmmercial Applications of Hexaarylbiimidazoles. All about HABIS Elsevier, 2006. -236 p.
- Fabian, J. MO-KCAO-Calculation on Polymethines. XXI. Electro-dabive, Electro-captive and Electrono-amdident Polymethine Radicals/J. Fabian, H. Hartmann//J. Pract. Chem. -1984. -Vol. 326, №2 3. -P. 443-456.
- MohammedM. The reaction between 1-ethyl-4-carbonetheoxy-ryridinyl radical and 4-nitrobenzyl halides/M. Mohammed, E. M. Kosower//Journal American Chemical Society. -1971. -Vol. 93. -P. 2713-2719.
- Proll, P. J. Kinetics of the decomposition of DFPH in some non-aqueous solvents/P. J. Proll, R. H. Sutclifte//Trans. Faradoy Soc. -1963. -Vol. 59. -P. 2090-2098.


