О молекулярных факторах полигликанов свекловичного жома, определяющих их водоудерживающую способность
Автор: Кондратенко В.В., Кондратенко Т.Ю., Царва М.А., Давыдова А.Ю., Алабина Н.М.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 4 (78), 2018 года.
Бесплатный доступ
Базовым структурным элементом клеточных стенок свекловичного жома являются пищевые волокна, поэтому глубокая переработка данного вида сырья представляет значительный интерес. Одним из основных физико-химических свойств пищевых волокон, использующихся при производстве пищевых продуктов, является их водоудерживающая способность. Однако пищевые волокна свекловичного жома, как гетерогенные полимерные компоненты, исключительно лабильные к условиям их извлечения. В этой связи актуальным является выявления технологических факторов и их рациональной последовательности, при которых целевые свойства будут выражены в максимальной степени. Авторами был разработан разветвлённый алгоритм последовательного извлечения пищевых волокон из свекловичного жома с избирательной обработкой гомоферментными препаратами, включая разные варианты предварительной подготовки сырья. В результате были выделены образцы свекловичных волокон (преимущественно гомогалакутронаны), соответствующие ключевым узлам-графам разработанного алгоритма...
Пищевые волокна, свекловичный жом, водоудерживающая способность, гомогалактуронаны, неуронидные пищевые волокна, ферменты, гомоферментные препараты
Короткий адрес: https://sciup.org/140244254
IDR: 140244254 | DOI: 10.20914/2310-1202-2018-4-156-163
Текст научной статьи О молекулярных факторах полигликанов свекловичного жома, определяющих их водоудерживающую способность
Пищевые волокна обладают широким спектром физиологического воздействия на организм, основным из которых является детоксикация организма и стимулирование пищеварения. Различные виды пищевых волокон способны выводить из организма холестерин, радионуклиды и тяжёлые металлы, выравнивать уровень глюкозы в крови, стимулировать перистальтику кишечника, обладают обволакивающими и пребиотическими свойствами [1,2]. Отличительная особенность их в устойчивости к гликолитическим ферментам [3]. В толстом кишечнике пищевые волокна частично гидролизуются микробными ферментами [4]. Благодаря безопасности и физико-химическим свойствам пищевые волокна признаны эссенциальным элементом в питании человека, и их недостаток в ежедневном рационе способен привести к развитию рака прямой кишки, желчнокаменной болезни, атеросклерозу, аппендициту, ишемической болезни сердца и другим заболеваниям [5, 6]. В России физиологическая потребность в пищевых волокнах определена на уровне 20 г в сутки для взрослого человека и 10–20 г. в сутки для детей старше трёх лет [7]. В других странах принятые нормы могут отличаться, в частности, в соответствии с рекомендациями Всемирной организации здравоохранения норма составляет 25–35 г в сутки [4]. При избыточном потреблении пищевых волокон может проявиться отрицательное влияние на организм. Пищевые волокна способны выводить не только токсичные, но также и многие эссенциальные вещества, такие как витамины, аминокислоты и др [8].
По определению к пищевым волокнам могут быть отнесены преимущественно структурные олиго- и полигликаны и даже некоторые полимерные соединения неуглеводной природы [9, 10]. В природе они являются компонентами клеточных стенок растений. Химический и компонентный состав пищевых волокон может зависеть от таксономической принадлежности растения, типа ткани и её физиологического состояния. К пищевым волокнам относят такие полигликаны, как целлюлоза, гемицеллюлозы, камеди, пектин, слизи, каррагинаны и альгиновые кислоты. Они могут быть как гомогенны, так и гетерогенны по молекулярному составу, иметь различные функциональные группы (метоксильные, гидроксильные, ацетильные, амидные, карбоксильные), иметь линейную, либо разветвлённую цепь, находиться в различных конформациях [9]. Все это определяет их физико-химические свойства, к которым традиционно относят сорбционную ёмкость и водоудерживающую способность. Также они проявляют свойства пребиотиков [10]. По растворимости пищевые волокна разделяют на хорошо растворимые, или мягкие, набухающие и нерастворимые, или грубые волокна [11]. По водоудерживающей способности их подразделяют на три вида, в которых наиболее силь-ноудерживающие волокна способны связать более 8 г воды на 1 г пищевых волокон [12]. На сорбционные свойства влияет целый ряд факторов, среди которых молекулярная масса, особенности пространственной структуры, наличие и природа функциональных групп. Различные виды пищевых волокон проявляют разную сорбционную ёмкость в отношении разных сорбируемых веществ, в качестве которых могут выступать холестерин, глюкоза, жирные кислоты, тяжёлые металлы и др. [13]. Иногда пищевые волокна проявляют ионообменные свойства, выступая по отношению к сорбируемым ионам в качестве катионитов, амфолитов или анионитов различной силы [14]. Из всех перечисленных свойств одним из наиболее важных для пищевой промышленности является водоудерживающая способность.
Свекловичный жом как вторичный продукт свеклосахарного производства является нативным ассоциатой полигликанов, которые в комплексе либо будучи дифференцированы могут выступать в качестве пищевых волокон. Потенциально, если брать пищевые волокна, все полигликаны свекловичного жома условно можно разделить на две-три большие группы: пектиновые вещества, гемицеллюлозы А, гемицеллюлозы В + целлюлоза. При этом первые две группы представлены водорастворимыми (после извлечения) полигликанами, а третья – набухающими в воде. Традиционно, когда упоминают пищевые волокна свекловичного жома в части их выделения, имеют в виду преимущественно третью группу.
Цель работы – определить свойства первой и второй групп полигликанов и установить взаимосвязь между этими свойствами и молекулярным составом.
В связи с тем что нативные пектиновые вещества представляют собой гетерогенный биополимер, в состав которого входят не только линейные – гомогалактуронановые – участки, состоящие преимущественно из остатков α-D(+) – галактуроновой кислоты, но и разветвлённые, включающие остатки до 17 различных видов нейтральных углеводов [15], мы функционально перегруппировали первые две группы полигликанов свекловичного жома на гомога-лактуронаны и арабинаны + галактаны + гемицеллюлозы А, что соответствует разнице между ними по составу функциональных групп.
Таким образом, дифференциация свекловичного жома на пищевые волокна позволяет решить сразу две проблемы: утилизацию отходов пищевой промышленности и производство пищевых волокон с широким спектром свойств для нужд отечественной промышленности.
Материалы и методы
В качестве объектов исследований были использованы сухой негранулированный немелассированный свекловичный жом, произведённый в Воронежской области; образцы гомоферментных препаратов – эндо-(1→4)-рамногалактуронанлиаза (RGL) и гетерологичная эндо-(1→5)-α-арабиназа А (AEP); продукты ступенчатого ферментативного гидролиза. Определение водоудерживающей способности выделенных образцов пищевых волокон проводили по [16]. КР-спектроскопические исследования осуществляли при λ возбуждения = 785 нм: продолжительность сканирования спектра – 3 с, количество проходов на один спектр – 50, мощность индуцирующего излучения – 0,5%.
При проведении исследований использовали шейкер лабораторный ELMI SkyLine, программируемый ротатор Multi Bio RS-24 BioSan, центрифугу Eppendorf™ MiniSpin. Анализ молекулярных факторов проводили при помощи рамановского спектрометра/микроскопа RENISHAW InVia с конфокальным микроскопом Leica DM 2500M и CCD детектором. Обработку спектров комбинационного рассеяния (КР-спектров) проводили с использованием программного обеспечения RENISHAW WiRE 3.0 – для первичной обработки и экспортирования спектров, Origin Lab Origin Pro 2015 – для определения базовой линии по алгоритму FitPeaks(Pro) c интерполяцией полиномом пятой степени, нормированием спектров по базовой линии, нахождением пиков по семи локальным точкам с порогом фильтрации по высоте 7%, в том числе скрытых пиков – по второй производной, и Addinsoft XLSTAT 2014 – для обработки по методу главных компонент.
Исследования проводили в два этапа: ступенчатое последовательное ферментативное фрагментирование с выделением препаратов целевых компонентов сырья и оценка аналитических характеристик полученных препаратов.
С целью дифференцированного извлечения полигликанов фрагментирование было проведено в четыре ступени в соответствии с общим алгоритмом, представленным на рисунке 1. Первая ступень включала процесс набухания сырья (этап 1). Навеску сырья массой 20 г крупной фракции помещали в стеклянный стакан, куда затем приливали 400 см3 бидистиллированной воды температурой 20 °С, тщательно перемешивали и оставляли для набухания на 18 ч.
По истечении времени экспозиции смесь фильтровали через бумажный складчатый фильтр «белая лента». Ступень промывки включала два последовательных идентичных технологических этапа (этапы 2 и 3). На каждом остаток с фильтра по окончании предыдущего этапа количественно переносили обратно в стакан небольшими порциями бидистиллированной воды, предварительно нагретой до 40 °С. Далее в стакан вносили такое количество бидистилли-рованной воды, предварительно нагретой до 40 °С, чтобы суммарное количество бидистил-лированной воды составило 500 см3. Обработку проводили на водяной бане при температуре 40 ±1 °С в течение 30 мин. Смесь фильтровали через складчатый бумажный фильтр «белая лента». Ступень декатионизации также включала два последовательных этапа (этапы 2’ и 3’). На каждом остаток с фильтра по окончании предыдущего этапа количественно переносили обратно в стакан небольшими порциями водного раствора комплексона ЭДТА концентрацией 2,87 г/дм3, предварительно нагретого до 40 °С. Далее в стакан вносили такое количество водного раствора комплексона, предварительно нагретого до 40 °С, чтобы суммарное количество раствора составило 500 см3. Обработку проводили на водяной бане при температуре 40 ±1 °С в течение 30 мин. Смесь фильтровали через складчатый бумажный фильтр «белая лента».
Ступень выделения гомогалактуронановых фрагментов протопектинового комплекса (HG) включала от одного (этапы 4 и 4’) до двух (этапы 4а и 5а, 4а’ и 5а’, 4b’ и 5b’) последовательных идентичных технологических этапов.
Остаток с фильтра, полученный на предыдущем этапе, количественно переносили обратно в стакан небольшими порциями бидистиллированной воды общим объёмом 100 см3, предварительно нагретой до 48 °С. В стакан с осадком приливали 300 см3 водного раствора гомоферментного препарата RGL концентрацией 612,5 (этапы 4, 4’, 4a, 4a’ и 4b’) и 226,7 мг/дм3 (этапы 5a, 5a’ и 5b’). Образовавшуюся систему тщательно, но осторожно перемешивали и помещали на водяную баню с заданной температурой 48 ±1 °С. Продолжительность ферментации составляла 120 (этапы RGL-I fix – 4a, 4a’ и 4b’), 405 (этапы RGL-I max – 4 и 4’), 70 (этап RGL-II fix – 5b’) и 130 мин (этапы RGL-II max – 5a и 5a’). По окончании ферментации процесс останавливали, помещая стакан с обработанной системой на кипящую водяную баню на 10 мин, после чего быстро охлаждали до комнатной температуры. Экстракт отфильтровывали через обеззоленный бумажный складчатый фильтр «белая лента». Остаток на фильтре промывали 100 см3 бидистиллированной воды. Сборный экстракт обрабатывали, как описано далее.
Жом
Sugar beet pulp
2r---------------
Промывка I Washing I
Набухание Soaking
Декатионизация I
4b’
RGL-I (фикс/fix)
5b
RGL-II (фикс/fix)
6b’
AEP (макс/max)
4’
Декатионизация II
Decationization I Decationization II п
RGL-I (макс/max)
♦ HG
4a’
RGL-I
5a’
RGL-II
(фикс/fix) (макс/max)
> HG
Рисунок 1. Алгоритм дифференцированного извлечения пищевых волокон свекловичного жома
Figure 1. Algorithm for differentiated extraction of food fiber from sugar beet pulp
Ступень выделения растворимых пищевых волокон неуронидной природы (AX) включала один технологический этап (AEP max – 6b’). Остаток с фильтра, полученный на предыдущем этапе (5b’), количественно переносили обратно в стакан небольшими порциями биди-стиллированной воды общим объёмом 100 см3, предварительно нагретой до 50 °С. В стакан с осадком приливали 300 см3 водного раствора гомоферментного препарата AEP концентрацией 213,5 мг/дм3. Образовавшуюся систему тщательно, но осторожно перемешивали и помещали на водяную баню с заданной температурой 50 ±1 °С. Продолжительность ферментации составляла 150 мин. По окончании ферментации процесс останавливали, помещая стакан с обработанной системой на кипящую водяную баню на 10 мин, после чего быстро охлаждали до комнатной температуры. Экстракт отфильтровывали через обеззоленный бумажный складчатый фильтр «белая лента» Остаток на фильтре промывали 100 см3 бидистиллированной воды. Сборный экстракт обрабатывали, как описано далее.
Каждый собранный экстракт упаривали на ротационном испарителе под вакуумом в 10 раз при температуре 38 °С. Количественно переносили его в стеклянный стакан, куда затем вносили водный раствор ацетатного буфера с рН 4,7–4,8 в количестве 10% от исходного объёма упаренного экстракта. Стакан с содержимым встряхивали на колбовстряхивателе в течение 5 мин, после чего его помещали на кипящую водяную баню, где выдерживали 10 мин. Содержимое стакана фильтровали через обеззоленный бумажный складчатый фильтр «белая лента». Осадок на фильтре промывали 10 мл холодной бидистиллированной воды. Фильтрат охлаждали до температуры 15–16 °С, после чего тонкой струйкой приливали в стеклянный стакан, содержащий двойной объём предварительно охлаждённого до этой же температуры этилового спирта-ректификата крепостью 96%об. Смесь выдерживали 30 мин при комнатной температуре, непрерывно перемешивая, после чего количественно переносили в центрифужную пробирку. Систему центрифугировали при 8 000 g в течение 20 мин. Супернатант декантировали. К осадку прибавляли объём этилового спирта-ректификата крепостью 96%об. объёмом, равным объёму исходного фильтрата. Центрифугирование повторяли при тех же условиях, что и предыдущее. Супернатант декантировали. Осадок из центрифужной пробирки количественно переносили на чашку Петри и сушили в течение 24 ч при температуре не выше 50 °С.
Результаты и обсуждение
При рассмотрении исходного алгоритма как связанного графа, в котором технологические этапы представлены узлами, и рассматривая путь от вершины графа до каждого конкретного узла как независимые подграфы, обладающие своей историей – глубиной переработки, получили два связанных множества подграфов:
5 = [ Graph { 1,2,3,4 } ; { Graph { 1,2,3,4 a } ;
Graph { 1,2,3,4 a , 5 a } } J
5 ' = [ Graph { 1,2',3',4' } ;
{ Graph { 1,2', 3', 4 a ' } ; Graph { 1,2', 3', 4 a ', 5 a ' } } ;
{ Graph { 1,2', 3', 4 b ' } ; Graph { 1,2', 3', 4 b ', 5 b ' } ;
Graph {1,2', 3', 4 b ',5 b ',6 b *}}], где S – множество последовательных подграфов при условии присутствия поливалентных катионов; 5' - множество подграфов при условии декатионизации; Graph {а, в, /,...} -подграф технологического этапа; а,в,Y,... — коэффициенты технологических этапов (координаты подграфа).
Внутри каждого множества присутствует совокупность графов с различной глубиной воздействия на сырье. Глубина воздействия для каждого отдельно взятого графа находится в прямой зависимости от количества координат, его задающих. Значит, сопоставление множеств друг с другом, равно как и графов внутри множества, определяет условия комплексного воздействия указанных факторов на результирующий признак.
Исследования водоудерживающей способности представлены в таблице 1.
Сравнительный анализ водоудерживающей способности продуктов ступенчатого ферментативного фрагментирования показывает, что добавление этапа декатионизации и глубина технологического воздействия положительно влияют на целевой показатель:
[ Graph { 1,2,3,4 } <
{ Graph { 1,2,3,4 a } < Graph { 1,2,3,4 a ,5 a } } J <
-
< [ Graph { 1,2', 3', 4' } < { Graph { 1,2', 3', 4 a ' } «
-
® Graph { 1,2', 3', 4 a ', 5 a ' } } ®
® { Graph { 1,2',3',4 b ',5 b ' } >
-
> Graph { 1,2',3',4 b ',5 b ',6 b ' } ] .
Таблица 1.
Водоудерживающая способность полимерных продуктов фрагментации
Table 1.
Water-holding capacity of fragmentation polymeric products
|
Подраф этапа получения продукта ферментации / Sub-graph of fermentation stage |
Экспозиция / Exposure |
Водоудерживающая способность / Water-holding capacity, см3/г / cm3/g |
|
Graph { 1, 2, 3, 4 } |
макс/max |
10,47 |
|
Graph { 1, 2, 3, 4 a } |
фикс/fix |
12,66 |
|
Graph { 1, 2, 3, 4 a , 5 a } |
макс/max |
15,08 |
|
Graph { 1, 2', 3', 4' } |
макс/max |
15,13 |
|
Graph { 1, 2', 3', 4 a ' } |
фикс/fix |
18,53 |
|
Graph { 1, 2', 3', 4 a ', 5 a ' } |
макс/max |
18,20 |
|
Graph { 1, 2', 3', 4 b ' } |
фикс/fix |
26,34* |
|
Graph { 1, 2', 3', 4 b ', 5 b ' } |
фикс/fix |
19,12 |
|
Graph { 1, 2', 3', 4 b ',5 b ',6 b ' } |
макс/max |
17,13 |
* Значение несущественно при α ≤ 0,05.
* Data is insufficient at α ≤ 0,05.
Однако данное утверждение справедливо лишь для продуктов одного типа. Например, по целевому показателю подмножество 5 = { Graph {1,2', 3', 4 a'}; Graph {1,2', 3', 4 a ',5 a'}} множества 5' и граф Graph {1,2',3',4b ',5b'} - элемент того же множества – практически идентичны. Это приводит к выводу о том, что увеличение количества однотипных ступеней в рамках множества S’ приводит лишь к увеличению совокупного выхода продукта при малой дисперсии его свойств.
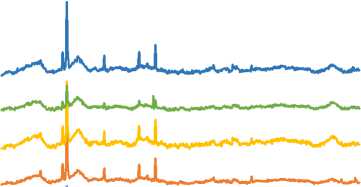
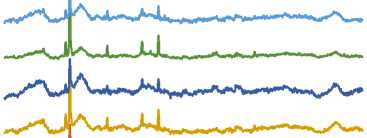
Для установления механизма водоудерживающей способности семейств продуктов, полученных в рамках каждого графа, были получены КР-спектры (рисунок 2). Анализ спектров показал наличие характерных пиков, специфичных для каждого семейства продуктов. Использование второй производной позволило выявить скрытые пики. В КР-спектрах продуктов семейства гомогалактуронанов присутствовали пики, характерные для пектиновых веществ: 880–900 см-1 – пик, отражающий экваториальный аномерный Н, характерный для α-аномеров и α-гликозидов; 850–860 см-1 – пики метоксилиро-вания карбоксильных групп и пики ацетилирования R-OH групп в положениях С3 и С4 атомов углерода пиранозильного кольца галактуро-нидных остатков. В КР-спектрах растворимых волокон неуронидной природы были обнаружены пики ксилананов в интервале 475–515 см-1.
5a
5b'
5a'
4'
4a
4b'
4a'

" " I " " I " " I " " I " " I " " I " " I " " I " " I " " I " " I " " I" " I
100 200 300 400 500 600 700 800 900 1000 1100 1200 1300 1400
Волновое число / Raman shift, см-1 / cm-1
Рисунок 2. КР-спектры полигликанов
-
Figure 2. Raman spectra of polyglycans
В силу многофакторности молекулярных факторов, обусловливающих водоудерживающую способность, очень трудно было оценить вклад в неё конкретных молекулярных структур, поэтому для решения этой задачи был выбран метод главных компонент Пирсона. В качестве переменных были использованы высоты пиков полученных спектров, а зависимая переменная, под которой понималась величина водоудерживающей способности, была использована в качестве добавочной переменной (ВУС / WHC).
В итоге был получен спектр зависимых и независимых компонентов в координатах первой и второй главных компонент (рисунок 3), смысл которых при интерпретации выделенных пиков следующий:
-
• первый главный компонент F1 – активность свободных гидроксильных групп углеводного скелета;
-
• второй главный компонент F2 – активность ксиланановой составляющей, трансформации связей между атомами углерода, а также углерода и кислорода в составе углеводных колец.
Анализ результатов показывает, что водоудерживающая способность находится в антагонизме с обоими главными компонентами, хорошо коррелирует с высотой пиков на волновых числах 436, 852, 924 и 1075 см-1 и предположительно находится в тесной зависимости от активности атомов кислорода гликозидных связей и активности гидроксильных групп, не принадлежащих углеводному кольцу.
Переменные / Variables (оси / axes F1 and F2: 53,53 %)
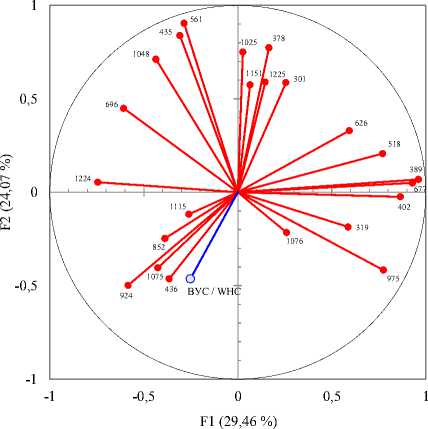
Рисунок 3. Молекулярные факторы, влияющие на водоудерживающую способность
-
Figure 3. Molecular factors affecting water-holding capacity
Однако используемые главные компоненты описывают лишь 53,5% дисперсии высот пиков, что может говорить об участии в формировании пиков сторонних факторов. Это говорит о необходимости дальнейших исследований.
Таким образом, ключевое влияние на водоудерживающую способность полимерных продуктов ступенчатого ферментативного фрагментирования свекловичного жома оказывает наличие в матриксе клеточной стенки ионов поливалентных металлов, в связи с чем существенную роль играет количество этапов фрагментирования и их продолжительность; в их отсутствие ключевую роль играет природа продуктов фрагментации.
Выводы
В процессе исследований зависимости водоудерживающих свойств полимерных компонентов свекловичного жома от условий дифференцированного ферментативного извлечения было установлено ключевое влияние степени насыщенности матрикса клеточных стенок ионами поливалентных металлов:
-
• в присутствии катионов в матриксе ключевую роль в формировании водоудерживающей
Список литературы О молекулярных факторах полигликанов свекловичного жома, определяющих их водоудерживающую способность
- Драчева Л.В., Зайцев Н.К., Сидоренко Ю.И. и др. Пищевые биоволокна -аспект антиоксидантной активности//Хранение и переработка сельхозсырья. 2011. № 5. С. 26-28.
- Cheng G., Zhang X., Simmons B., Singh S. Theory, practice and prospects of X-ray and neutron scattering for lignocellulosic biomass characterization: towards understanding biomass pretreatment//Energy Environmental Science. 2015. V. 8. P. 436-455 DOI: 10.1039/C4EE03147D
- Дружинин П.В., Новиков Л.Ф., Лысиков Ю.А. Основные виды пищевых волокон. Их структура и свойства. 2010. URL: http://on-line-wellness.com/view_post.php? id=95
- Lattimer J.M., Haub M.D. Effects of dietary fiber and its components on metabolic health//Nutrients. 2010. V.2. P. 1266-1289 DOI: 10.3390/nu2121266
- Fadaei V., Salehifar M. Some chemical and functional characteristics of dietary fiber from five fiber sources//European Journal of Experimental Biology. 2012. V. 2(3). P.525-528.
- Singh A., Singh S.N. Dietary fiber content of indian diets//Asian Journal of Pharmaceutical and Clinical Research. 2015. V. 8(3). P.58-61.
- Тутельян В.А., Погожева А.В., Высоцкий В.Г. Роль пищевых волокон в питании человека. М.: Новое тысячелетие, 2008. 325 с.
- Hong Y., Zi-jun W., Jian X., Ying-jie D. et al. Development of the dietary fiber functional food and studies on its toxicological and physiologic properties//Food and Chemical Toxicology. 2012. V. 50. P. 3367-3374
- DOI: 10.1016/j.fct.2012.05.011
- Goni I., Diaz-Rubio M.E., Perez-Jimenez J., Saura-Calixto F. Towards an updated methodology for measurement of dietary fiber, including associated polyphenols, in food and beverages//Food Research International. 2009. V. 42. P. 840-846
- DOI: 10.1016/j.foodres.2009.03.010
- Daou Ch., Zhang H. Physicochemical properties and antioxidant activities of dietary fiber derived from defatted rice bran//Advance Journal of Food Science and Technology. 2011. V. 3(5). P. 339-347.
- Rodr?guez R., Jimenez A.J., Fernandez-Bolanos J. et al. Dietary fibre from vegetable products as source of functional ingredients//Trends in Food Science & Technology. 2006. V. 17. P. 3-15
- DOI: 10.1016/j.tifs.2005.10.002
- Ozyurt V.H., Otles S. Effect of food processing on the physicochemical properties of dietary fibre//Acta Scientiarum Polonorum Technologia Alimentaria. 2016. V.15(3). P. 233-245
- DOI: 10.17306/J.AFS.2016.3.23
- Dhingra D., Michael M., Rajput H., Patil R.T. Dietary fibre in foods: a review//Journal of Food Science and Technology 2012. V. 49(3). P. 255-266
- DOI: 10.1007/s13197-011-0365-5
- Schwellenbach J., Taft F., Villain L., Strube J. Preparation and characterization of high capacity, strong cation-exchange fiber based adsorbents//Journal of Chromatography A. 2016. V. 1447. P. 92-106. 04.019
- DOI: 10.1016/j.chroma.2016
- Vincken J.P., Schols H.A., Oomen R.J., McCann M.C. et al. If homogalacturonan were a side chain of rhamnogalacturonan I. Implications for cell wall architecture//Plant Physiology. 2003. V. 132. P.1781-1789
- DOI: 10.1104/pp.103.022350
- Kurek M.A., Piwinska M., Wyrwisz J. et al. Automated static image analysis as a novel tool in describing the physical properties of dietary fiber//Food Science and Technology (Campinas). 2015. V. 35. № 4. P. 620-625
- DOI: 10.1590/1678-457X.6720


