О взаимодействии 3-гидрокси-6-фторпиразин-2-карбоксамида (фавипиравира) с аринами
Автор: Завьялова В.В., Словеснова Н.В., Петрова В.Е., Петров А.Ю., Ватолина С.Е., Криночкин А.П., Ковалев И.С., Шабунина О.В., Копчук Д.С., Зырянов Г.В.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 4 т.16, 2024 года.
Бесплатный доступ
3-Гидрокси-6-фторпиразин-2-карбоксамид (фавипиравир) был одним из препаратов, рекомендованных для терапии COVID-19. Как и для других лекарственных препаратов, для фавипиравира актуальным является вопрос утилизации лекарственных субстанций с истекшим сроком годности. В рамках данной статьи нами исследован способ возможной химической утилизации фавипиравира путем его взаимодействия с аринами (1,2-дегидробензолами) с образованием практически ценных изохинолинов.
Covid-19, 3-гидрокси-6-фторпиразин-2-карбоксамид, фавипиравир, утилизация, арины, 3-фтороизохинолин-1-карбоксамид
Короткий адрес: https://sciup.org/147246056
IDR: 147246056 | УДК: 547.861.1 | DOI: 10.14529/chem240412
Текст научной статьи О взаимодействии 3-гидрокси-6-фторпиразин-2-карбоксамида (фавипиравира) с аринами
Развитие фармацевтической промышленности приводит к появлению новых лекарственных препаратов на рынке. Вместе с тем чрезвычайно остро встает вопрос эффективной утилизации неиспользованных препаратов, например, путем их возврата в оборот [1, 2] или уничтоже-ния/захоронения препаратов с истекшим сроком годности [3]. Последнее осложнено как этическими аспектами, так и местными или национальными законодательными актами. Например, большинство респондентов выбрасывают неиспользуемые лекарственные препараты [4], а в РФ лишь с 2023 года действует единый оператор, ответственный за сбор и уничтожение лекарственных препаратов [5]. Наиболее рациональным способом утилизации лекарственных препаратов можно рассматривать их возможное использование в качестве синтонов для получения биоактивных веществ. В рамках настоящей работы нами проведено исследование одного из таких подходов на примере 3-гидрокси-6-фторпиразин-2-карбоксамида (препарат фавипиравир), рекомендованного для терапии COVID-19 на начальном этапе пандемии [6–10]. Известно, что пиразины способны вступать во внутримолекулярные реакции Дильса – Альдера с ацетиленовыми фрагментами в боковой цепи с образованием анне-лированных пиридинов [11–13]. В ряде случаев взаимодействие с диенофилами приводит к достройке дополнительных гетероциклов к пиразиновому циклу, не вызывая его трансформации. Например, испанскими авторами описано межмолекулярное взаимодействие бис(дибромметил)пиразина с енаминами и алкинами в присутствии иодида натрия в условиях микроволнового облучения с образованием замещенных хиноксалинов с приемлемыми выходами. Взаимодействие протекает через in situ образование высокореакционного o -хинидометана [14]. 5-(Алкил/ариламино)-6-хлорпиразин-2,3-дикарбонитрилы взаимодействовали с фенилацетиленом с образованием пирроло[2,3- b ]пиразинов – продуктов синтеза индолов по Лароку [15]. Бис- О -триметилсилиловый эфир 2-фенил-2 H -пирроло[3,4- b ]пиразина в реакции с метилакрилатом давал хиноксалин с выходом до 38 % [16]. Описано несколько случаев реакций циклоприсоединения с участием хиноксалинов. Так, имеются примеры процессов межмолекулярного 1,3-диполярного циклоприсоединения хиноксалинов с нит-рилиминами [17] или кетеном [18], а также один случай внутримолекулярного циклоприсоединения в 1-(4-хлорфенил)-2-[3-(4-хлорфенил)хиноксалин-2(1 Н )-илиден]этаноне под действием оксалилхло-рида с образованием пирроло[1,2- a ]хиноксалин-1,2-диона [19]. Описаны два примера взаимодействия пиразинов с аринами. В одном случае метил 3-(аминотриметилсилил)пиразин-2-карбоксилат образовывал пиразино[2,3- b ]хинолин-10(5 H )-он при взаимодействии с 1,2-дегидробензолом [20]. Во втором случае китайскими авторами опубликовано Cu-катализируемое взаимодействие аринов с иодозамещенными пиразинами и хиноксалинами, а также с другими азагетероциклами, с образованием соответствующих 2-иодгетеробиарилов [21].
В рамках настоящей работы нами в рамках поиска возможных путей химической утилизации 3-гидрокси-6-фторпиразин-2-карбоксамида (фавипиравира) было исследовано его взаимодействие с двумя аринами, генерированными in situ из антраниловой и 2-амино-4,5-дифторбензойной кислот.
Экспериментальная часть
Субстанция исходного 3-гидрокси-6-фторпиразин-2-карбоксамида ( 3) получена путем экстракции из таблеток Арепливир®, серия 121121, годен до 01.2024, производитель «Промомед». Наибольший выход действующего вещества (74,75 %) был найден для способов с использованием этилацетата или этанола (50 мл) в качестве экстрагентов.
Взаимодействие 3-гидрокси-6-фторпиразин-2-карбоксамида (3) с аринами. В 40 мл сухого толуола было суспендировано 75 мг (0,48 ммоль) соединения 1 , к суспензии было добавлено 0,24 мл (1,44 ммоль) изоамилнитрита. Полученную смесь перемешивали при кипячении в атмосфере аргона и по каплям в течение 30 мин добавляли раствор соответствующей антраниловой кислоты (1,44 ммоль) в 15 мл сухого 1,4-диоксана. После этого смесь кипятили в течение 1 ч, затем охлаждали до комнатной температуры, промывали 3 M водным раствором NaOH (3 × 50 мл), органический слой был высушен над безводным Na2SO4, отфильтрован, растворители были отогнаны при пониженном давлении.
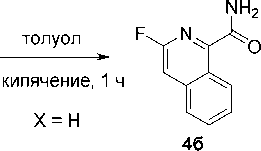
3-Фторизохинолин-1-карбоксамид (4б). Продукт был выделен колоночной хроматографией на силикагеле, элюент – CHCl 3 , затем смесь этилацетат/CHCl 3 (9:1) Аналитический образец продукта был получен перекристаллизацией из MeCN. R f 0,6. 22 мг (24 %). Т пл = 165–167 °C. Спектр ЯМР 1H (600 МГц, CDCl 3 , м. д., J /Гц): 5,78 (уш. с, 1Н, NH 2 ); 7,44–7,46 и 7,83–7,86 (оба м, 1Н, Н-5 и Н-8 (изохинолин); 7,61–7,65 и 7,71–7,74 (оба м, 1Н, Н-6 и Н-7 (изохинолин); 7,77–7,86 (уш. с, 1Н, NH 2 ), 9,54–9,57 (м, 1Н, Н-4 (изохинолин). Спектр ЯМР 19F (564 МГц, CDCl 3 , м. д.): –78,69 (c, 1F). MS ESI: m/z ( I , %): 191,06 (100) [M+H]+, 192,07 (10,8) [M+H+1]+. Найдено, %: C 63,29; H 3,58; N 14,90. Вычислено, %: C 63,16; H 3,71; N 14,73.
Спектры ЯМР регистрировали при комнатной температуре на Bruker Avance-600, 298 К, разрешение ±0,01 м. д., внутренний стандарт ТМС.
Обсуждение результатов
Таким образом, примеров взаимодействия пиразинов с аринами, приводящих к образованию продуктов трансформации пиразинового цикла, до настоящего времени в литературе описано не было. С другой стороны, аннелирование фрагментов карбо- и гетероциклов к пиразинам в результате реакций с другими диенофилами приводит к образованию перспективных структур, что, по нашему мнению, может быть успешно применено для модификации 3-гидрокси-6-фторпиразин-2-карбоксамида 3 .
Исходный субстрат был получен путем экстракции из таблеток Фавипиравир ®. Наибольший выход действующего вещества (74,75 %) был найден для способов с использованием этилацетата или этанола (50 мл) в качестве экстрагентов.
Далее было изучено взаимодействие соединение 3 с аринами, генерированными in situ из 2-амино-4,5-дифторбензойной и антраниловой кислот по ранее описанным методам [23–25], а именно путем добавления раствора соответствующей кислоты к суспензии исходного пиразина толуоле в присутствии изо -амилнитрита при нагревании. При использовании о -дифторарина 2а , генерированного из 2-амино-4,5-дифторбензойной кислоты, наблюдалось интенсивное осмоление реакционной массы и ожидаемый изохинолин 4а выделен не был, что в принципе согласуется с имеющимися у нас данными по изучению трансформаций 1,2,4-триазинов с аринами, когда для галогенаринов взаимодействие осложнялось протеканием «неариновых» трансформаций [22–24].
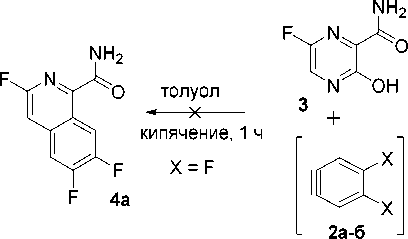
. /so-Amyl-ONO, толуол, 25 °C 15 мин но2с^^
X = F (а), Н (б)
h2n^^^x
1а-б
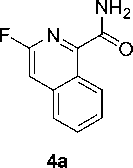
При взаимодействии соединения 1 с 1,2-дегидробензолом 2б с выходом 40 % был получен продукт 4а , строение которого как 3-фторизохинолин-1-карбоксамида было доказано на основании данных спектроскопии ЯМР 1Н, 19F, масс-спектрометрии, а также данных элементного анализа.
Так, в спектре ЯМР 1Н присутствуют сигналы протонов вновь образованной хинолиновой системы в виде мультиплетов в области 7,44–7,86 м. д., сигнал протона вновь образованного пиридинового фрагмента в виде мультиплета в области 9,54–9,57, а также сигналы протонов амидной группы в виде двух уширенных синглетов. В масс-спектре фиксируется пик молекулярного иона.
Образование изохинолина 4а можно объяснить, исходя из ранее полученных нами результатов. Так, на первом этапе имеет место циклоприсоединение арина к пиразину с образованием интермедиата А , который, в случае X = H, стабилизируется путем отщепления изоциановой кислоты и образует целевой изохинолин 4а .
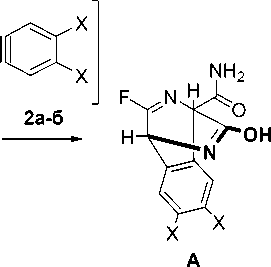
-HNCO
X=H
Можно отметить высокую хемоселективность процесса в данном случае в отличие от реакции с о -дифторарином. Так, несмотря на наличие фрагмента первичного амида в исходном пиразине 3 и конечном изохинолине 4а , нами не фиксировалось образования продуктов нитрозирова-ния, например, по атому азота фрагмента амида действием NO+, образующегося из амилнитрита in situ . Следует упомянуть, что ранее нами в 1,2,4-триазинах наблюдались, наряду с ариновыми трансформациями, некоторые побочные процессы с участием функциональных групп азинового каркаса. Например, в случае взаимодействия 3-(2-пиридил)-замещенных 5-фенацил-1,2,4-триазинов с 1,2-дегидробензолом нами фиксировалось образование 1-(2-пиридил)изохинолин-3-карбонитрилов как продуктов С -нитрозирования фрагмента фенацила и реакции по типу Богера между 1,2,4-триазином и данным диенофилом [25].
Синтезированный в рамках данной статьи изохинолин 4а является перспективным синтоном, например, он может быть использован для получения недавно описанного лекарственного кандидата для терапии гепатита С [26].
Заключение
Таким образом, в рамках настоящей статьи нами был предложен один из способов химической утилизации 3-гидрокси-6-фторпиразин-2-карбоксамида (фавипиравира) 3 посредством его взаимодействия с 1,2-дегидробензолом, генерированным in situ из антраниловой кислоты. Реакция протекает в течение короткого времени и с выходом 40 % приводит к образованию 3-фторизохинолин-1-карбоксамида 3 , который является ценным прекурсором, в частности, он может быть использован для синтеза препаратов для лечения гепатита С. Структура полученного продукта была однозначно доказана с использованием спектроскопии ЯМР 1Н, 19F, а также данных элементного анализа и масс-спектрометрии. В результате взаимодействия 3 с о -дифторарином, генерированным из 2-амино-4,5-дифторбензойной кислоты, образования целевого изохинолина не фиксировалось, возможно, из-за интенсивного осмоления реакционной массы вследствие протекания побочных трансформаций. Изучение применимости других антраниловых кислот продолжается.
Список литературы О взаимодействии 3-гидрокси-6-фторпиразин-2-карбоксамида (фавипиравира) с аринами
- Pomerantz J.M. // Med. Gen. Med. 2004. V. 6, Iss. 2. P. 4. PMID: 15266231
- Connelly D. // The Pharmaceutical Journal. 2018. V. 301, Iss. 7915. P. 20. DOI: 10.1211/PJ.2018.20205091.
- FaezA. // International Journal of Environmental Research and Public Health. 2020. V. 17, Iss. 3. Article № 787. DOI: 10.3390/ijerph17030787
- Sonowal S., Desai C., Kapadia J.D. et al. // J. Basic. Clin. Pharm. 2017. V. 8, Iss. 1. P. 4. DOI: 10.4103/0976-0105.195079
- Письмо Минздрава РФ (Минздрав РФ) № 25-4/9317 от 20.09.2023.
- Матвеев А.В., Киселёв Ю.Ю., Сычёв Д.А. // Качественная клиническая практика. 2020. № S4. С. 106.
- Hassaniazad M., Bazram A., Hassanipour S. et al. // Trials. 2020. V. 21, Iss. 1. P. 886. DOI: 10.1186/s13063-020-04747-8.
- Hashemian S.M., Khoundabi B., Velayati A.A. et al. // Int. Immunopharmacol. 2022. V. 102. P. 107693. DOI: 10.1016/j.intimp.2021.107693
- Mutair A.A., Shamou J., Alhumaid S. et al. // Journal of Infection and Public Health. 2022. V. 15, Iss. 4. P. 389. DOI: 10.1016/j.jiph.2022.01.013
- BosaeedM., Alharbi A., Mahmoud E. et al. // Clin. Microbiol. Infect. 2022. V. 28, Iss. 4. P. 602 DOI: 10.1016/j.cmi.2021.12.026
- Haider N, van der Plas H.C. // Tetrahedron. 1990. V. 46, Iss. 10. P. 3641. DOI: 10.1016/S0040-4020(01)81533-7
- Brach N., Popek L., Truong M. et al. // Organic Letters. 2024. DOI: 10.1021/acs.orglett.3c03052ff. ffhal-04262921f
- Geurtsen B., de Bie D.A., van der Plas H.C. // Tetrahedron. 1989. V. 45, Iss. 20. P. 6519. DOI: 10.1016/S0040-4020(01)89528-4
- Diaz-Ortiz A., de la Hoz A., Moreno A. et al. // Synlett. 2002. V. 12. P. 2037. DOI: 10.1055/s-2002-35593.
- Keivanloo A., BakheradM., Nasr-Isfahani H. et al. // Tetrahedron Letters. 2012. V. 53. P. 3126. DOI: 10.1016/j.tetlet.2012.04.016
- Troll T., Schmid K. // Journal of Heterocyclic Chemistry. 1986. P. 1641. DOI: 10.1002/jhet.5570230607
- Lauria A., Guarcello A., Macaluso G. // Tetrahedron Letters. 2009. V. 50, Iss. 52. P. 7333. DOI: 10.1016/j.tetlet.2009.10.062.
- Nakahara K., Yamaguchi K., Yoshitake Y. // Chemical and Pharmaceutical Bulletin. 2009. V. 57. Is. 8. P. 846. DOI: 10.1248/cpb.57.846
- Silaichev P.S., Kryuchkova M.A., Maslivets A.N. // Russian Journal of Organic Chemistry. 2009. V.45, Iss. 11. P. 1730. DOI: 10.1134/S1070428009110293.
- Khanapure S.P., Bhawal B.M., Biehl E.R. // Heterocycles. 1991. V. 32. P. 1773
- Cao W.-X., Zhu L., He Y. et al. // Angewandte Chemie International Edition. 2023. V. 62, Iss. 39. Article № e202305146. DOI: 10.1002/anie.202305146.
- Nikonov I.L., Kopchuk D.S., Kovalev I.S. et al. // Tetrahedron Letters. 2013. V. 54. P. 6427. DOI: 10.1016/j.tetlet.2013.09.042
- Kopchuk D.S., Nikonov I.L., Khasanov A.F. et al. // Organic and Biomolecular Chemistry. 2018. V. 16. P. 5119. DOI: 10.1039/C8OB00847G
- Moseev T.D., Varaksin M.V., Lavrinchenko I.A. et al. // Tetrahedron. 2020. V. 76, Iss. 18. Article № 131147. DOI: 10.1016/j.tet.2020.131147
- Kopchuk D.S., Krinochkin A.P., Khasanov A.F. et al. // Synlett. 2018. V. 29. P. 483. DOI: 10.1055/s-0036-1590961
- Laurent D.R.S., Serrano-Wu M.H., Belema M. et al. // J. Med. Chem. 2014. V. 57. P. 1976. DOI: 10.1021/jm301796k


