Образование и перенос электронных дефектов в твердом электролите RbCu Cl I. 4 3 2
Автор: Остапенко Г.И., Веселова Л.Г.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Физика твёрдого тела и твердотельная электроника
Статья в выпуске: 2 т.1, 1999 года.
Бесплатный доступ
Проанализированы причины значительного отличия электронной проводимости для образцов твердого электролита RbCu Cl I, приготовленных в различных условиях. Выдвинуто предположение, что величина электронной проводимости зависит от количества электронных дефектов, возникающих при окислении RbCu Cl I в процессе его приготовления. Рассмотрены соответствующие квазихимические реакции. Из экспериментов с ячейкой Вагнера было выяснено, что концентрация электронных дефектов в исследованном образце RbCu Cl I составляет 1,25Ч1018 cm-3. Коэффициент диффузии электронных дефектов равен 1,5Ч10-8 cм2Чс-1 при их проводимости 1,2Ч10-7 СмЧcм-1. Расчетная величина потенциала стеклоуглеродного электрода после электрохимического разложения RbCu Cl I (0,606 В) удовлетворительно совпадает с экспериментальной величиной (0,58 В), что свидетельствует об адекватности рассмотренной моде ли возникновения электронных дефектов при приготовлении RbCu Cl I. 4 3 2
Короткий адрес: https://sciup.org/148197535
IDR: 148197535
Текст научной статьи Образование и перенос электронных дефектов в твердом электролите RbCu Cl I. 4 3 2
Твердый электролит RbCu4Cl3I2 наряду с высокой ионной проводимостью по ионам Cu+ обладает электронной проводимостью. Если величина ионной проводимости практически одинакова для образцов RbCu4Cl3I2 , исследованных различными авторами, то величины электронной проводимости значительно отличаются (1016...107 См.см-1 [1-3]). Здесь анализируются возможные причины, от которых может зависеть величина электронной проводимости RbCu4Cl3I2.
Твердый электролит RbCu 4 Cl3I 2 имеет широкую запрещенную зону (Е > 3 эВ [1]) , поэтому возникновение в нем ощутимой собственной электронной проводимости маловероятно. Однако J.Schmidt и J.Bazan [4] для стехиометрического CuI, входящего в состав RbCu 4 Cl3I 2 , предлагают следующий механизм образования электронных дефектов (в обозначениях Ф.Крегера и Х.Винка [5]):
Cuх cu = Cuх i + Vх Cu т.е. ион Cu+ из узла (CuхCu) переходит в междоузлие (Cuх .) с образованием нейтральной вакансии VхCu. Затем эта вакансия иони- зируется
VхГ
Cu
= V Г + h • Cu
с образованием отрицательно заряженной вакансии V Cu и дырки h • . Энергия образования дырки составляет 0,29 эВ .
Однако, как было сказано выше, интервал дырочной проводимости RbCu 4 Cl3I 2 составляет несколько порядков величин. Это характерно для примесной проводимости. Поэтому рассмотрим пути появления примесей в RbCu 4 Cl3I2 . Обычно RbCu 4 Cl3I2 готовят плавлением смеси RbCl, CuCl и CuI с последующим длительным отжигом при 130...200 0С [2,6]. При синтезе галогенидов меди и приготовлении RbCu4Cl 3 I2 могут происходить химические реакции, приводящие к появлению примесей в RbCu4Cl 3 [2 . Эти примеси приводят к возникновению атомных и электронных дефектов в решетке RbCu 4 Cl 3 I2 и появлению электронной проводимости.
Рассмотрим некоторые из этих реакций. В основном это реакции окисления галогенидов меди кислородом воздуха, который а небольших количествах присутствует даже при вакуумировании. Для упрощения будем рассматривать RbCu 4 Cl 3 [2 как смесь индивидуальных галогенидов.
Реакция окисления CuCl :
4CuCl + 1/2 O2 = 2 CuCl2 + Cu2O (1)
Здесь два атома меди уходят на поверхность кристалла CuCl и образуют решетку Cu2O . В глубине кристалла CuCl образуются отрицательно заряженные вакансии V'Cu. CuCl и CuCl2 имеют практически одинаковую упаковку ионов Cl- [7] и образуют твердые растворы [8]. Поэтому CuCl2 , по-видимому, не образует индивидуальную решетку. Следовательно, в узлах решетки, обычно занимаемых Cu+- ионами ( Cu х Cu ), образуются Cu2+- ионы ( Cu • Cu ). Тогда реакцию (1) можно записать:
Cu х„
Cu
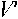
Cu
+ Cu • „
Cu
Cu2 +:
Далее возможна реакция диссоциации
Cu • Cu = Cu х Cu + h • (3)
и захвата дырки отрицательно заряженной вакансией:
V Cu + h ^ = V X Cu (4) с образованием V- центра.
E. Нимон и др . [9] полагают, что имеет место только реакция (2) и в ячейке Вагнера осуществляется перенос ионов Cu2+ терми
чески активированными перескоками электронных носителей между ионами меди различной валентности. Однако C.Schwab и A.Goltzene [7] отмечают, что в монокристаллах CuCl методом ЭПР не обнаружены равновесные ионы Cu2+ и V - центры. Следовательно, в CuCl имеет место реакция (3) и не протекает реакции (4).
Реакция окисления CuI [10]:
2CuI + O2 = 2CuO + Т2-г по-видимому, происходит в две стадии
[11]:
CuI + 1/2O 2 = Cu 2O + I 2 г (5) Cu2O + 1/2O 2 = 2CuO ’г (6)
Вероятно, при протекании реакции (5) на поверхности кристалла CuI строится решетка Cu2O , а внутри кристалла возникают заряженные вакансии меди VCu и иода V • I . Тогда реакцию (5) можно записать:
1/20 2 + 2 Iх I = 12 ОX O +2V Cu + 2V • I +1 2 - , где: Iх I есть I - в решетке CuI, O х O - ион
O2 - в решетке Cu2O . Ассоциация вакансий меди и иода должна привести к разрыхлению кристалла CuI .
При температурах менее 270 0 С закись меди, образовавшаяся на поверхности зерен CuI , содержит избыток кислорода [12] , т.е.
имеет место реакция (6):
1/2O 2 = Oх O ■ 2Vх Cu
Следовательно, при таких температурах CuO не образует индивидуальную решетку, но образует твердые растворы Cu2O - CuO [13], т.е. окислы переменного состава Cu2- x O . При этом часть нейтральных вакансий диссоциирует:
V х Cu = V Cu + h ^ , (7)
что и обеспечивает дырочную проводимость Cu2O .
При повышенных температурах и вакууме из CuI может испаряться иод [14]. Эту реакцию можно записать:
Iх I = Vх I + 1/2I^ (8)
Возникшая нейтральная вакансия иода ( Vх I ) может диссоциировать
Vх I = V • I + e ’ (9)
с образованием избыточного электрона е’.
Практически все приведенные выше реакции создают вакансии в решетке RbCu4Cl 3 I2 и электронные дефекты при его приготовлении. Вакансии теоретически должны привести к увеличению ионной проводимости RbCu4Cl 3 I2 , однако на фоне и без того высокой ионной проводимости по ионам Cu+ этот эффект, по-видимому, незаметен.
Реакции (3), (5) и (9) приводят к образованию дырок и избыточных электронов. Эти электроны, по-видимому, рекомбинируют с дырками. RbCu 403 2 2 имеет дырочную проводимость. Следовательно, реакции (3) и (7) превалируют над реакцией (9). Тем более, что при 200 оС давление паров иода над CuI очень невелико и составляет приблизительно 10 -9 Па [15] и соответственно очень невелико количество образовавшихся по реакциям (8) и (9) избыточных электронов.
Таким образом, можно сделать вывод, что концентрация электронных дефектов зависит от процедуры приготовления RbCu4Cl 3 I2 . Эта концентрация особенно чувствительна к содержанию кислорода в реакционной среде. Следовательно, широкий интервал величин дырочной проводимости в RbCu4Cl 3 I2 можно объяснить различиями условий его приготовления.
Формально, без конкретизации состояния электронных дефектов ( Cu2+ или дырки), с учетом (3) будем записывать электронный
дефект как Cu2+. Так проще записывать химические и электрохимические равновесия в RbCu4Cl 3 I2.
Эксперимент
Исследовали RbCu4Cl 3 I2 , приготовленный по способу, описанному в работе [16].
Ячейки:
Cu /RbCu4Cl 3 I2 / C ( стеклоуглерод) (10) приготавливали в атмосфере сухого воздуха (осушитель Р 2 О 5 ) путем прессования при давлении 2,2 • 10 8 Па порошков RbCu4Cl 3 I2 и меди к плоскому стеклоуглеродному диску диаметром 12 мм. В электролит помещали электрод сравнения из медной проволоки диаметром 0,2 мм. Поджим ячеек составлял примерно 3 • 10 6 Па. Перед измерениями ячейки прокаливали три часа при 140 оС. Измерения проводили с помощью потенциостата П5848 при комнатной температуре.
Результаты и дискуссия
На рис. 1 изображена квазистационарная вольт-амперная характеристика стеклоуглеродного электрода, построенная по результатам потенциостатических измерений. На рис .2 изображена циклическая потенциоди-намическая кривая электрохимического разложения RbCu4Cl 3 I2 на стеклоуглеродном электроде (реверс потенциала при 0,67 Л ).
Рассчитаем равновесную концентрацию ионов Cu2+ в RbCu4Cl 3 I2 . Электроактивны-ми частицами в RbCu4Cl 3 I2 являются ионы Cu+ и Cu2+. Поэтому потенциал медного электрода в RbCu4Cl 3 I 2 :
т о к.Г , [Cu]cu jCu jcu2+/Cu* e [Cu+ ]Cu (11)
о о где: jCu2+/Cu + есть стандартный потенциал пары Cu2+/Cu+ в RbCu4Cl3I2;
[ Cu2 +] Cu - концентрация Cu2+ у медного электрода;
[ Cu +] Cu - концентрация Cu+ у медного электрода;
k - постоянная Больцмана ;
Т - температура;
е - заряд электрона.
Потенциал стеклоуглеродного электрода:
о kT [Cu2+]c jc = jCu 2+,-c ++ T lHKu'L ^
Если предположить, что в RbCu4Cl 3 I2 : [ Cu2 +] << [ Cu +], то [ Cu +] Cu » [ Cu +] C и из (11) и (12) э.д.с. ячейки (10):
kT [Cu 2+ ]C j = jc - jCu = T b—^ (B)
Следовательно, (10) есть концентрационная ячейка и j 0 зависит от соотношения концентраций ионов Cu2+ у электродов.
Величина [ Cu2 +] Cu определяется из равновесия химической реакции:
Cu2+ +Cu0 = 2Cu+.
С использованием j Cu 2 +/ Cu + = 0,624 В [17] при концентрации ионов Cu+ в решетке RbCu4Cl 3 I2 [ Cu +] = 1,585.10 2 см -3 [6] из (11) можно получить:
[Cu2+]Cu = 4,17.1011 cm-3.
Подставляем эту величину в (13) и при j0 = 0,5 В (рис.Р) с учетом “решеточного на сыщения” в RbCu4Cl3I2:
[Cu2+] + [Cu*] = 1,585.102 см -3 получаем:
[Cu2+]C = 1,25.1018 cm-3.
Эта концентрация соответствует содержанию Cu2+ в RbCu4Cl 3 I2 приблизительно 0,8% от всей меди в RbCu4Cl3I2 . С учетом образования твердых растворов CuCl2 в CuCl исследованный RbCu4Cl 3 I2 имеет состав примерно RbCu4-0 03C1 3 L 2 . Эти данные хорошо соответствуют содержанию Cu2+ в RbCu4Cl3I2 около 2% из измерений магнит-
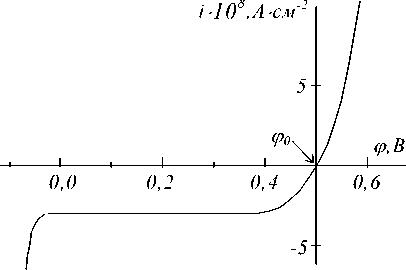
Рис 1. Вольт-амперная характеристика стеклоуглеродного электрода в RbCu4Cl3I2 относительно медного электрода сравнения
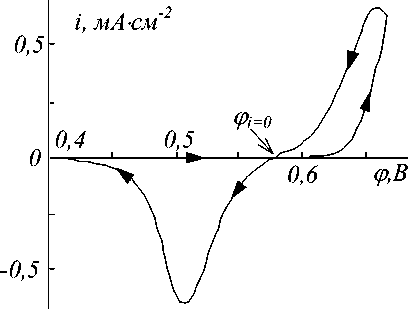
Рис 2. Вольтамперограмма электрохимического разложения RbCu4Cl 3 I 2 на стеклоуглеродном электроде. Скорость развертки потенциала 5 мВЧс1
ной восприимчивости [18].
(При использовании очень чистой СиС1 , при прокаливании под вакуумом 0,1...1 Па с использованием атмосферы сухого аргона получен RbCu4Cl3I2 высокой чистоты [19]. С этим RbCu 4 Cl 3 I2 э.д.с. j 0 в ячейке ( 10 ) равна приблизительно 10 мВ [17], что соответствует [ Си2 +] = 6,2 ■ 1011 см -3 ).
В интервале потенциалов стеклоуглеродного электрода 0... j 0 ионная проводимость по Си + в ячейке ( 10 ) блокирована. Следовательно, горизонтальный участок вольт-амперной характеристики (рис.1) есть предельный диффузионный ток i пр подведения Си2 + к стеклоуглеродному электроду. С учетом реакции (3) проводимость по электронным дефектам исследуемого RbCu4Cl3I2 :
~ _ eLiny sCu '' = sh = kT составляет 1,2.10- См-cм-1, где: L = 1 мм есть толщина слоя КЬСи4С1312 в ячейке (10).
Коэффициент диффузии ионов Си2+ :
_ sCu2 + (kT/e2)
Cu 2 + = [Cu 2 + ]c равен 1,5.10— см2-c-1.
При протекании тока на стеклоуглеродном электроде имеет место электрохимическая реакция:
Cu+ - e = Cu2+ справа налево при j < j0 и слева направо при j > j0. В последнем случае [Си2+] у электрода увеличивается. Как только [Си2+]
превысит предел растворимости Си2 + в RbCu4Cl3I2 , на поверхности электрода пойдет реакция анодного разложения RbCu 4 С1 3 I2 [20]:
RbCu4Cl3I2 = Cu+ + RbCuCl3 + 2CuI (14)
После этой реакции при условии, что продукты реакции полностью покрывают поверхность электрода, одному иону Си2 + из RbCuCl3 соответствуют два иона Си+ из Си1 . Следовательно здесь соотношение [ Си2 +] С / [ Си +] С = 0,5 . При этом соотношении потенциал стеклоуглеродного электрода, вычисленный по (12), должен быть равен 0,606 В . Однако экспериментальный бестоковый потенциал j i= 0 после разложения КЬСи 4 С1 3 12 равен 0,58 В . Различие между расчетным и измеренным бестоковыми потенциалами (26 мВ ) незначительно. Это различие можно объяснить, например, различными коэффициентами активности ионов Си2+ и Си+ в RbCuQ3 и Си1 соответственно, т.е. ошибкой при приравнивании активности и концентрации ионов.
Хорошее соответствие расчетных величин концентрации ионов Си2+ в КЬСи 4 С1 3 12 с экспериментальными э.д.с. ячеек (10) и потенциалом электрохимического разложения электролита свидетельствует об адекватности рассмотренной модели возникновения электронных дефектов при приготовлении RbCu4aзI2 .
Работа выполнена в рамках проекта А 0065 ФЦП “Интеграция”.


