Образование в мостомозжечковом углу головного мозга - что за ним скрывается? Клиническое наблюдение
Автор: Мухутдинова Г.З., Сергеев Н.И., Регентова О.С., Сидибе Н., Ребрикова В.А., Цаллагова З.С., Лагкуева И.Д., Котляров П.М.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Клиническое наблюдение
Статья в выпуске: 3 т.23, 2023 года.
Бесплатный доступ
В клиническом наблюдении представлен случай диффузной срединной глиомы с альтерацией в гене H3K27, WHO Grade 4. Данная опухоль располагалась в левом мостомозжечковом углу головного мозга и имитировала картину вестибулярной шванномы.
Диффузная срединная глиома с альтерацией в гене h3k27, глиобластома, детская глиобластома, вестибулярная шваннома, образование мостомозжечкового угла
Короткий адрес: https://sciup.org/149143504
IDR: 149143504
Текст научной статьи Образование в мостомозжечковом углу головного мозга - что за ним скрывается? Клиническое наблюдение
По данным литературы 80% образований мостомозжечкового угла – это вестибулярные шванномы [1]. Вестибулярная шваннома (ВШ) – это доброкачественная опухоль, происходящая из миелиновой оболочки преддверно-улиткового нерва, располагающаяся преимущественно в полости внутреннего слухового прохода и имеющая тенденцию к распространению в мостомозжечковый угол [2]. Примерно в 90 % случаев ВШ развиваются из нижней части вестибулярной порции преддверно-улиткового нерва, остальные 10% приходятся на развитие из верхней части вестибулярной порции и из слуховой порции этого нерва [3]. Эти опухоли также называются невриномами слухового нерва и акустическими шванномами.
ВШ представляет собой плотное, тканевое опухолевое образование, в редких случаях содержит в своей структуре кисты, имеет хорошо выраженную капсулу, четко отграниченную от мозгового вещества [2,4].
Заболеваемость ВШ составляет от 10 до 15 случаев на 1 млн человек в год, чаще всего возникает на четвертом и пятом десятилетиях жизни [5]. Односторонние ВШ встречаются в 95% случаев, а у 5% пациентов выявляют двусторонние ВШ, которые развиваются на фоне нейрофиброматоза II типа [6].
Первыми и наиболее частыми клиническими проявлениями ВШ являются: ипсилатеральное снижение слуха (72,2%), шум в ушах (66,7%), нарушение равновесия и походки (22,2%). При распространении ВШ в мостомозжечковый угол объемное воздействие опухоли приводит к нарушению функции близлежащих черепных нервов, ядер ствола мозга или мозжечка [7,8]. Таким образом, клиническая картина вестибулярных шванном складывается из трех основных групп симптомов – признаков поражения черепных нервов, стволовых симптомов и мозжечковых нарушений.
Выбор тактики ведения при ВШ зависит от выраженности симптомов, размеров образования и степени распространения опухолевого процесса на близлежащие структуры. При наличии вестибулярных и/или слуховых симптомов, чтобы избежать дальнейшего ухудшения, выполняется радиохирургическое или микрохирургическое удаление опухоли [9]. Такой вид лечения в 98% случаев приводит к полному излечению [10].
Если 80% образований мостомозжечкового угла – это ВШ, то что скрывается за остальными 20%? Приводим наше клиническое наблюдение, отражающее трудности дифференциальной диагностики образований данной локализации.
Клиническое наблюдение
Пациент Ц. 9 лет, рос и развивался по возрасту. В начале февраля 2023 г. внезапно появились жалобы на головную боль, тошноту и рвоту. Затем с середины февраля 2023 г. к вышеуказанным жалобам присоединилось левостороннее снижение слуха и левосторонняя слабость лицевой мускулатуры. Ребенок госпитализирован в больницу, выполнена МРТ головного мозга с внутривенным контрастным усилением. По данным МРТ: в области левого мостомозжечкового угла в режиме FLAIR определялась зона перифокального отека с выраженным масс-эффектом и формированием умеренной окклюзионной гидроцефалии; при в/в контрастном усилении в левом мостомозжечковом углу определялся очаг гипернакопления контрастного вещества с наличием участков некроза в структуре и распространением на левый внутренний слуховой проход (рис. 1).
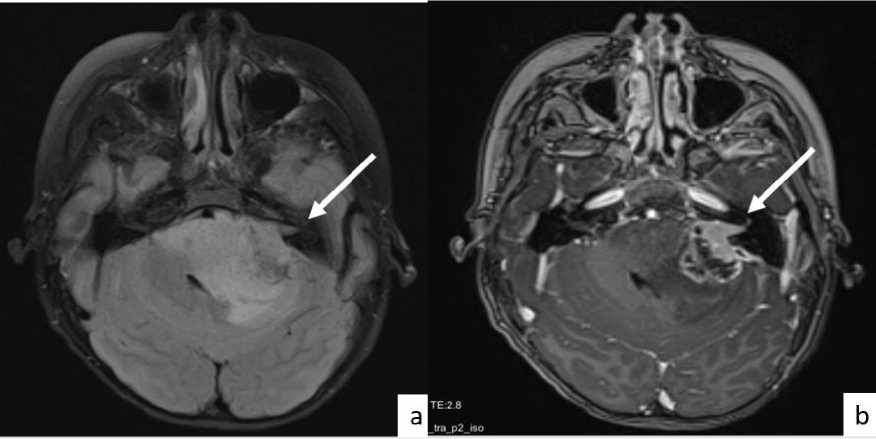
Рис. 1. МРТ головного мозга в аксиальных проекциях: (а) режим FLAIR, зона измененного МР-сигнала в области мостомозжечкового угла слева с выраженным масс-эффектом, размерами 60 × 40 × 45 мм; (b) режим T1 с контрастным усилением, в левом мостомозжечковом углу очаг гипернакопления контрастного вещества с наличием участков некроза в структуре и распространением на левый внутренний слуховой проход, размерами 30 х 30 мм.
Учитывая клинико-рентгенологическую картину, заподозрена вестибулярная шваннома. В начале марта 2023 г., в связи с прогрессированием окклюзионной гидроцефалии, пациенту установлен наружный вентрикулярный дренаж, а затем выполнено микрохирургическое удаление опухоли мостомозжечкового угла слева с нейрофизиологическим мониторингом.
В послеоперационном периоде выполнена КТ головного мозга - интракраниальные осложнения исключены, наружный вентрикулярный дренаж удален. Но в неврологическом статусе отмечалось сохранение слабости лицевой мускулатуры слева, ухудшение слуха слева до глухоты, развилось нарушение статики и походки, а также возникли симптомы левостороннего поражения V, IX, X черепных нервов. Получено морфологическое заключение: диффузная срединная глиома c альтерацией в гене H3K27, WHO Grade 4.
Учитывая основной диагноз, возраст пациента, объем проведенного ранее лечения, а также морфологическое заключение, пациенту показано проведение курса локальной 3D-конформной лучевой терапии на ложе удаленной опухоли мостомозжечкового угла до СОД 54,0 Гр с радиомодификацией темозоломидом в дозировке 75 мг/кг массы тела. Через 4 недели после оперативного вмешательства пациент госпитализирован для проведения химиолучевой терапии, но, в связи с нарастанием общемозговой симптоматики (общая слабость, вялость, тошнота, многократная рвота, головная боль), принято решение не начинать курс химиолучевой терапии. На фоне усиленной противоотечной терапии состояние ребенка ухудшилось - по жизненным показаниям в экстренном порядке установлен наружный вентрикулярный дренаж. После установки дренажа состояние улучшилось, отмечалось уменьшение головной боли и тошноты. Затем в плановом порядке установлен вентрикуло-перитонеальный шунт справа.
Через 6 недель после оперативного вмешательства пациент вновь госпитализирован для проведения химиолучевой терапии на ложе удаленной опухоли мостомозжечкового угла. Учитывая нарастающий неврологический дефицит, выполнены МРТ головного и спинного мозга с в/в контрастным усилением. По данным МРТ: выявлена МР-картина продолженного роста образования левого мостомозжечкового угла, с наличием метастатического поражения полушарий и оболочек головного мозга и протяженного метастатического поражения оболочек спинного мозга на уровне C1-S1 (рис. 2,3).
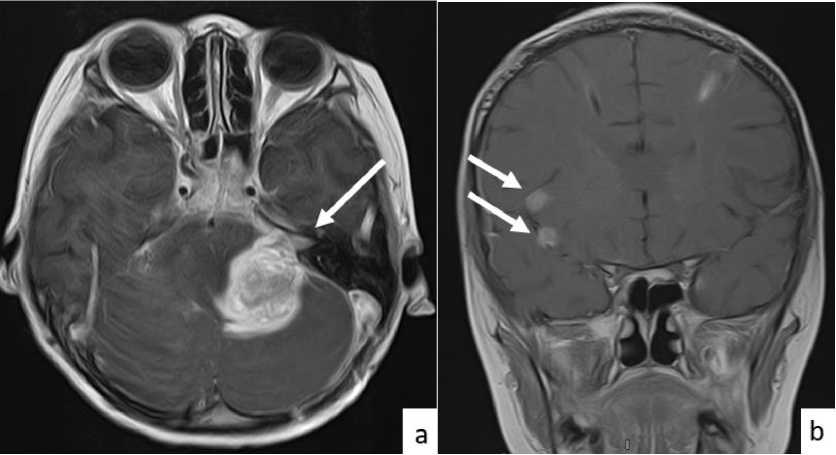
Рис. 2. МРТ головного мозга: (а) аксиальная плоскость, режим T1 с контрастным усилением, в левом мостомозжечковом углу отмечается очаг гипернакопления контрастного вещества, соответствующий продолженному росту опухоли; (b) корональная плоскость, режим T1 с контрастным усилением, округлые очаги гипернакопления контрастного вещества, соответствующие метастатическому поражению оболочек головного мозга.
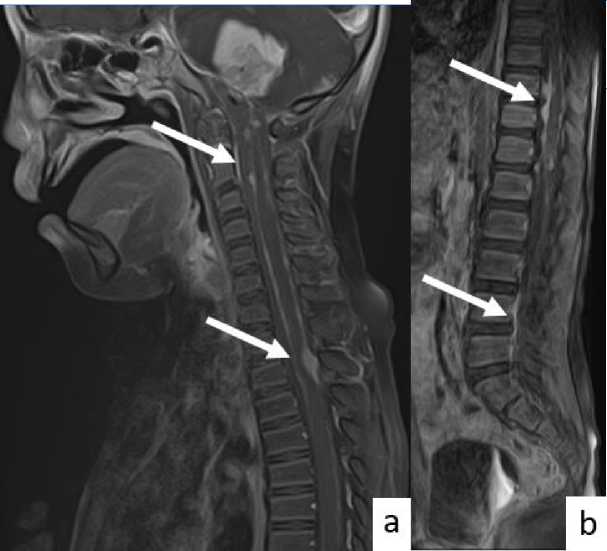
Рис. 3. МРТ спинного мозга, сагиттальная плоскость: (а-b) режим T1 FS с контрастным усилением, очаги гипернакопления контрастного вещества, соответствующие метастатическому поражению оболочек спинного мозга.
Принимая во внимание объём поражения, выявленный по данным МР-исследования головного и спинного мозга, начат курс лучевой терапии в объеме облучения ложа удаленной опухоли мостомозжечкового угла в режиме гиперфракционирования с РОД 1,0 Гр, СОД 11,0 Гр, а также в объеме краниоспинального облучения с РОД 1,6 Гр, СОД 17,4 Гр.
На фоне усиленной противоотечной терапии дексаметазоном до 12 мг/сут., комбинированной дегидратационной терапии фуросемидом и маннитолом, пациент переносил лечение с выраженными лучевыми реакциями, отмечалась отрицательная динамика в неврологическом статусе. Также в соответствии с протоколом HGG пациенту было показано проведение радиомодификации с использованием темозоломида, однако в связи с тяжестью состояния радиомодификация не была проведена.
Таким образом, учитывая основное заболевание, морфологическое заключение, тяжесть состояния пациента, прогрессирование опухолевого процесса по ЦНС, отсутствие эффекта от проводимого курса лучевой терапии на фоне усиленной противоотечной и дегидратационной терапии, а также обращая внимание на степень выраженности лучевого отека в связи с объемом облучения, нарастание общемозговой симптоматики и неврологического дефицита, продолжение курса лучевой терапии было нецелесообразным, и пациенту был присвоен паллиативный статус.
Обсуждение
Термин «глиома» включает в себя все опухоли, возникающие из глиальных клеток; глиомы высокой степени злокачественности (WHO Grade 4) носят название глиобластом (ГБМ). ГБМ является самой распространенной первичной злокачественной опухолью головного мозга у взрослых, чаще всего локализующейся в супратентрориальных отделах [11]. Согласно определению ВОЗ, глиома IV степени представляет собой диффузноинфильтративную астроцитарную опухоль с клеточной атипией, анаплазией, митотической активностью, микрососудистой пролиферацией и/или некрозом [12].
У детей ГБМ встречается реже, чем у взрослых: распространенность составляет 9,5% среди всех первичных опухолей головного мозга, а пик заболеваемости приходится на 9 лет [13]. Раньше ГБМ взрослых и детей рассматривались совместно, однако успехи в понимании молекулярно-биологических особенностей опухолей ЦНС привели к тому, что в 2016 году в классификацию первичных опухолей ЦНС ВОЗ было включено семейство детских диффузных глиом высокой степени злокачественности [14]. Диффузные глиомы высокой степени злокачественности у детей, в зависимости от локализации, возраста и молекулярного профиля, включают различные типы: 1) диффузная срединная глиома, с альтерацией в гене H3K27; 2) диффузная полушарная глиома, с мутацией в гене H3G34; 3) диффузная детская глиома высокой степени злокачественности, без мутаций в генах H3 и IDH; 4) младенческая полушарная глиома [15].
У рассматриваемого нами пациента была выявлена диффузная срединная глиома с альтерацией в гене H3K27. Данный тип опухоли локализуется в стволе или в срединных структурах головного мозга, обладает диффузным инфильтративным ростом и склонностью к раннему метастазированию [13]. Прогноз при диффузной срединной глиоме с альтерацией в гене H3K27 чрезвычайно плохой: 2-летняя выживаемость <10%, медиана выживаемости 10-12 месяцев [16]. Такой неблагоприятный прогноз обусловлен агрессивностью злокачественного процесса, диффузным поражением близлежащих структур, а также распространением опухоли на жизненно важные структуры головного мозга, что, в свою очередь, затрудняет резекцию опухоли [17].
Cтандартным подходом в лечении ГБМ является максимально безопасная резекция в комбинации с химиолучевым лечением [18]. К сожалению, диффузная срединная глиома с альтерацией в гене H3K27 невосприимчива к имеющимся терапевтическим подходам, однако в настоящее время появляются новые данные об онкопатогенезе опухоли, выделяются новые молекулярные профили, что позволит в будущем оказывать таргетное лечебное воздействие с более благоприятным прогнозом [19].
Магнитно-резонансная томография (МРТ) - метод выбора в диагностике опухолей головного мозга и, в частности, диффузных глиом высокой степени злокачественности [20]. Однако относительная редкость ГБМ у детей затрудняет интерпретацию данных МРТ. Типичными МР-характеристиками диффузной срединной глиомы у детей являются:
гиперинтенсивное образование на Т2-ВИ и FLAIR с вовлечением более 50% моста; при DWI и ADC визуализируется ограничение диффузии; при контрастном усилении выявляются контраст-накапливающие очаги, а также зоны некроза и кисты [21].
В чем же заключалась схожесть вестибулярной шванномы и диффузной срединной глиомы в нашем клиническом наблюдении? В литературе описывается симптом, характерный для вестибулярной шванномы - симптом «рожка мороженого» [22,23]. Конусом рожка является внутриканальцевый компонент опухоли преддверно-улиткового нерва, расположенного во внутреннем слуховом проходе. Так как внутренний слуховой проход ограничен костными структурами, опухоль начинает расти в зону наименьшего сопротивления - интракраниально в сторону мостомозжечкового угла, образуя тем самым шарик мороженого. Данный симптом имел место и в нашем клиническом наблюдении, но соответствовал не вестибулярной шванноме, а диффузной срединной глиоме, распространившейся на структуры внутреннего слухового прохода, что и вызвало трудности дифференциальной диагностики этих двух образований (рис. 4).
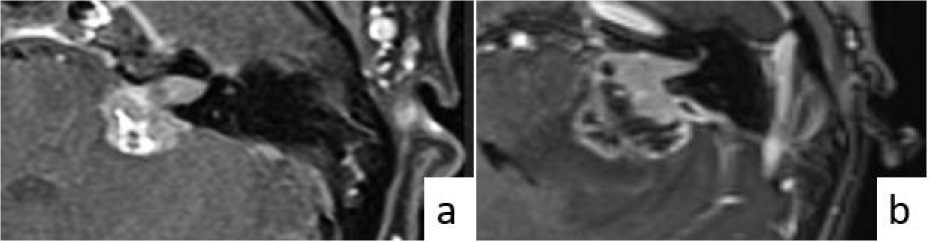
Рис. 4. МРТ головного мозга в режиме Т1 с контрастным усилением: (а) Симптом «рожка мороженого» в вестибулярной шванноме, подтвержденной морфологически. Источник: ; (б) Симптом «рожка мороженого» в диффузной срединной глиоме с альтерацией в гене H3K27 мостомозжечкового угла, подтвержденной морфологически.
Заключение
Наиболее частым образованием в мостомозжечковом углу головного мозга является вестибулярная шваннома. Однако в дифференциально-диагностический ряд образований данной локализации необходимо включать и диффузную срединную глиому, встречающуюся у детей в срединных структурах и стволе головного мозга, характеризующуюся диффузным распространением не только на интракраниальные, но и на эктстракраниальные структуры, что может имитировать картину других заболеваний.
Вклад авторов. Г.З. Мухутдинова: написание и редактирование текста, Н.И. Сергеев: написание и редактирование текста, О.С. Регентова: подготовка литературной справки, Н. Сидибе: подготовка и оформление иллюстраций, В.А. Ребрикова: подготовка и оформление иллюстраций, З.С. Цаллагова: редактирование текста, И.Д. Лагкуева: редактирование текста: П.М. Котляров: редактирование текста. Все авторы прочитали и согласились с версией рукописи, представленной для публикации.
Финансирование. Это исследование не получило внешнего финансирования.
Соблюдение прав пациентов и правил биоэтики. Комитет по этике РНЦРР одобрил данное исследование и предоставил освобождение от необходимости получения информированного согласия в связи с ретроспективным дизайном исследования.
Список литературы Образование в мостомозжечковом углу головного мозга - что за ним скрывается? Клиническое наблюдение
- Whitmore RG, Urban C, Church E, Ruckenstein M, Stein SC, Lee JY. Decision analysis of treatment options for vestibular schwannoma. J Neurosurg. 2011 Feb;114(2):400-413. doi: 10.3171/2010.3.JNS091802.
- Ильялов СР, Голанов АВ, Банов СМ. Внутриканальные вестибулярные шванномы. Наблюдение, радиохирургия или микрохирургия - что выбрать? Нейрохирургия. 2020; 22(3):102-109. doi: 10.17650/1683-3295-2020-22-3-102-109.
- Khrais T, Romano G, Sanna M. Nerve origin of vestibular schwannoma: a prospective study. J Laryngol Otol. 2008 Feb;122(2):128-131. doi: 10.1017/S0022215107001028.
- Koen N, Shapiro C, Kozin ED, et al. Location of small intracanalicular vestibular schwannomas based on magnetic resonance imaging. Otolaryngol Head Neck Surg 2020;162(2):211–214. doi: 10.1177/0194599819893106.
- Stangerup SE, Tos M, Thomsen J, Caye-Thomasen P. True incidence of vestibular schwannoma? Neurosurgery. 2010 Nov;67(5):1335-1340; discussion 1340. doi: 10.1227/NEU.0b013e3181f22660.
- Greenberg M.S. Handbook of neurosurgery. 8th edn. Thieme Medical Publishers, 2016. P. 670-687. doi: 10.1055/b-006-149702.
- Matsushima K, Kohno M, Ichimasu N, Nakajima N, Yoshino M. Pediatric vestibular schwannoma without evidence of neurofibromatosis: consecutive 18 microsurgical experiences. Childs Nerv Syst. 2022 Aug;38(8):1505-1512. doi: 10.1007/s00381-022-05477-9.
- Pisani D, Gioacchini FM, Chiarella G, Astorina A, Ricciardiello F, Scarpa A, et al. Vestibular Impairment in Patients with Vestibular Schwannoma: A Journey through the Pitfalls of Current Literature. Audiol Res. 2023 Apr 13;13(2):285-303. doi: 10.3390/audiolres13020025.
- Goldbrunner R, Weller M, Regis J, Lund-Johansen M, Stavrinou P, Reuss D, et al. EANO guideline on the diagnosis and treatment of vestibular schwannoma. Neuro Oncol. 2020 Jan 11;22(1):31-45. doi: 10.1093/neuonc/noz153.
- Tamura R, Toda M. A Critical Overview of Targeted Therapies for Vestibular Schwannoma. Int J Mol Sci. 2022 May 13;23(10):5462. doi: 10.3390/ijms23105462.
- Ostrom QT, Price M, Neff C, Cioffi G, Waite KA, Kruchko C, Barnholtz-Sloan JS. CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2015-2019. Neuro Oncol. 2022 Oct 5;24(Suppl 5):v1-v95. doi: 10.1093/neuonc/noac202.
- Broekman ML, Maas SLN, Abels ER, Mempel TR, Krichevsky AM, Breakefield XO. Multidimensional communication in the microenvirons of glioblastoma. Nat Rev Neurol. 2018 Aug;14(8):482-495. doi: 10.1038/s41582-018-0025-8.
- Ostrom QT, Price M, Ryan K, Edelson J, Neff C, Cioffi G, et al. CBTRUS Statistical Report: Pediatric Brain Tumor Foundation Childhood and Adolescent Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2014-2018. Neuro Oncol. 2022 Sep 6;24(Suppl 3):iii1-iii38. doi: 10.1093/neuonc/noac161.
- Karremann M, Gielen GH, Hoffmann M, Wiese M, Colditz N, Warmuth-Metz M, et al. Diffuse high-grade gliomas with H3 K27M mutations carry a dismal prognosis independent of tumor location. Neuro Oncol. 2018 Jan 10;20(1):123-131. doi: 10.1093/neuonc/nox149.
- Мацко М., Мацко Е. Нейроонкология, 2021. Краткий анализ новой классификации Всемирной организации здравоохранения опухолей центральной нервной системы. Вестник Санкт-Петербургского университета. Медицина. 2022;17(2):88-100. doi: 10.21638/spbu11.2022.202
- Louis DN, Giannini C, Capper D, Paulus W, Figarella-Branger D, Lopes MB, et al. cIMPACT-NOW update 2: diagnostic clarifications for diffuse midline glioma, H3 K27M-mutant and diffuse astrocytoma/anaplastic astrocytoma, IDH-mutant. Acta Neuropathol. 2018 Apr;135(4):639-642. doi: 10.1007/s00401-018-1826-y.
- Gianno F, Giovannoni I, Cafferata B, Diomedi-Camassei F, Minasi S, Barresi S, et al. Paediatric-type diffuse high-grade gliomas in the 5th CNS WHO Classification. Pathologica. 2022 Dec;114(6):422-435. doi: 10.32074/1591-951X-830.
- Tan AC, Ashley DM, López GY, Malinzak M, Friedman HS, Khasraw M. Management of glioblastoma: State of the art and future directions. CA Cancer J Clin. 2020 Jul;70(4):299-312. doi: 10.3322/caac.21613.
- Rosenberg T, Yeo KK, Mauguen A, Alexandrescu S, Prabhu SP, Tsai JW, et al. Upfront molecular targeted therapy for the treatment of BRAF-mutant pediatric high-grade glioma. Neuro Oncol. 2022 Nov 2;24(11):1964-1975. doi: 10.1093/neuonc/noac096.
- Сергеев НИ, Ребрикова ВА, Котляров ПМ, Солодкий ВА. Магнитно-резонансная томография с перфузионной визуализацией в диагностике глиобластом головного мозга (обзор литературы). Вестник Российского научного центра рентгенорадиологии. 2021;21(1):45-59.
- Louis DN, Perry A, Wesseling P, Brat DJ, Cree IA, Figarella-Branger D, et al. The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol. 2021 Aug 2;23(8):1231-1251. doi: 10.1093/neuonc/noab106.
- Ho HH, Li YH, Lee JC, Wang CW, Yu YL, Hueng DY, et al. Vestibular schwannomas: Accuracy of tumor volume estimated by ice cream cone formula using thin-sliced MR images. PLoS One. 2018 Feb 13;13(2):e0192411. doi: 10.1371/journal.pone.0192411. 23. Kentala E, Pyykkö I. Clinical picture of vestibular schwannoma. Auris Nasus Larynx. 2001 Jan;28(1):15-22. doi: 10.1016/s0385-8146(00)00093-6.


