Оценка буферной емкости модельных систем и природных вод экспериментальным и расчетным методами
Автор: Кочергина Ольга Васильевна, Онина Светлана Александровна
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Науки о земле
Статья в выпуске: 12 т.6, 2020 года.
Бесплатный доступ
Целью данной работы является обучение студентов определению устойчивости малых озер в отношении процессов закисления путем расчета буферной емкости вод. Понижение pH природных вод вызвано поступлением кислотообразующих оксидов серы и азота в атмосферу и в водоемы. Повышение кислотности водоемов имеет крайне негативные последствия, способствует выщелачиванию тяжелых металлов, изменяет ионный состав вод, снижает способность природных водоемов к самовосстановлению. Особенно уязвимыми в отношении процессов закисления являются низко минерализованные воды малых озер северных регионов. В качестве критериев устойчивости природных вод используют показатель кислотонейтрализующей способности, содержание гидрокарбонатов, значение буферной емкости природных вод. Для расчета буферной емкости в данной работе использованы следующие показатели химического состава вод: водородный показатель (pH), содержание органических (Cорг) и минеральных (Cмин) форм углерода. Концентрации сопряженных форм компонентов природных кислотно-основных систем рассчитаны на основе представлений о кислотно-основном равновесии в растворах угольной кислоты и гумусовых кислот.
Закисление, буферная емкость, кислотонейтрализующая способность, гидрокарбонаты, гумусовые кислоты
Короткий адрес: https://sciup.org/14117771
IDR: 14117771 | УДК: 550.47 | DOI: 10.33619/2414-2948/61/07
Текст научной статьи Оценка буферной емкости модельных систем и природных вод экспериментальным и расчетным методами
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 550.47
Северные регионы страны требуют большого внимания в связи с увеличением хозяйственной и прочей деятельности человека на данной территории. Природные водные объекты подвергаются наибольшему пагубному воздействию, из-за свойства накапливать почти все виды загрязнения, которые образуются при деятельности человека.
Количество таких загрязнений, как оксиды азота и серы, неуклонно увеличивается. Это ведет к образованию «кислотных дождей», которые подкисляют природную воду, что имеет последствия для всего водоема в целом.
Поэтому, особую актуальность приобретают исследования, направленные на разработку простых способов оценки буферных свойств пресноводной экосистемы по отношению к природному и антропогенному закислениям.
Общая буферная емкость природных вод рассчитана как сумма гидрокарбонатной и гумусовой буферной емкости [2]. На основании полученных данных выявлены наиболее устойчивые и уязвимые к закислению водные объекты.
Буферные качества природных вод связаны с содержанием анионов слабых кислот и их способностью к связыванию поступающих в воды протонов. Карбонаты, гидрокарбонаты и анионы гумусовых кислот выступают главными компонентами природных буферных систем. Природные системы предусматривают равновесия, какое-либо смещение которых осуществляется во время изменения значения кислотности воды:
СО 3 2- + Н+ ↔ НСО 3 -
НСО 3 - + Н+ ↔ Н 2 СО 3
Hum- + H+ ↔ HHum
Смещение равновесия в этих системах происходит при изменении кислотности среды и зависит от природы кислоты. Угольная кислота имеет значения констант кислотности: К1= 4,3×10-7, рК1=6,35; К2=4,7×10-11, рК2=10,3 [1], для гумусовых кислот значение константы изменяется в соответствии с их природой, но всегда указанные кислоты будут сильнее, чем угольная, их константы диссоциации находятся в интервале 2–4. Для определения буферной емкости природных вод необходимо знать равновесные концентрации всех форм кислотноосновных компонентов природных систем при том значении рН, которое характерно для водной среды. Для расчета равновесных концентраций различных форм угольной и гумусовых кислот при известном значении рН можно использовать их мольные доли [3].
В виде объектов для проведения анализа выбраны 11 проб воды из различных мест одной водной системы — Обской губы (Рисунок 1).
Упомянутый залив находится в Западной Сибири, в арктической зоне Тюменской области. Пробы воды отбирались работниками научного центра исследования Арктики (г. Надым) в апреле 2020 года. Отбор проб осуществлялся из-под льда. При этом место отбора проб 1, 2, 3, 8, и 9 располагается возле поселка «Мыс Каменный». Возле поселка «Новый порт» брались пробы 4, 7, 10. Пробы 5, 6, 11 отбирались ближе к южной части Обской губы (N 66,81528 E 72,26306), на данной территории нет крупных населенных пунктов. 7 проб отбирались с поверхности водоема (с 1 по 7) и 4 пробы придонной воды (с 8 по 11).
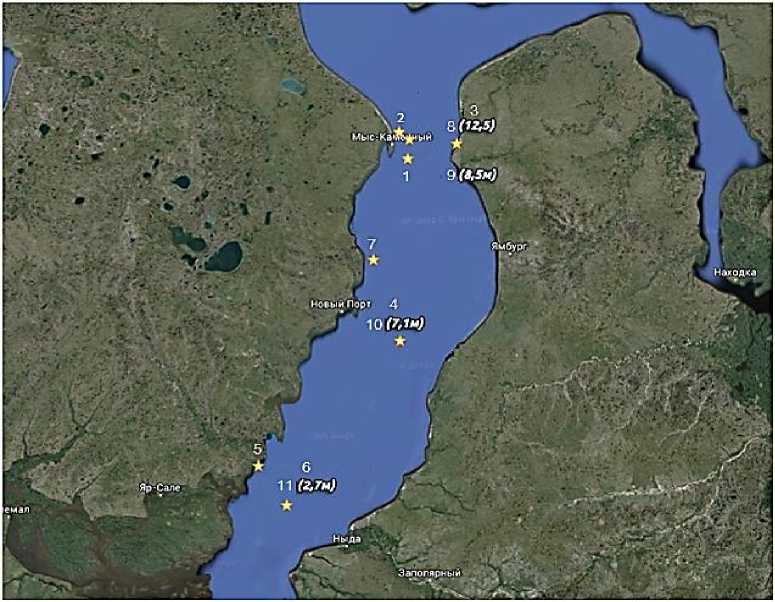
Рисунок 1. Изображение водного объекта — Обская губа, и размещение мест отбора проб.
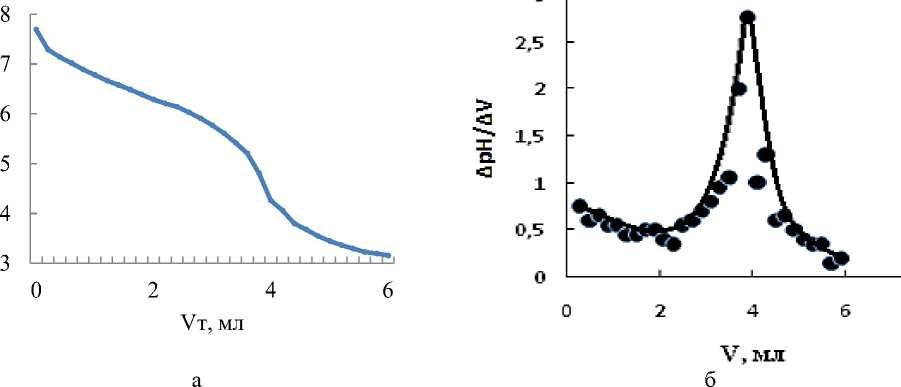
Чтобы определить значение буферной емкости природных вод с помощью расчетного и графического метода требуется определить pH и уровень концентрации гидрокарбонат-ионов. Для определения pH воспользовались методикой прямой потенциометрии, чтобы определить содержание гидрокарбонат-ионов, воспользовались методикой элементного анализа и потенциометрического титрования. Кривые титрования (дифференциальная и интегральная), графические зависимости, позволяющие определить буферную емкость пробы №1, представлены на Рисунке 2.
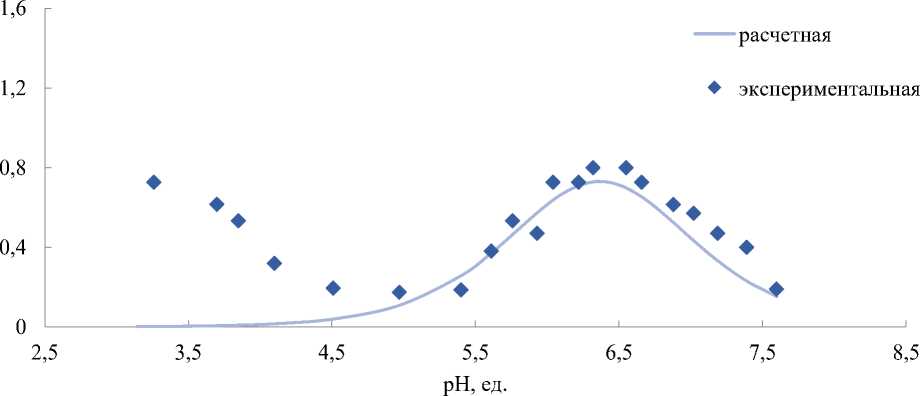
Итоги буферной емкости, рассчитанные с помощью расчетной и экспериментальной методики, продемонстрировали хорошее совпадение значений, разница показателей буферной емкости (pH=6,4) не больше 5– 11%.
Критическое значение буферной емкости, по теоретическим материалам, равняется 0,015 ммоль/дм3. Получившиеся значения буферной емкости говорят о довольно высоком уровне устойчивости вод Обской губы к поступлению различных кислотообразующих веществ.
В результате анализа кривых титрования систем не были выявлены скачки в сфере pH меньше 4,5. Соответственно, в рассматриваемой природной воде, с помощью методики потенциометрического титрования, наличие каких-либо органических кислот не подтверждено. Разница между концентрациями гидрокарбонат-ионов в системах до и после добавления добавки совпало со значением уровня концентрации гидрокарбонат-ионов в добавках (в рамках погрешности).
Значения буферной емкости, определенные с помощью расчетной и экспериментальной методик, продемонстрировали хорошее совпадение сведений, выявленная разница между значениями буферной емкости (pH=6,4) не больше 10%.
в
Рисунок 2. Кривые титрования природной воды (проба №1) соляной кислотой: точки — экспериментальные данные, линии — расчетные данные (а); дифференциальная кривая титрования природной воды (проба №1) (б); Зависимость буферной емкости природной воды от pH: точки — экспериментальные данные; линии — расчетные данные (в).
Список литературы Оценка буферной емкости модельных систем и природных вод экспериментальным и расчетным методами
- Потапова И. Ю. Оценка устойчивости водных объектов Карелии к закислению по буферной емкости и кислотонейтрализующей способности // Водная среда Карелии: исследование, использование, охрана: Материалы II республиканской школы-конференции молодых ученых (20-21.02.2006). Петрозаводск: КарНЦ РАН, 2006. 98 с.
- Горлевских О. Г. Аналитическая химия и физико-химические методы анализа. Объемный титриметрический анализ. М.: Огни, 2018. 12 c.
- Сидоренко М. Л. Анализ воды по микробиологическим показателям. М.: LAP Lambert Academic Publishing, 2018. 88 c.


