Оценка фагоцитарной активности клеток крови тиляпии в условиях индуцированного гормонами стресса
Автор: Березина Дарья Игоревна
Журнал: Молочнохозяйственный вестник @vestnik-molochnoe
Рубрика: Сельскохозяйственные и ветеринарные науки
Статья в выпуске: 3 (43), 2021 года.
Бесплатный доступ
Работа посвящена изучению фагоцитарной способности клеток крови нильской тиляпии Oreochromis niloticus L. под влиянием гормональной индукции стресса различной продолжительности. В нативных мазках выявлено, что Staphylococcus aureus подвергается фагоцитированию как лейкоцитами, так и тромбоцитами и эритроцитами крови тиляпий. Проведена количественная оценка фагоцитарной способности этих клеток. Установлено, что длительное воздействие стресса обладает иммуносупрессивным влиянием на фагоцитарную активность лейкоцитов и иммуностимулирующим влиянием на фагоцитарную активность эритроцитов (60 мин. инкубации) к концу эксперимента по сравнению с другими группами. Кратковременное воздействие стресса повышает активность лейкоцитов и снижает активность эритроцитов (60 мин. инкубации) в течение 7-ми дней после воздействия.
Фагоцитарная активность, рыбы, стресс, кровь, лейкоциты, тромбоциты, эритроциты
Короткий адрес: https://sciup.org/149138113
IDR: 149138113 | УДК: 639.215.2:574.24./625 | DOI: 10.52231/2225-4269_2021_3_37
Текст научной статьи Оценка фагоцитарной активности клеток крови тиляпии в условиях индуцированного гормонами стресса
Актуальность
Стресс у культивируемых рыб является все более изучаемой темой из-за его влияния на рост [1], размножение [2], функционирование защитных систем: иммунитета и гемостаза [3] и, в конечном счете, на приспособленность животного. Наиболее полно влиянию стресса на восприимчивость рыб к болезням и функционированию иммунной системы посвящены работы G.A. Wedemeyer [4] и L. Tort [5]. Влияние синтетических гормонов (дексаметазон и гидрокортизон) на структуру и функцию иммунной системы некоторых видов рыб подробно описаны в работе Д.В. Микрякова [6].
При оценке реакции клеточного звена иммунитета рыб на различные виды стресса в первую очередь необходимо обратить внимание на наиболее филогенетически древний неспецифический врожденный фактор иммунной защиты ‒ фагоцитарную активность клеток крови. Фагоцитоз характерен для нейтрофилов, моноцитов крови и макрофагов в почках, селезенке, тимусе, печени, лейдиговом органе, стенках кишечника [7]. Фагоцитарная активность лейкоцитов рыб зависит от температуры среды [8]. У рыб в определенных условиях отмечают фагоцитоз эритроцитов [9; 10] благодаря тому, что они имеют сходные с клетками белой крови изменения в цитоскелете [11], а также тромбоцитов [8], причем именно сенсибилизированные лейкоциты активизируют фагоцитоз тромбоцитов благодаря растворимым факторам [12]. Имеющиеся данные говорят о снижении способности фагоцитировать бактерии под воздействием стресс-реакции у лейкоцитов в результате температурного воздействия [13], снижения кислотности среды [14], введения кортизола [15], увеличения плотности посадки [16]. Другие эксперименты отмечают усиление фагоцитарной активности лейкоцитов и эритроцитов рыб, вместе с коагуляцией, в результате комбинированного стресса [17], изменения солевого состава воды [18] и метеорологических параметров [19]. У тиляпии количественно охарактеризовано увеличение фагоцитарной способности эритроцитов к определенным патогенам в результате гипо- и гипертермического воздействия [20].
Иммуносупрессия, оцененная по косвенным признакам (устойчивость к заражению) была вызвана введением такого синтетического кортикостероида, как триамцинолон [21]. Другие авторы [22] обнаружили, что даже незначительное хроническое повышение уровня кортизола снижает сопротивляемость рыб к болезням, вероятно, из-за нарушения функций как В-, так и Т-лимфоцитов, и это часто связано со снижением устойчивости к патогенам (бактериям, грибам, простейшим или вирусам) или экспериментальному заражению [3].
Данные о количественном анализе фагоцитарной активности различных клеток крови тиляпии под влиянием синтетических кортикостероидов в литературе отсутствуют.
Целью работы было изучение изменений фагоцитарной способности ядерных клеток крови (эритроцитов, лейкоцитов) тиляпии в условиях длительной и кратковременной гормональной индукции.
Материалы и методы
Работа выполнена в центре развития аквакультуры «АкваБиоЦентр» Вологодской ГМХА имени Н.В. Верещагина в рамках реализации гранта РФФИ №19-3490109 («Аспиранты»).
Эксперимент проводили на 30 тиляпиях Oreochromis niloticus L. Рыб каждого вида в соответствии с видом гормонального воздействия предварительно раздели- ли на группы (таблица): рыбы с имитацией острого стресса (первая экспериментальная группа), рыбы с имитацией хронического стресса (вторая экспериментальная группа) и контрольные животные. Для имитации острого стресса использовали дексаметазон-фосфат (4 мг/мл) [23], который метаболизируется в течение 4 часов. Животных однократно обрабатывали Дексаметазоном (Эллара, Россия) путем парентеральных инъекций в дозе 0,2 мл или 0,8 мг активного вещества дексамета-зон-фосфата на особь. В качестве глюкокортикоида, имитирующего хронический стресс, однократно применяли суспензию бетаметазона (2,63 мг бетаметазона натрия фосфата + 6,43 мг бетаметазона дипропионата/мл), период выведения которого более 10 дней. Рыбам инъецировали Дипроспан (Schering-Plough Labo N.V., Бельгия) по 0,5 мл на особь, что соответствует 3,5 мг активного вещества, доза которого была определена экспериментальным путем по нормам вещества на массу, установленным в инструкции. Контрольная группа оставалась интактной.
Рыб содержали в экспериментальной установке с обеспечением непрерывной циркуляции воды между аквариумами и принудительной аэрацией при температуре воды 28-30◦C, режим кормления ‒ 1 раз в сутки гранулированным кормом. Перед забором крови рыб анестезировали при помощи добавления в воду гвоздичного масла в дозе 0,033 мл/л [24] с последующей выдержкой в ней 15 минут.
Для оценки состояния клеточного иммунитета определяли фагоцитарную активность (ФА) клеток крови (эритроцитов, лейкоцитов, тромбоцитов) к Staphylococcus aureus согласно общепринятой методики [25].
Полученные в ходе исследования результаты обрабатывались с помощью программного обеспечения Microsoft Excel и STATISTICA 12.0. Значения полученных результатов в работе представлены в виде средней величины и стандартной ошибки средней (M±m). Достоверность различий показателей крови для множественных независимых выборок определяли с помощью критерия Кроскелла–Уоллеса, для парных зависимых выборок использовали критерий Вилкоксона. Результаты исследования со значением вероятности допущения альфа-ошибки, равные либо менее 5% (р < 0,05), расценивались как статистически значимые. Различие двух показателей считали достоверным, если оно равнялось или превышало свою среднюю ошибку разности в два и более раз.
Результаты
В результате проведенных исследований был зафиксирован факт фагоцитирования Staphylococcus aureus как лейкоцитами, так и эритроцитами в нативных мазках крови тиляпий (рисунок) , а также количественно охарактеризована фагоцитирующая способность этих клеток в зависимости от времени действия гормо-ниндуцированного стресса (см. таблицу).
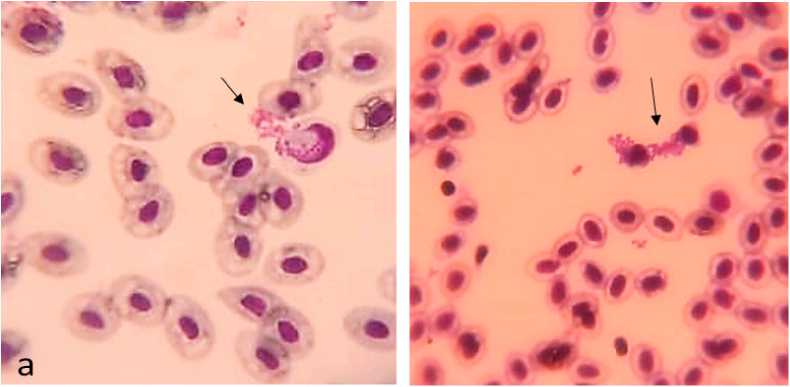
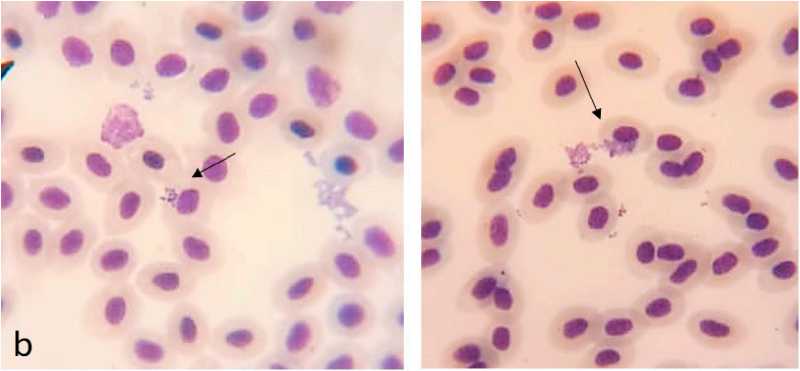
Рисунок. Процесс фагоцитирования стафилококка лейкоцитами (a) и эритроцитами (b) у тиляпий
Фагоцитарная активность (ФА) – процент лейкоцитов (нейтрофилов, моноцитов, лимфоцитов), способных к связыванию с патогенной микрофлорой и ее перевариванию.
Стоит отметить снижение ФА лейкоцитов у рыб с модуляцией хронического стресса, в отличие от рыб других групп, при 30-ти минутной инкубации на 50% к концу эксперимента по сравнению с исходным значением, тогда как этот показатель у рыб в других группах повысился за тот же период на 19,7‒33,3%.
Динамика ФА лейкоцитов при 60-минутной инкубации у рыб во всех группах оставалась сходной.
ФА лейкоцитов количественно в контрольной и второй экспериментальной группах достигала своего максимума в первый день эксперимента спустя 120 минут инкубации с патогеном, затем, сохраняя отрицательную динамику, снизилась на 70 и 20% соответственно к последнему дню эксперимента. Напротив, ФА лейкоцитов первой экспериментальной группы достигла максимума при таком же времени инкубации на 7-й день на 72,7%, что говорит о краткосрочном иммуностимулирующем эффекте обработки, затем снизилась на 36,8% к концу эксперимента, оставаясь при этом на 9% больше относительно изначального значения.
Из вышеизложенных данных можно заключить, что наиболее деструктивно хронический стресс влияет на начальную ФА лейкоцитов по сравнению с другими группами, тогда как острый стресс имеет сильный иммуностимулирующий эффект на конечную ФА лейкоцитов, длящийся в пределах семи дней.
Анализируя динамику ФА эритроцитов, максимум активности этих клеток крови выявлялся спустя 30 минут инкубации в контрольной группе, затем, претерпев кратковременный спад на 47,2%, она снизилась на 30,5% к концу эксперимента по отношению к исходному. Аналогичная динамика (на 63,2 и 36,7% соответственно) отмечается и у эритроцитов под влиянием острого стресса. Падение активности у эритроцитов второй группы рыб к 21-му дню происходило прямолинейно и составило 49,2%.
Наименьшую активность спустя 60 минут инкубации можно отметить у эритроцитов первой группы рыб, упавшую на 38,2% спустя 7 дней эксперимента и восстановившуюся к его концу. ФА эритроцитов у рыб второй группы при таком же времени инкубации, наоборот, сильно повысилась к 7-му дню на 63,2% и оставалась выше на 47,3% к 21-му дню по сравнению с исходным значением. Эта динамика указывает на острое иммунносупрессивное влияние кратковременного стресса к середине эксперимента и иммуностимулирующее действие хронического стресса к его концу относительно фагоцитарной активности эритроцитов рыб при часовой инкубации их с патогенами.
Значительных изменений ФА эритроцитов при 120-минутной инкубации с патогеном выявлено не было.
Выводы
Таким образом, можно сделать вывод, что у тиляпий в условиях хронического стресса, вызванного синтетическими кортикостероидами, наиболее четко можно проследить его иммуносупрессивное влияние на конечную фагоцитарную активность лейкоцитов и иммуностимулирующее влияние на срединную фагоцитарную активность эритроцитов по сравнению с другими группами к концу эксперимента.
Острый стресс, напротив, стимулирует конечную фагоцитарную активность лейкоцитов и снижает срединную активность эритроцитов в течение недели после воздействия.
Таблица. Динамика параметров фагоцитоза лейкоцитов, эритроцитов и тромбоцитов тиляпий в ходе эксперимента
|
Показатель |
До обработки |
7-й день |
21-й день |
|||||||
|
контроль-ная группа (n=10) |
первая экспе-римен-таль-ная группа (n=10) |
вторая экспе-римен-таль-ная группа (n=10) |
контроль-ная группа (n=10) |
первая экспе-римен-таль-ная группа (n=10) |
вторая экспе-римен-таль-ная группа (n=10) |
контроль-ная группа (n=10) |
первая экспе-римен-таль-ная группа (n=10) |
вторая экспе-римен-таль-ная группа (n=10) |
||
|
30 минут |
||||||||||
|
ФА лейкоцитов, % |
1,67± 0,67 |
1,50± 0,50 |
2,00± 1,00 |
2,25± 0,63 |
1,50± 0,50 |
2,00± 0,41 |
2,00± 0,00 |
2,00± 0,58 |
1,00 |
|
|
ФА эритроцитов, % |
14,40± 2,50#bc |
9,80± 2,58bc |
10,50± 2,18 |
7,60± 1,60# |
3,60± 0,40*c |
8,75± 1,75 |
10,00± 2,45 |
6,20± 0,37 |
5,33± 0,33 |
|
|
Показатель |
До обработки |
7-й день |
21-й день |
||||||
|
контроль-ная группа (n=10) |
первая экспе-римен-таль-ная группа (n=10) |
вторая экспе-римен-таль-ная группа (n=10) |
контроль-ная группа (n=10) |
первая экспе-римен-таль-ная группа (n=10) |
вторая экспе-римен-таль-ная группа (n=10) |
контроль-ная группа (n=10) |
первая экспе-римен-таль-ная группа (n=10) |
вторая экспе-римен-таль-ная группа (n=10) |
|
|
60 минут |
|||||||||
|
ФА лейкоцитов, % |
1,10± 0,37bc |
1,63± 0,55 |
1,50± 0,29 |
2,25± 0,63 |
2,00± 1,00 |
2,33± 0,88 |
2,00± 0,41 |
1,80± 0,58 |
1,67± 0,67 |
|
ФА эритроцитов, % |
6,60± 1,08 |
6,80± 0,66 |
4,75± 0,85b |
6,20± 0,73 |
4,20± 1,02*c |
7,75± 1,31 |
7,75± 0,48 |
6,60± 0,68 |
7,00± 1,53 |
|
120 минут |
|||||||||
|
ФА лейкоцитов, % |
5,00± 1,64c |
2,75± 0,63 |
2,50± 0,87 |
4,40± 1,03c |
4,75± 0,85*c |
2,25± 0,63 |
1,50± 0,50 |
3,00± 0,71 |
2,00± 0,58 |
|
ФА эритроцитов, % |
5,80± 0,80 |
5,20± 1,07b |
4,50± 1,26 |
4,80± 0,97c |
3,80± 0,66 |
5,25± 0,48 |
8,00± 1,47# |
3,60± 0,87 |
4,33± 0,33 |
|
#Различия с показателем первой экспериментальной группы в тот же день эксперимента достоверны (p≤0,05). *Различия с показателем второй экспериментальной группы в тот же день эксперимента достоверны (p≤0,05). b Различия с аналогичным показателем аналогичной группы на 7-й день эксперимента достоверны (p≤0,05). с Различия с аналогичным показателем аналогичной группы на 21-й день эксперимента достоверны (p≤0,05). |
|||||||||
Список литературы Оценка фагоцитарной активности клеток крови тиляпии в условиях индуцированного гормонами стресса
- Van Weerd, J.H., Komen, J. The effects of chronic stress on growth in fish: a critical appraisal. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 1998, no. 120(1), pp. 107‒112.
- Reid, S.G., Bernier, N.J., Perry, S.F. The adrenergic stress response in fish: control of catecholamine storage and release. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology, 1998, no. 120(1), pp. 1‒27.
- Berezina, D.I, Fomina, L.L. Effect of hormone-induced stress on carp (Сyprinus carpio) coagulogram. Periodico Tche Quimica, 2020, no. 17(36), pp. 346‒356.
- Wedemeyer, G.A., Meyer, F.P., Smith, L. Environmental stress and fish diseases. Neptune City: T.F.H. Publications, 1976. 192 p.
- Tort, L. Stress and immune modulation in fish. Developmental & Comparative Immunology, 2011, no. 35(12), pp. 1366‒1375.
- Микряков, Д.В. Влияние некоторых кортикостероидных гормонов на структуру и функцию иммунной системы рыб: автореферат дис. ... кандидата биологических наук : 03.00.10, 14.00.36 / Д. В. Микряков. ‒ М., 2004. ‒ 24 с.
- Аминева, В.А. Физиология рыб: учеб. для высш. спец. учеб. заведений / В.А. Аминева, А.А. Яржомбек. ‒ М. : Лег. и пищ. пром-сть, 1984. ‒ 200 с.
- Ботяжова, О.А. Физиология системы крови: сравнительные, экологические и эволюционные аспекты: учеб. пособие / О.А. Ботяжова. ‒ Ярославль: Ярославский гос. ун-т, 2000. – 60 с.
- Березина, Д.И. Динамика фагоцитарной активности эритроцитов рыб под воздействием эндогенного и синтетического кортизола / Д. И. Березина, Л. Л. Фомина // Молодежная наука ‒ развитию агропромышленного комплекса : мат-лы Всеросс. (нац.) науч.-практ. конф. студ., асп. и мол. уч., Курск, 3–4 декабря 2020 года. – Курск: Курская ГСХА им. И.И. Иванова, 2020. – С. 401‒405.
- Чернявских, С.Д. О способности к фагоцитозу и фагоцитарной активности ядерных эритроцитов холоднокровных (на примере Rana ridibunda и Cyprinus carpio) / С.Д. Чернявских, Д.Х. Кует, И.С. Буковцова, В.В. Тхань // Научные ведомости Белгородского государственного университета. Серия: Естественные науки. – 2016. – Т. 35. – № 11 (232).
- Chernyavskikh, S.D., Fedorova, M.Z., Van Thanh, V. Reorganization of actin cytoskeleton of nuclear erythrocytes and leukocytes in fish, frogs, and birds during migration. Cell and Tissue Biology, 2012, no. 6(4), pp. 348‒352.
- Nagasawa, T., Somamoto, T., Nakao, M. Carp thrombocyte phagocytosis requires activation factors secreted from other leukocytes. Developmental & Comparative Immunology, 2015, no. 52 (2), pp. 107‒111.
- Chen, W.H., Sun, L.T., Tsai, C.L., Song, Y.L., Chang, C.F. Cold-stress induced the modulation of catecholamines, cortisol, immunoglobulin M, and leukocyte phagocytosis in tilapia. General and comparative endocrinology, 2002, no. 126(1), pp. 90‒100.
- Nagae, M., Ogawa, K., Kawahara, A., Yamaguchi, M., Nishimura, T., Ito, F. Effect of acidification stress on endocrine and immune functions in carp, Cyprinus carpio. Water, Air, and Soil Pollution, 2001, no. 130(1), pp. 893‒898.
- Law, W.Y., Chen, W.H., Song, Y.L., Dufour, S. and Chang, C.F., 2001. Differential in vitro suppressive effects of steroids on leukocyte phagocytosis in two teleosts, tilapia and common carp. General and Comparative Endocrinology, 121(2), pp.163-172.
- Ortuno, J., Esteban, M.A., Meseguer, J. Effects of short-term crowding stress on the gilthead seabream (Sparus aurata L.) innate immune response. Fish & shellfish immunology, 2001, no. 11(2), pp.187‒197.
- Ruis, M.A., Bayne, C.J. Effects of acute stress on blood clotting and yeast killing by phagocytes of rainbow trout. Journal of aquatic animal health, 1997, no. 9(3), pp. 190‒195.
- Адамова, В.В. Морфофункциональные особенности ядерных эритроцитов и лейкоцитов Cyprinus carpio и Rana ridibundа в условиях умеренной гипотонии / В.В. Адамова., С.Д. Чернявских // Региональные геосистемы. – 2013. – Вып. 23. ‒ № 10 (153). – С. 103‒106.
- Поглотительная способность ядерных гемоцитов Cyprinus carpio L. и Rana ridibunda Pall. в разные сезоны года / И.С. Буковцова, С.Д. Чернявских, Кует До Хыу, Тхань Во Ван // Региональные геосистемы. – 2013. – Вып. 24. ‒ № 7(160). – С. 86‒91.
- Тхань Во Ван. Действие температурного фактора на фагоцитарную активность ядерных эритроцитов Oreochromis sp. / Тхань Во Ван, С.Д. Чернявских, Кует До Хыу; Международный Научный Институт «Educatio». – 2015. ‒ № 6 (13). – С. 6‒7.
- Houghton, G., Matthews, R.A. Immunosuppression of carp (Cyprinus carpio L.) to ichthyophthiriasis using the corticosteroid triamcinolone acetonide. Veterinary Immunology and Immunopathology, 1986, no. 12(1‒4), pp. 413‒419.
- Pickering, A.D., Pottinger, T.G. Stress responses and disease resistance in salmonid fish: effects of chronic elevation of plasma cortisol. Fish physiology and biochemistry, 1989, no. 7(1), pp. 253‒258.
- Балабанова, Л. В. Реакция лейкоцитов карпа Cyprinus carpio на гормониндуцируемый стресс / Л.В. Балабанова, Д.В. Микряков, В.Р. Микряков // Биология внутренних вод. – 2009. – № 1. – С. 91.
- Hamackova, J., Kouril, J., Kozak, P., Stupka, Z. Clove oil as an anaesthetic for different freshwater fish species. Bulgarian Journal of Agricultural Science, 2006, no. 12(2), p. 185.
- Методические указания по определению уровня естественной резистентности и оценке иммунного статуса рыб № 113-4-2 / 1795 от 25.11.99. ‒ М. : Минсельхозпрод, 1999.


