Оценка генетического разнообразия в популяциях тувинских лошадей по локусам систем крови и микросателлитным ДНК
Автор: Чысыма Р.Б., Храброва Л.А., Зайцев А.М., Макарова Е.Ю., Федоров Ю.Н., Луду Б.М.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Структура генома и генетическое разнообразие
Статья в выпуске: 4 т.52, 2017 года.
Бесплатный доступ
Тувинская лошадь - одна из перспективных местных пород универсального назначения. Она хорошо приспособлена к условиям круглогодичного пастбищного содержания, устойчива к заболеваниям и требует минимальных затрат при производстве мяса. Генетические процессы в популяции тувинских лошадей, имеющих древнее происхождение и эволюционирующих в условиях относительной географической изоляция, представляют несомненный научный интерес. Аллелофонд тувинской породы изучали в 2009-2016 годах в базовых хозяйствах Тувинского НИИ сельского хозяйства (ГУП «Бай-Тал» и КФХ «Биче-Шивилиг, Бай-Тайгинский и Кызыльский районы, Республика Тыва). Исследовали пробы крови ( n = 32) и образцы волоса ( n = 35); выполнение анализов сертифицировано Международным обществом по генетике животных (International Society of Animal Genetics, ISAG). Исследования показали, что лошади тувинской породы характеризуются значительной генетической изменчивостью по структурным генам и микросателлитной ДНК. Высокую степень полиморфности выявили в локусах трансферрина, альбумина, эстеразы и особенно в системе D групп крови. Сравнительно высокую частоту встречаемости отмечали у аллелей Dcgm, Dbcm и Dd, относительно редкими были аллели Dad, Dde и Ddk. При исследовании полиморфизма микросателлитной ДНК у тувинских лошадей в 17 локусах было обнаружено 113 аллелей (в среднем 6,65 аллеля на локус), что свидетельствует о высоком генетическом разнообразии в этой породе. В ряде локусов выявили редкие аллели VHLP, АНТ4P, HMS7J, ASB23L, ASB2B, HMS3N, ASB17Q, LEX3K и LEX3P, HMS1I, HMS1N, а также HMS1R, который не обнаружен в популяциях лошадей европейского происхождения (L.H.P. Van de Goor с соавт., 2010). В изученных микросателлитных локусах имелось от 4 до 9 аллелей, среднее число эффективных аллелей на один локус (Ае) составило 4,20, что считается достаточно высоким показателем даже для местных пород лошадей. Наиболее разнообразным спектром аллелей были представлены локусы ASB17 (10 аллелей), АНТ4, VHL20 и ASB2 (по 9 аллелей) и ASB23 (8 аллелей). При генетико-популяционном анализе подтвердилось хорошее соответствие показателей наблюдаемой (Но = 0,748) и ожидаемой (Не = 0,742) гетерозиготности и отсутствие внутрипородного инбридинга (Fis = -0,008). Наибольшее генетическое сходство проявилось между тувинской и хакасской (0,823), а также тувинской и монгольской (0,822) лошадьми, ареалы которых граничат на юге и юго-востоке. Общность происхождения тувинских и монгольских лошадей, которые образуют одну общую ветвь в древе эволюции конских пород, подтверждают и данные полногеномного ассоциативного анализа (J.R. Mickelsn с соавт., 2012). Полученные результаты свидетельствует о высокой генетической пластичности тувинской породы. В целом обследованная популяция тувинских лошадей характеризуется оригинальным аллелофондом, включающим ряд редких аллелей, которые важно сохранить в породе при дальнейшем разведении.
Генетическое разнообразие, микросателлиты днк, полиморфные системы крови, популяционный анализ, тувинская лошадь
Короткий адрес: https://sciup.org/142214062
IDR: 142214062 | УДК: 636.1:575.17(571.52) | DOI: 10.15389/agrobiology.2017.4.679eng
Текст научной статьи Оценка генетического разнообразия в популяциях тувинских лошадей по локусам систем крови и микросателлитным ДНК
Отечественные заводские и локальные породы лошадей, хорошо приспособленные к местным природно-климатическим условиям и устойчивы к заболеваниям, часто обладают уникальным аллелофондом, который представляет собой значительный селекционный резерв (1).
Генетические маркеры позволяют осуществлять мониторинг генеалогической структуры популяций, подбор и отбор животных для селекционных программ с учетом генотипа (2-5). С помощью микросателлитного анализа изучен генофонд, состав популяций, филогенетические связи у ряда уникальных отечественных пород лошадей — хакасской и других аборигенных сибирских (6-8), буденновской (9), башкирской (10) и карачаевской (11). Микросателлиты применяют для молекулярно-генетического сравнения линий и семейств (12, 13), оценки генетического разнообразия (14, 15) и стабильности пород (16), при маркировании генотипов, контроле 679
происхождения (17-19), изучении потоков генов (20). Микросателлиты могут сочетаться с маркерами полиморфизма структурных или митохондриальных генов (17, 21, 22). Системы групп крови благодаря кодоминантному типу наследования антигенных факторов, широкому полиморфизму и сравнительно легкому определению (23, 24) также остаются важными маркерами в популяционных исследованиях (25-28).
Тувинская лошадь ( Equus ferus caballis ), которая по происхождению родственна, но по размерам несколько крупнее монгольской, ценится за приспособленность к круглогодичному пастбищному содержанию в табунах на подножном корме без подкормки и помещений. Она устойчивее к абиотическим и биотическим стрессорам, в том числе патогенам, и мало подвержена заболеваниям (29). В коневодческих хозяйствах республики содержится 68,1 тыс. гол. (30). Основное направление их использования — мясное, средняя живая масса кобыл к концу пастбищного периода — 316±7,2 кг. В структуре поголовья доля кобыл — 35,2-42,5 %, выход жеребят — 58 гол/100 маток (31). Производство конины почти в 3 раза дешевле говядины, что (наряду с наличием благоприятных условий и спроса) определяет целесообразность разведения местных лошадей и повышения их мясной продуктивности, которая сравнительно невелика. В то же время важно сохранить ценные приспособительные качества породы. Поэтому в селекционно-племенной работе необходимо учитывать не только фенотип, но и генотипические характеристики животных.
Отметим, что иммуногенетическим признакам лошадей Тувы посвящена одна работа, в которой изучали системы полиморфных белков крови (24), и только в последнее время началось тестирование по локусам микросателлитов ДНК. Мы впервые в комплексном исследовании популяции тувинской лошади проанализировали сочетание иммуногенетических маркеров (полиморфные белки — трансферрин, альбумин, эстераза; системы групп крови) с молекулярными (микросателлиты ДНК), что позволяет значительно расширить круг маркеров для генетико-селекционных программ.
Целью настоящей работы стало изучение и анализ генетической структуры популяции тувинской лошади по распространенности локусов полиморфных систем крови и полиморфизму микросателлитов ДНК.
Методика . Исследования выполняли в 2009-2016 годах в базовых хозяйствах Тувинского НИИ сельского хозяйства — ГУП «Бай-Тал» и КФХ «Биче-Шивилиг» (Бай-Тайгинский и Кызыльский районы, Республика Тыва) на лошадях ( Equus feru scaballis ) тувинской породы . Биоматериалом служили пробы крови ( n = 32) и образцы волоса с волосяной луковицей ( n = 35). При отборе лошадей для исследования оценивали экстерьер, масть, живую массу и наличие аборигенных признаков. Животных весь год содержали на подножном корме.
Генотипы по локусам белков и ферментов сыворотки крови определяли при горизонтальном электрофорезе в крахмальном геле согласно рекомендациям (32), антигены систем групп крови — в реакции гемагглютинации с моноспецифическими сыворотками производства Всероссийского НИИ коневодства (сертифицирован Международным обществом по генетикe животных — International Society of Animal Genetics, ISAG), идентифицированных с международными эталонами.
ДНК выделяли из волосяных луковиц с применением наборов Di-atomTM DNA Prep и ExtraGeneTM DNA Prep (ООО «Изоген», Москва). Амплификацию проводили с использованием StockMarks for Horses Genotyping Kit Equine («Thermo Fisher Scientific, Inc.», США) в термоциклере 2720 680
Termal Cycler («Applied Biosystems, Inc.», США) с набором праймеров для 17 локусов микросателлитов, рекомендованных ISAG. Электрофорез продуктов амплификации осуществлялся в автоматическом 4-капиллярном генетическом анализаторе 3130 DNA Analyzer («Applied Biosystems, Inc.», США). Расшифровку и документирование результатов выполняли с помощью программного обеспечения GeneMapperTM v. 4.0 («Applied Biosystems, Inc.», США).
Для характеристики аллелофонда определяли среднее число аллелей (Na) и число эффективных аллелей (Ne) в расчете на локус, рассчитывали наблюдаемую (Ho) и ожидаемую (He) гетерозиготность, степень по-лиморфности (Ae). Генное равновесие в популяции, генетическое сходство и генетическое расстояние оценивали общепринятыми методами (33, 34).
Кластерный анализ выполняли на основании расчета генетических дистанций между породами лошадей по частотам встречаемости аллелей микросателлитных локусов по методу M. Nei (34). При сравнении генетической структуры тувинской лошади с другими породами были использованы ранее опубликованные данные (3, 8).
Статистическую обработку данных проводили в программах MS Excel 2003 и Statistica 6 («StatSoft Inc.», США). В таблицах представлены средние ( X ) и стандартные ошибки средней (± х ). Различия между показателями считали статистически значимыми при Р > 0,95.
Результаты. Анализ по системам групп крови ( n = 17) и полиморфным системам белков крови ( n = 15) выявил выраженное породное своеобразие генетической структуры тувинских лошадей, несмотря на небольшое число исследованных животных. В системе трансферрина обнаружили 5 аллелей — TfD , TfF , TfH , TfR и TfO . В аллелофонде популяции преобладал аллель TfF , частота которого составила 0,324; частота аллелей TfH и TfR была практически одинаковой (0,235). Сравнительно редко встречался аллель TfO (0,029). В локусе альбумина выявили 2 аллеля — ALBA и ALBB , при этом преобладал ALBB (0,559). В локусе эстеразы было 3 аллеля — EsF , EsG и EsI . У исследованных лошадей самым распространенным оказался аллель EsI (0,559), относительно реже встречались EsF (0,206) и EsG (0,235).
Мы определили частоту антигенов трех генетических систем крови (А, К и D). По ЕАА системе тувинские лошади были носителями маркера крови Aa (табл. 1). В системе ЕАК у тувинских лошадей обнаружили антигены, указывающие на присутствие аллелей Ka и K - при сравнительно высокой частоте аллеля Kа (0,2941±0,1110).
1. Частота локусов по системам групп крови у тувинских лошадей ( X±x, n = 17, Бай-Тайгинский и Кызыльский районы, Республика Тыва, 2009-2016 годы)
|
Система EAА |
Система TAD |
Система EAK |
|
|
генотип 1 частота |
генотип 1 частота |
генотип 1 |
частота |
|
Aa |
1,00±0,00 |
D ad/d |
0,0588±0,0570 |
Ka |
0,2941±0,1110 |
|
D bcm/dghm |
0,0588±0,0570 |
K - |
0,7059±0,1110 |
||
|
D bcm/cgm |
0,1176±0,0780 |
||||
|
D bcm/d |
0,1176±0,0780 |
||||
|
D cgm/d |
0,0588±0,0570 |
||||
|
D cgm/de |
0,1765±0,0920 |
||||
|
D cgm/dk |
0,0588±0,0570 |
||||
|
D cgm/cgm |
0,0588±0,0570 |
||||
|
D cgm/dghm |
0,2941±0,1110 |
Большое разнообразие отмечалось по частоте антигенных факторов в системе ЕАD. У лошадей эта система групп крови — наиболее сложная (включает 17 антигенов, которые образуют более 30 феногрупп) и считает- ся самой информативной для понимания генезиса пород. Полученные нами данные (см. табл. 1) свидетельствовали о доминировании в местной породе генотипа Dcgm/dghm, частота которого составила 29,41 %. Сравнительно высокую частоту демонстрировали аллели Dcgm, Dbcm и Dd, относительно редкими оказались аллели Dad, Dde и Ddk.
При исследовании полиморфизма микросателлитной ДНК у ту- винских лошадей в 17 локусах обнаружили 113 аллелей, или в среднем 6,65 аллеля на локус, что свидетельствует о высоком генетическом разнообразии в породе (табл. 2). В ряде локусов были выявлены редкие аллели VHLP, АНТ4P, HMS7J, ASB23L, ASB2B, HMS3N, ASB17Q, LEX3K, LEX3P, HMS1I, HMS1N и HMS1R. Следует специально отметить наличие у тувинских лошадей очень редкого аллеля HMS1R (0,014), который не обнаружен в популяциях лошадей европейского происхождения (18).
Тестирование показало, что для тувинских лошадей характерен значительный полиморфизм
2. Частота гетерозиготности ( Нo) по 17 микросателлитным локусам у тувинских лошадей ( X ± x , n = 35, Бай-Тай-гинский и Кызыльский районы, Республика Тыва, 2009-2016 годы)
|
Локус |
Аллели |
Н o |
|
|
число |
набор |
||
|
VHL20 |
9 |
I, J, L, M, N, O, P*, Q, R |
0,771 |
|
HTG4 |
6 |
K, L, M, N, O, P* |
0,600 |
|
AHT4 |
9 |
H, I, J, K, L, M, N, O, P* |
0,857 |
|
HMS7 |
5 |
J*, L, M, N, O |
0,771 |
|
HTG6 |
5 |
G, I*, J, M*,O |
0,714 |
|
AHT5 |
6 |
J, K, L, M, N, O |
0,743 |
|
HMS6 |
5 |
K, L, M, O, P |
0,857 |
|
ASB23 |
8 |
G*, H*, I, J, K, L, S, T, U |
0,857 |
|
ASB2 |
9 |
B*, C*, I*, K, M, N, O, P, Q |
0,800 |
|
HTG10 |
7 |
I*, K, M, O, Q, R, S* |
0,714 |
|
HTG7 |
4 |
K, M, N, O |
0,829 |
|
HMS3 |
6 |
I, M, N*, O, P, Q, R |
0,886 |
|
HMS2 |
5 |
H, I, J, K, L |
0,794 |
|
ASB17 |
10 |
G, I, J, K, L, N, P, Q*, R |
0,943 |
|
LEX3 |
7 |
F, H, I, L, M, N, P |
0,886 |
|
HMS1 |
6 |
I*, J, K, M, N*, R* |
0,514 |
|
CA425 |
6 |
I, K, L, M, N, O |
0,800 |
|
Прим еч ани е. Звездочкой отмечены редкие аллели. |
|||
|
Аллель R, выявленный в локусе HMS1, не встречается |
|||
по ряду микросателлитных локусов. Это свидетельствует о весьма высоком генетическом разнообразии в популяции. В изученных микросателлитных локусах выявили от 4 до 9 аллелей, среднее число эффективных аллелей на локус (Ае) составило 4,20, что считается достаточно высоким показателем даже для местных пород лошадей. Наиболее разнообразный спектр аллелей имели локусы ASB17 (10 аллелей), АНТ4, VHL20 и ASB2 (по 9 аллелей) и ASB23 (8 аллелей). Уникальность генетической структуры тувинской породы была подтверждена результатами кластерного анализа (рис.).
у европейских пород лошадей.
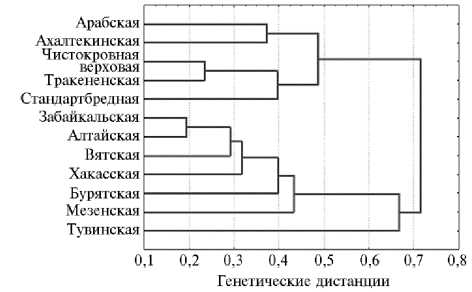
Дендрограмма генетических дистанций по M. Nei между породами лошадей по 17 локусам микросателлитов ДНК (данные В.В. Калашникова с соавт.) (3).
При обследовании лошадей в КФК «Биче-Ши-вилиг» (n = 11) в 9 из 16 изученных микросателлит-ных локусов вывили 12 дополнительных аллелей, которые встречались с частотой < 5 %, что свидетельст- вует о высокой генетической пластичности породы. Среднее значение Но по микросателлитным локусам у тувинских лошадей из этого хозяйства составило 0,721 с колебаниями от 0,480 до 0,960.
Генетико-популяционный анализ продемонстрировал хорошее со- ответствие показателей наблюдаемой (Но = 0,748) и ожидаемой (Не = 0,742) гетерозиготности микросателлитных локусов и отсутствие внутрипородно-го инбридинга у тувинской лошади (FIS = -0,008). При сравнении пород наибольшую степень генетического сходства проявили тувинская и хакасская (0,823) а также тувинская и монгольская (0,822) лошади, ареалы которых граничат на юге и юго-востоке. Общность происхождения тувинских и монгольских лошадей, образующих одну общую ветвь в древе эволюции конских пород, подтверждается и результатами полногеномного ассоциативного анализа (35).
Таким образом, изучение локусов систем крови и микросателлит-ной ДНК показало, что у тувинской лошади проявляется генетическая изменчивость по аллелям как структурных генов, так и микросателлитов. По полиморфности структурных генов выделились локусы трансферрина, альбумина, эстеразы и особенно системы D групп крови, где имелись как часто, так и относительно редко встречающиеся аллели. Полиморфизм мик-росателлитной ДНК в среднем составил 6,65 аллеля на локус, что свидетельствует о высоком генетическом разнообразии в породе. В ряде локусов выявлены редкие аллели и аллель HMS1R, который не встречается у европейских лошадей. Локусы ASB17, АНТ4, VHL20, ASB2 и ASB23 были представлены наиболее разнообразным спектром аллелей. Тувинская лошадь генетически наиболее сходна с хакасской (0,823) и монгольской (0,822), с которыми граничит ареалами. Выявленный оригинальный аллелофонд тувинской лошади, включающий ряд редких аллелей, важно сохранить в породе при дальнейшем разведении и при селекционной работе. Селекционное улучшение тувинской лошади, для которой характерна генетическая пластичность, представляется весьма перспективным.
Список литературы Оценка генетического разнообразия в популяциях тувинских лошадей по локусам систем крови и микросателлитным ДНК
- Храброва Л.А., Зайцев А.М., Юрьева И.Б., Вдовина Н.В. Методические рекомендации по ведению генетического мониторинга местных пород лошадей. Дивово, 2005.
- Эрнст Л.К., Зиновьева Н.А. Биологические проблемы животноводства в ХХI веке. М., 2008.
- Калашников В.В., Храброва Л.А., Зайцев А.М., Зайцева М.А., Калинкова А.А. Полиморфизм микросателлитной ДНК у лошадей заводских и локальных пород. Сельскохозяйственная биология, 2011, 2: 41-45.
- Зиновьева Н.А., Костюнина О.В., Гладырь Е.А., Банникова А.Д., Харзинова В.Р., Ларионова П.В., Шавырина К.М., Эрнст Л.К. Роль ДНК-маркеров признаков продуктивности сельскохозяйственных животных. Зоотехния, 2010, 1: 8-10.
- Зайцев А.М., Калашников В.В., Ковешников В.С. Проблемы и перспективы развития местных пород лошадей России. Мат. I Всерос. науч.-практ. конф. с межд. участием «Аборигенные породы лошадей: их роль и место в коневодстве Российской Федерации». Ижевск, 2016: 51-55.
- Дергунова М.М., Коломеец Ю.Ю., Храброва Л.А. Молекулярно-генетические особенности Хакасской лошади. Коневодство и конный спорт, 2012, 6: 8-9.
- Кузнецова М.М. Генетическая структура и филогенетические связи аборигенных пород лошадей Западной Сибири. Канд. дис. Дубровицы, 2011.
- Храброва Л.А. Молекулярно-генетическая характеристика местных пород лошадей России. Мат. Межд. конф. «Актуальные проблемы животноводства». М., 2009: 92-95.
- Храброва Л.А., Курнявко Н.Ю., Сотникова С.А. Характеристика полиморфизма микросателлитных локусов у лошадей буденовской породы. Коневодство и конный спорт, 2012, 3: 6-8.
- Шириев В.М., Уразбахтин Р.Ф., Гайнуллина К.П. Исследование полиморфизма микросателлитной ДНК у лошадей башкирской породы. Вестник российской сельскохозяйственной науки, 2014, 5: 13-15.
- Эркенов Т.А., Глазко В.И. Подбор молекулярно-генетических маркеров для выявления особенностей генетической структуры карачаевской лошади. Интеграл, 2013, 3: 36-38.
- Храброва Л.А. Сравнительная характеристика аллелофонда местных пород лошадей по ДНК маркерам. Мат. I Всерос. науч.-практ. конф. с межд. участием «Аборигенные породы лошадей: их роль и место в коневодстве Российской Федерации». Ижевск, 2016: 171-177.
- Khrabrova L. Characterization of genetic horse breeding resources in Russia. Lambert Academic Publishing, 2015.
- Ling Y.H., Ma Y.H., Guan W.J., Cheng Y.J., Wang Y.P., Han J.L., Mang L., Zhao Q.J., He X.H., Pu Y.B., Fu B.L. Evaluation of the genetic diversity and population structure of Chinese indigenous horse breeds using 27 microsatellite loci. Anim. Genet., 2011, 42(1): 56-65 ( ) DOI: 10.1111/j.1365-2052.2010.02067.x
- Cunningham E.P. Molecular methods and equine genetic diversity. In: Conservation genetics of endangered horse breeds. EAAP publication No 116. Bled, Slovenia, 2005: 15-24.
- Campana M.G., Stock F., Barrett E., Benecke N., Barker G.W.W., Seetah K., Bower M.A. Genetic stability in the Icelandic horse breed. Animal Genetics, 2011, 43: 447-449.
- Koban E., Denizci M., Aslan O., Aktoprakligil D., Aksu S., Bower M., Balcioglu B.K., Ozdemir Bahadir A., Bilgin R., Erdag B., Bagis H., Arat S. High microsatellite and mitochondrial diversity in Anatolian native horse breeds shows Anatilia as a genetic conduit between Europe and Asia. Anim. Genet., 2011, 43(3): 401-409 ( ) DOI: 10.1111/j.1365-2052.2011.02285.x
- Van de Goor L.H.P., Panneman H., Haeringen W.A. A proposal for standardization in forensic equine DNA typing: allele nomenclature for 17 equine-specific STR loci. Anim. Genet., 2010, 41(2): 122-127 ( ) DOI: 10.1111/j.1365-2052.2009.01975.x
- Мельник О.В., Дзицюк В.В., Спиридонов В.Г. Генетическая дифференциация некоторых пород лошадей Украины по 12 локусам микросателлитам ДНК. Известия Оренбургского ГАУ, 2013, 6(44): 128-131.
- Achmann R., Curik I., Dovc P., Kavar T., Bodo I., Habe F., Marti E., Solkner J., Brem G. Microsatellite diversity, population subdivision and gene flow in the Lipizzan horse. Anim. Genet., 2004, 35: 285-292.
- Luis C., Juras R., Oom M.M., Cothran E.G. Genetic diversity and relationships of Portuguese and other horse breeds based on protein and microsatellite loci variation. Anim. Genet., 2007, 38(1): 20-27.
- Keyser-Tracqui C., Blandin-Frappin P., Francford H.-P., Ricaut F-X., Lepetz S., Crubezy E., Samashev Z., Ludes B. Mitochondrial DNA analysis of horses recovered from a frozen tomb (Berel site, Kazakhstan, 3rd Century BC). Anim. Genet., 2005, 36(3): 203-215.
- Дубровская Р.М., Стародумов И.М., Банникова Л.В. Генетическая дифференциация пород лошадей по полиморфным локусам белков крови. Генетика, 1992, 28(4): 152-165.
- Монгуш А.Н., Ольховская Л.В., Криворучко С.В. Иммуногенетическая характеристика крови тувинских местных лошадей по полиморфизму белков и ферментов. Сб. науч. тр. Всероссийского НИИ овцеводства и козоводства (Ставрополь), 2009, 1(1): 99-100.
- Дергунова М.М., Коломеец Ю.Ю., Храброва Л.А. Основные популяционно-генетические характеристики хакасских лошадей по системам полиморфных белков и групп крови. В сб.: Проблемы развития АПК Саяно-Алтая. Абакан, 2011.
- Jiskrová I., Glasnák V., MisařD. The use of blood protein polymorphism for determining the genetic distance between the Moravian warm-blooded horse and the Czech warm-blooded and Trakehner horses. Czech J. Anim. Sci., 2002, 47(3): 98-105.
- Vinocur M.E., Brass K.E., Rubin M.I., Silva C.A.M. Genetic variability in the Brazilian criollo horse breed. Ciência Rural, 2003, 33(1): 137-142.
- Nunes R.L., Oliveira D.A.A., Coelho E.G.A. Polymorphism of serum proteins in Campolina horses. Anim. Reprod., 2005, 2(1): 60-62.
- Чысыма Р.Б., Федоров Ю.Н., Макарова Е.Ю., Куулар Г.Д. Активность гуморальных и клеточных факторов естественной резистентности у местных пород животных в экстремальных природно-климатических условиях Республики Тыва. Сельскохозяйственная биология, 2015, 6: 847-852 ( ) DOI: 10.15389/agrobiology.2015.6.847rus
- Поголовье скота в Республике Тыва на 01.01.2016 г. (cтат. сборник). Кызыл, 2016.
- Иргит Р.Ш., Самбуу-Хоо Ч.С., Макарова Е.Ю., Кан-Оол Б.К. Информационный бюллетень о состоянии развития коневодства в Республике Тыва. Кызыл, 2003.
- Дубровская P.M. Методические рекомендации по использованию полиморфных систем белков и групп крови при контроле достоверности происхождения лошадей. Дивово, 1986.
- Куликов Л.В., Никишев А.А. Математическое обеспечение эксперимента в животноводстве. М., 2006.
- Вейр Б. Анализ генетических данных. М., 1995.
- Mickelson J.R., Petersen J.L., Mccue M.E. Genetic variation in horse breeds derived from whole genome SNP data. In: Book of Abstracts of the 63rd Annual Meeting of the European Federation of Animal Science (Bratislava, Slovakia). Wageningen Academic Publishers, Wageningen, 2012, No 18: 326.


