Оценка изменения структурно-группового состава продукта сопигментации L-аскорбиновой кислоты и D-глюкозы в условиях окислительного стресса
Автор: Черепанов И.С., Тарасова Д.А., Егорова А.И.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Статья в выпуске: 4 (91), 2023 года.
Бесплатный доступ
В настоящее время одним из приоритетных направлений инновационного развития является получение продуктов с новыми потребительскими свойствами, в связи с чем разработка составов пищевых колеров с оптимизированными параметрами на основе биологически активных природных соединений представляется перспективной. В настоящей работе изучены структурно-групповой состав продукта совместной карамелизации (сопигментации) L-аскорбиновой кислоты и D-глюкозы и его изменение в условиях окислительного стресса. Окислительная стабильность и функциональный состав синтезированного карамельного продукта исследованы методами элементного анализа и колебательной спектроскопии. Показано, что в ходе эксперимента существенной окислительной трансформации и фотохимической деструкции структуры не происходит, вероятно, вследствие устойчивости первичной структуры, а также возможности таутомерного перехода между оксолактонным хромофором и α-пироновой формой, стабилизированной внутримолекулярными связями. Дополнительно установлено отсутствие в составе выделенных продуктов потенциально опасных низко- и высокомолекулярных производных фуранов. Развитие настоящего исследования предполагается в направлении экспериментальной оценки биоактивности изученного продукта.
Аскорбиновая кислота, глюкоза, карамелизация, сопигментация, структурно-групповой состав, спектроскопия, окислительный стресс
Короткий адрес: https://sciup.org/142240099
IDR: 142240099 | УДК: 664.144 | DOI: 10.53980/24131997_2023_4_25
Текст научной статьи Оценка изменения структурно-группового состава продукта сопигментации L-аскорбиновой кислоты и D-глюкозы в условиях окислительного стресса
Широкое распространение карамельных колеров в пищевой индустрии предполагает непрерывное совершенствование технологии их получения, поскольку наряду с общеизвестными достоинствами углеводные карамели обладают рядом недостатков, таких как жесткие условия получения [1], сложность технологического оформления процессов [2], а также образование потенциально токсичных продуктов [3], в частности азотистых гетероциклов ряда имидазолов [2]. К настоящему времени показано, что основными потенциально опасными являются низкомолекулярные вещества (производные фурана) в составе продуктов карамелизации [4], что предполагает необходимость их нивелирования посредством смягчения температурного режима синтеза либо их последующего удаления [5]. Натуральные пищевые красители безопасны, при этом существует проблема их низкой светостойкости вследствие окисления по кратным С=С-связям [6], что приводит к потере функциональности.
В настоящее время описаны различные способы стабилизации пищевых красителей в составе технологических сред, один из последних обзоров по данной тематике [7] классифицирует методы повышения устойчивости на несколько групп, в частности выделяются группы методов оптимизации экспериментальных условий и методов химической модификации структуры пигментов.
Первая группа методов предполагает варьирование внешних и внутренних параметров пищевых систем, в частности кислотности, температуры, а также оптимизацию условий хранения после выделения из природных систем, в том числе с применением глубоких эвтектических растворителей.
Во втором случае возможна модификация посредством химических реакций, в частности ацилирования и гликозилирования енольных фрагментов природных полифенолов, кроме того, описано формирование комплексов флавоноидов с аминокислотами и пептидами, образование соединений включения в системах антоцианы – циклодекстрин, а также комплексообразование порфириновых красителей с ионами металлов.
Одним из наиболее функциональных подходов является сопигментация, предполагающая ковалентное или нековалентное взаимодействие стабилизируемого красителя с сопигмен-том; в этом случае, помимо стабилизации, дополнительно увеличивается протяженность хромофоров. Ранее нами была разработана методика получения карамельного колерного состава на основе L -аскорбиновой кислоты в системе с D -глюкозой [8], предполагающая низкотемпературное взаимодействие компонентов с последующим выделением целевого продукта в форме водно-этанольного раствора для возможности его применения в качестве красителя в карамельной массе [6]. Оценка хроматических параметров последнего показала их соответствие количественным характеристикам углеводных карамелей и близость к таковым для коммерческих продуктов, указывая на перспективность дальнейших исследований.
Цель работы – изучение структурно-группового состава продукта совместной карамелизации (сопигментации) L -аскорбиновой кислоты и D -глюкозы и его изменения в условиях окислительного стресса.
Материалы и методы исследования
Получение целевого продукта проводили по ранее предложенной методике [8] посредством первичной термоактивации в 40%-ном этаноле (50 ° С; 1,5 ч) с последующим выдерживанием растворов (25 ° С) до стабилизации спектральных параметров. Полученный продукт в виде масла желто-коричневого цвета анализировали непосредственно после выделения из водно-этанольной среды, а затем после выдерживания на воздухе при 25±2 ° С при дневном 26
освещении в течение 90 сут [9]. Колебательные спектры поглощения регистрировали на ИК-Фурье спектрометре «ФСМ-2201» (ООО «Инфраспек», СПб), образцы готовили и исследовали в форме тонких пленок на CaF 2 и KBr-подложках (интервал волновых чисел 4000– 860(CaF 2 )/400(KBr) см-1, разрешение по волновому числу 2 см-1 при 60 циклах накопления). Вторые производные спектральных интервалов были получены в результате численного дифференцирования в окнах до 15 точек при сглаживании полиномом 4-го порядка. Обработку спектров проводили в программе FSpec 4.3.0.9, интенсивность пиков оценивали по методу базовой линии (спектры нулевого порядка) и по разности амплитуд сигналов (спектры второго порядка). Элементный анализ твердых фаз на содержание углерода (С, %) и водорода (Н, %) проводили на CHNS-анализаторе Vario MICRO Cube (Elemental Analyzer Gmbh, Германия), содержание кислорода оценивали по разности 100-(С, %+Н, %). Параметры окрашивания продуктов определяли по методикам [8] на спектрофотометре СФ-2000 (ОКБ «Спектр», СПб.).
Результаты исследования и их обсуждение
Ранее нами [8] и другими авторами [6] для оценки сохраняемости свойств колеров применялся спектрофотометрический метод исследования, предполагающий анализ динамики изменения оптической плотности растворов. В настоящей работе оценку изменения структуры в условиях окислительного стресса проводили сравнительным анализом данных колебательной спектроскопии и элементного анализа. Установленный ранее структурно-групповой состав полученной карамели характеризуется интенсивными ИК-полосами около 1630 и 1730 см-1, относимые к валентным колебаниям кратных С=С-связей в составе сопряженных систем и С=О-связей δ -лактонного цикла [8]. Окисление сложных органических веществ О -окислителями протекает по наиболее активным реакционным центрам субстратов, что сопровождается образованием С=О-функций в различном структурном окружении. В колебательных спектрах последнее регистрируется, кроме прочего, как усиление интегральной интенсивности ИК-сигналов в области около 1720–1730 см-1, что относят к ν с=О с алифатическими заместителями [10]. Представленные на рисунке 1 спектры исследованных систем показывают близость спектральных профилей, что может свидетельствовать о несущественном изменении структурно-группового состава в ходе окислительного стресса.
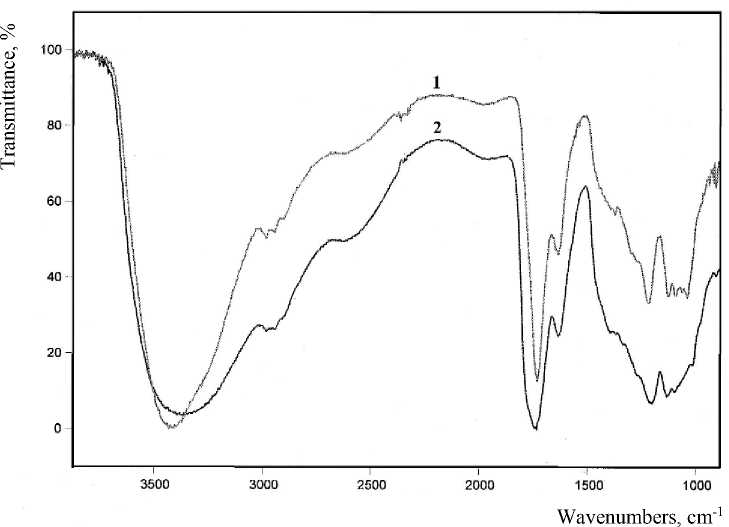
Рисунок 1 – Колебательные спектры (тонкая пленка) синтезированного продукта непосредственно после выделения (1) и по окончании окислительного стресса (2) 27
Следует отдельно отметить постоянство интенсивности полосы при 1630 см-1 (ν С=С ), в то же время фиксируется уширение полосы 1730 см-1 на высокочастотном крыле, а также группы полос валентных колебаний ОН-групп (3500–3000 см-1). Данный эффект может быть обусловлен дополнительным межмолекулярным взаимодействием карбонильных функций с другими группами [11]. Данные элементного анализа также подтверждают постоянство структурно-группового состава и сохранение параметров окрашивания (табл. 1).
Таблица 1
Характеристики элементного состава и параметры окрашивания продуктов сопигментации до и после окислительного стресса
|
Продукт |
Элементный состав |
|||
|
С, % |
Н, % |
О, % |
CI (EBC unit) |
|
|
Непосредственно после выделения |
49,20 |
3,40 |
47,40 |
15689 |
|
После окислительного стресса |
49,79 |
3,75 |
46,46 |
16204 |
Известно [9], что окисление углеводных карамелей реализуется по кратным связям, что снижает протяженность сопряженных систем и приводит к снижению интенсивности окраски в целом. Данные таблицы 1 указывают на некоторое увеличение значений CI (EBC unit), пропорциональные поглощению в видимой области [8], что свидетельствует об отсутствии критической деструкции сопряженных систем.
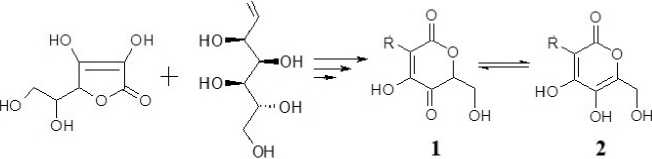
Относительная устойчивость конденсированной фазы на воздухе, вероятно, связана с возможностью таутомеризации, приводящей к равновесию оксолактонной 1 и α -пироновой структур 2 [8,13]:
О
Последнее подтверждается наличием в спектрах второй производной (рис. 2) полос 1720, 1700 и 1567 см-1 (ν С=O, c=c), характерных для гидроксиметил- 2Н -пиран-2-онов [13–15]. Число и соотношение интенсивностей полос в области 1730–1700 см-1, вероятно, связаны в том числе с проявлением резонанса Ферми [16]. Сигнал 1615 см-1 в спектре 2 подтверждает наличие 5-гидрокси-2-пираноновых фрагментов [17].
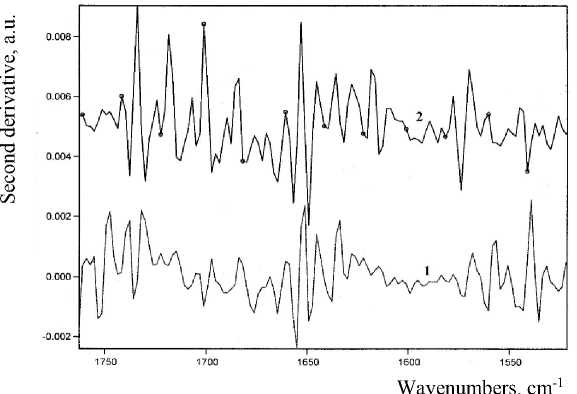
Рисунок 2 – Вторые производные колебательных спектров синтезированного продукта непосредственно после выделения (1) и по окончании окислительного стресса (2) 28
Можно предположить, что образующиеся структуры 2 дополнительно стабилизированы внутримолекулярными водородными связями, на образование которых указывает наличие усиливающихся полос около 2750 и 2000 см-1 (см. рис. 1), относимых к сложным колебаниям –ОН…О с участием фенольных структур [12].
Описанное авторами [18] окисление (О 2 , 20 ° С) полностью замещенных пиран-2-онов в свободно аэрируемых средах до а-, в -бутенолидов 3 , вероятно, реализуется для низкомолекулярных субстратов с донорными заместителями в положении 6.
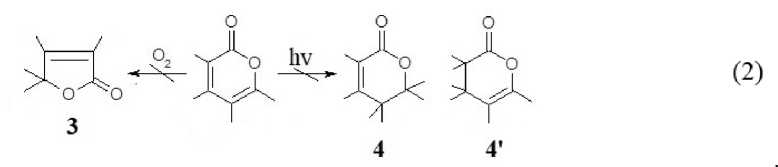
В спектре 2 (cм. рис. 2) характерный для продуктов окисления 3 ИК-дублет при 1750– 1760 + 1780 см-1 [19] не регистрируется, что указывает на отсутствие протекания описанной в [18] окислительной перегруппировки. Авторы [20], изучая антиокислительную активность сложных молекул, содержащих α-пироновые фрагменты, указывают на незначительный вклад подобных структур в восстановительную способность антиоксидантов.
Исследование [21] подтверждает стабильность α-пироновых фрагментов структуры в отношении фотохимических реакций: реализуемое в этом случае присоединение по одной из кратных С=С-связей должно приводить к продуктам 4 и 4’ . Протяженность сопряженных систем на основном хромофоре в этом случае должна снижаться, вызывая понижение значений общего индекса окрашивания CI (EBC unit), чего, согласно данным таблицы 1, не наблюдается.
Ранее было показано [8], что лактонный хромофор дополнительно стабилизируется сопряженным R-фрагментом в положении 3, природа которого не выяснена. Сопоставление низкочастотной области спектров (ниже 1600 см-1) с профилями спектров веществ фуранового ряда карамелизованных углеводов [22] показывает отсутствие последних в структуре полученных продуктов (табл. 2): наиболее характерные для фуранов полосы С=С и =С-Н-колеба-ний в спектрах исследуемых составов не фиксируются.
Таблица 2
Сопоставление спектральных характеристик исследованных карамелей с параметрами фурановых производных
|
Максимумы поглощения (ν, см-1) основных полос в спектрах |
|
|
исследуемые системы [8] |
производные фурана [22] |
|
^^^^^^в |
1500-1480 (С=С) |
|
1390-1380 (С-С-О, С-Н) |
1380-1370 (С-Н) |
|
1210-1206 (С-О) |
1240-1230(С-О) |
|
1140-1133 (С-О-С) |
1170-1150 (С-О, С-О-С) |
|
1060-1015 (С-ОН) |
1030-1010 (=С-НШ) -СН-ОН) |
|
^^^^^^в |
880-860 (=С-Н внепл ) |
Таким образом, можно констатировать отсутствие как низкомолекулярных 5 , так и конденсированных фурановых производных 6 при взаимодействии исходных компонентов в процессе сопигментации L -аскорбиновой кислоты и D -глюкозы:
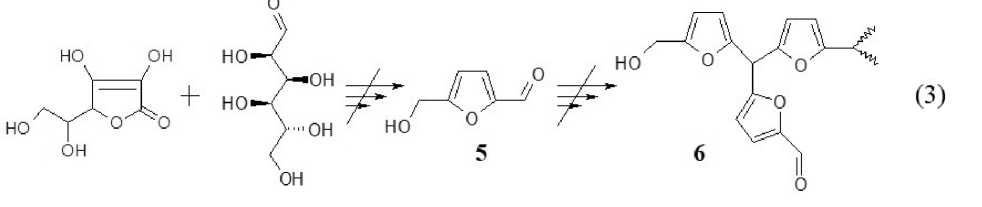
3-R-заместитель в структуре 2 , вероятно, представляет собой ациклический фрагмент, на начальном этапе встраиваемый в структуру оксолактонного хромофора посредством присоединения по Михаэлю к аскорбат-аниону производного трансформированного углевода [23]. Вероятно, что первичный продукт присоединения вступает в дальнейшие реакции конденсации и дегидратации, формируя сопряженную систему связей -С=С-(С) n -С(=О)- (n ≥ 0). Данный вывод подтверждается известными литературными данными [8]: в спектрах замещенных гидроксипиран-2-онов, фиксировавших интенсивные полосы в области 1640 - 1620 см-1; последнее объясняет достаточно высокую интенсивность полос 1630 см-1 (см. рис. 1), являющихся, по-видимому, составными, что подтверждается спектрами второго порядка (см. рис. 2).
Анализ литературных данных [17, 24, 25] указывает на проявление пиронсодержащими структурами различных видов биоактивности, в частности рострегулирующих свойств, антимикробной, противогрибковой и противоопухолевой активности, что предполагает перспективность изучения систем в данном направлении.
Заключение
Результаты проведенных исследований позволлили сделать следующие выводы:
-
1. Продукт сопигментации L -аскобиновой кислоты и D -глюкозы показал достаточную стабильность свойств в условиях действия свободно-аэрируемой среды, что подтвердилось данными молекулярной спектроскопии и элементного анализа.
-
2. Данные колебательной спектроскопии позволили детализировать структурно-групповой состав продуктов до и после окислительного стресса, подтверждая наличие в системе нескольких типов стабильных хромофоров.
-
3. Дополнительно показано отсутствие в составе выделенных продуктов потенциально опасных производных фурана, что отличает их от карамельных составов на основе углеводов.
-
4. Проявление различных видов биоактивности аналогичными по функциональногрупповому составу производными предполагает перспективность дальнейших исследований в направлении изучения структурно-зависимых свойств синтезированных продуктов.
Список литературы Оценка изменения структурно-группового состава продукта сопигментации L-аскорбиновой кислоты и D-глюкозы в условиях окислительного стресса
- Al-Abid M., Al-Shoaily K., Al-Amry M. et al. Preparation of caramel colour from dates // Acta Horticulturae. – 2007. – N 736. – P. 537–541.
- Hong S.-M., Park M., Lee K.-G. Development of caramel colour with improved colour stability and reduced 4-methylimidazole // Food Additives & Contaminants – Part A. Chemistry. –2020. – N 1 (37). – P. 1–8.
- Jacobson M. Carcinogenicity and regulation of caramel colorings // Int. J. Occup. Environ. Health. – 2012. – N 3 (18). – P. 254–259.
- Buczkowska M., Paciorek K., Kapcinska A. et al. Caramel colors in term of scientific research, with particular consideration of their toxicity // Postery Hig Med Dosw. – 2021. – N 1 (75). – P. 246–254.
- Guan Y.-G., Shi W.-H., Yu S.-J. et al. Ultrafiltration of caramel color solution reduces 5-hydroxymethyl-2-furaldehyde // J. Membrane Sci. – 2011. – N 1 (380). – P. 9–12.
- Дерканосова Н.М., Гинс В.К., Лупанова О.А. и др. Разработка способов получения и применения натурального пищевого красителя // Техника и технология пищевых производств. – 2015. – № 1. – С. 18–23.
- Nedamani A. Stability enhancement of natural food colorants – a review // Journal of Research and Innovation in Food Sciences and Technology. – 2022. – N 4 (10). – P. 369–388.
- Черепанов И.С. Формирование цветности карамельных составов на основе аскорбиновой кислоты // Вестник Южно-Уральского государственного университета. Серия: пищевые и биотехнологии. – 2023. – Т. 11, № 1. – С. 77–85.
- Savel J., Kosin P., Broz A. Anaerobic and aerobic beer aging // Czech. J. Food Sci. – 2010. – N 1 (28). – P. 18–26.
- Мамлеева Н.А., Харланов А.Н., Лунин В.В. Особенности деструкции лигнина в древесине под действием озона // Журнал физической химии. – 2020. – Т. 94, № 9. – С. 1337–1342.
- Kampouraki Z., Giannakoudakis D., Triantafyllidis K. et al. Catalytic oxidative desulfurization of a 4,6-DMDBT containing model fuel by metal-free activated carbons: the key role of surface chemistry // Green Chem. – 2019. – N 21. – P. 6685–6698.
- Rusinska-Roznak D. Energy of intramolecular hydrogen bonding in ortho-hydroxybenzaldehydes, phenones and quinones. Transfer of aromaticity from ipso-benzene ring to the enol system(s) // Molecules. – 2017. – Vol. 22. – 481 p.
- Djinni D., Defant A., Kecha M. et al. Antibacterial polyketides from the marine alga-derived endophilic Streptomyces sundarbansensis: a study of hydroxypyrone tautomerism // Mar. Drugs. – 2013. – N 1 (11). – P. 124–135.
- Barroso-Bogeat A., Alexandre-Franco M., Fernandez-Gonzalez C. et al. FT-IR analysis of pyrone and chromene structures in activated carbon // Energy Fuels. – 2014. – N 6 (28). – P. 4096–4103.
- Ganguly A., Govindachari T., Mohamed P. Structure of opuntiol, a constituent of Opuntia elatior // Tetrahedron. – 1965. – N 1 (21). – P. 93–99.
- Thul P., Gupta V., Ram V. et al. Structural and spectroscopic studies on 2-pyranones // Spectrochim. Acta. Part A. Mol. Biomol. Spectr. – 2010. – N 2 (75). – P. 251–260.
- Lin A., Lu X., Fang Y. et al. Two new 5-hydroxy-2-pyrone derivatives isolated from a marinederived Fungus Aspergillus Flavus // J. Antibiot. – 2008. – N 4 (61). – P. 245–249.
- Eade S., Adlington R., Cowley A. et al. A novel oxidative rearrangement of 6-metoxypyran-2-ones // Org. Lett. – 2005. – N 17 (7). – P. 3705–3707.
- Joshi V., Chamoli R. Synthesis of new α, β-unsaturated butenolides // Bull. Chem. Soc. Ethiop. – 2010. – N 3 (24). – P. 467–471.
- Rosa A., Deiana M., Atzeri A. et al. Evaluation of the antioxidant and cytotoxic activity of arzanol, a prenylated α-pyrone–phloroglucinol etherodimer from Helichrysum italicum subsp. Microphyllum // Chemico-biological Interaction. – 2007. – N 1 (165). – P. 117–126.
- Zuidema D., Jones P. Triplet photosensitization in cyercene A and related pyrones // J. Photochem. Photobiol. – 2006. – N 1 (83). – P. 137–145.
- Ghosh M., Howard M., Dussan K. et al. Mechanism and theory of D-glucopyranose homogeneous acid catalysis in the aqueous solution phase // Phys. Chem. Chem. Phys. – 2019. – N 32 (21). – P. 1–19.
- Черепанов И.С., Мухдарова Э.Ш. Изучение влияния D-глюкозы на процессы деструкции L-аскорбиновой кислоты в водно-этанольных средах // Вестник МГТУ. – 2022. – Т. 25, № 3. – С. 248–258.
- Bach T., Kirsch S. Synthesis of 6-substituted 4-hydroxy-2-pyrones from aldehydes by addition of an acetoacetate equivalent, Dess-Martin oxidation and subsequent cyclization // Synlett. – 2001. – N 12. – P. 1974–1976.
- Доржиева В.В., Ханхалаева И.А., Битуева Э.Б. и др. Исследование качества и безопасности производства комбинированного мясопродукта с использованием барьерной технологии и принципов ХАССП // Вестник ВСГУТУ. – 2019. – № 4 (75). – С. 32–39.


